照波的植物组织培养研究*
周 静,杨苏文,方小波,方 蓉,吴荣归,冉永姣,刘红美▲
(1贵州医科大学 生物与工程学院,贵州 贵阳 550025;2贵阳市开阳县人民医院 检验科,贵州 贵阳 550300)
照波的植物组织培养研究*
周 静1,杨苏文2,方小波1,方 蓉1,吴荣归1,冉永姣1,刘红美1▲
(1贵州医科大学 生物与工程学院,贵州 贵阳 550025;2贵阳市开阳县人民医院 检验科,贵州 贵阳 550300)
目的:建立照波组织培养体系。方法:以照波茎段为外植体,MS为基本培养基,通过添加不同的植物生长物质种类和浓度配比,筛选各阶段最适宜的培养基。结果:在MS+NAA0.1mg/L+ 6 -BA1.0mg/L的培养基组合中利于愈伤组织诱导,在MS+NAA0.05mg/L+ 6 -BA0.3mg/L的培养基中有较多不定芽形成。MS+NAA0.1mg/L培养基为最佳的诱导生根培养基,生根苗移栽成活率达到90 %,在1/2MS+NAA0.06mg/L和 1/2MS+NAA0.03mg/L培养基中培养60天后可见黄色花苞形成。结论:试验初步建立了照波组织培养体系。
照波,茎段,愈伤组织,组织培养
照波(Bergeranthus)为番杏科照波属的多年生草本植物,是番杏科多肉植物中的小属,又名仙女花。肉质叶短锥形,丛生,对生叶基部联合成肉质鞘,叶正面扁平,背面棱凸,叶顶端尖。叶表皮薄,有许多透明的疣。叶高2 cm~5 cm,基部联合。幼株单生,老株则密集丛生。花从两叶的中缝开出,黄色花,直径约2 cm~3 cm,每株只开一花,群生开花非常壮观[1]。因其小巧精致,叶片和花卉观赏性较强,具有防辐射功能,目前,多肉植物在花卉市场销售中所占比例越来越高。国内外有较多企业进行种植销售。据调查,美国一盆照波销售价格达4美元左右。多肉植物食药用价值目前也正在研究中,市场需求前景较大[2],此外,多肉植物叶片还可用于蛋白分离提取研究[3]。但目前,照波多采用种子和分株繁殖,存在繁殖系数较低,扩繁速度较慢等问题,无法满足市场生产需求。因而,应用植物组织培养方法建立照波组织培养方法体系较为重要。对于多肉植物组织培养研究,主要集中在对于仙人掌、玉露等研究[4,5],未见有关多肉植物照波组织培养研究相关报道。本试验将以市面销售的照波为研究材料,筛选最佳的激素组合诱导照波愈伤组织和不定芽的发生以及生根开花培养基筛选及最后炼苗出瓶。以期为规模化繁殖栽培降低生产成本。
1 材料与方法
1.1 实验材料
1.1.1 实验样品
实验材料购于贵阳市花鸟市场,经鉴定为黄花照波(Bergeranthusmulticeps)。
1.1.2 实验试剂
实验使用试剂:6—BA、NAA 植物生长激素及配制大量元素相关化学试剂均购自贵州凯信生物有限公司。
1.2 实验方法
1.2.1 外植体处理
(1)外植体选择
将照波置于植物组织培养室中暗培养一周左右,待茎段生长长度在1 cm左右时,选取生长良好、植株健壮的照波茎段作为外植体。用软毛刷小心清除植株表面杂质,流水下冲洗1 h左右,置于洁净容器中,待消毒处理。
(2)外植体消毒
将流水冲洗洁净的外植体进行消毒处理,75 %酒精浸泡8~10 s,无菌水冲洗3~4次,每次2~3 min;3.0 %次氯酸钠消毒8~10 min,无菌水冲洗4~5次,每次2~3 min;消毒后的无菌材料置于无菌滤纸上吸干水分,将照波茎段切成0.5 cm小段接种于基础培养基上(MS + 3 %蔗糖 + 0.9 %琼脂,pH5.9),每个消毒方案接种10块外植体,筛选适宜照波外植体消毒最佳方案。
1.2.2 愈伤组织和不定芽的诱导培养
(1)诱导培养基选择
将消毒好的照波茎段接种于以MS为基本培养基,选取不同浓度的NAA(萘乙酸)、6-BA(6-苄基腺嘌呤)的外源激素进行配比。从中筛选出最佳诱导愈伤组织和不定芽培养基。
(2)培养条件及方法
选取生命活力较强无污染的茎段,接种到愈伤组织和不定芽的诱导培养基上培养,每种外源激素配比培养基中接种10瓶,培养25 d以后进行观察统计分析。
以MS为基本培养基,不同处理组合激素浓度(表2),蔗糖3.0 %,琼脂粉0.8~0.9 %,pH值5.8~6.0。温度(24±2℃),光照强度1 800 lx,光照时间12 h/d,湿度保持在80 %[6]。
待不定芽长出,小苗生长到15 mm左右,将植株进行继代繁殖培养。
1.2.3 生根及开花培养
选取长势较好,不定芽长20 mm~30 mm左右照波再生苗接种到生根培养基中。生根培养基以1/2 MS或MS为基本培养基,NAA为主要激素,蔗糖3.0 %,琼脂粉0.8~0.9 %,pH值5.8~6.0。培养条件:温度(24±2℃),光照强度1 800 lx,光照时间12 h/d,湿度保持在80 %,培养15 d统计分析生根情况;培养60 d统计分析开花情况。
1.2.4 驯化与移栽
选取根系较为健壮且分支较多的植株进行驯化培养。首先进行瓶内驯化,将封口膜放松室温下炼苗培养5 d逐步适应室外环境,再转移到育苗床上进行瓶外驯化,注意保湿和遮光处理。经过一段时间驯化后,将根部培养基彻底冲洗干净,移栽到珍珠岩与腐殖土为1∶1经高压灭菌处理的移栽基质中,用塑料薄膜覆盖,早晚洒水以保持培养基质湿度,10 d以后隔日洒水。培养20 d以后统计成活率。
2 结果与分析
2.1 不同消毒剂配伍消毒效果分析
对照波外植体进行消毒处理中,为有效提高消毒效果并尽量保持外植体生长活性,本实验采用了3 %次氯酸钠与75 %乙醇联合配伍消毒法[7](表1)。接种两周后进行统计分析,经两种消毒剂4种不同时间消毒处理,3 %次氯酸钠消毒10 min与75 %乙醇消毒8 s联合消毒处理效果最好,污染率褐化率较低,存活率较高达75 %。
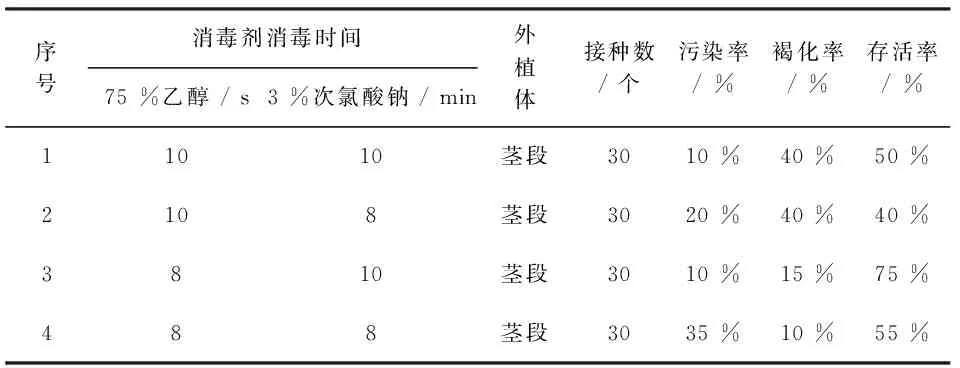
表1 消毒剂不同消毒时间对照波消毒效果的影响
注:污染率(%)=污染数/接种总数×100 %,褐化率(%)=褐化数/接种总数×100 %,存活率(%)=存活数/接种总数×100 %。
Note:Pollution rate(%)=number of pollution/the total of vaccination×100 %,Browning rate(%)=number of browning/the total of vaccination×100 %,The survival rate(%)=number of survival/the total of vaccination×100 %.
2.2 几种激素组合对愈伤组织和不定芽诱导效果分析
将灭菌处理后生命力较强的照波茎段接种于愈伤组织和不定芽诱导培养基中培养,培养10 d后在外植体切口处开始膨大,有淡绿色愈伤组织出现,培养15 d后在茎段愈伤组织的侧面和基部可见不定芽生长,培养25 d统计结果(表2)。
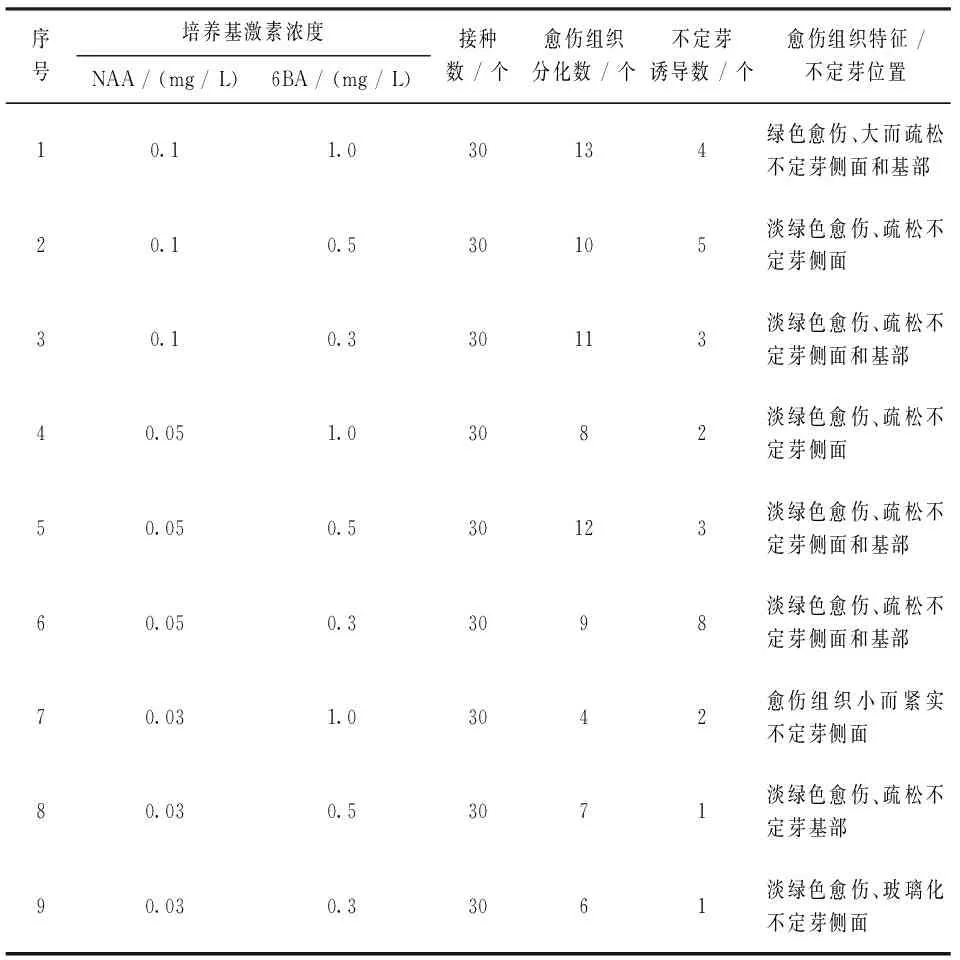
表2 不同激素组合对照波愈伤组织和不定芽诱导影响
由表2可见,9种培养基组合对照波茎段外植体均可诱导出愈伤组织,其中1号培养基愈伤组织诱导数最多,形成较早,褐化少,愈伤组织淡绿色较为疏松(图1 A,B)。而在7号培养基中,随着外源激素NAA浓度变化,愈伤组织诱导数目明显减少,愈伤组织生长势较差。因此,照波愈伤组织诱导最佳激素组合为NAA 0.1 mg/L和6 - BA 1.0 mg/L,即培养基组成为MS + NAA 0.1 mg/L + 6 - BA 1.0 mg/L。
9种培养基对照波愈伤组织均可诱导出不定芽诱导,其中6号培养基不定芽诱导数最多,形成较早,褐化少,不定芽长度在20 mm左右(图1 C,D)。而在8、9号培养基中鲜有不定芽生长。因此,照波不定芽诱导最佳激素组合为NAA 0.05 mg/L和6 - BA 0.3 mg/L,即培养基组成为MS + NAA 0.05 mg/L + 6 - BA 0.3 mg/L。

图1 A,B:茎段培养25 d后愈伤组织诱导情况;C,D:茎段培养25 d后不定芽从基部和侧面诱导生长情况
2.3 不同培养基对试管苗生根和开花效果分析
选取长势较好,不定芽长20 mm~30 mm左右照波再生苗接种到生根培养基中。培养15 d后,统计照波生根和开花情况(表3)。几种培养基组合均能促进根生长,无愈伤组织形成。1号培养基以MS为基本培养基,添加NAA(0.1 mg/L),生根率最高达到80 %,根短、粗壮且数量较多,有许多须根,生长势较好(图2 A,B)。4、5、6号培养基生根率明显降低,根条数少而纤细,生长势较差。由此可见适合照波生根的培养基为1号培养基。即培养基组成为MS + NAA 0.1 mg/L。
培养60 d后,几种培养基中仅4、5号培养基中照波有黄色花苞形成(图2 C,D),花期约2周左右。即培养基组成为1/2MS+NAA0.06 mg/L 和1/2MS+NAA 0.03 mg/L。
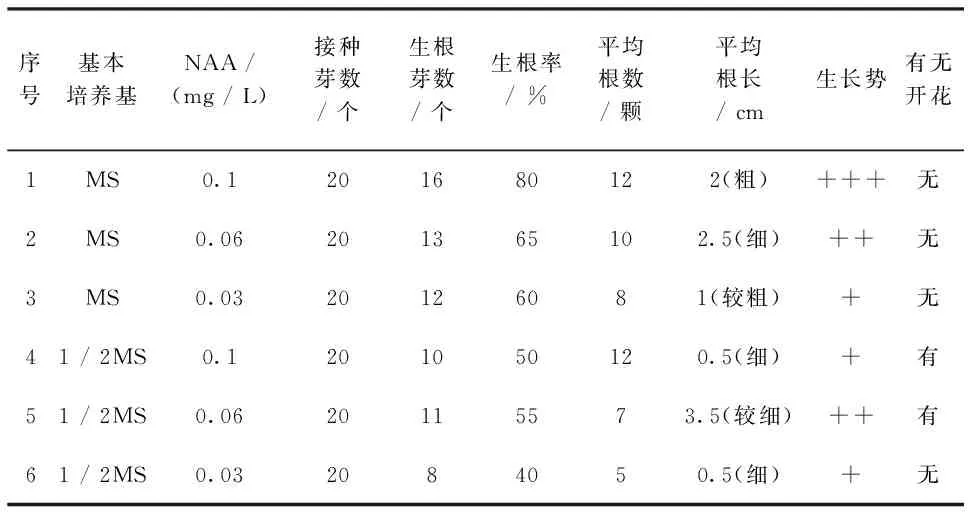
表3 不同培养基组合对照波生根和开花影响
注:生长势:较好+++,一般++,较差+
Note:The growth potential:good+++,general++,poor+

图2 A,B:不定芽接种15 d后生根情况;C,D:组培苗培养60 d后开花情况
2.4 驯化炼苗结果
选取根系较为健壮且分支较多的植株(图3 A),打开瓶盖炼苗4-5 d后,取出洗净根部琼脂移栽到灭菌好的基质中(珍珠岩∶腐殖土=1∶1),用塑料薄膜覆盖,早晚洒水以保持培养基质湿度,10 d以后隔日洒水。培养20天以后统计成活率达到90 %(图3B)。

图3 A:根系较为发达粗壮的植株;B:驯化炼苗20 d后植株生长情况。
3 讨论和结论
3.1 照波外植体选择及处理
适宜外植体选择是植物组织培养关键因素之一。一方面选取分化能力较强的外植体;另一方面选取污染程度低的外植体,可有效降低消毒剂处理强度,增强外植体再生能力。因而,在选取照波外植体中,将植株置于相对洁净培养室中培养一周左右,待其茎部长出淡黄色茎段,作为照波植物组织培养外植体,降低了消毒强度,利于愈伤组织形成。
3.2 植物外源激素选择
外源激素对组织分化的调节起着非常重要的作用,尤其是生长素与细胞分裂素的比值对组织的发育方向起决定性作用[8]。外源激素的种类及浓度决定了照波组培的成苗率。6 - BA与NAA配合对愈伤组织诱导、分化具有明显促进作用,参照多肉植物仙人掌及玉露外源激素选择[4,5],本试验采用6 - BA与NAA两种外源激素,以不同浓度进行配比组合,在MS + NAA 0.1 mg/L + 6 - BA 1.0 mg/L培养基和MS + NAA 0.05 mg/L + 6 - BA 0.3 mg/L培养基中分别利于愈伤组织和不定芽形成。在MS + NAA 0.1 mg/L 培养基中诱导生根根系最为发达健壮。在1/2MS + NAA 0.06 mg/L 和1/2MS + NAA 0.03 mg/L培养基中培养60天后可见黄色花苞形成。
因而,本试验初步建立了照波植物组织培养体系。
【REFERENCES】
[1] 王玉成.700种多肉植物原色图鉴[M].南京:江苏科学技术出版社,2013:68-70.
[2] 程星星.多肉植物的未来发展及应用[J].科技展望,2015,25(26).88-89.
[3] Jones,Richard W.1.Application of succulent plant leaves for Agrobacterium infiltration-mediated protein production[J].Journal of Microbiological Methods,2016,120:65-67.
[4] 关丽霞,韩德伟,谢永刚,等.4种仙人掌科植物的组织培养研究[J].广东农业科学,2009(9):34-36.
GUAN L X,HAN D W,XIE Y G,et al.Research on tissue culture of four kinds of cactaceae plant[J].Guangdong Agricultural Sciences,2009(9):34-36.
[5] 宋扬.冰灯玉露的组织培养与快速繁殖技术研究[J].现代农业科技,2014(18):164-166.
[6] 巩振辉,申书兴.植物组织培养[M].北京:化学工业出版社,2007:45-46.
[7] 黄作喜,邱 超,曾桢迦,等.植物组织培养中消毒剂的应用研究进展[J].内江师范学院学报,2013,28(6):26-29.
HUANG Z X,QIU C,ZENG Z J,et al.Research progress of disinfectant application in plant tissue culture[J].Journal of NEIJIANG Normal University,2013,28(6):26-29.
[8] 冉懋雄.中药组织培养实用技术[M].北京:科学技术文献出版社,2004:35-37.
Tissue Culture of Bergeranthus*
ZHOU Jing1,YANG Suwen2,FANG Xiaobo1,FANG Rong1,WU Ronggui1,RAN Yongjiao1,LIU Hongmei1▲
(1SchoolofBiologyandEngineering,GuizhouMedcialUniversity,Guiyang550004,China;2ClinicalLaboratoryofKaiyangPeople’sHospital,Guiyang550300,China)
In this study,we developed a tissue culture system forBergeranthus.WithBergeranthusstems as explants,MS as basic medium,through adding different types and concentrations of plant growth regulators,we screened out the optimum medium for different phases of growth.The optimum callus induction medium was MS + NAA 0.1 mg/L + 6 - BA 1.0 mg/L,the optimum adventitious bud induction medium was MS + NAA 0.05 mg/L + 6 - BA 0.3 mg/L,and the best medium for rooting was MS + NAA0.1 mg/L.Under above conditions,90 % plantlets survived.After 60 days culturing in the medium of 1/2 MS + NAA 0.06 mg/L and 1/2 MS + NAA 0.03 mg/L,the plant produced yellow buds.This study preliminarily established the tissue culture system forBergeranthus.
Bergeranthus,stems,callus,tissue culture
Q
A
2016-09-05;
2016-09-29
贵阳医学院高等学校2014年大学生创新创业训练计划项目(HPLC分析白芨组培苗与实生苗有效成分含量,201410660015);贵州医科大学高等学校2015年大学生创新创业训练计划项目(贵州大方天麻蜜环菌筛选和鉴定,201510660034)。
周 静(1981-),女,汉族,硕士研究生,贵州贵阳人,贵州医科大学生物与工程学院讲师,研究方向:植物组织培养研究。
▲通讯作者:刘红美(1975-),女,汉族,博士研究生,贵州遵义人,贵州医科大学生物与工程学院副教授,研究生导师,研究方向:植物生物技术。

