正交优选苦紫洗剂提取工艺研究
范世忠,郭华,曾倩,谈静,袁强华
·炮制制剂·
正交优选苦紫洗剂提取工艺研究
范世忠1,郭华2,曾倩1,谈静1,袁强华1
目的:优选苦紫洗剂的提取工艺。方法:采用L9(34)正交试验,以羟基萘醌类总色素含量为评价指标,以乙醇用量、浸泡时间和浸泡次数为考察因素,筛选紫草的醇提工艺条件;以氧化苦参碱和苦参碱总含量及干膏收率为评价指标,以加水倍数、提取时间和煎煮次数为考察因素,筛选苦紫洗剂的水提工艺条件。结果:优选醇提工艺为加10倍量95%乙醇,浸泡2次,每次12 h;优选水提工艺为加8倍量水,提取3次,每次1 h。结论:优选得到的提取工艺稳定、合理、可行。
苦紫洗剂;羟基萘醌总色素;氧化苦参碱;苦参碱;提取工艺
苦紫洗剂为成都中医药大学附属医院的在研医院制剂,该方由苦参、紫草等药味组成,为妇科用于治疗老年性阴道炎疾病的经验方,在临床应用多年,疗效确切,具有清热解毒,燥湿止痒,补益肝肾的功效。根据处方药味的主要药效成分的理化性质,以羟基萘醌总色素含量为评价指标,考察紫草醇提工艺;以苦参碱和氧化苦参碱总量及干膏收率为评价指标考察其余药味与醇提后药渣的水提工艺,通过正交试验优选提取工艺,为本制剂的开发研究提供工艺条件参数。
1 仪器与试药
岛津UV-210A紫外分光光度仪(日本岛津公司);HP-1100型高效液相色谱仪(G1322A 在线真空脱气装置、G1311A 四元梯度泵、G1313A 标准自动进样器、G1316A 柱温箱、G1315A DAD 检测器、Agilent ChemStation B03.01工作站,美国安捷伦(惠普)公司),电子分析天平(SARTΟRIUS ,Bp211D)。
左旋紫草素对照品(批号:110769-200405),苦参碱对照品(批号:110805-200508),氧化苦参碱对照品(批号:110780-200506),均由中国食品药品检定研究院提供;紫草、苦参等饮片由四川新荷花中药饮片股份有限公司提供;乙腈、甲醇、乙醇为色谱纯,水为重蒸馏水,其余试剂为分析纯。
2 醇提工艺研究
紫草萘醌类成分为紫草的主要有效成分,性质极不稳定,受温度影响较大,根据药效成分的理化性质及预试实验结果,参考相关文献[1],针对羟基萘醌类总色素的不稳定性,为合理有效地进行紫草有效部位的提取与制备,经过预试,确定紫草用95%乙醇常温浸提,以左旋紫草素为对照品计算羟基萘醌总色素含量,对紫草的提取条件进行筛选。
2.1 羟基萘醌总色素含量测定
2.1.1 测定方法 采用紫外-可见分光光度法,检测波长:516 nm。
2.1.2 线性范围的考察 精密 量 取 左 旋 紫 草 素 对 照 品溶 液(0.06 mg.mL-1)1.0、2.0、3.0、4.0、5.0 mL,分别置10 mL 量 瓶 中 ,用 乙 醇 定 容 至刻度;以95%乙醇 为 空 白 对 照,分别于516 nm处测 定 吸 光 度,以左旋紫草素含量(mg)为横坐标,吸 收 度 为 纵 坐标 进 行 线 性 回 归计算,得 回 归 方程:Y=2.2799 X+0.0078(r=0.9999)。结果:左 旋 紫 草 素 含量在0.006~0.030 mg.mL-1范围内吸 收 度 线 性 关 系良好。
2.1.3 样品含量测定 分别精密吸取正交试验各样品溶液2.0 mL置50 mL容量瓶中,加95%乙醇定容,摇匀即得。以95%乙醇为空白参比,于516 nm处测定吸光度,据标准曲线回归方程计算出正交试验各紫草样品中羟基萘醌总色素的含量。
2.2 醇提正交试验
选用正交试验法,以95%乙醇为溶媒,对影响紫草醇提的主要因素:乙醇用量、浸泡时间、浸泡次数进行考察,根据预试结果选择三个因素的水平,进行L9(34)正交试验,筛选紫草醇提工艺条件。因素水平设计见表1。
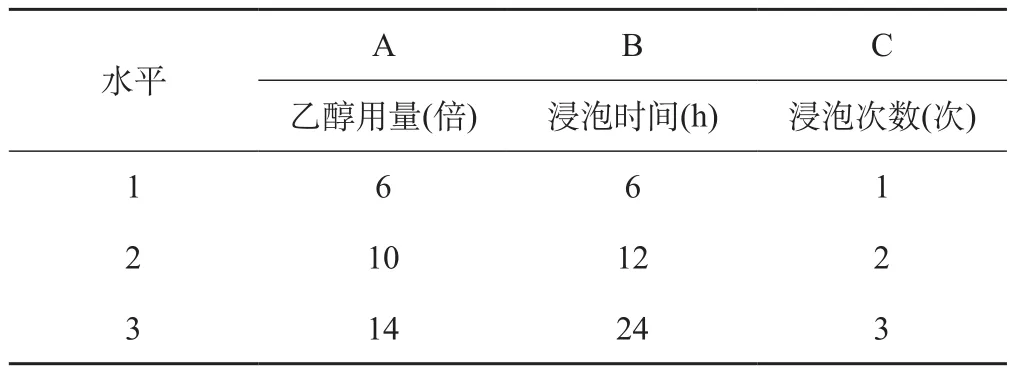
表1 醇提正交设计因素水平
称取紫草饮片100 g,按正交试验设计表的条件进行常温浸提试验,提取液滤过,用95%乙醇定容至4000 mL。正交试验结果见表2,方差分析见表3。

表2 正交试验结果

9 3 3 2 1 40.86 K1 103.41 101.88 91.94 106.27 K2 107.52 110.74 116.07 108.71 K3 112.86 111.17 115.78 108.81 R 3.15 3.10 8.04 0.85

表3 方差分析结果
结果:由表2直观分析结果可知,影响提取效果的因素顺序为: C(浸泡次数)> B(浸泡时间)>A(乙醇用量),最佳醇提工艺为:A3B3C2;由表3方差分析结果可知,C因素(浸泡次数)有显著影响,B因素(浸泡时间)与A因素(乙醇用量)无显著影响;为节约资源,降低工业化生产的成本,A因素取中间值A2, B2和B3相差很小,B因素取B2,因此优选醇提工艺为A2B2C2,即加10倍量95%乙醇,常温浸泡2次,每次12 h。
2.3 醇提验证试验
取紫草100 g,共三份,按照正交试验优选的提取工艺进行验证试验,结果稳定,羟基萘醌总色素平均含量为38.82 mg/g,RSD=2.06%。
3 水提工艺研究
3.1 氧化苦参碱和苦参碱的含量测定
3.1.1 色谱条件[2-7]色谱柱为C18(250×4.6 mm,5 μm);流动相为乙腈-甲醇-0.1%磷酸溶液(三乙胺调pH=7.5)(12∶5∶83);流速1.0 mL.min-1;柱温30 ℃;检测波长220 nm。
3.1.2 线性关系考察 精密吸取苦参碱(0.3704 mg.mL-1)和氧化苦参碱(0.2424 mg.mL-1)混合对照品溶液,按3.1.1项色谱条件分别进样0.5 μL、1 μL、3 μL、5 μL、7 μL、10 μL,测定峰面积,以峰面积(Y)对进样量(X)进行回归,计算氧化苦参碱和苦参碱的回归方程,氧化苦参碱回归方程:Y=822.83X+12.121(r=0.9999);苦参碱回归方程:Y=1153.6X-5.1574(r=0.9999);结果表明,氧化苦参碱和苦参碱在0.1852~3.704 μg和0.1212~2.424 μg之间与峰面积呈良好线性关系。
3.1.3 样品含量测定 分别精密吸取正交试验样品液各5.0 mL置25 mL容量瓶中,加无水乙醇20 mL,超声处理10 min,放至室温,用无水乙醇定容,摇匀,微孔滤膜滤过(0.45 µm),取续滤液作为供试品溶液。阴性对照液为处方缺苦参的提取液按上述方法制得,分别进样对照品溶液、供试品溶液和阴性对照液各5 μL测定,阴性对照液色谱图中无氧化苦参碱和苦参碱色谱峰,说明其它成分不干扰测定,见图1。

图1 苦紫洗剂中氧化苦参碱和苦参碱HPLC图Ⅰ:样品;Ⅱ:对照品;Ⅲ:阴性对照;A:氧化苦参碱;B:苦参碱Fig 1 HPLC of Oxymatrine and Matrine of Kuzi lotionⅠ:sample solution;Ⅱ: reference substance solution;Ⅲ:negative sample solution;A:Οxymatrine;B:Matrine
3.2 水提正交试验
采用水煎煮提取的方法,影响水提的主要因素有加水量、煎煮时间、煎煮次数,根据预试结果选择三个因素的水平,按L9(34)正交表进行正交试验,因素水平见表4。
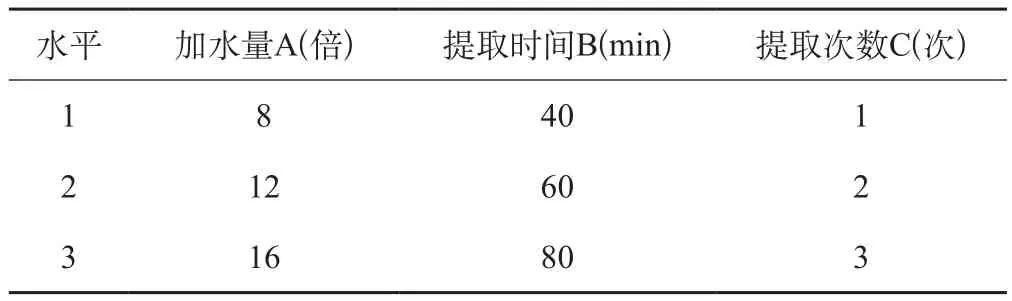
表4 水提正交设计因素水平
按处方比例称取苦参等饮片与紫草残渣共煎,按L9(34)正交表安排试验提取,加水煎煮,滤过,合并滤液,浓缩至500 mL。按3.1.3项下方法测定各正交提取液中氧化苦参碱和苦参碱总含量;精密吸取各正交样品液25.0 mL,分别置已干燥至恒重的蒸发皿中,水浴蒸干,于105 ℃干燥3 h,置干燥器中冷却30 min,迅速精密称定重量,计算干膏率。以氧化苦参碱和苦参碱总含量(占70%)及干膏收率(占30%)两项综合加权评分为指标,考察各因素对提取工艺的影响。结果见表5、表6。

表5 正交试验结果

表6 方差分析表
结果:由表5直观分析结果可知,影响提取效果的因素顺序为: C(提取次数)> B(提取时间)>A(加水量),最佳水提工艺为:A3B2C3;由表6方差分析结果可知,C因素(提取次数)对提取效果有极显著性影响,B因素(提取时间)对提取效果有显著性影响,A因素(加水量)对提取效果无显著性影响,为节约资源,降低工业化生产成本,将A3调整为A1,因此优选水提工艺为A1B2C3,即加8倍量水,提取3次,每次1 h。
3.3 水提验证试验
按处方比例称取饮片500 g,共三份,按照正交试验优选的工艺条件进行验证实验,结果:氧化苦参碱和苦参碱总含量平均值为18.32 mg/g,RSD=2.10%;干膏收率平均值为28.35%,RSD=2.07%,表明该水提工艺稳定可行。
4 讨论
(1)乙酰紫草醌、紫草醌、去氧紫草素等萘醌类色素为紫草的主要有效成分[8]。萘醌类成分极不稳定,受温度影响较大,目前报道多采用高浓度的乙醇提取,但提取方法不一,有回流法、浸渍法、渗漉法等,不同方法对成分的破坏影响差别较大[9-12],预实验发现紫草提取液加热回流前后颜色发生改变,回流法得到的供试品溶液与饮片样品、左旋紫草素对照品的紫外吸收图谱不一致,其原因是在乙醇回流温度下,萘醌类色素被破坏。前期实验通过比较温浸法(65 ℃)、渗漉、浸渍法、超声法对羟基萘醌总色素含量的影响,4种提取方法得到的羟基萘醌总色素含量以渗漉法、温浸法(65 ℃)最高,各方法差别不大,与文献[12]报道基本一致。超声提取与浸渍提取相比,虽提取时间短,但提取率略低且超声提取对设备要求高, 能耗大,超声过程影响因素不易控制;浸渍法提取略低于渗漉法,但综合比较来看,浸渍法作为提取萘醌类成分初始提取方法,可以节约能源,对设备要求低,操作简便,转移率高,更适用于工业化生产,故以95%乙醇为溶媒,采用常温浸渍法对紫草进行提取。
(2)苦参加热提取时,苦参碱和氧化苦参碱的含量存在动态变化[13-14],鉴于此原因,在水提工艺研究时,含量测定以氧化苦参碱和苦参碱的总含量为指标。
(3)苦参为本处方的君药,苦参碱和氧化苦参碱为本处方主要药效成分,其含量的高低直接影响着药效的发挥,因此水提工艺研究时给予苦参碱和氧化苦参碱的总含量70%的加权系数。
[1] 冯文文,李国玉,谭勇,等.新疆紫草中萘醌类成分的提取工艺研究[J].石河子大学学报(自然科学版),2011,29(1):67-70.
[2] 罗美兰,廖银根,王文,丁志军.复方苦蛇黄洗剂质量标准[J].中国实验方剂学杂志,2013,19(13):131-133.
[3] 张善玉,姜艳玲,申英爱.抗妇炎胶囊中苦参碱和氧化苦参碱的含量测定[J].时珍国医国药,2006,17(5):728-729.
[4] 李华荣,高逢喜.HPLC法测定妇舒能洗剂中氧化苦参碱的含量测定[J].中国药师,2009,12(5):620-621.
[5] 王小龙,叶晓娅.不同提取工艺对制霉洗剂中苦参碱与氧化苦参碱含量的影响[J].医药导报,2009,28(5):645-646.
[6] 张薇,陈浩浩,范华均等.不同微波辅助法提取苦参生物碱的比较[J].中国实验方剂学杂志,2012,18(20):34-38.
[7] 毛 丹,陈 钶,王 柯等.HPLC法测定苦参软膏中苦参碱、槐定碱和氧化苦参碱[J].中成药,2011,33(9):1531-1534.
[8] 阴健,郭力弓.中药现代研究与临床应用[M].北京:学苑出版社,1993:6341.
[9] 吴学渊,刘萍.正交试验设计优选紫草的醇提工艺[J].中国医院用药评价与分析,2008,8(10):750-752.
[10] 校合香,万明,陈洪燕等.均匀设计优化紫草的醇提工艺[J].中国医院药学杂志,2008,28(1):381-384.
[11] 刘晓华,易建勇.紫草提取纯化工艺优选及稳定性研究[J].中药材,2001,24(5):3571-3573.
[12] 杨秀芳.正交实验法优选紫草的提取工艺[J].中成药,2005,27(3):3511-3513.
[13] 陆蕴如,杨钟柯,董育妹.苦参在复方中化学成分变化的研究[J].中国中药杂志,1996,21(7):412-414.
[14] 江海燕, 陈勇, 张辉.苦参不同炮制品中苦参碱和氧化苦参碱含量测定[J].中成药,2001,23(3):185-187.
(责任编辑:傅舒)
Study on extraction process of Kuzi lotion with orthogonal test/
FAN Shi-zhong1, GUO Hua2, ZENG Qian1, TAN Jing1, YUAN Qiang-hua1//( 1.Affiliated Hospital of Chengdu University of Traditional Chinese Medicine, Chengdu 610072, Sichuan;2. Dazhu County Food and Drug Insititute, Dazhou 635100, Sichuan)
Objective: To optimize extraction process of Kuzi lotion. Method: With L9(34) orthogonal test, the investigation factors influencing Zicao alcohol extraction conditions including alcohol volume, extraction time, extraction times were optimized with hydroxy naphthoquinone content as index. The investigation factors influencing water extraction conditions of Kuzi lotion including water volume, boiling times and extraction times were optimized with the contents of oxymatrine and matrine and dry extraction rate as indexes. Result: The optimal alcohol extraction conditions were as follows: reflux extracting 2 times with 10-fold 95% alcohol, 12 hours each time. The optimal water extraction conditions were as follows: extracting 3 times with 8-fold water, 1 hour each time. Conclusion: The optimum extraction process is reasonable, feasible and stable.
Kuzi lotion; hydroxy naphthoquinone; oxymatrine; matrine; extraction process
R 284.2
A
1674-926X(2016)04-005-04
成都中医药大学附属医院基金项目(2009-D-YY-44)
1.成都中医药大学附属医院,四川 成都 610072 2.大竹县食品药品检验所,四川 达州 635100
范世忠(1976-),男,本科,主管药师,研究方向为药剂学及药事管理,
Tel:028-87783251 Email:fanshzh@126.com
2015-8-2

