利用间歇浸没式生物反应器进行慈姑组培快繁研究
高美萍,林志城,张 驰,江 文,何芳练,杨 柳,韦绍龙*
(1.广西农业科学院生物技术研究所,广西 南宁 530007;2.广西植物组培苗有限公司,广西 南宁 530007;3.广西桂林市平乐县农业局,广西 平乐 542400)
利用间歇浸没式生物反应器进行慈姑组培快繁研究
高美萍1,林志城2,张 驰3,江 文1,何芳练1,杨 柳1,韦绍龙1*
(1.广西农业科学院生物技术研究所,广西 南宁 530007;2.广西植物组培苗有限公司,广西 南宁 530007;3.广西桂林市平乐县农业局,广西 平乐 542400)
以慈姑(Sagittariasagittifolia)茎尖诱导的组培苗为材料,利用间歇浸没式生物反应器(TIBs)开展慈姑组培快繁激素组合的筛选、慈姑不同代数继代材料的培养效果、不同接种密度对慈姑组培增殖影响及不同间歇频率对慈姑组培快繁的影响等组培快繁技术体系研究。结果表明:TIBs系统可以使慈姑组培苗一代增殖19.5倍以上,比传统方法提高3倍以上;培养基含6-BA 3.0 mg/L+NAA 0.01 mg/L的TIBs适合组培苗继代增殖培育;TIBs系统中,以第5代继代材料为宜,接种密度10株/L,间歇浸没频率在10 min/3 h时,最有利于慈姑组培苗的增殖和生长。
慈姑;组培快繁;间歇浸没式生物反应器(TIBs)
慈姑(SagittariasagittifoliaL.)是泽泻科(Alismataceae)慈姑属宿根性水生草本。在我国主要分布于长江流域及其以南各省(区),其中太湖沿岸及珠江三角洲为主产区,长江以北亦有少量栽培。广西是全国优良慈姑品种白慈姑主产区,已有一、两百年栽培历史,其中“桂林白慈姑”以球茎个大、皮白、品质优、无苦涩味,商品性好而闻名国内外。
目前我国慈姑种植方式主要为留种繁殖,以球茎留种过程不仅消耗大量商品慈姑,而且还占用大量田地,同时,因慈姑主产区多年连作,导致病虫害逐年加重,许多优良品种种性退化、产量下降等诸多问题。采用慈姑组培苗繁殖,可保持品种优良种性,节约用种成本,朱红莲等[1-2]对慈姑组织培养研究结果表明,慈姑组织培养继代一代仅增殖3~4倍,且慈姑组培苗内生菌污染特别严重,继代培养2~3次仍可再次出现内生菌污染,影响慈姑的快速繁殖的进展[3];间歇浸没式生物反应器(TIBs)是一种用于植物组织培养和植物次生代谢物研究的系统,其原理是利用液体培养基以经过过滤的空气压力为动力对植物组培苗进行间歇式培养,使材料获得最大的增殖数。该系统自动化程度高,在2个月的培养周期中,材料无需转接,节省人力物力,在组织培养过程中可大为降低生产成本[4-7]。目前有关“桂林白慈姑”组培苗快繁相关技术研究尚未见报道,因此,拟通过采用TIBs系统对慈姑进行组培快繁研究,为慈姑组培苗生产提供理论依据和技术支撑,对解决市场需求及实现慈姑组培苗工厂化生产及对推动慈姑产业的可持续发展具有重要意义。
1 材料与方法
1.1 试验材料
以广西农业科学院生物技术研究所提供的经茎尖脱毒培养的慈姑组培苗“桂慈1号”。TIBs系统参照Lorenzo等[8]设计思路建立。TIBs 系统中培养瓶和储液瓶分别为 2.5和3.0 L 的广口白色玻璃瓶和三角瓶,瓶高分别为26和30 cm,直径为14和15 cm。储液瓶中液体培养基体积均为1.0 L。
1.2 试验方法
1.2.1 TIBs系统与传统慈姑组培方法的比较 传统慈姑组培采用半固体培养方式,培养基采用MS+6-BA 2.5 mg/L+ NAA 0.01 mg/L+白糖25 g/L。TIBs系统各参数参考Lorenzo等[8-9]的设计思路,接种密度为10株/L,间歇频率按浸没10 min 间歇1 h。TIBs系统继代增殖培养6周。传统方法每3 周继代1次,比较两种方法的增殖倍数、萌芽时间、株高、叶片数、生根数。
1.2.2 TIBs系统中慈姑组培快繁激素组合的筛选 试验以第6代继代组培苗,接种密度为10株/L,TIBs系统间歇频率按浸没10 min 间歇1 h,6-BA质量浓度为1.0、1.5、2.0、3.0和4.0 mg/L ,NAA质量浓度为0.01、0.05 mg/L。
1.2.3 慈姑不同代数的继代材料在TIBs系统中的培养效果 利用继代数为1~8 代的组培苗为材料,增殖培养基为MS+6-BA 3.0 mg/L+ NAA 0.01 mg/L+白糖25 g/L,TIBs系统间歇频率按浸没10 min 间歇1 h,接种密度10株/L。
1.2.4 不同接种密度对TIBs系统中慈姑组培增殖影响 试验材料为经5次继代的组培苗,增殖培养基及TIBs系统设计同试验方法1.2.3,接种密度为5、10、15、20和25株/L。
1.2.5 TIBs系统中不同间歇频率对慈姑组培快繁的影响 试验材料为经5次继代的组培苗,增殖培养基同试验方法1.2.3,接种密度为10株/L,TIBs系统浸没间歇频率按浸没10 min 分别间歇1、3、6、12和24 h。
以上各试验培养条件:光照强度1500 lx,培养温度(28±2) ℃,光照16 h/d,黑暗8 h/d。培养基pH 5.0~6.0,增殖培养6周。试验均设每个处理5套TIBs系统,重复3次,采集增殖倍数、株高、萌芽时间、生根数、污染率等,取平均值。试验数据采用SPSS18.0软件SNK法进行统计及多重比较显著性分析。
2 结果与分析
2.1 TIBs系统与传统慈姑组培方法比较
由表1可见,慈姑组培苗1代继代增殖倍数在传统Semi-solid培养方式下为6.3倍,而利用TIBs系统培养,其增殖倍数为19.5倍,两者差异达显著水平(P<0.05,下同)。TIBs系统培养方式下,组培苗的株高、生根数和叶片数等指标均高于传统方法,其中株高、生根数显著高于传统方法,而两种方法下慈姑组培苗叶片数差异不显著(P>0.05,下同)。
2.2 TIBs系统中慈姑组培快繁激素组合的筛选
从表2可以看出, 当NAA添加浓度固定时,慈姑组培苗的增殖倍数均随着6-BA添加浓度增加而增加。当NAA添加浓度为 0.05 mg/L时,6-BA添加浓度为4.0 mg/L处理的组培苗增殖倍数(22.7)显著高于其他处理,1.0 mg/L处理组培苗增殖倍数(10.5)显著低于其他处理, 2.0 和3.0 mg/L2处理之间增殖倍数差异不显著,且均显著高于1.5 mg/L处理。当NAA添加浓度为0.01 mg/L时,6-BA添加浓度为4.0 mg/L处理的组培苗增殖倍数(25.3)显著高于其他处理,1.0 mg/L处理组培苗增殖倍数(12.6)显著低于其他处理, 1.5和2.0 mg/L 2处理之间增殖倍数差异不显著,且均显著低于3.0 mg/L处理。当NAA添加浓度固定时,不同6-BA添加浓度处理间,慈姑组培苗株高、叶片数和生根数差异均不显著;NAA添加浓度为0.05 mg/L处理慈姑组培苗生根数均显著多于0.01 mg/L处理。同时,在研究过程中观察发现,当6-BA浓度达 4.0 mg/L 时,虽然增殖倍数多,但其植株较细,长势稍逊,且出现一部分玻璃化苗,这可能与6-BA浓度高有关。为降低组培苗变异率,保证组培苗质量,又不影响增殖倍数,选择6-BA 3.0 mg/L +NAA 0.01 mg/L效果较好。

表1 TIBs系统与传统慈姑组培方法比较
注:同列数据后*表示差异达显著水平(P<0.05)。
Note:* in the same column meant significant difference(P<0.05).
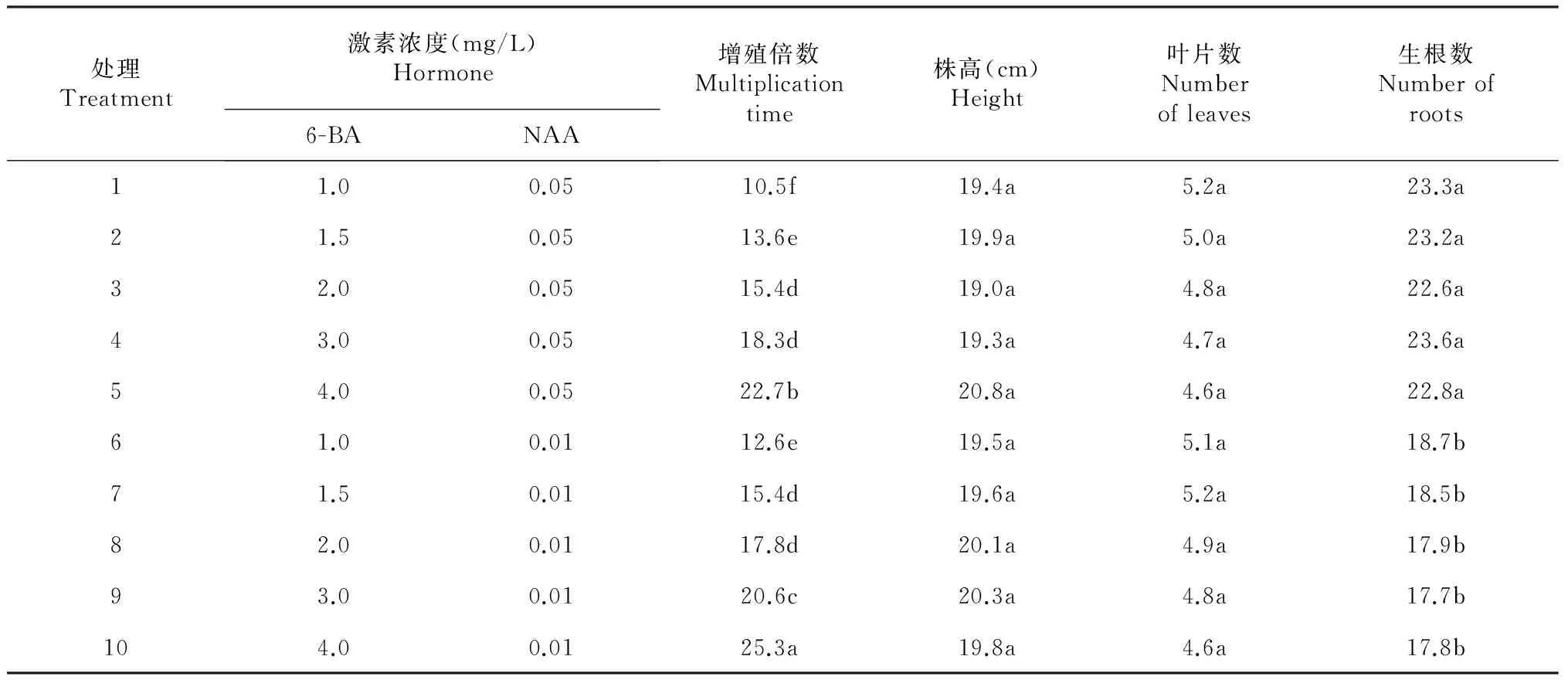
表2 TIBs系统中慈姑组培快繁激素组合的筛选
注:同列数据后不同小字母表示差异达5 %显著水平。下同。
Note:Different capital and small alphabets in the same column meant significant difference at 5 %.
2.3 慈姑不同代数的继代材料在TIBs系统中的培养效果
从表3可知,在第3代以前的材料增殖倍数为7倍左右,从第4代开始显著增加,其中第5代材料增殖倍数为19.5,显著高于前4代材料,且与第6~8代材料差异不显著。在TIBs系统中,为保证慈姑组培苗有足够材料又不影响增殖条件下,选择第5代苗为继代材料进行快繁较好。在1~5代,随着代数的增高,萌芽的时间呈缩短趋势,但差异不显著,均为3 d左右,在第6~8代,萌芽时间推迟,为5 d左右;不同继代材料对叶片数、株高影响不显著。前6代污染率均为0,第7和8代污染率分别为15.00 %和17.00 %。
2.4 不同接种密度对TIBs系统中慈姑组培增殖影响
从表4结果可以看出,在TIBs系统中,慈姑组培苗增殖倍数随接种密度增加呈先增大后减少的趋势;其中接种密度为15株/L处理,增殖倍数最大(20.9倍),显著高于除10株/L处理外的其他各接种密度处理,接种密度为10、20和25株/L处理间增殖倍数差异均不显著,且均显著高于5株/L处理。慈姑组培苗萌芽时间随接种密度增加呈缩短趋势,其中25株/瓶处理萌芽用时最少,为2.6 d,显著少于其他处理;5株/L处理萌芽用时最长,为6.2 d,显著高于其他处理;10~20株/L处理间萌芽时间差异不显著,均为4.0 d左右。不同接种密度对慈姑组培苗株高、叶片数的影响差异均不显著。培养基污染率随接种密度增加而增加,其中接种密度为5和10株/L的处理污染率均为0。因此,从不影响继代增殖倍数及植株生长,又可降低培养基被污染风险角度综合考虑,选择10株/L的接种密度为宜。
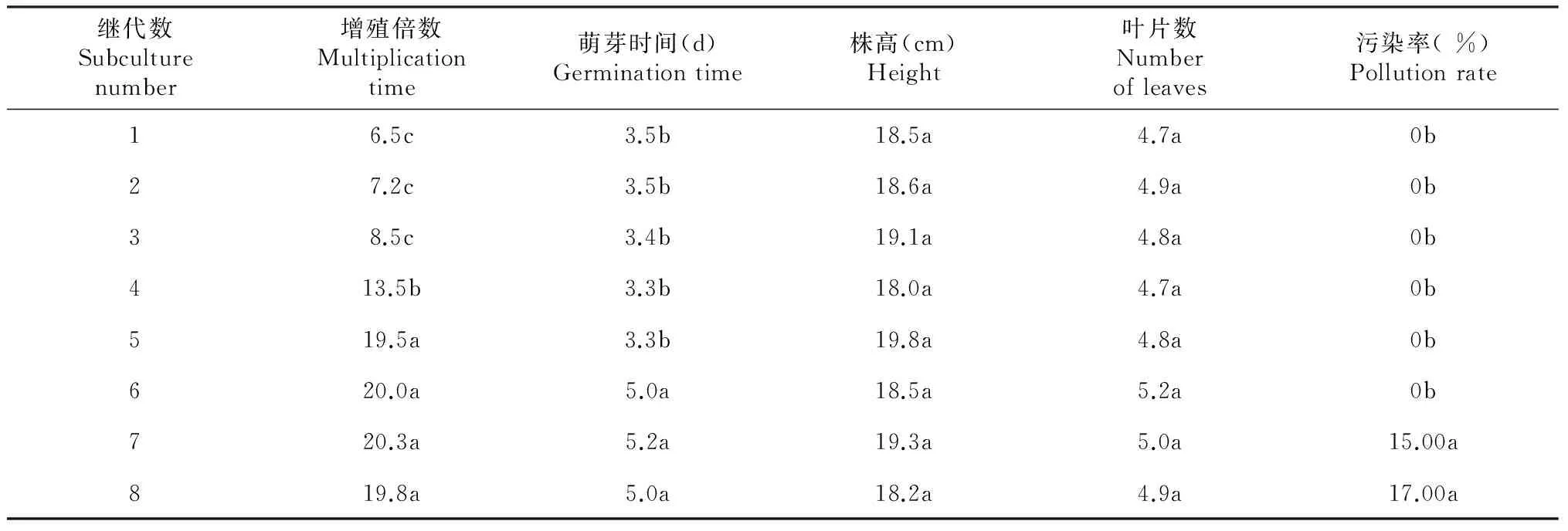
表3 不同代数继代组培苗在TIBs系统中的增殖效果
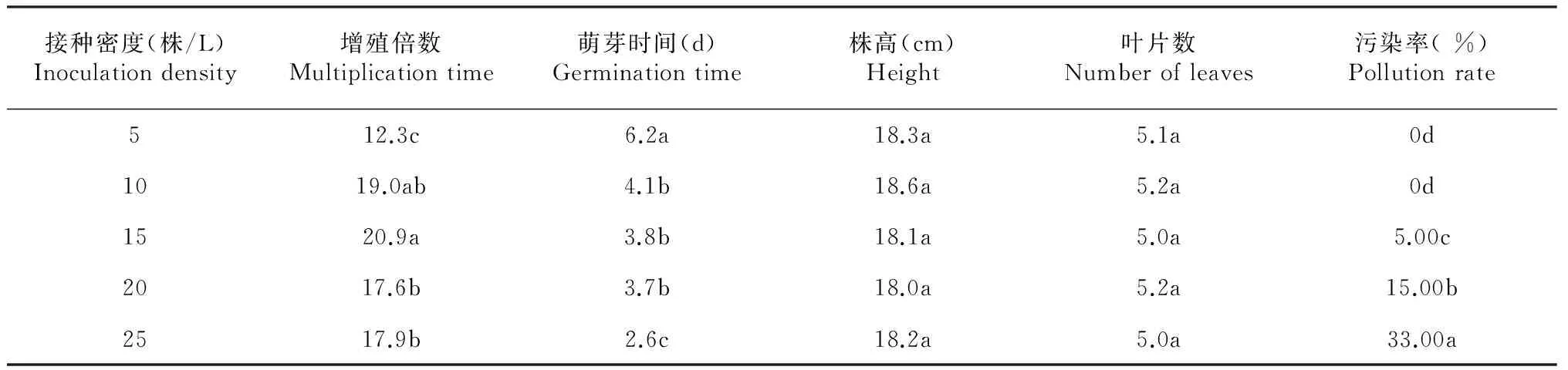
表4 不同接种密度对TIBs系统中慈姑组培增殖影响

表5 TIBs系统中不同间歇频率对慈姑组培快繁的影响
2.5 TIBs系统中不同间歇频率对慈姑组培快繁的影响
在TIBs 系统中,随着间歇频率的降低,继代增殖倍数降低。如表5所示,间歇频率为10 min/h和10 min/3h处理之间的增殖倍数差异不显著,且均显著高于其余各处理;不同间歇频率处理对萌芽时间影响差异不显著,均在3 d左右;组培苗的株高和根长均随间歇频率降低呈增加趋势,且各处理间差异均达显著水平。随着间歇频率的降低,组培苗污染率的风险提高,24 h时,污染率达到20.00 %。综合继代增殖率、同时又能控制低污染率,节约电能等考虑,最优选择间歇频率为10 min/3h。
3 讨 论
TIBs系统培养综合固体培养和液体培养的有点,并对其进行了优化,使培养材料达到最大的增殖数。Angela[10]等将澳大利亚的几个不同甘蔗品种在不同生物反应器进行试验比较,发现利用 TIBs 系统的甘蔗组培苗一代增殖率超过20倍。本研究条件下,慈姑组培苗在TIBS系统中继代增殖达19倍以上,远远高于传统方法。在国内,刘丽敏等[14]利用该系统对ROC16和ROC22两个甘蔗品种研究,发现ROC16一代增殖率达40倍, ROC22一代增殖率为30倍。目前国内外利用此套系统研究的作物种类也在不断增加,报道较多的主要有菠萝[11]、香蕉[12-13]、甘蔗[14-15]、桉树[16]、咖啡[17]等。
在利用TIBs进行组培快繁的过程中,不同代数对组培苗的继代增殖效果不同。使用不同代数的继代苗为材料,其组培苗的生长、增殖等状况也不同。Quiala等[18]在利用TIBS进行菠萝组培快繁时研究发现,以第2代继代苗为外植体时,保持了较高的增殖和生长能力,而粟靖等[19]研究发现,以第7代香蕉继代组培苗为材料时,香蕉的生长和增殖达到最好效果。本研究结果表明在控制组培苗变异率情况下,慈姑工厂化生产的代数一般不高于8代效果最好。
接种密度是TIBs系统中重要的调控参数之一。McClelland等[20]报道,外植体数/培养基量、外植体数/容器容积等比值直接影响器官形成与发育,培养过程中适宜的接种密度随植物种类不同而有所差异。笃斯越橘丛生苗(Vacciniumuliginosum)也具有类似特性[21]。杨柳等[13]研究报道,在TIBs系统中接种密度在10~15株/L时组培苗增殖和生长较优。Angela[10]等发现在TIBs系统中接种密度在15~20株/L时效果最好。而本研究结果则表明较低的接种密度(10株/L)既能控制低污染率又不影响组培苗增殖效果。
间歇浸没频率影响植物组培快繁,不同作物对间歇频率要求不同。Marta 等[22]得出的结论是短的浸没时间和高频率浸没能增加栓皮栎体细胞胚的数量和质量(1 min浸没间歇12 h),相反,Raúl等[23]对酒店草研究结果显示,低频率浸泡(每24 h)和短浸泡时间(5 min)比每3和12 h组培增殖产生更好的结果。本实验研究发现,提高间歇浸没频率,有利于降低内生菌污染风险。这可能与高频率的气体交换,及间干间湿的生长环境有关,具体原因有待进一步深入分析。
4 小 结
本研究结果表明,利用TIBs系统进行慈姑组培苗快繁,适宜增殖生长的培养基激素组合为6-BA 3.0 mg/L +NAA 0.01 mg/L,取第5代继代材料,接种密度10株/L,间歇浸没时间10 min/3h,继代增殖倍数达19倍以上。该实验为利用间歇浸没式生物器进行慈姑组培快繁的研究应用,为实现大规模、自动化慈姑组培健康种苗的工厂化生产奠定一定基础,为推广TIBS系统在植物组培中的应用提供了实验依据。
[1]刘玉平,柯卫东.慈姑的组织培养[J]. 植物生理学通讯,2002,38(3):244.
[2]朱红莲,柯卫东,汪李平. 慈姑茎尖组织培养与快速繁殖[J].中国蔬菜,2006(3):17-19.
[3]黄凯丰,时 政.慈姑茎尖组织培养的研究[J].安徽农业科学,2011,39(15):8848-8849.
[4]Benlal A,Maehad O P,Cortegaza L, et al. Priming,integrated into sugarcane propagation technology by Temporary Bioreactor to TIBs[J]. Sugar Technolygy, 2008, 10(1):42-47.
[5]Park S Y, Murthy H N, Paek K Y. Mass multiplication of protocorm-like bodies using bioreactor system and subsequent plant regeneration in Phalaenopsis[J].Plant Cell,Tissue and Organ Culture, 2002, 63(1):67-72.
[6]Arencibia A D, Bernal A, Yang L, et al. New role of phenyl compounds during sugarcane micro-propagation in Temporary. Immersion Bioreactors (TIBs) [J]. Plant Science, 2008, 175(4):487-496.
[7]Zhu L H, Li X Y, Welander M. Optimization of growing conditions for the apple rootstock M26 grown in RITA containers using temporary immersion principle[J]. Plant Cell, Tissue and Organ Culture, 2005, 81(2):313-318.
[8]Lorenzo J C, Gonza L, Escalona B M. Sugarcane shoot formation in an improved temporary immersion system[J]. Plant Cell, Tissue and Organ Culture, 2001,54(1):197-200.
[9]Lorenzo J C, Ojeda E, Espinosa A. Field performance of temporary immersion bioreactor-derived sugarcane plants[J]. In Vitro Cellular & Developmental Biology-Plant, 2003,37(6):803-806.
[10]Angela M, Jean A B, Prakash L, et al. Development of a temporary immersion system (RITA R for mass production of sugarcane Saccharum spp. inter specific hybrids)[J]. In Vitro Cellular & Developmental Biology-Plant, 2009, 45:450-457.
[11]Arago C E, Sealona M,Rodriguez R. Effect of sucrose and carbon dioxide on piantain micropropagation in temporary immersion bioreaetors[J].I In Vitro Cellular & Developmental Biology-Plant ,2010,46:89-94.
[12]Ikram H , Muhammad U D. Effect of immersion systems on chlorophyll contents in micro-propagating banana[J]. African Journal of Biotechnology, 2007,6 (9):1095-1101.
[13]杨 柳,秦 刚,杨丽涛,等. 利用间歇浸没式生物反应器进行甘蔗组培快繁的研究[J]. 华南农业大学学报, 2011(1):37-41.
[14]刘丽敏,李 松,戴友铭,等.甘蔗茎尖脱毒培养技术研究[J].中国糖料,2009(2):18-20.
[15]Escalona M, Lorenzo J C, González B, et al. Pineapple (AnanascomosusL. Merr) micropropagation in temporary immersion systems[J]. Plant Cell Report,1999, 18:743-748.
[16]Mcalister B,Finnie J,Watt M P. Use of the temporary immersion bioreactor system(RITA)for production of commercial Eu-calyptus clones in Mondi Forests [J]. Plant Cell Tissue Organ Culture, 2005(81):347-358.
[17]Herv E, Dechamp E, Barryv E D. Bioreactors in coffee mircro-propagation[J]. Plant Physiology, 2006, 18(1):45-54.
[18]Quiala E, Canal MJ, Meijon M, et al. Morphological and physiological responses of proliferating shoots of teak to temporary immersion and BA treatments[J]. Plant Cell Tissue Organ Culture, 2012, 109(2):223-234.
[19]粟 靖. 利用间歇浸没式生物反应器(TIBs)进行香蕉组培快繁研究[D].南宁:广西大学:2011.
[20]McClelland M T, Smith M A, Vessel L, et al. Losure and explants orientation influence in vitro performance of five woody species[J]. Hortscience,1990, 5(7):797-800.
[21]李铁军,朴炫春,廉家盛,等. 利用生物反应器接触培养法增殖笃斯越橘丛生苗[J]. 林业科学, 2012, 48(11):130-133.
[22]Marta P, Marria A B , Maritza E, et al. Temporary immersion systems (RITA) for the improvement of corkoak somatic embryo genetic culture proliferation and somatic embryo production[J].Trees, 2013, 27:1277-1284.
[23]Raúl V T, Jacqueline C T, Alma R L, et al. Effect of immersion cycles on growth, phenolics content, and antioxidant properties of Castilleja tenuiflora shoots[J]. In Vitro Cellular & Developmental Biology-Plant, 2014 ,50:471-477.
(责任编辑 汪羽宁)
Optimization ofSagittariasagittifoliaRapid Propagation in Temporary Immersion Bioreactors System
GAO Mei-ping1,LIN Zhi-cheng2,ZHANG Chi3, JIANG Wen1,HE Fang-lian1,YANG Liu1,WEI Shao-long1*
(1.Biotechnology Research Institute, Guangxi Academy of Agricultural Sciences, Guangxi Nanning 530007,China;2.Guangxi Plant Tissue Cultured Seedlings Co. Ltd,Guangxi Nanning 530007,China;3.Guangxi Pingle Agricultural Bureau,Guangxi Pingle 542400,China)
A new protocol using temporary immersion bioreactors (TIBs) was established for micro-propagation ofSagittariasagittifolia. The influence of different hormone , sub-cultured , immersion frequency together with inoculation density onSagittariasagittifoliamultiplication in TIBs was carried out in this paper. The resulted showed that more than 19.5 times multiplication rate were obtained in TIBs, which was more than three times higher than that of traditional method. And also better morphological characteristics were obtained in TIBs. TIBs with 3.0 mg/L 6-BA+NAA 0.01 mg/L were good forSagittariasagittifoliaproliferation and growth. In TIBs , the materials from 5thsubcultures resulted in a higher multiplication rate than other subcultures. And the most suitable density inoculums were 10 plantlets per liter. Temporary frequency of 10 min per 3 h was suitable for multiplication. This research provided the theory basis forSagittariasagittifoliafactory production.
Sagittariasagittifolia; Rapid propagation; Temporary immersion bioreactors (TIBs)
1001-4829(2016)11-2704-05
10.16213/j.cnki.scjas.2016.11.035
2016-07-11
广西农业科学院科技发展基金项目(2015JM10);广西农业厅和农科院共建项目(广西平乐慈姑试验站)
高美萍(1985-),福建南平人,助理研究员,主要从事生物技术育种与植物组培快繁技术研究工作, *为通讯作者,E-mail:weishaolong@gxass.net。
S645.9
A

