电针迎香穴对嗅觉障碍大鼠嗅粘膜Ki-67、IGF-1R及嗅球IGF-1表达的影响*
王 强 刘智斌 牛文民 杨晓航 王 渊 朱先伟 刘思洋 王卫刚
陕西中医药大学(咸阳 712046)
·实验研究·
电针迎香穴对嗅觉障碍大鼠嗅粘膜Ki-67、IGF-1R及嗅球IGF-1表达的影响*
王 强 刘智斌△牛文民 杨晓航 王 渊 朱先伟 刘思洋▲王卫刚■
陕西中医药大学(咸阳 712046)
目的:观察电针迎香穴干预嗅觉障碍大鼠嗅粘膜Ki-67、IGF-1R及嗅球IGF-1表达的影响。方法: 取SD雄性大鼠40只,随机分为空白组,嗅觉障碍组,嗅觉障碍+电针迎香穴组,嗅觉障碍+眶下神经切断+电针迎香穴组,每组10只。除空白组外,其余各组均用灌注TritonX-100的方法建立嗅觉障碍,造模成功后进行电针干预10d,用免疫组织化学法及Westernblot法测定组织中Ki-67、IGF-1和IGF-1R的表达水平。结果: 嗅觉障碍模型中嗅黏膜Ki-67、IGF-1R和嗅球IGF-1表达减少(P<0.05),电针迎香穴可以显著增加嗅黏膜Ki-67、IGF-1R和嗅球IGF-1的表达水平 (P<0.05),而电针迎香穴+眶下神经切断组则无显著干预效应。结论 :电针迎香穴干预可以改善TritonX-100诱导的大鼠嗅觉功能障碍,其机制可能与提高嗅觉神经相关细胞因子Ki-67和IGF-1、IGF-1R在嗅黏膜及嗅球的表达有关,且迎香穴的干预效应与三叉神经通路的完整性密切相关。
嗅觉功能减退与多种疾病有密切联系,譬如神经退行性疾病或鼻黏膜炎症相关疾病[1]。神经解剖学表明,鼻黏膜神经上皮层是中枢神经系统神经元和环境直接相连的部位之一,所以通过嗅觉传导通路异常可能会导致中枢神经病变的发生,其可以分为嗅觉部分或完全性减退或异常[2]。而嗅感觉神经元(Olfactory receptor neurons,ORNs)的损伤可以导致不同程度的嗅觉障碍[3]。有文献表明,Ki-67与胰岛素样生长因子-1(Insulin-like growth factor 1,IGF-1)及其受体胰岛素样生长因子-1R(IGF-1R)在嗅感神经元的发生中有重要作用[4]。本实验应用免疫组化及蛋白质印迹法,通过观察嗅球及嗅黏膜中嗅觉相关细胞因子表达的变化,来探讨Triton-100经鼻滴入对大鼠嗅觉功能的影响,以及电针迎香穴对于嗅觉功能障碍大鼠的效应机制,之前的实验我们应用动物行为学证明了电针迎香穴对于嗅觉功能障碍大鼠的改善效果,所以本实验拟进一步阐明迎香穴对嗅觉障碍的干预效应是基于三叉神经通路完整性而发挥作用的。
1 材料及方法 1.1 动物及分组 清洁级SD大鼠雄性大鼠40只,随机分为空白组(Sham),嗅觉障碍组(Model),嗅觉障碍+电针迎香穴组(YXX),嗅觉障碍+眶下神经切断+电针迎香穴组(KXSJ+YXX),每组10只。
1.2 试剂与仪器 小鼠胰岛素样生长因子1(IGF-1)、小鼠胰岛素样生长因子1R(IGF-1R)、Ki-67免疫组化试剂盒(Sigma公司);生物素化山羊抗兔IgG(中山金桥生物有限公司);BA200Digital数码三目摄像显微摄像系统(麦克奥迪实业集团有限公司);2015型转轮式切片机;PHY-Ⅲ型病理组织漂烘仪(常州市中威医疗仪器有限公司);Image-Pro Plus 6.0图像分析系统(美国Media Cybernetics公司)。
1.3 嗅觉障碍模型 将大鼠用0.3%戊巴比妥钠麻醉后,用微量注射器(注射器针头磨钝)对双侧鼻孔一次性灌注100μL 0.7% Triton X-100(PBS配制),灌流时间1min[5]。
1.4 眶下神经切断模型 常规消毒大鼠两侧眶下皮肤区域,沿两侧眶下缘做一水平切口,长约0.5cm,钝性分离皮下脂肪,暴露眶下孔,仔细分离眶下神经及其同名动静脉,避开血管,切断眶下神经。
1.5 电针方法 迎香穴定位[6]:大鼠鼻孔外侧上端,有毛与无毛交界处。电针方法:迎香穴向内上方斜刺0.3cm,电针参数:1mA,疏密波;正极和负极各接一侧迎香穴,刺激时间10min,1次/d。以上电针处理均在造模成功后第1天进行。疗程参照嗅神经切断对ORN的影响的文献[7]制定,确定5d为1个疗程,休息2d,共进行2个疗程,未行电针干预组常规饲养至电针疗程结束。
1.6 组织取材方法 疗程结束后实施组织取材。嗅黏膜采集方法:75%的医用酒精消毒大鼠皮肤,2%戊巴比妥钠完全麻醉后,断头处理。用血管钳将鼻中隔取出,可见嗅区呈黄色的区域,将此嗅区鼻中隔(嗅黏膜和骨质)完整取下,在显微镜下将嗅黏膜完整刮下。参考The Rat Brain嗅球采集方法:采用电钻在前囟前3.2mm 为后界开窗,使左侧嗅球暴露,继而从后界垂直插入取出嗅球[8]。免疫组化和电镜分别给与不同切片处理。
1.7 嗅黏膜Ki-67、IGF-1R表达检测方法 按照常规免疫组化方法处理,包括载玻片防脱片处理、脱蜡、热修复抗原、山羊血清封闭液;滴加1∶200的一抗后,4℃孵育过夜。次日,PBS洗3次后滴加山羊抗鼠/兔IgG二抗,PBS洗后使用DAB试剂盒显色;最后至苏木素复染、脱水、透明及封片。
1.8 图像采集 图像采集应用显微摄像系统,对于采集组织的所有切片,先将其置于100倍镜下进行观察,其次参照嗅黏膜和嗅球组织表达情况进行图像采集,选取1个区域进行镜下400倍观察。
1.9 嗅球IGF-1表达检测方法 采用蛋白质印迹法进行检测,应用试剂盒(上海众生生命科学发展有限公司提供)进行蛋白抽提,匀浆嗅球组织至完全裂解,将裂解液于4℃离心机中离心(10000×g,15min)。用蛋白质定量试剂盒(BCA法,海门碧云天生物技术研究所)及酶标仪(Synergy2)测量562nm各孔光密度值,定量待测样品蛋白浓度。得到样品经电泳,转膜,封闭后加入兔抗IGF-1一抗(Millipore公司,1∶1000)4℃过夜,Tris-HCL缓冲盐溶液(TBST)反复漂洗后加入辣根过氧化物酶(HRP)标记的羊抗兔二抗(美国sigma公 司,1∶5000)室温避光孵育1h,TBST漂洗后用ECL法显影,结果用Bio-RAD Quantity one 图像分析软件进行扫描分析。以IGF-1的目的条带与内参GAPDH条带的比值代表产物的相对表达量。
测定目标图像的平均光密度值,应用SPSS17.0统计分析软件,采用单因素方差分析(one-way ANOVA),所有数据以均数±标准差表示。
2 结 果 2.1 各组大鼠嗅黏膜中IGF-1R的表达
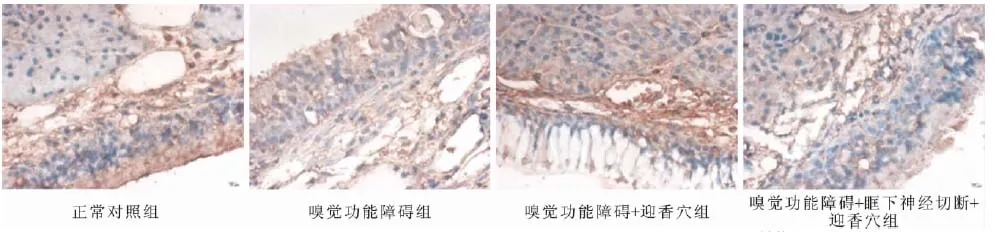
图1 各组大鼠嗅黏膜中IGF-1R阳性表达灰度值(免疫组化染色,IHC×400)

表1 各组大鼠IGF-1R蛋白表达
如图1和表1所示,各组嗅黏膜均可见IGF-1R阳性表达,模型组和空白组比较,嗅黏膜中IGF-1R的阳性表达均显著低于空白组(P<0.05),电针迎香穴组显著提高了IGF-1R在嗅黏膜中的表达(P<0.05),而电针迎香穴干预眶下神经切断模型组大鼠与模型组比较没有明显的变化。
2.2 各组大鼠嗅黏膜中Ki-67的表达

图2 各组大鼠嗅黏膜中Ki-67阳性表达灰度值(免疫组化染色,IHC×400)
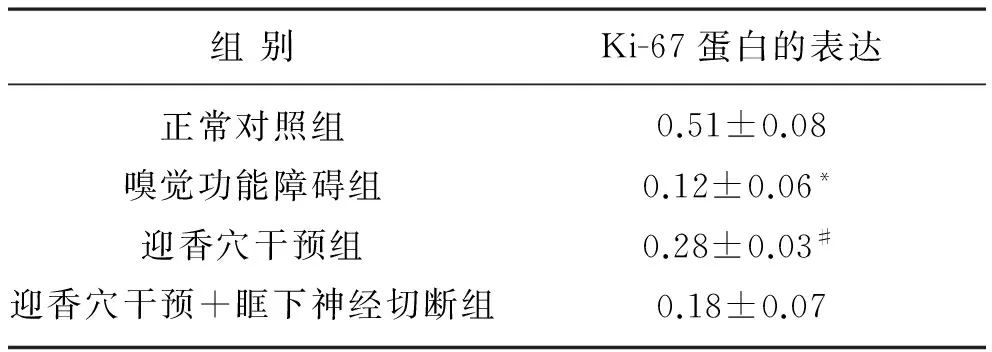
表2 各组大鼠Ki-67蛋白表达
如图2和表2所示,模型组和空白组比较,嗅黏膜中Ki-67阳性表达均显著低于空白组(P<0.05),电针迎香穴组显著升高了Ki-67在嗅黏膜中的表达(P<0.05),而电针迎香穴干预眶下神经切断模型组大鼠与模型组比较没有明显的变化。
2.3 各组大鼠嗅球中IGF-1蛋白的表达

图3 各组大鼠嗅球中IGF-1蛋白的表达

表3 各组大鼠IGF-1蛋白的表达
如图3和表3所示,模型组和空白组比较,嗅球中IGF-1蛋白的表达均显著低于空白对照组(P<0.05),电针迎香穴组显著提高了IGF-1在嗅球组织中的表达(P<0.05),电针迎香穴干预眶下神经切断模型组大鼠与模型组比较没有明显的变化。
3 讨 论 Ki-67通常表达于人增殖细胞的各期,在有丝分裂后Ki-67抗原表达下降,所以,这种抗原被命名为Ki-67抗原,是一类与细胞周期相关的细胞核非组蛋白[9]。在我们的实验中观察到,对于嗅觉障碍模型大鼠嗅黏膜中的Ki-67阳性细胞,其数量较正常组显著降低,而且基底层的这种变化更为明显。位于嗅黏膜基底层中的基底细胞类似神经干细胞,即可以进行分裂增殖,文献表明,在正常生理情况下,嗅感神经元在凋亡以后,新的嗅感神经元能够由基底细胞分化出来,从而维护正常的嗅觉功能,在发生嗅觉障碍的时候,由于Ki-67的表达减少,会导致嗅感神经元再生能力降低,最终导致感受嗅觉的神经元显著减少[10]。电针迎香穴组与模型组比较发现Ki-67的阳性细胞数量显著恢复,结合之前行为学实验结果发现嗅觉障碍同时也得到了明显改善。
胰岛素样生长因子-1R(IGF-1R)及胰岛素样生长因子-1(IGF-1)主要在肝脏产生,与胰岛素同源,同时也具有胰岛素样效应,IGF-1的受体包括IGF-1R。在我们的实验中发现,模型组大鼠嗅黏膜IGF-1R和嗅球IGF-1中的表达量相对于空白组明显降低,提示嗅感神经元数量减少可能是由于IGF-1的作用减弱,进而引发嗅觉障碍加重。结果表明,电针迎香穴可以抑制IGF-1表达减少,这可能是电针干预对大鼠嗅觉障碍改善的机制之一,而与Ki-67表达一样,眶下神经切断后,电针干预组与模型组没有显著性差异。我们发现,嗅觉障碍大鼠的Ki-67和IGF-1及其受体在嗅球以及嗅黏膜上的表达具有正相关,表明二者在促进嗅感觉神经元的再生方面可能具有协同作用,在切断眶下神经后,这些因子的表达同样具有一致性。
嗅觉障碍在中医文献中多以“鼻聋”命名,但由于病因不明,目前没有明确的西医干预手段。我们通过研究证实,由于Ki-67和IGF-1、IGF-1R表达的减少,从而导致了嗅感神经元的再生能力减弱,以至于无法产生足够的神经元来维持正常的嗅觉,而电针迎香穴干预嗅觉障碍的结果表明,其可以抑制上述因子表达的减少。另外,我们通过切断眶下神经,从反面印证了我们的推测,即电针迎香穴是基于三叉神经通路的完整性而发挥对上述因子的良性调控效应的。
[1] 刘巧平,刘建华.针刺内迎香治疗嗅觉下降[J].北京中医药大学学报(中医临床版),2011,18(2):21-22.
[2] Brunert D,Klasen K,Corey E. PI3Kgamma-dependent signaling in mouse olfactory receptor neurons[J]. Chem Senses,2010,35,301-308.
[3] Vent J,Wang DW,Damm M.Effects of traditional Chinese acupuncture inpostviral olfactory dysfunction[J].Otolaryngol Head Neck Surg,2010,142(4):505-509.
[4] KimS,Mammen A.Phosphoinositide and Erk signaling pathways mediate activity-driven rodent olfactory sensory neuronal survival and stress mitigation[J]. Neurochem,2015,134(10):486-498.
[5] 秦照萍,叶树明,杜继曾,等.Triton损伤成年大鼠嗅上皮对嗅球钙结合蛋白-D和小白蛋白表达的影响[J].中国药理学与毒理学杂志,2005,19(3):226-228.
[6] 郭 义.实验针灸学[M]. 北京:中国中医药出版社,2008.
[7] Nathan BP.Olfactory function in apo-E knockoutmice[J].Behav Brain Res,2004,50(2):1-7.
[8] Jonas KO,Maria J,Ingrid E,etal. Long-term episodic memory decline is associated with olfactory deficits only in carriers of ApoE-ε4 [J]. Neuropsychologia,2016,85(3): 1-9.
[9] Koohdani F,Sasani F,Mohammad K.Comparison of Ki-67 antigen expression and K-ras mutation in lung tumours induced by urethane in mice[J].J Sing Med,2009,50(7):729-733.
[10] Szebenyi S,Ogura T,Sathyanesan A. Increases in intracellular calcium via activation of potentially multiple phospholipase C isozymes in mouse olfactory neurons[J].Neurosci,2014,8(10):336-343.
(收稿2016-06-05;修回2016-06-28)
Effects of electroacupuncture of Yingxiang on expression of Ki-67 and IGF-1R of olfactory mucosa and IGF-1 of olfactory bulb in rats with olfactory dysfunction
Shaanxi University of Chinese Medicine (Xianyang 712046)
Wang Qiang Liu Zhibin Niu Wenmin et al
Objective: To observe the effect based on trigeminal nerve pathway of electroacupuncture of “Yingxiang” (LI20) on Ki-67 and IGF-1R of olfactory mucosa and IGF-1 of olfactory bulb of olfactory dysfunction(OD) rats. Methods: 40SD mouses were divided into four groups:control group、model group、OD + LI20group and OD + ONT + LI20group,OD models were established by perfused Triton X-100.10days were taken as one treatment course. We monitored behavioral detection of rats and observed the expression level Ki-67 and IGF-1R of olfactory bulb or olfactory mucosa by immuno histochemistry.Results: According to olfactory dysfunction model,expression of Ki-67 and IGF-1R of olfactory mucosa and IGF-1 of olfactory bulb were significantly decreased by electroacupuncture group(P<0.05),meanwhile,there was no significant difference for electroacupuncture group on ONT of OD rats.Conclusion: Electroacupuncture on LI20had a favorable effect on Triton X-100-induced olfactory disorders,its mechanism might based on increasing the expression of Olfactory nerve related cytokines Ki-67 and IGF-1R of olfactory mucosa and IGF-1 of olfactory bulb,and the intervention effect might be relied on the integrity of trigeminal nerve pathway.
Olfaction disorders/acupuncture-moxibustion Point LI20(Yingxiang) Electroacupuncture Rats Animal experimentation
*国家自然科学基金项目(81273859)
嗅觉障碍/针灸疗法 穴,迎香 电针 大鼠 动物实验
R
Adoi:10.3969/j.issn.1000-7369.2016.11.050
陕西省教育厅专项科学研究项目(11JK0679)
▲西安医学院(西安 710021)
■陕西中医药大学附属医院(咸阳 712000)
△通讯作者

