野生豆腐柴叶总黄酮抗氧化活性研究
曹稳根,段红,翟科峰,徐礼生
野生豆腐柴叶总黄酮抗氧化活性研究
曹稳根,段红,翟科峰,徐礼生

豆腐柴叶;总黄酮;抗氧化活性
豆腐柴(PremnamicrophyllaTurcz)为马鞭草科豆腐柴属多年生落叶灌木植物,是一种具有营养价值和药用价值的野生植物资源,多生于山坡、林下或林缘,主要分布于我国华东、华中、中南、西南各省区,我国野生资源十分丰富。豆腐柴叶蛋白含量高,必需氨基酸组分齐全,且富含维生素C(Vc)、β-胡萝卜素、微量元素等各种营养物质。鲜叶可制成叶豆腐生食或熟吃,其根、茎、叶入药,具有活血散瘀、强筋健骨、驱风止痛的功效,民间常用来治疗腰腿痛、跌打损伤、风湿关节炎及感冒身痛、淋巴节炎、肩周炎、肥大性脊椎炎等症[1-3]。已有的研究表明, 豆腐柴主要含有黄酮类、萜类、酚酸及生物碱等有效成分[4-9]。
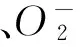
1 实验
1.1 材料与试剂
豆腐柴叶于当年7月采集于安徽省皖南地区,经清水漂洗,室温阴干,粉碎过100-120目筛后贮存于棕色试剂瓶中备用;AB-8大孔树脂购自沧州宝思化工有限公司;芦丁标准品购自中国药品生物制品检定所;1,1-二苯基-2-三硝基苯肼(DPPH自由基)、2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS+自由基)由美国Sigma公司提供;抗坏血酸由国药集团化学试剂有限公司提供;其他试剂均为分析纯。
1.2 仪器与设备
U-3310型紫外分光光度计,日本Hitachi公司;RE-52型旋转蒸发器,上海青浦泸西仪器厂;HK-04A 200g型手提式粉碎机,广州市旭朗机械设备有限公司;CHA-S气浴恒温振荡器,苏金坛市金城国胜实验仪器厂。
1.3 实验方法
1.3.1 标准曲线的绘制
准确称取干燥至恒重的芦丁标准品0.005 g置于小烧杯中,用75%乙醇溶解并定容至100mL容量瓶中即得芦丁标准溶液。分别准确移取上述芦丁标准溶液0.0、2.0、4.0、6.0、8.0、10.0、12.0 mL于7只50 mL容量瓶中,用75%乙醇补充至20.0 mL,加入5%的NaNO2溶液2.0 mL,摇匀,放置6 min 后,加入10%Al(NO3)3溶液2.0 mL,6 min 后再加入4%的NaOH溶液20.0 mL,摇匀后用75%乙醇定容至刻度,放置15 min,备用。在507 nm处测定溶液的吸光度,以芦丁溶液的浓度x(mg/mL)为横坐标,吸光度值y为纵坐标,得回归方程为 y=9.1964x-0.0013,R2=0.9964,总黄酮在0~0.012 mg/mL浓度范围内与其吸光度呈现良好的线性关系。
1.3.2 豆腐柴叶总黄酮粗提液的制备
准确称取过筛的豆腐柴叶粉末5g置于小烧杯中,用少量75%乙醇溶解后移至圆底烧瓶中。在料液比1∶30 (g/ mL) 、乙醇浓度75%的条件下,加热回流提取1h,收集滤液。再用同样方法回流提取1次,合并2次滤液。将收集好的滤液用石油醚萃取至滤液呈亮黄色为止。然后用浓缩定容于250 mL容量瓶中,即得豆腐柴叶总黄酮粗提液,保存于4℃冰箱,备用。
1.3.3 豆腐柴叶总黄酮纯化液的制备
1.3.3.1 AB-8大孔树脂的预处理见参考文献[13]。
1.3.3.2 AB-8大孔树脂分离纯化液的制备。精密称取处理过AB-8大孔树脂2 g, 湿法装入树脂柱中,控制上样液流速1 mL/min,加入豆腐柴叶总黄酮粗提液25 mL进行动态吸附。待树脂充分吸附饱和后,控制流速0.5 mL/min,用90%乙醇20 mL进行解吸附。收集解吸液即为豆腐柴叶总黄酮纯化液。按标准曲线绘制方法操作,平行测定3次,根据回归方程计算豆腐柴叶总黄酮纯化液的质量浓度。
1.3.4 豆腐柴叶总黄酮对DPPH·自由基的清除作用。参照文献[14]修改如下:取5支具塞试管,各加0.1 mmol/L的DPPH溶液3mL,然后再分别加入不同质量浓度豆腐柴叶总黄酮粗提液3mL,摇匀,静置30 min。以无水乙醇调零,测定在517 nm处的吸光度Ai。同时测定3 mL无水乙醇和3mL不同质量浓度豆腐柴叶总黄酮粗提液的混合液在517 nm处的吸光度Aj,以及测定3 mL无水乙醇和3 mL DPPH溶液的混合液在517 nm处的吸光度A0。按下式计算DPPH·清除率。再以相同质量浓度豆腐柴叶总黄酮纯化液和Vc做对照,计算清除率。
DPPH·自由基清除率=[1-(Ai-Aj)/A0]×100%
1.3.5 豆腐柴叶总黄酮对·OH自由基的清除作用。参照文献[15]的方法。取7支具塞试管,分别加入0.75 mmoL/L的邻二氮菲溶液1mL、pH7.4 的磷酸缓冲溶液(PBS)3.8 mL,充分混匀后,加入0.75 mmol/L 硫酸亚铁溶液1.5 mL,每加一管立即混匀,然后向其中5管分别加入不同质量浓度豆腐柴叶总黄酮粗提液1mL,混匀。另2支试管分别为损伤管与未损伤管,不加样液。再分别加入0.01% 过氧化氢1mL,未损伤管不加过氧化氢,以蒸馏水补充体积至10.0 mL,于37 ℃水浴加热30 min,在536nm处测定吸光值。按下式计算· OH自由基的清除率。再以相同质量浓度豆腐柴叶总黄酮纯化液和Vc做对照,计算· OH自由基的清除率。
· OH自由基清除率=
[ (A样液-A损伤)/ (A未损伤-A损伤)]×100%

1.3.7 豆腐柴叶总黄酮对ABTS+自由基的清除作用。参照文献[14]的方法。取6支具塞试管,其中5支试管分别加入不同质量浓度的豆腐柴叶黄酮粗提液1mL、ABTS+工作液2mL,补水至5mL;另1支试管用不加粗提液用1mL蒸馏水替代。室温避光放置20 min后,于734 nm处测定粗提液吸光度An,未加样液吸光度A0。按下式计算ABTS+自由基的清除率。再以相同质量浓度豆腐柴叶总黄酮纯化液和Vc做对照,计算ABTS+自由基的清除率。
ABTS+自由基清除率=[(A0-An)/A0]×100%
2 结果与分析
2.1 豆腐柴叶总黄酮含量的测定
准确移取稀释的豆腐柴叶总黄酮粗提液2 mL于50 mL容量瓶中,按标准曲线绘制方法操作,平行测定3次吸光度。根据回归方程求得豆腐柴叶总黄酮粗提液质量浓度为1.0175 mg/mL,总黄酮含量为5.088%。
2.2 豆腐柴叶总黄酮对DPPH·自由基的清除作用
DPPH·自由基是一种较稳定的自由基,当加入样品后,若含有抗氧化物质提供电子与DPPH·自由基配对使其颜色变浅,通过褪色程度就可以衡量清除活性的大小[14]。豆腐柴叶总黄酮粗提液、纯化液及Vc对照液对DPPH·自由基的清除能力见图1。从图1可以看出,在实验质量浓度范围内,随着溶液质量浓度的不断增大,豆腐柴叶总黄酮粗提液、纯化液和Vc对照液对DPPH·自由基清除能力也逐渐增加,但豆腐柴叶总黄酮粗提液、纯化液均强于Vc对照液。其中纯化液对DPPH·自由基的清除能力显著增加,说明纯化液含有清除DPPH·自由基更多的成分。
图1 豆腐柴叶总黄酮对DPPH·自由基的清除作用
2.3 豆腐柴叶总黄酮对·OH自由基的清除作用
· OH自由基是已知的最活泼的活性氧自由基,也是毒性最大的氧自由基。当加入样品后,若含有抗氧化物质便会与邻二氮菲竞争· OH,从而降低有色产物的生成量[15]。从图2可以看出,豆腐柴叶总黄酮粗提液、纯化液及Vc对照液对· OH自由基的清除能力随其浓度的增大而增大,且豆腐柴叶总黄酮粗提液、纯化液强于Vc对照液,纯化液尤为显著。

图2 豆腐柴叶总黄酮对对· OH自由基的清除作用
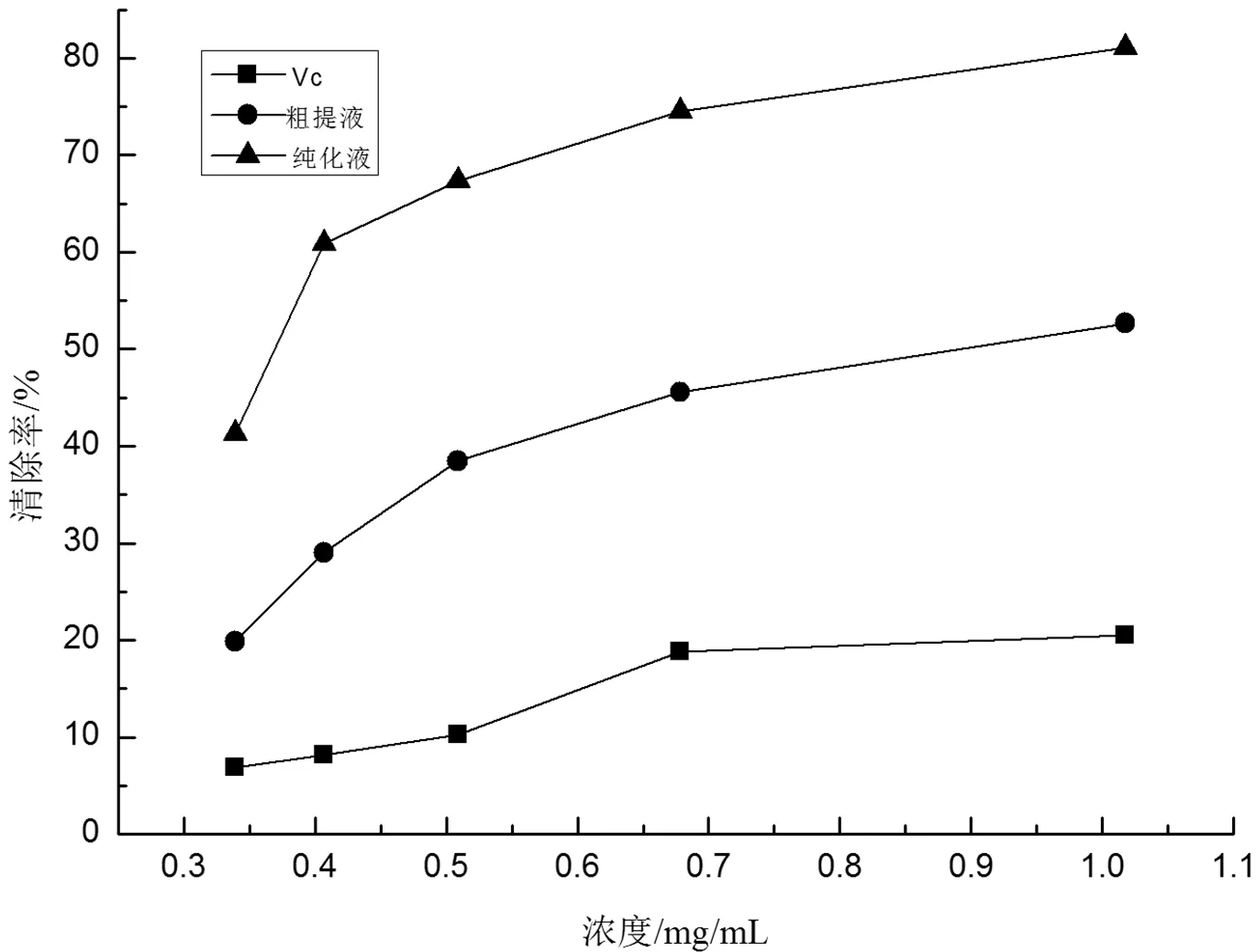
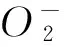
图3 豆腐柴叶总黄酮对·自由基的清除作用
2.5 豆腐柴叶总黄酮对ABTS+自由基的清除作用
ABTS+是一种经氧化后形成的绿色自由基,当加入样品后,当加入样品后,若含有抗氧化物质提供供氢体使其颜色变浅,其褪色程度与抗氧化剂浓度呈正相关[14]。不同质量浓度豆腐柴叶总黄酮粗提液、纯化液及Vc对照液对ABTS+自由基的清除能力见图4。从图4可以看出,豆腐柴叶总黄酮粗提液、纯化液及Vc对照液对ABTS+自由基的清除能力与其质量浓度呈正相关;豆腐柴叶总黄酮粗提液、纯化液对ABTS+自由基的清除能力大于Vc对照液,而且豆腐柴叶总黄酮纯化液尤为显著。
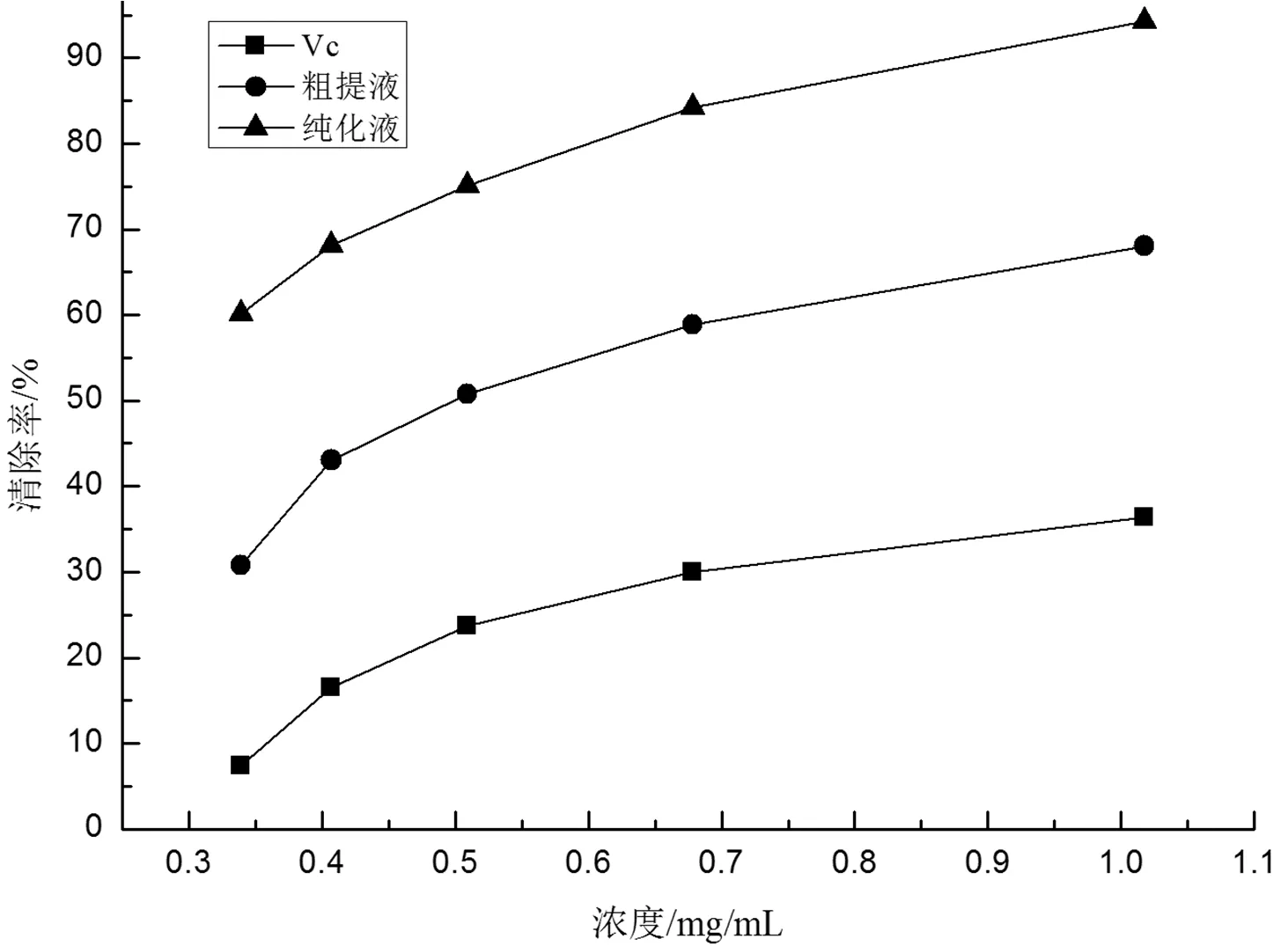
图4 豆腐柴叶总黄酮对ABTS+自由基的清除作用
3 结论
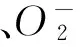
[1] 中国科学院植物所.中国高等植物图鉴(第三册)[M].北京:科学出版社,1985:589.
[2] 曹稳根,蔡红,高贵珍,等.野生豆腐柴营养成分分析[J].生物学杂志,2001,18(4):23-24.
[3] 高贵珍,曹稳根,蔡红,等.野生豆腐柴叶营养成分分析及评价[J].植物资源与环境学报,2003,12(1):60-61.
[4] 李钦,沈月毛,李芹.思茅豆腐柴中的化学成分研究[J].中国药学杂志,2008,43(6):417-419.
[5] 张驰,吴永尧,彭振坤,等.豆腐柴中有效成分复合分离提取研究[J].食品科学,2005,12(8):234-238.
[6] HU Zheng-xi,XUE Yong-bo,YAO Guang-min ,et al. Chemical constituents from the leaves ofPremnamicrophyllaTurcz[J]. Journal of Chinese Pharmaceutical Sciences,2013,22(5):431-434.
[7] 林颖华,吴晓玲,彭荣珍,等.响应面法优化豆腐柴中总黄酮提取工艺[J].中国医药导报,2013,10(8):116-118,134.
[8] 曹稳根,段红,翟科峰,等.正交设计优选豆腐柴叶总黄酮的微波提取工艺[J].光谱实验室,2013,30(5):2174-2178.
[9] 曹稳根,段红,翟科峰,等.超声波法提取豆腐柴根总黄酮的工艺[J].光谱实验室,2014,31(1):38-42.
[10] 黄巧燕,赵文英,戎晋华,等.加压提取菊花中黄酮类成分及其抗氧化活性研究[J].林产化学与工业,2013,33(5):83-87.
[11] 贾学静,李乐,丁春邦,等.响应面法优化微波辅助提取成熟叶老鹰茶总黄酮及其抗氧化研究[J].林产化学与工业,2014,34(3):85-91.
[12] WANG Dong,TANG Wei,YANG Guang-ming,et al. Anti-inflammatory, Antioxidant and cytotoxic activities of flavonoids fromOxytropisfalcataBunge[J].Chinese Journal of Natural Medicines,2010,8(6):461-465.
[13] 王海潮,翟科峰,曹稳根,等.AB-8大孔树脂对豆腐柴根提取物中总黄酮的吸附性能[J].光谱实验室,2012,29(2):1272-1272.
[14] 李帅,胡继荣,刘军军,等.X-5大孔吸附树脂分离纯化黑柴胡黄酮及抗氧化性研究[J].化学与生物工程,2013,30(9):39~43.
[15] 谢晓凤,童莲花,童德胜,等.马齿苋总黄酮的提取及其浓缩汁抗氧化性研究[J].食品工业,2013,38(2):192-197.
[16] 侯学敏,李林霞,张直峰,等.响应面法优化薄荷叶总黄酮提取工艺及抗氧化活性[J].食品科学,2013,34(6):124-128.
责任编辑:刘海涛
Antioxidant Activity of Total Flavonoids fromWildPremnamicrophyllaTurcz Leaves
Cao Wengen, Duan Hong, Zhai Kefeng, Xu Lisheng
The crude and purified product of total flavonoids fromPremnamicrophyllaTurcz Leaves were obtained respectively on the basis of reflu technology and macroporous resin AB-8 dynamic adsorption and desorption technology, the antioxidant activity of total flavonoids fromPremnamicrophyllaTurcz Leaves was evaluated. The results indicated that the scavenging activity of the crude and purified product of total flavonoids fromPremnamicrophyllaTurcz Leaves to DPPH·,· OH,O2-· and ABTS+increased with the increasing of concentrations of total flavonoids fromPremnamicrophyllaTurcz Leaves. Under the same concentration, the scavenging activity of the crude and purified product of total flavonoids fromPremnamicrophyllaTurcz Leaves against the radicals was in the order to DPPH·>ABTS+> O2-·>· OH, and the purified product had better antioxidant activity than the crude product. Total flavonoids from wildPremnamicrophyllaTurcz Leaves had strong antioxidant activities in vitro.
PremnamicrophyllaTurcz Leaves; total flavonoids; antioxidant activity
TQ35;R284.2
A
1673-1794(2016)05-0040-04
曹稳根,宿州学院生物与食品工程学院教授,主要从事生物化学及天然产物化学研究;段红,翟科峰,徐礼生,宿州学院生物与食品工程学院(安徽 宿州234000)。
安徽省高校省级自然科学研究重点项目(KJ2012A264)
2016-03-09

