云南汉族γ-干扰素受体基因多态性与动脉粥样硬化斑块稳定性的相关性
杨天睿,撒亚莲
(云南省第一人民医院:1.内干科;2.基研室,昆明 650032)
云南汉族γ-干扰素受体基因多态性与动脉粥样硬化斑块稳定性的相关性
杨天睿1,撒亚莲2
(云南省第一人民医院:1.内干科;2.基研室,昆明 650032)
目的 探讨云南汉族γ-干扰素受体(IFNGR)的两个氨基酸位点Val14Met和GIn64Arg多态性与动脉粥样硬化(AS)斑块稳定性的相关性。方法 收集该院2014年3月至2015年3月收治的AS斑块不稳定的患者作为观察组,而同期入院的AS斑块稳定/无斑块的患者为对照组。采集患者外周静脉血,提取基因组DNA,通过聚合酶链反应(PCR)产物直接测序法检测IFNGR1 Vall4Met和IFNGR2 Gln64Arg位点的基因型,采用DNAStar、GeneTool软件分析测序结果,用流式细胞术检测患者血浆细胞因子[γ-干扰素(IFN-γ)]的水平。结果 204例当地汉族患者列入研究,其中观察组109例,年龄(76.89±12.08)岁;对照组95例,年龄(65.99±16.32)岁。IFNGR1 Vall4Met 位点在观察组和对照组中均未发现多态性改变。IFNGR2 Gln64Arg在观察组AA基因型频率为51.95%(40/77),AG基因型频率为53.06%(52/98),GG基因型频率为58.62%(17/29);对照组AA基因型频率为48.05%(37/77),AG基因型频率为46.94%(46/98),GG基因型频率为41.38%(12/29),卡方检验P=0.824,IFNGR2基因型AA、AG和GG与AS斑块稳定性没有关系;观察组IFNGR2 A等位基因频率为52.38%(132/252),G等位基因频率为55.13%(86/156),对照组A等位基因频率为47.62%(120/252),G等位基因频率为44.87%(70/156),卡方检验校正P=0.661,IFNGR2等位基因A和G与AS斑块稳定性没有关系。经Hardy-Weinberg遗传平衡检验,该样本人群该基因频率符合遗传平衡法则。观察组血浆中IFN-γ水平为(4.60±1.91)ng/mL,对照组为(4.88±2.10)ng/mL,差异无统计学意义(P=0.318);血浆IFN-γ水平与AS斑块稳定性无相关性(P=0.308)。结论 IFNGR基因多态性不能作为AS斑块稳定性的预警指标。
动脉粥样硬化;γ-干扰素受体;基因;多态性
动脉粥样硬化(atherosclerosis,AS)是一种常见多发疾病,其斑块的不稳定导致斑块破裂、血栓形成及血管阻塞,是急性心、脑血管事件的主要原因,极大的威胁着人民群众的生命健康,防治AS已成为当今医学科学研究的重大课题。γ-干扰素(IFN-γ)是多功能细胞因子,是巨噬细胞、自然杀伤(NK)细胞、血管内皮细胞的活化剂,且具有阻止胶原蛋白合成,抗纤维化的作用。某些基因位点上的多态性会影响基因的转录效率和/或表达产物的功能,不同细胞因子发挥生物学功能均是通过与细胞膜表面受体相互作用最终促进靶基因的表达[1],γ-干扰素表面受体复合物(IFNGR)基因多态性是否影响AS的发生及其斑块稳定性尚不十分清楚,目前已发现的IFNGR多态性位点有IFNGR1 Vall4Met、IFNGR2 Gln64Arg,本研究针对本地区广大汉族人群,通过用聚合酶链反应(PCR)产物直接测序检测以上位点基因型,流式细胞术检测外周血浆Th1型、Th2型细胞因子,探讨炎症介质在AS斑块稳定性中的作用,为明确云南汉族IFNGR基因多态性是否影响AS斑块稳定性提供理论依据,为早期、有效评估斑块稳定性和预警急性心脑血管事件提供有效方法。
1 资料与方法
1.1 一般资料 选取云南省第一人民医院内干科2014年3月至2015年3月收治的汉族患者204例,经颈动脉超声检查和相关临床症状分为AS斑块不稳定组(观察组)和无斑块/AS斑块稳定组(对照组)。其中观察组111例,男65例,女46例,年龄(76.89±12.08)岁;对照组97例,男57例,女40例,年龄(65.99±16.32)岁。
诊断标准为研究对象经颈动脉超声检查,发现内膜-中膜厚度(IMT)≥1.3 mm者即可做出颈动脉粥样硬化斑块的诊断。根据斑块病理类型及超声特点,将斑块分为4型,即硬斑、软斑、扁平斑和溃疡斑。硬斑和扁平斑因表面有钙盐沉积,富含纤维组织属稳定斑块,而软斑与溃疡斑富含脂质及大量的炎性细胞,易脱落出血,属不稳定斑块。患者取头后仰卧位,检查一侧颈动脉时头偏向对侧约45°,分别检查左右颈动脉。探头沿颈动脉走向,自下向上作连续纵、横切面扫查。检测部位包括:颈总动脉(CCA)的远端(颈内、外动脉分叉水平连线下方1.0~1.5 cm),颈内动脉(ICA)起始部(分叉水平上方1.0~1.5 cm)和颈总动脉分叉(BIF),颈外动脉(ECA)。观察颈动脉IMT,有无斑块,斑块的形态、大小及性质,彩色血流显像观察血流是否通畅,色彩明暗程度,有无彩色血流充盈缺损。临床表现中存在冠心病心绞痛、急性脑卒中患者为AS斑块不稳定组(观察组)。冠心病心绞痛诊断符合2012年中国《非ST段抬高型急性冠脉综合征诊断和治疗指南》,具有心绞痛典型症状。脑卒中患者具有明确的脑梗死影像学依据。
1.2 仪器与试剂 运用Philips-iu 22彩色超声诊断仪进行颈动脉超声检查。全血基因组DNA提取试剂盒、PCR扩增和电泳所需试剂购自北京百泰克生物技术公司;细胞因子微球为BD公司TH1/TH2 cytokine kitⅡ试剂盒。Chemidoc XRS化学发光成像系统购自Bio-RAD,Nano Drop2000(ND2000)超微量分光光度计购自Thermo公司,PCR仪为Gene Amp PCR Systeerm 9700,高速冷冻离心机购自日本Hitachi-CR22G,BG-sub MIDI水平电泳仪购自Baygene公司;测序由硕阳科技生物技术公司完成。
1.3 试验方法
1.3.1 基因组的DNA提取及质量鉴定 依照全血基因组DNA提取试剂盒说明书逐步抽提基因组DNA。取2 μL用1.0%琼脂糖凝胶电泳检测DNA的质量,其余分装冻存于-60 ℃冰箱备用。用1.2%琼脂糖凝胶检测外周血DNA的质量,上样2 μL,Marker为DL2000。
1.3.2 引物设计与合成 从Genebank下载序列,用GeneTool软件设计引物。IFNGR1 Vall4Met引物为,F:5′-CAG CGA CCG TCG GTA GCA GC-3′,R:5′-GCC ACG AAC TGA GAC CAC GAT G-3′;扩增片段为722 bp。IFNGR2 Gln64Arg引物为,F:5′-ACC AGT AGG GCC ATC TTT GTA GC-3′,R:5′-TGC CAG TGT AGT TTA AGC CTT CAG-3′;扩增片段为531 bp。内参引物为,F:5′-GCC TTC CCA ACC ATT CCC TTA-3′;R:5′-TCA CGG ATT TCT GTT GTG TTT C-3′;扩增片段为426 bp。
1.3.3 目的片段的PCR扩增及其产物检测分析 PCR扩增体系为20 μL,含2×Taq PCR Master Mix 10 μL,25 μmol/L上游、下游引物各0.25 μL,模板DNA 1 μL,IFNGR1 Vall4Met的扩增条件为95 ℃预变性5 min,95 ℃变性30 s,63 ℃退火45 s,72 ℃延伸60 s,32个循环;72 ℃延伸7 min,4 ℃保存。扩增IFNGR2 Gln64Arg的退火温度为60 ℃;扩增IFN-γ+2 109的退火温度为52 ℃。取2 μL PCR扩增产物进行1.5%琼脂糖凝胶电泳。其余PCR产物送公司测序检测目的片段序列。
1.3.4 PCR产物直接测序 测序引物与PCR扩增引物相同。对PCR产物用乙醇沉淀法纯化,经Bigdye测序反应,用ABI 3730XL测序仪进行测序。 测序结果采用DNAStar、GeneTool软件分析基因型。
1.3.5 流式细胞术检测血浆细胞因子浓度 按试剂盒说明书进行流式细胞仪方案设计,绘制标准曲线。用乙二胺四乙酸(EDTA)抗凝管收集患者外周静脉血1~2 mL,3 000 r/min离心10 min,取0.5~1.0 mL血浆冻存备用。将50 μL血浆和50 μL微球混合液混合,1.5 h后加入T1染色液,孵育1.5 h后,加入Buffer,1 500 r/min离心10 min,去除上清液后加入Buffer,上流式细胞仪,根据分析软件系统测定血浆中IFN-γ水平。
1.4 统计学处理 采用SPSS 20.0统计软件进行数据整理和分析,计算各组的等位基因和基因型频率。对样本及基因型分布频率 用Hardy - Weinberg遗传平衡检验;计数资料的组间比较使用χ2检验,计量资料的组间比较使用t检验,与AS斑块稳定性的相关性用相关分析,以P<0.05为差异有统计学意义。
2 结 果
2.1 Hardy - Weinberg遗传平衡检验 为了确保资料的可靠性,对等位基因频率进行了Hardy-Weinberg平衡定律检验(表1)。
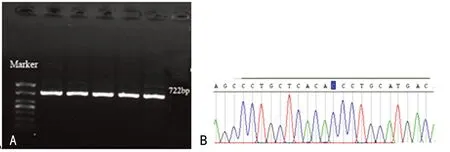
2.2 目的片段的PCR扩增产物及测序分析 对204例患者的外周血DNA样本进行PCR扩增,均扩增到特异性条带,其片段大小与预期结果相符合(图1、2)。
2.3 IFNGR1 Vall4Met、IFNGR2 Gln64Ar基因型频率及等位基因频率的比较 观察组和对照组IFNGR1 Vall4Met均为野生型,位点未见突变。
2.3.1 IFNGR2 Gln64Arg AA、AG和GG 基因型与AS斑块稳定性分析 观察组IFNGR2 Gln64Arg的AA、AG、GG基因型的频率分别为51.95%、 53.06%、58.62%,对照组AA、AG、GG基因型的频率分别为48.05%、46.94%、41.38%,观察组IFNGR2 Gln64Arg的AA、AG、GG基因型频率与对照组比较,差异无统计学意义(P=0.824),见表2。
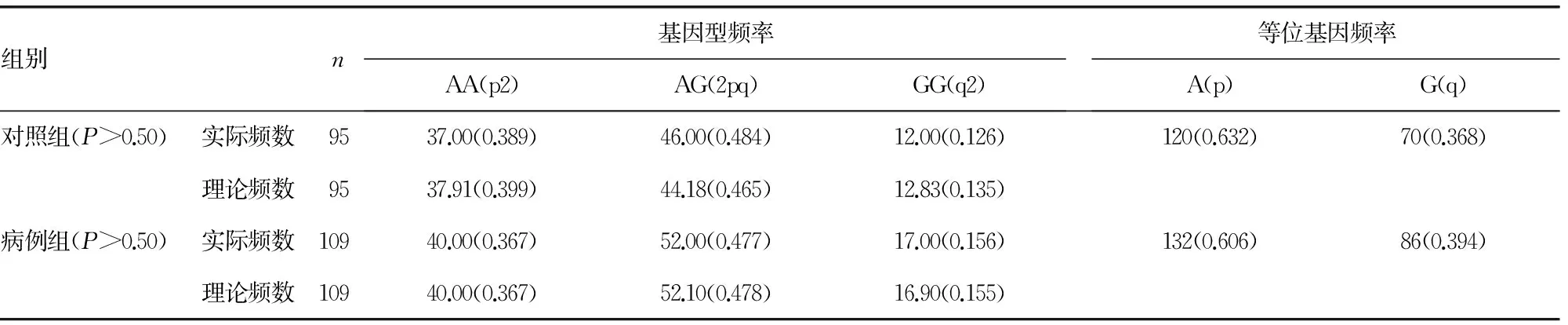
表1 IFNGR2 A/G等位基因频率Hardy-Weinberg平衡定律检验
A:电泳检测IFNGR1的PCR扩增产物;B:IFNGR1 Vall4Met的反向测序图 (CC基因型,野生型)。
图1 PCR扩增产物直接测序检测IFNGR1 Vall4Met
A:电泳检测IFNGR2的PCR扩增产物;B:IFNGR2 Gln64Arg的正向测序图 (AA基因型,野生型);C:IFNGR2 Gln64Arg的正向测序图 (AG基因型,杂合子);D:IFNGR2 Gln64Arg的正向测序图(GG基因型,纯合子)。

图2 PCR扩增产物直接测序检测IFNGR2 Gln64Arg
2.3.3 IFNGR2 Gln64Arg 等位基因A和G与AS斑块稳定性的关系分析 观察组IFNGR2 Gln64Arg的A、G等位基因频率分别为52.38%和55.13%,对照组A、G等位基因频率分别为47.62%和44.87%,观察组IFNGR2 Gln64Arg的A、G等位基因频率与对照组比较,差异无统计学意义(P=0.589),见表3。
2.4 流式细胞术检测血浆IFN-γ的水平 观察组血浆中IFN-γ水平为(4.60±1.91)ng/mL,对照组血浆中IFN-γ水平为(4.88±2.10)ng/mL,观察组与对照组血浆IFN-γ水平比较,差异无统计学意义(P=0.318)。

表3 IFNGR2 A、G等位基因与AS斑块稳定性(n)
2.5 血浆IFN-γ水平与AS斑块稳定性的关系 Pearson相关分析显示,血浆IFN-γ水平与AS斑块稳定性无相关性(P=0.308)。
3 讨 论
目前心血管疾病已经成为威胁人类健康的一大杀手,有研究显示,心血管病的发病率和病死率已经超过了恶性肿瘤,每年全国有超过300万人死于心血管疾病,且发病年龄呈现低龄化的趋势。AS是冠状动脉疾病、脑梗死等血管性疾病的病理基础,因此,防治AS已成为防治心脑血管病的根本性战略措施之一。AS的发病机制尚不十分清楚,有血栓形成学说、脂质浸润学说、细胞因子学说、炎症-损伤反应学说、病毒学说、受体缺失学说和癌基因学说等,但近年来大量的基础和临床研究支持AS是一种慢性炎症和自身免疫性疾病这一新看法[2-3]。IFN-γ是由免疫细胞分泌的多功能细胞因子,能增强抗原提呈、活化T淋巴细胞、巨噬细胞并促进其释放炎性因子,协同其他致炎因子促进粥样病灶处的炎性反应,加速病变进展[4]。另外,IFN-γ尚有阻止胶原蛋白合成的抗纤维化的作用[5],这些是通过与特异的细胞表面受体复合物(IFNGR)结合而发挥作用。
人类DNA序列的变异以单核苷酸多态性(singlenucleotidepolymorphism,SNP)为最常见的遗传变异类型。某些位点上的基因多态性会影响基因的转录效率和/或表达产物的功能,并成为不同人群中一些疾病存在不同发病率或不同临床表现、治疗反应及预后的内在机制[6]。IFNGR是由配体结合链(IFNGR1)和信号转导(IFNGR2)两个亚单位组成的异源二聚体,IFNGR1和IFNGR2存在Val14Met和Gln64Arg氨基酸多态性,并发现它们的基因型与某些疾病(主要为传染性、免疫学疾病)的易感性有关,但目前研究仅限于IFN-γ与AS的相关性研究,IFN-γ多态性及其受体基因多态性与AS及其斑块稳定性研究甚少,本研究旨在明确本地区特定人群血IFN-γ水平及IFNGR多态性与AS斑块稳定性间是否存在相互关系。经检测,研究并没有发现血浆IFN-γ水平及IFNGR多态性位点与AS斑块稳定性有相互关系,血浆IFN-γ及IFNGR基因多态性尚不能作为云南汉族人群AS易损斑块的预警指标。
[1]Gattoni A,Parlato A,Vangieri B,et al Interferon-gamma:biologic functions and HCV therapy(type Ⅰ/Ⅱ)[J].Clin Ter,2006,157(4):377-386.
[2]Virella G,Lopes-Virella MF.Atherogenesis and the humoral immune response to modified lipoproteins[J].Atherosclerosis,2008,200(2):239-246.
[3]Getz GS.Thematic review series:the immune system and atherogenesis[J].J Lipid Res,2005,46(1):1-10.
[4]Whitman SC,Ravisankar P,Daugherty A.IFN-gamma deficiency exerts gender-specific effects on atherogenesis in apolipoprotein E-/-mice[J].J Interferon Cytokine Res,2002,22(6):661-670.
[5]Daugherty A,Webb NR,Rateri DL,et al.Thematic review series:The immune system and atherogenesis[J].J Lipid Res,2005,46(9):1812-1822.
[6]Chevillard C,Henri S,Stefani F,et al.Two new polymorphisms in the human interferon gamma(IFN-gamma)promoter[J].Eur J Immunogenet,2002,29(1):53-56.
Correlation between IFNGR gene polymorphism and atherosclerotic plaque stability in Yunnan Han nationality
YangTianrui1,SaYalian2
(1.DepartmentofGeriatrics;2.BasicResearchRoom,YunnanProvincialFirstPeople′sHospital,Kunming,Yunnan650032,China)
Objective to explore the correlation between interferon-γ receptor(IFNGR)2 amino acid sites Val14Met and GIn64Arg polymorphism and atherosclerosis plaque stability in Yunnan Han nationality.Methods The patients with unstable atherosclerotic plaque in our hospital from March 2014 to March 2015 were collected as the observation group and contemporaneous patients with stable atherosclerotic plaque/ non- plaque as the control group.The peripheral venous blood was collected for extracting genomic DNA.IFNGR Val14Met and GIn64Arg loci genotype was detected by the PCR product direct sequencing method.The sequencing results were analyzed by adopting the DNAStar and GeneTool software.The levels of plasma cytokines(IFN-γ)was detected by the flow cytometry.Results Two hundreds and four native Han patients were included in this study,including the observation group,109 cases,age(76.89±12.08)years old;the control group,95 cases,age(65.99±16.32)years old.The polymorphism change of IFNGR1 Vall4Met loci was not found in the two groups.In the observation group,the frequency of IFNGR2 Gln64Arg genotype AA was 51.95%(40/77),which of AG was 53.06%(52/98)and which of GG was 58.62%(17/29);in the control group,the frequencies were 48.05%(37/77),46.94%(46/98)and 41.38%(12/29),chi-square test,P=0.824.The IFNGR2 Gln64Arg genotypes AA,AG and GG had no relation with atherosclerotic plaque stability.The A and G allele frequencies in the observation group were 52.38%(132/252)and 55.13%(86/156)respectively,which of the control group were 47.62%(120/252)and 44.87%(70/156),chi-square test′sP=0.661.The IFNGR2 Gln64Arg A/G allele had no relation with atherosclerotic plaque stability.By Hardy-Weinberg genetic balance test,the gene frequency in this sample population was in accordance with the genetic equilibrium law.The plasma IFN-γ level in the observation group was(4.60±1.91)ng/mL,which in the control group was(4.88±2.10)ng/mL,the difference was not statistically significant(P=0.318);the plasma IFN-γ content had no relation with atherosclerotic plaque stability(P=0.308).Conclusion The genetic polymorphisms of IFNGR can not serve as a warning indicator of atherosclerotic plaque stability.
atherosclerosis;IFNGR;gene;polymorphism
杨天睿(1972-),硕士,主治医师,主要从事老年病及心血管内科的研究。
��·临床研究
10.3969/j.issn.1671-8348.2016.33.011
R543.5
A
1671-8348(2016)33-4643-03
2016-03-11
2016-06-25)

