三七改善慢性肾脏病大鼠肾脏纤维化的研究*
徐 颖,王 丽,吉琳梅,沈宏春,程偲婧,樊均明,文 丹
(1.西南医科大学附属医院肾病内科,四川泸州 646000;2.西南医科大学附属中医医院 中西医结合研究中心,四川泸州 646000;3.西南医科大学中西医结合学院,四川泸州 646000;4.西南医科大学附属中医医院肾病内科,四川泸州 646000;5.四川大学生物治疗 国家重点实验室,成都 610041;6.西南医科大学,四川泸州 646000)
三七改善慢性肾脏病大鼠肾脏纤维化的研究*
徐 颖1,王 丽2,吉琳梅1,沈宏春3,程偲婧3,樊均明4,5△,文 丹6
(1.西南医科大学附属医院肾病内科,四川泸州 646000;2.西南医科大学附属中医医院 中西医结合研究中心,四川泸州 646000;3.西南医科大学中西医结合学院,四川泸州 646000;4.西南医科大学附属中医医院肾病内科,四川泸州 646000;5.四川大学生物治疗 国家重点实验室,成都 610041;6.西南医科大学,四川泸州 646000)
目的 探讨三七及引经药介导的三七通过调控转化生长因子-β(TGF-β)的表达改善慢性肾脏病(CKD)大鼠肾脏纤维化的作用。方法 将雄性SD大鼠100只随机分为5组:正常组(NOR,n=20)、模型组(CKD,n=20)、三七组(RN,n=20)、三七肉桂组(RNC,n=20)、三七桔梗组(RNP,n=20)。除NOR组外均采用腺嘌呤灌胃方法建立CKD大鼠模型,建模后NOR组和CKD组予以同等体积生理盐水灌胃,RN、RNC、RNP组予以相应药物灌胃,连续4周。4周后处死各组大鼠取血清检测肾功能[肌酐(Scr)、尿素氮(BUN)],取肾脏组织做HE、Masson染色观察各组大鼠肾脏组织病理损伤程度,应用免疫组化法检测肾脏组织纤维连接蛋白(FN)、层黏连蛋白(LN)表达,用Westetn blot法检测肾脏组织转化生长因子-β(TGF-β)、α-平滑肌肌动蛋白(α-SMA)表达。结果 与NOR组相比,模型组肾功能能减退,Scr、BUN显著升高(P<0.01),肾间质出现严重纤维化表现,胶原的沉积增多(P<0.05),肾脏组织TGF-β、α-SMA、FN、LN表达显著升高。与模型组相比,各治疗组肾功改善,Scr、BUN明显降低(P<0.01),肾间质纤维化程度降低,胶原的沉积减少(P<0.05),肾组织α-SMA、TGF-β、FN、LN表达有所回降。其中RNC组作用强于RN组和RNP组。结论 三七及引经药介导的三七均能不同程度延缓腺嘌呤所致CKD大鼠肾间质纤维化的进程,其可能机制是降低TGF-β蛋白表达。
肾间质纤维化 ;慢性肾脏疾病;转化生长因子;三七; 肉桂; 桔梗
慢性肾脏疾病(chronic kidney diseases,CKD)是严重危害人类健康的常见、多发疾病,肾间质纤维化是各种肾脏疾病进展到终末期的共同途径和主要病理机制。肾脏纤维化过程涉及多种细胞生物学和分子信号转导途径。转化生长因子-β(TGF-β)是主要的致肾脏纤维化因子,TGF-β能调控多种细胞的生长、分化、凋亡甚至自噬。相关研究[1-2]表明TGF-β过度表达使肾小管上皮细胞转分化,进而导致肾小管和肾小球的炎症及硬化,在慢性肾脏病的发生、发展中发挥了重要的作用。中医中药在肾脏疾病治疗中有很好的疗效。艾娜等[3]在最新一项临床研究中发现,三七复方结合西医基础治疗能明显提高CKD 3期患者总有效率,改善生活质量。但其具体改善肾脏病的分子机制未明,因此本研究通过建立腺嘌呤诱导的CKD大鼠模型,观察三七及引经药介导的三七对CKD大鼠肾功能、肾脏纤维化及TGF-β蛋白的影响,进一步探讨三七及引经药介导的三七对肾脏保护作用的可能机制。
1 材料与方法
1.1 材料 健康雄性SD大鼠100只,购于西南医科大学SPF动物实验中心,体质量200~250 g,10~16周。三七组药物由三七10 g组成;三七肉桂组药物由三七10 g、肉桂10 g组成;三七桔梗组药物由三七10 g、桔梗10 g组成。药物的购买、质检和制备由西南医科大附属中医院中药制剂室协助完成。各药物组均制备成浓缩剂备用,由专人负责一次性制备完成。经煮沸、过滤、浓缩至每毫升药液含生药2.5 g。免疫组化SP剂盒购自北京中杉金桥生物技术有限公司;TGF-β抗鼠单克隆抗体购自Cell Signaling Technology 公司,FN抗鼠单克隆抗体、α-SMA抗兔单克隆抗体、LN抗兔单克隆抗体均购自Abcam公司。
1.2 动物分组、模型建立及处理 动物随机分成5组:正常组(NOR,n=20)、模型组(CKD,n=20)、三七组(RN,n=20)、三七肉桂组(RNC,n=20)、三七桔梗组(RNP,n=20)。CKD组和RN、RNC、RNP组参照文献[4]采用腺嘌呤(300 mg/kg)灌胃4周的方法建立大鼠CKD模型,建模后RN、RNC、RNP组予以相应药物(3 mL/d)灌胃,NOR组和CKD组予以同等体积生理盐水灌胃,连续4周。于药物干预后4周分别处死各组大鼠,留取血清检测肾功能;同时收集肾脏标本,部分于4%多聚甲醛溶液中固定并用石蜡包埋,部分置于-80℃冰箱冻存备用。
1.3 检测指标及方法
1.3.1 肾脏功能指标测定 腔静脉采血3 mL,离心后取上层血清,采用全自动生物化学仪(Beckman CX7,美国)检测尿素氮(BUN)、肌酐(Scr)。
1.3.2 肾脏病理及纤维化改变 采用HE染色,普通光学显微镜下观察肾脏组织病理改变。Masson染色操作按照常规方法。取Masson染色组织切片参考Mizuguchi等[5]的方法,每个切片选取10个不重复的400倍视野以蓝色胶原沉积为阳性信号,应用Image Pro Plus Software 6.0 图像分析系统软件进行分析,计算肾间质胶原沉积面积与视野内肾小管间质总面积(去除肾小管管腔)的比值,并取平均值。
1.3.3 免疫组化法测定肾脏α-SMA、纤维连接蛋白(FN)、层黏连蛋白(LN)蛋白表达 肾组织常规脱水、包埋、切片后,采用SP法按照实验试剂盒操作说明书检测大鼠肾脏组织中FN、LN蛋白表达。DAB染色、苏木精复染、脱水、透明、封片。 阳性的FN、LN蛋白在细胞质和(或)细胞核中呈棕黄色颗粒。
1.3.4 Western-blot测定肾脏TGF -β蛋白表达 抽提肾脏组织总蛋白,采用BCA法测定蛋白浓度。所得蛋白于100 g/L SDS-聚丙烯酰胺凝胶中电泳,电转至PVDF膜。5%脱脂牛奶常温封闭1 h,洗膜3次,每次10 min;加兔抗大鼠α-SMA多克隆抗体(1∶1 000)4 ℃慢摇过夜;洗膜3次,每次10 min;加HRP标记羊抗兔IgG(1∶3 000)37 ℃ 1 h,洗膜;加鼠抗大鼠TGF -β多克隆抗体(1∶1 000)4 ℃慢摇过夜,洗膜3次,每次10 min;加HRP标记羊抗鼠IgG(1∶3 000)37 ℃ 1 h,洗膜;ECL放射自显影。显影结果使用Quantity One软件进行光密度(OD)值分析,结果用GAPDH校正。

2 结 果
2.1 肾功能检测 实验至药物干预第4周时,CKD、RN、RNP、RNC组大鼠Scr、BUN均较NOR组明显升高(P<0.01)。RN、RNP、RNC与CKD组比较,各指标均有明显降低(P<0.01),说明应用RN、RNP、RNC后,均能降低血Scr、BUN,改善肾功能,见表1。

表1 各组大鼠肾功能指标比较±s)
a:P<0.01,与NOR组比较;b:P<0.01,与CKD组比较。
2.2 肾脏病理损伤及纤维化程度
2.2.1 肾脏HE染色观察 NOR组大鼠肾小管排列整齐,肾间质无异常改变,无纤维组织增生,肾小管管腔内无结晶物沉积;CKD组可见大量肾小管上皮细胞脱落或空泡样变性,高度扩张的肾小管与萎缩的肾小管并存,还可见肾小球明显萎缩,肾小管内有蛋白管型,肾间质纤维化增生,肾间质可见大量炎性细胞浸润。RN、RNP、RNC组肾小管轻度扩张、肾小球萎缩、肾间质轻度纤维化,病变程度均较CKD组轻,见图1。
2.2.2 Masson染色肾间质纤维化面积的定量分析 Masson染色肾间质纤维化面积百分比分别为NOR组11.72%±4.06%,CKD组63.21%±18.17%,RN组45.21%±12.16%,RNP组48.78%±11.34%,RNC组31.16%±10.4%。CKD组的纤维化面积最大,所占肾间质的百分比最高,与NOR组比较差异有统计学意义(P<0.05)。RN、RNP、RNC组肾间质中纤维化面积所占百分比均显著低于CKD组(P<0.05),见图2。
2.3 免疫组化检测肾脏FN、LN蛋白表达
2.3.1 NOR组大鼠FN在肾小球、肾小管基膜上表达,FN在间质几乎不表达,CKD组肾小球、肾小管间质中大量表达,相对于CKD组,各治疗组FN表达均有所下降,RNC组下降最明显,见图3。
2.3.2 NOR组大鼠LN在肾小球、肾小管间质几乎不表达。CKD组肾小球硬化或黏连处有表达,肾小管间质中大量表达,相对于CKD组,各治疗组LN表达均有所下降,RNC组下降最明显,见图4。
2.4 Western blot检测肾脏TGF-β和α-SMA蛋白表达
2.4.1 NOR组肾组织TGF-β微量表达,CKD组表达明显增强,差异有统计学意义(P<0.01)。与CKD组相比,各治疗组TGF-β表达均有所下降,差异有统计学意义(P<0.05),其中RNC组下降最为明显,见图5。
2.4.2 NOR组肾组织α-SMA几乎不表达,CKD组表达明显升高,差异有统计学意义(P<0.01)。与CKD组相比,各治疗组α-SMA表达均有所降低,差异有统计学意义(P<0.05),其中RNC组下降最为明显,见图5。
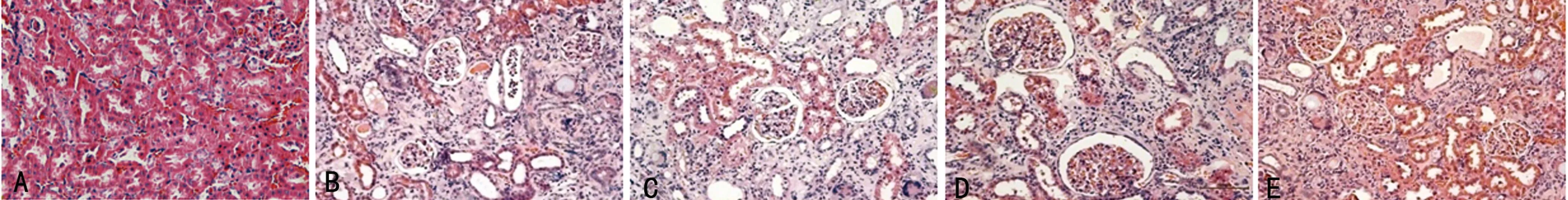
A:NOR组;B:CKD组;C:RN组;D:RNP组;E:RNC组。
图1 各组大鼠肾脏组织HE染色(×200)
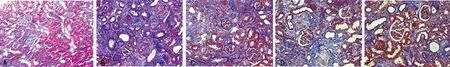
A:NOR组;B:CKD组;C:RN组;D:RNP组;E:RNC组。
图2 各组大鼠肾脏组织Masson染色(×200)
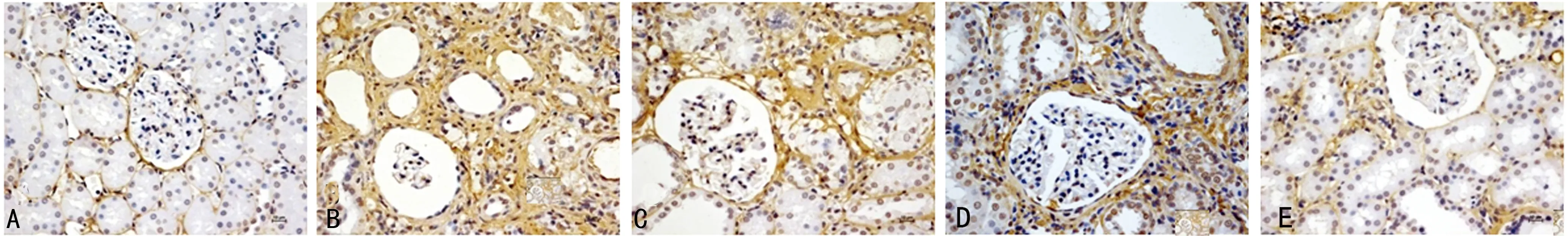
A:NOR组;B:CKD组;C:RN组;D:RNP组;E:RNC组。
图3 各组大鼠肾脏组织FN表达(×400)
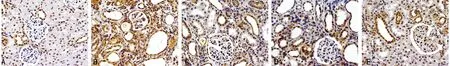
A:NOR组;B:CKD组;C:RN组;D:RNP组;E:RNC组。
图4 各组大鼠肾脏组织LN表达(×400)
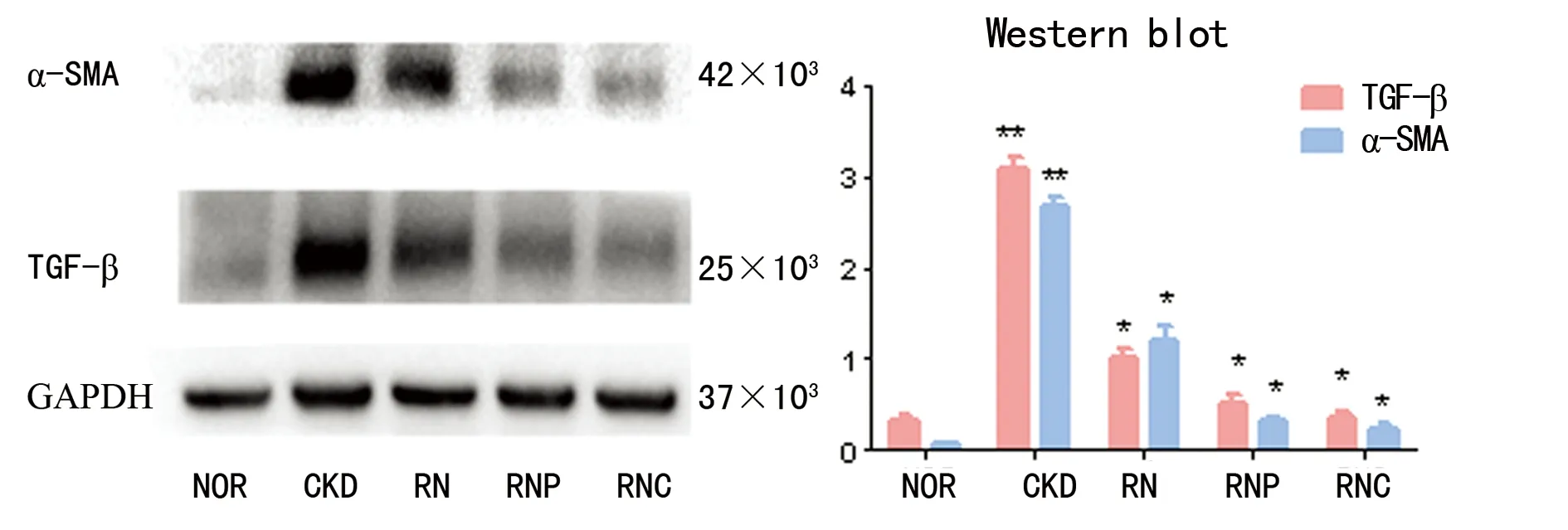
**:P<0.01,与NOR组比较;*:P<0.05,与CKD组比较。
图5 各组大鼠肾脏组织TGF -β和α-SMA蛋白表达
3 讨 论
肾间质纤维化是由各种病因引起的慢性肾脏疾病,逐渐进展至终末期肾衰竭(end-stage renal disease,ESRD)的共同通路,其病理改变主要为肾单位的进行性破坏,同时大量成纤维细胞及肌成纤维细胞增生,细胞外基质产生堆积而导致肾小球硬化和肾间质纤维化,最终导致肾衰竭。因此,抑制肾间质的纤维化,阻断纤维化发展的通路,对CKD的治疗有十分重要的意义。越来越多的证据表明细胞信号传导通路在细胞因子的介导下导致肾纤维化。其中,TGF-β是主要的致肾脏纤维化的因子,TGF-β信号系统调控着各种慢性肾小球损伤的一系列的病理生理过程,介导肾小球的硬化、肾间质纤维化。有研究表明,在糖尿病状态下,肾脏内过多的ROS可使TGF-β信号通路(non-Smad)激活,活化的TGF-β进入细胞核,通过转录因子而影响致纤维化因子的基因转录和蛋白表达,最终促进ECM过度沉积而形成肾纤维化。在本研究中,笔者也发现TGF-β蛋白的表达在CKD大鼠的肾脏组织中明显升高,肾间质出现严重纤维化表现,胶原的沉积增多,α-SMA、FN、LN表达显著升高,且出现明显的肾功能减退。这说明TGF-β信号传导通路可能是肾脏纤维化、慢性肾脏病进展的重要因素之一,针对TGF-β信号通路活化作为靶点的治疗手段,可能成为延缓肾脏病进展的重要措施。
CKD的中医药防治已经成为中西医结合延缓肾脏疾病进展的普遍临床应用及研究热点,而肾间质纤维化作为其主要病理基础,是中医药防治慢性肾脏病的主要切入点。
目前已有关于中医药通过调控TGF-β信号通路改善肾脏纤维化的研究。最近一项关于TGF-β信号通路的研究进一步阐述了其在肾间质纤维化的作用及慢性肾病炎症的分子机制。TGF-β信号通路在调节肾脏组织的炎性反应、改善降低肾小球和肾间质炎性反应损伤的同时刺激了细胞外基质在肾脏组织的沉积,进而导致进行性的肾纤维化。TGF-β还可促进肾小管上皮细胞转分化为肌成纤维细胞,肌成纤维细胞也会导致细胞外基质在肾组织的沉积[6]。来自体内外的研究证据证明利用中和TGF-β抗体、核心蛋白聚糖、反义寡核苷酸阻断TGF-β可以预防或改善肾纤维化。三七在临床上应用于慢性肾小球肾炎、肾病综合征、糖尿病肾病及慢性肾衰竭等各种肾脏疾病的治疗,取得了良好的疗效。其有效成分三七总皂苷可通过抑制肾组织TGF-β信号通路以及降低致纤维化细胞因子及炎症因子蛋白表达水平,减轻肾小球和肾间质炎性反应,从而改善UUO大鼠肾纤维化。本研究中三七及引经药介导的三七均下调了CKD大鼠肾组织TGF-β的表达,改善了肾功能,减少了胶原的沉积,降低了肾组织α-SMA、FN、LN表达,改善了CKD大鼠的肾间质纤维化。
引经、归经理论是中医理论体系的重要组成部分。引经药指药物对机体某部分的选择性作用,即某些药对某些脏腑、经络有特殊的亲和作用,因而对这些部位的病变起着主要或者特殊的治疗作用[7]。从现代医学观点来看中医的引经理论与西医的载体学说有着相似之处。引经药作为药物的定向载体,把药物送到或介导至作用点或靶器官,既充分发挥了对作用点或靶器官的治疗作用,又避免了对其他器官的毒副作用。目前已有研究[8-9]从中医归经和引经理论出发,利用现代医学验证了三七和引经药物介导的三七复方对UUO所致的大鼠肾间质纤维化的抑制作用。本研究中RNC组的疗效优于RN组及RNC组,也从一定程度上揭示了引经药物的靶向治疗作用。
因此,三七及引经药介导的三七可能同样通过调控TGF-β信号通路起到改善肾脏纤维化作用,本实验结果证实了这一猜想。相关研究[10]及本研究发现,在使用三七及引经药介导的三七干预之后,能明显降低CKD大鼠血肌酐和尿素氮,且减轻大鼠肾脏纤维化水平以及病理损伤。同时,对TGF-β的测定发现,药物干预后CKD大鼠肾脏组织内TGF-β的蛋白表达水平均有下降,这说明三七及引经药介导的三七对CKD的肾纤维化产生保护作用,这种保护作用与其对TGF-β抑制所致的纤维化水平降低存在密切联系。
综上所述,笔者认为三七及引经药介导的三七能通过抑制TGF-β的活化,有效地减轻CKD的肾纤维化,减轻肾脏病理损伤,延缓肾功能损伤进展。TGF-β在肾小管间质纤维化发生发展中具有重要的作用,抑制TGF-β的活化有望成为延缓肾脏纤维化的一条良好途径,且为中医药延缓CKD提供较好的理论基础。
[1]Ding Z,Chen Z,Chen X.Adenovirus-mediated anti-sense ERK2 gene therapy inhibits tubular epithelial-mesenchymal transition and ameliorates renal allograft fibrosis[J].Transpl Immunol,2011,25(1):34-41.
[2] Lin L,Zhang H,Zhang HT,et al.Role of integrin-linked kinase in renal tubular epithelial-mesenchymal transition[J].Chinese J Clin,2009(29):909-913.
[3]艾娜,谢席胜,王宝福,等.黄芪三七复方对CKD3期患者肾功能及其生活质量的影响[J].西部医学,2014,26(11):1445-1447.
[4]Boon AC,Lam AK,Gopalan V,et al.Endogenously elevated bilirubin modulates kidney function and protects from circulating oxidative stress in a rat model of adenine-induced kidney failure[J].Sci Rep,2015(5):15482.
[5]Mizuguchi Y,Miyajima A,Kosaka T,et al.Atorvastatin ameliorates renal tissue damage in unilateral ureteral obstruction[J].J Urol,2004,172(6 Pt 1):2456-2459.
[6] Lan HY.Tubular epithelial-myofibroblast transdifferentiation mechanisms in proximal tubule cells[J].Curr Opin Nephrol Hypertens,2003,12(1):25-29.
[7]贲长恩,郭顺根.中药归经理论研究述评[J].北京中医药大学学报,1999,22(2):2-6.
[8]谢席胜,左川,张紫媛,等.引经药物介导三七抗肾间质纤维化及肾靶向作用研究[J].四川大学学报(医学版),2012,43(1):28-33.
[9]谢席胜,冯胜刚,左川,等.黄芪三七合剂对单侧输尿管梗阻大鼠肾间质纤维化的作用研究[J].西部医学,2011,23(10):1854-1858.
[10]胡溪,吴金玉.三七注射液对慢性肾衰竭大鼠肾间质纤维化的防治作用研究[J].广西中医药,2014,37(5):74-77.
Research on radix notoginseng for improving CKD rat renal fibrosis*
XuYing1,WangLi2,JiLinmei1,ShenHongchun3,ChengSijing3,FanJunming4,5△,WenDan6
(1.DepartmentofNephrology,AffiliatedHospital,SouthwestMedicalUniversity,Luzhou,Sichuan646000,China; 2.ResearchCenterofIntegratedChineeandWesternMedicine,AffiliatedHospitalofIntegratedChineeandWesternMedicine,SouthwestMedicalUniversity,Luzhou,Sichuan646000,China;3.CollegeofIntegratedChineeandWesternMedicine,SouthwestMedicalUniversity,Luzhou,Sichuan646000,China;4.DepartmentofNephrology,AffiliatedHospitalofTraditionalChineseMedicine,SouthwestMedicalUniversity,Luzhou,Sichuan646000,China;5.NationalKeyLaboratoryofBiotherapy,SichuanUniversity,Sichuan610041,China6.SouthwestMedicalUniversity,Luzhou,Sichuan646000,China)
Objective To investigate the effects of notoginseng and guiding medicinals mediated notoginseng for improving the renal interstitial fibrosis in rats with chronic kidney disease(CKD)by regulating TGF-β signaling pathway.Methods A total of 100 male SD rats were randomly divided into five groups:normal group(NOR,n=20),model group(CKD,n=20),radix notoginseng group(RN,n=20),radix notoginseng plus platycodi group(RNP)and radix notoginseng plus cinnamon group(RNC,n=20).Except for the NOR group,the CKD rat model in other groups was established by adenine gavage.After modeling,the NOR group and CKD group were given the same volume of normal saline by gavage,while the group RN,RNP and RNC were given corresponding drugs by gavage,for 4 weeks.After 4 weeks,the rats in each group were sacrificed for collecting serum and detecting the renal function(serum Scr,BUN),the renal tissues were taken for conducting HE and Masson staining.Then the renal tissue pathological damage severity was observed.The expressions of FN and LN in kidney tissue were detected by immunohistochemistry and the expressions of TGF-β,α-SMA were detected by Western blot method.Results Compared with the NOR group,the model group exhibited the renal dysfunction(P<0.01),renal interstitial severe fibrosis manifestation and increased collagen deposition(P<0.05),and the expression of kidney tissues α-SMA(P<0.01),TGF-β(P<0.01),FN and LN were significantly increased.Compared with the model group,the renal function in various treatment groups was improved,Scr(P<0.01)and BUN(P<0.01)were significantly decreased,the renal interstitial fibrosis degree was reduced,collagen desposition was decreased(P<0.05),renal tissue α-SMA(P<0.05),TGF-β(P<0.05),FN and LN expression were reduced to some extent,in which the effect of RNC group was stronger than that of the RN group and RNP group.Conclusion Notoginseng and guiding medicinals mediated notoginseng can retard the progression of renal interstitial fibrosis caused by adenine in CKD rat in varying degrees,its mechanism maybe reduce the expression of TGF -β protein.
renal interstitial fibrosis ;chronic renal disease;TGF -β;radix notoginseng;cinnamon;platycodi
��·基础研究
10.3969/j.issn.1671-8348.2016.33.006
四川省泸州市科技局基金资助项目(2013LZLY-J09、2013COLZ-S20);四川省科技项目(14ZC0027)。 作者简介:徐颖(1990-),硕士,主要从事慢性肾脏疾病的相关研究。△
R692
A
1671-8348(2016)33-4625-04
2016-03-26
2016-05-10)

