米曲霉β-半乳糖苷酶系的克隆表达与酶学特性分析
董自星,贾 超,王 君,路福平,王正祥,,*
(1.天津科技大学化工与材料学院生物化工系,天津 300457;2.天津科技大学生物工程学院与工业发酵微生物教育部重点实验室,天津 300457)
米曲霉β-半乳糖苷酶系的克隆表达与酶学特性分析
董自星1,贾 超2,王 君2,路福平2,王正祥1,2,*
(1.天津科技大学化工与材料学院生物化工系,天津 300457;2.天津科技大学生物工程学院与工业发酵微生物教育部重点实验室,天津 300457)
本研究通过对米曲霉的3个β-半乳糖苷酶基因O158、AO及O76进行了克隆与表达,成功构建了相应的重组菌GS115(pPIC-O158)、GS115(pPIC-AO)和GS115(pPIC-O76),并获得相应的重组酶。进一步分析发现,重组酶O158、AO和O76的最适作用pH分别为4.0、5.5和7.0;最适作用温度均为50 ℃;在pH5.0~7.5之间或30~40 ℃均较为稳定。Mn2+对重组酶O158、AO和O76有明显的激活作用,而Fe2+、Cu2+和Zn2+则强烈抑制它们的酶活。O158、AO和O76只对乳糖具有水解与转苷活性,而且AO对乳糖的亲和力和催化效率均高于O158和O76。此外,在所试米曲霉菌种中不存在参照基因组中的β-半乳糖苷酶基因O42。本文系统地对米曲霉的3个β-半乳糖苷酶进行了异源表达及酶学性质的研究,为其大规模生产及工业化应用奠定了基础。
米曲霉,β-半乳糖苷酶,分子克隆,酶学性质
Cloning,expression and biochemical characterization ofβ-galactosidases fromAspergillusoryzae
DONG Zi-xing1,JIA Chao2,WANG Jun2,LU Fu-ping2,WANG Zheng-xiang1,2,*
(1.Department of Biochemical Engineering,College of Chemical Engineering and Materials Science,Tianjin University of Science & Technology,Tianjin 300457,China;2.Key Laboratory of Industrial Fermentation Microbiology,Ministry of Education,
β-半乳糖苷酶(β-Galactosidase,EC 3.2.1.23),是能水解多糖、寡糖或次级代谢产物中的β-半乳糖苷键的一类酶,可将乳制品中的乳糖水解为半乳糖和葡萄糖,用于治疗乳糖不耐受症。某些β-半乳糖苷酶还能催化转糖基反应[1],可生产半乳糖化的产品(galactosylated products)[2]。
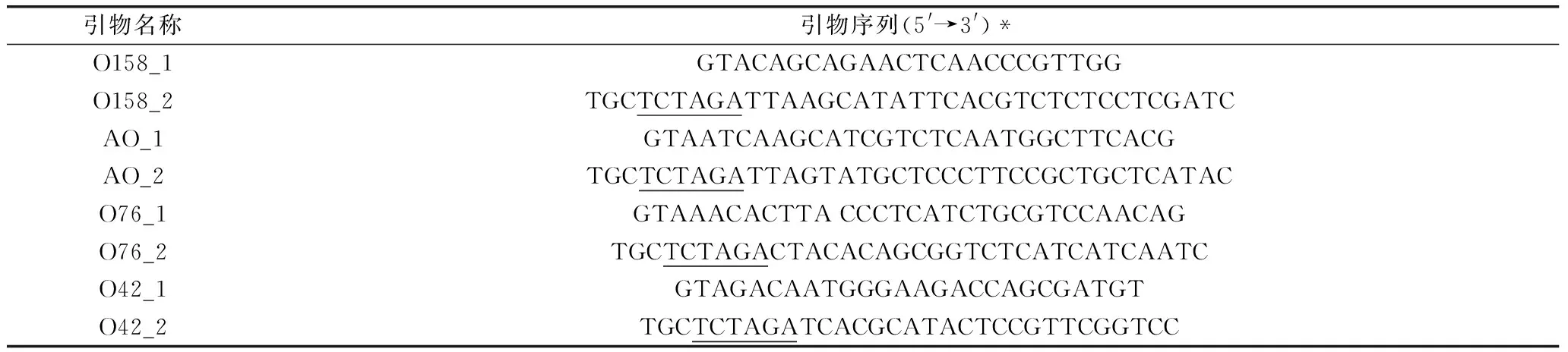
表1 引物序列Table 1 Primer sequence
*注:下划线部分为限制性酶切位点。此外,β-半乳糖苷酶在基因工程、医药、分析检测和环境保护等领域都有着广泛的应用[2-3]。
β-半乳糖苷酶的来源非常广泛,但目前工业上常用的β-半乳糖苷酶主要由克鲁维酵母、曲霉和青霉等发酵制得[3]。克鲁维酵母可以产生大量的β-半乳糖苷酶,但它们均为中性的胞内酶,较难应用于酸性的工业环境;黑曲霉和多色青霉等所产的β-半乳糖苷酶为嗜酸胞外酶,但其产量远低于酵母菌,限制了其在工业上的应用[4]。研究表明,米曲霉具有合成与分泌β-半乳糖苷酶的酶活特征,且其产生的β-半乳糖苷酶具有较高的转糖基活性[5]。米曲霉也成为了工业上β-半乳糖苷酶的主要生产菌株[6]。针对米曲霉来源的β-半乳糖苷酶,目前的研究主要集中在异源表达[7]、酶学特征解析[7-8]、转糖基反应[9]和固定化[10]等方面。
研究显示,单一生物体往往具有多个β-半乳糖苷酶,而且这些酶之间存在性质与功能的差异[11]。本课题组之前对黑曲霉β-半乳糖苷酶家族的研究也揭示了这一特征,但米曲霉菌种中是否也具有与黑曲霉相似的β-半乳糖苷酶家族尚未见文献报道。本研究将米曲霉来源的4个β-半乳糖苷酶进行了克隆表达,并系统研究了其生化特征的异同点,以期为实现其大规模工业化生产与应用奠定基础。
1 材料与方法
1.1 材料与仪器
菌株Pichia pastoris GS115以及质粒pPIC9K Invitrogen公司。大肠杆菌(EscherichiacoliJM109)和米曲霉(AspergillusoryzaeCICIM F1005F) 本实验保藏。大肠杆菌用LB培养基进行培养;米曲霉采用CD培养基进行培养;毕赤酵母及其重组菌的培养基及其培养方法按照Invitrogen的毕赤酵母操作手册进行。
LA Taq DNA聚合酶、限制性内切酶等 宝生物工程(大连)有限公司;T4DNA连接酶、质粒小量提取试剂盒和小量DNA产物纯化回收试剂盒等 Thermo公司提供;RNA抽提试剂盒(High Pure RNA Isolation Kit)以及cDNA 合成试剂盒(Transcriptor High Fidelity cDNA Synthesis Kit) Roche公司产品;胰蛋白胨(Tryptone)和酵母抽提物(Yeast Extract) 英国OXOID公司;G418、生物素(D-Biotin)和无氨基酵母氮源(YNB) 北京索莱宝生物科技有限公司;邻-硝基酚-D-半乳糖吡喃糖苷(ONPG) 上海生物工程有限公司,其它试剂均为国产分析纯。
PTC-200型PCR仪 MJ Research Inc.;凝胶成像仪 美国SYNGENE公司;Gene Pulser Xcell电转仪 美国BIO-RAD公司;恒温水浴锅 郑州长城科工贸有限公司;SBA 40-C生物传感分析仪 山东省科学院生物研究所;Agilent HP 1100高效液相色谱仪 美国惠普公司。
1.2 米曲霉β-半乳糖苷酶系的克隆与表达
1.2.1 毕赤酵母工程菌的构建 米曲霉总RNA的提取与cDNA的制备按照试剂盒说明书进行。基因扩增过程所采用的4对寡核苷酸引物由生工生物工程(上海)股份有限公司合成,其核苷酸序列汇总于表1。PCR产物纯化、质粒、酶切、连接以及电转化等采用实验室常规方法进行[12]。
1.2.2 重组酶的诱导表达与制备 将构建成功的毕赤酵母重组菌GS115(pPIC-O158)、GS115(pPIC-AO)和GS115(pPIC-O76)在YPD平板上进行纯化,挑取单菌落接种于YPD液体培养基中,30 ℃、220 r/min振荡培养至对数生长期(OD600=2~6,约18~20 h)。按1%接种量接入25 mL BMGY培养基中,30 ℃、220 r/min振荡培养至对数生长期(OD600=2~6,约16~18 h)。室温下5000 r/min离心5 min回收酵母细胞,弃上清,将细胞重悬于50 mL BMMY培养基中至OD600=1.0,30 ℃继续培养并开始诱导。每隔24 h补加0.5%的甲醇以维持诱导,同时取样进行酶活测定。发酵结束后,12000 r/min离心10 min收集发酵上清液,即为粗酶液,保存到新的离心管中,-20 ℃保存备用。
1.3 重组β-半乳糖苷酶的酶活测定与酶学特征分析
1.3.1β-半乳糖苷酶的酶活测定 将发酵上清用0.05 mol/L pH5.0醋酸缓冲液稀释,称取0.2 g乳糖加入1 mL酶液,即反应体系中含有20%的乳糖,在50 ℃水浴中反应12 h。反应结束后,在沸水中灭活20 min,再通过生物传感仪检测葡萄糖的含量。β-半乳糖苷酶的活性定义为:在pH5.0、50 ℃下1 h分解乳糖生成1 mmol/L葡萄糖所需的酶量为一个酶活力单位(U)。
1.3.2 最适pH和pH稳定性的测定 将酶用不同pH的缓冲液稀释,以酶活最高者为100%,以相对酶活力对pH作图;将酶用不同pH的缓冲液稀释,25 ℃保温1 h后,测定各自的酶活力,以最适pH下测得的酶活力为100%,以残余酶活力对pH作图,绘制pH稳定性曲线。所用缓冲液为:0.05 mol/L醋酸钠缓冲液(pH3.0~6.5)和0.05 mol/L磷酸缓冲液(pH7.0~9.0)。
1.3.3 最适反应温度和热稳定性的测定 将反应体系分别置于30~80 ℃水浴进行酶促反应以测定其酶活力,以酶活最高者为100%,以相对酶活对温度作图;分别将酶液置于30~80 ℃水浴1 h后,立即置于冰上,测定残余酶活力,以未水浴处理过的酶活为100%,以残余酶活力对温度作图。

表2 米曲霉β-半乳糖苷酶基本特征Table 2 The properties of β-galactosidases from A. oryzae
1.3.4 不同金属离子和化学试剂对酶活的影响 在β-半乳糖苷酶与其底物进行反应的体系中,加入终浓度为10 mmol/L的不同的金属离子或化学试剂,分别测定加入不同金属离子或化学试剂后各反应体系中β-半乳糖苷酶的相对酶活,以不加金属离子和化学试剂的反应体系的酶活定义为100%。
1.3.5β-半乳糖苷酶动力学参数的测定 在0.05 mol/L pH5.0缓冲体系中,加入不同浓度的乳糖底物。反应1 h后,用生物传感仪测定葡萄糖含量,计算出不同底物浓度的反应速率。利用软件Origin 8.0对数据进行拟合得到米氏方程,并计算出酶反应的Km、Vmax、kcat和kcat/Km。
1.4 底物特异性与反应产物分析
在1 mL酶促反应体系中,加入终浓度为20%(w/v)的不同的底物,并加入经适当稀释的酶液。在50 ℃水浴锅中反应12 h,将反应液经过适当稀释,进行高压液相色谱分析。色谱条件:流动相为乙腈∶水=65∶35(体积比)。色谱柱:TSK-GEL G3000PWXL-CP(7.8 mm×300 mm,7 μm)。柱温25 ℃,流速:1.0 mL/min。检测器:蒸发光散射检测器,其漂移管的温度为90 ℃,气体流速:2.2 mL/min。进样量:10 μL。低聚半乳糖标准品由本实验室制备,使用前进行适当稀释。
1.5 米曲霉基因组中β-半乳糖苷酶系的生物信息分析与比对
从NCBI(http://www.ncbi.nlm.nih.gov/)中获取不同来源的β-半乳糖苷酶的氨基酸序列。利用Clustal X2软件对这些序列进行多序列比对,并通过软件MEGA 4.0以邻近法(Neighbour-joining)构建进化树,分析它们亲缘关系的远近[13]。通过软件BioEdit对米曲霉来源的β-半乳糖苷酶的氨基酸序列进行比对和分析。
2 结果与分析
2.1 米曲霉β-半乳糖苷酶的基因克隆与序列分析
依据A.oryzaeRIB40的基因组序列信息(EMBL BA000049~BA000056),采用BLAST等分析方法,获得了4个可能编码β-半乳糖苷酶的基因,分别重新命名为O158、AO、O76和O42(表2,其中在参照基因组中的β-半乳糖苷酶基因O42在所试米曲霉菌种中不存在)。进一步制备米曲霉cDNA,以此为模板PCR扩增β-半乳糖苷酶并成功克隆入pPIC9K,获得重组质粒pPIC-O158、pPIC-AO和pPIC-O76。通过测序结果可知,O158的测序结果比原始序列多出75个核苷酸残基(即25个氨基酸),且另有3个氨基酸不同;而AO和O76的测序结果与原始序列保持一致(表2)。
利用MEGA 4.0将不同来源的β-半乳糖苷酶的氨基酸序列进行比对和进化树的构建,结果汇总于图1。此进化树反映了不同来源的β-半乳糖苷酶之间的遗传距离。其中,3个米曲霉来源的β-半乳糖苷酶分属3个不同组合,相对而言O158与AO的相似度高一些。进一步分析发现,O158、AO和O76分别与来源于A.niger、A.candidus以及A.flavusAF70的β-半乳糖苷酶具有较高相似度。
以AoAO的三维结构[14]为参照,通过氨基酸序列比对对AoO158和AoO76的保守区进行分析和比较,结果如图2所示。AoO158与AoAO具有较高的序列相似度,且具有相似的结构域(Domain 1到6)。其中,第一个结构域(Asp40~Thr397)为催化功能区,具有(α/β)8桶状结构。它们的保守区组成为:作为酸/碱催化剂的Glu200和作为亲核剂的Glu298。而AoO76比AoAO和AoO158少了一个结构域(Domain 6),且其与AoAO中的Glu200和Glu298对应的氨基酸残基分别为Pro196和Ala307。
2.2β-半乳糖苷酶的重组表达与重组酶的酶学特征
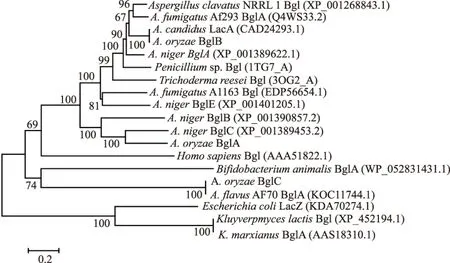
图1 进化树描述不同来源的β-半乳糖苷酶的遗传距离Fig.1 Phylogenetic tree describing the genetic distances among β-galactosidases from different microorganisms注:米曲霉来源的β-半乳糖苷酶用黑体表示;采用Jones-Tay-Thornton(JTT)距离矩阵模型计算遗传距离。

图2 不同来源的β-半乳糖苷酶的氨基酸序列比对Fig.2 Multiple sequence alignment of β-galactosidases from different microorganisms注:保守的氨基酸、保守的替换和半保守的替换分别用星号、分号和点表示;圆矩形表示的是前蛋白序列;AoAO中的1~6个结构域依次用矩形、下划线、浅灰色、灰色、深灰色和黑色表示;AoO158、AoAO、AoO76、AnBglA和AfBglA分别为A. oryzae O158、A. oryzae AO、A. oryzae O76、A. niger BglA以及A. flavus AF70 BglA。
将上述构建获得的重组质粒pPIC-O158、pPIC-AO和pPIC-O76分别线性化后,转化毕赤酵母GS115,获得重组菌GS115(pPIC-O158)、GS115(pPIC-AO)和GS115(pPIC-O76)。采用摇瓶发酵实验,在甲醇的诱导下进行酶液制备。发酵持续120 h,离心收集酶液并经冻干获得重组β-半乳糖苷酶O158、AO和O76。通过酶活测定发现,这三个重酶的酶活分别为0.35,0.30 U/g和0.28 U/g。同步以pPIC9K质粒转化毕赤酵母GS115获得含有空白质粒的重组菌,其发酵液检测不到β-半乳糖苷酶酶活。
2.2.1 重组酶的最适作用pH及pH稳定性 在不同pH反应条件下分析重组酶O158、AO和O76的酶活力,结果汇总于图3A。O158、AO和O76的最适作用pH分别为4.0、5.5和7.0。O158具有相对宽泛的pH作用范围(pH3.5~7.0),在该pH范围内相对酶活在80%以上。而AO在pH低于5.5或高于6.0时,酶活会急剧下降;O76在pH低于6.5或高于7.5时,酶活也会急剧下降。因此,AO和O76的酶活力较O158更容易受pH的影响。
pH稳定性实验的结果如图3B所示。在25 ℃、不同pH的缓冲液中放置1 h后,O158、AO和O76残留的酶活在80%以上的pH范围分别为4.0~8.5、3.5~7.5和5.5~8.0。与AO和O76相比,O158在较宽泛的pH范围内相对酶活稳定。
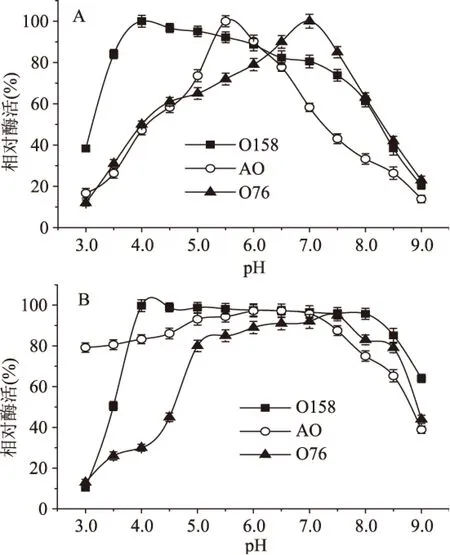
图3 β-半乳糖苷酶的最适作用pH及pH稳定性Fig.3 pH optima and pH stability of β-galactosidases注:A:最适作用pH;B:pH稳定性。
2.2.2 重组β-半乳糖苷酶的最适作用温度及热稳定性 在不同温度下测定β-半乳糖苷酶的酶活,结果汇总于图4A。米曲霉来源的3种β-半乳糖苷酶O158、AO和O76的最适作用温度均为50 ℃。当温度低于50 ℃或者高于50 ℃时,酶活力会显著下降,温度变化对三者酶活力影响都较大。
重组酶的热稳定性结果汇总于图4B。在不同的温度下孵育1 h后,重组酶O158、AO和O76残留的酶活随着温度的上升显著降低。
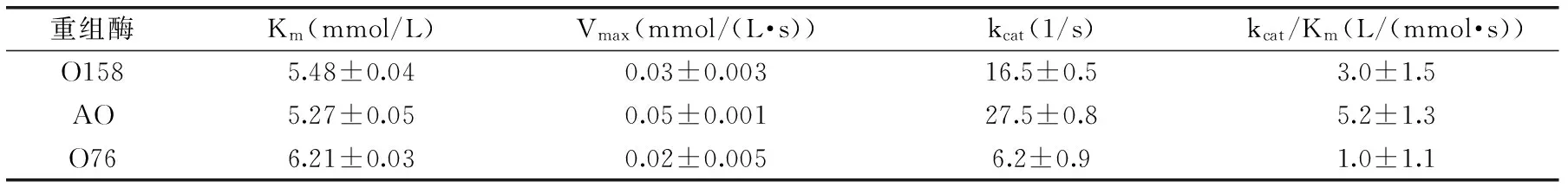
表4 重组β-半乳糖苷酶的动力学参数Table 4 Kinetic parameters of recombinant β-galactosidases
这三种酶残留的酶活在80%以上的温度范围分别为30~50、30~40、30~40 ℃;残留酶活小于40%的温度范围分别为60 ℃以上、70 ℃以上和70 ℃以上。此外,在30~50 ℃内,O158的稳定性优于AO和O76;而在60~80 ℃时,O158的稳定性低于AO和O76。
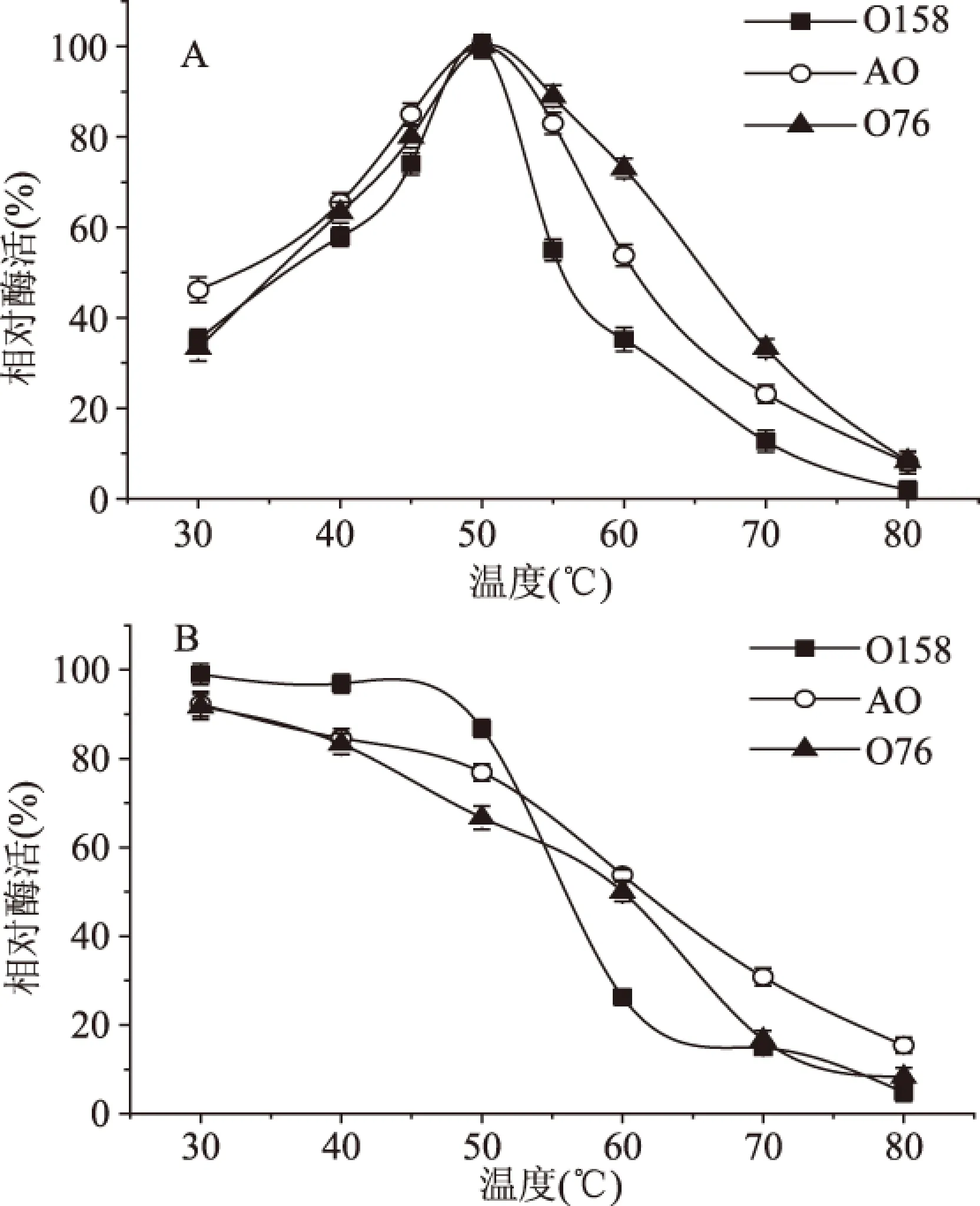
图4 β-半乳糖苷酶的最适作用温度及pH稳定性Fig.4 The optimal temperature and stability of β-galactosidases注:A:最适作用温度;B:热稳定性。
2.2.3 金属离子和化学试剂对重组β-半乳糖苷酶活性的影响 在酶促反应中加入不同的金属离子或化学试剂(终浓度10 mmol/L),研究其对O158、AO和O76酶活的影响,结果汇总于表3。只有Mn2+对三者的活性有明显促进作用。Fe2+、Cu2+对三者的活性有明显抑制作用,EDTA和Zn2+对三者的活性有轻微的抑制作用。Ca2+、K+对O158和O76有微弱的抑制作用,而对O76的酶活没有影响。而Co2+、Na+对O158及O76没有影响,但是对O76有轻微的抑制作用。此外,Mg2+对三者的活性均无影响。
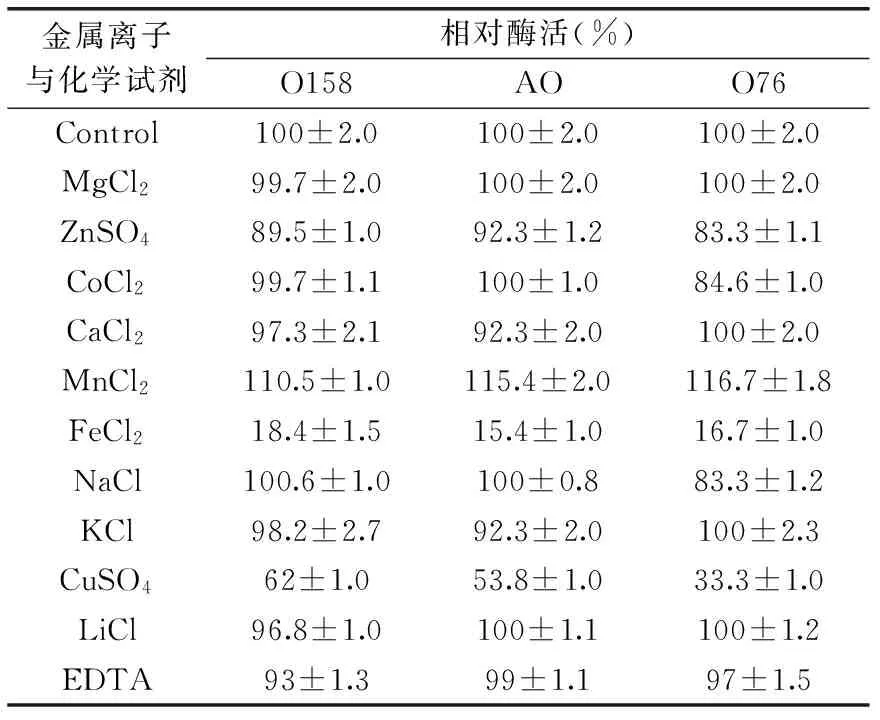
表3 金属离子及化学试剂 对重组β-半乳糖苷酶活性的影响Table 3 Effect of metal ions and chemicals on enzymatic activity of recombinant β-galactosidases
2.2.4 米曲霉β-半乳糖苷酶动力学参数与比较 以不同浓度的乳糖为底物,其它条件保持不变,测定酶的反应速度。采用双倒数作图法(Lineweaver-Burk法),分别绘制O158、AO和O76水解乳糖的动力学曲线,求出其动力学参数(表4)。结果表明,O158、AO和O76的Km分别为5.48、5.27和6.21 mmol/L;Vmax分别为0.03、0.05和0.02 mmol/(L·s);kcat分别为16.5、27.5和6.2 1/s;kcat/Km分别为3.0、5.2和1.0 L/(mmol·s)。其中,AO的Km最小,Vmax、kcat以及kcat/Km均最大,说明AO对底物乳糖的亲和力大于O158和O76,且具有更高的催化效率。
2.3 米曲霉β-半乳糖苷酶的底物特异性与催化特征分析
分别以乳糖、半乳糖、葡萄糖、木糖、甘露糖、蔗糖、麦芽糖、戊聚糖、低聚木糖及果胶为底物,分别在O158、AO和O76的最适反应pH(分别为4.0、5.5和7.0)和最适作用温度(均为55 ℃)下反应12 h后取样,采用高效液相色谱仪分析反应产物,结果汇总于表5。O158、AO和O76均对乳糖表现出水解与转苷活性,对其它测试底物则未表现出任何活性。其中,O158、AO和O76对乳糖的水解率分别为27.4%、19.0%和51.1%;对乳糖的转苷率分别为3.2%、3.1%和2.3%(图5)。
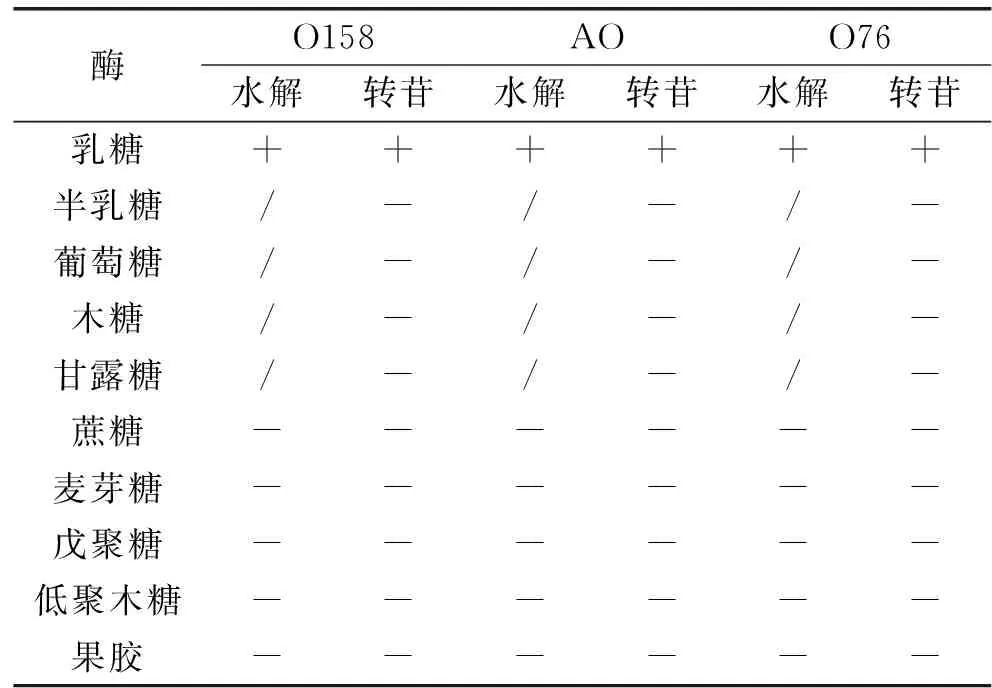
表5 米曲霉β-半乳糖苷酶的底物作用特征Table 5 Substrate specificity of A. oryzae β-galactosidases
注:+:具有活性,-:没有活性,/:没有测定。

图5 重组β-半乳糖苷酶作用于乳糖的产物分析Fig.5 HPLC profile of lactose catalyzed by recombinant β-galactosidases
3 结论与讨论
米曲霉乳糖酶常被用于处理牛奶、酸奶和生产低聚半乳糖,是商业化乳糖酶制剂的主要来源之一[14]。但是,国内外还没有系统研究米曲霉β-半乳糖苷酶酶系的酶学特征的报道。本研究对米曲霉的4个可能的β-半乳糖苷酶基因进行了分子克隆与表达、酶学性质等方面的研究,首次解析了它们之间的异同点。
米曲霉基因组中含有4个β-半乳糖苷酶开放阅读框,其中3个基因O158、AO和O76已经被成功地克隆和表达。通过测序结果分析,O158的测序结果有差异,AO与O76的测序结果一致(表2)。然而,以米曲霉CICIM F1005F的cDNA和基因组DNA为模板均没有将β-半乳糖苷酶基因O42扩增成功。氨基酸序列比对的结果显示,AO和O158的活性中心均是Glu200(酸/碱催化剂)和Glu298(亲和剂)(图2)。它们的催化反应遵循两步反应的双替换机制(two-step double-displacement mechanism),包括糖基-酶复合物过渡态的形成和水解,每步反应均通过酸碱催化完成[15]。而O76 与AO中的Glu200和Glu298对应的氨基酸残基分别为Pro196和Ala307,且比它们少了一个结构域。进一步通过BLAST分析发现,与O76氨基酸序列相似度较高(≧40%)的β-半乳糖苷酶都没有相关研究报道,它可能是一种新的真菌β-半乳糖苷酶。
米曲霉来源的β-半乳糖苷酶最适作用pH较低,一般在2.5和5.5之间;最适作用温度较高,通常为45~60 ℃[4]。本研究中的重组β-半乳糖苷酶O158、AO和O76的最适作用温度均为50 ℃,在30~40 ℃有较高的热稳定性。O158和AO的最适作用pH分别为4.0、5.5,pH稳定范围分别为4.0~8.5和3.5~7.5。而O76最适pH为7.0,偏中性,与酵母和细菌β-半乳糖苷酶的最适反应pH接近;pH稳定范围是5.0~8.0。这三种重组酶的最适作用pH以及pH稳定性差别较大,综合了真菌和细菌类β-半乳糖苷酶的优势。其中,AO的最适作用pH略高于已报道的最适反应pH(5.2),而最适作用温度则低于文献报道(60 ℃)[6],这可能是由于所用的底物不同造成的。除了O158,AO和O76的最适作用pH均高于A.oryzaeRT102以及A.oryzaeh26-10-7β-半乳糖苷酶的最适作用pH(分别为4.8和4.75)[16-17];这三种重组酶的最适作用温度高于A. oryzae RT102β-半乳糖苷酶的最适作用温度(46 ℃)[16],却低于A.oryzaeh26-10-7β-半乳糖苷酶的最适作用温度(60 ℃)[17]。
本研究中的重组β-半乳糖苷酶O158、AO和O76的Km分别为5.48、5.27、6.21 mmol/L,远高于A.oryzaeh26-10-7以及A.oryzaeβ-半乳糖苷酶对乳糖的Km值(分别为69.36 mmol/L[17]和50.0 mmol/L[18]),对天然底物乳糖表现出更高的底物亲和力。但是,这三者的Km均高于MushroomsA.oryzae(Sigma)β-半乳糖苷酶的Km(1.6 mmol/L);它们的Vmax均低于该β-半乳糖苷酶的Vmax(62.8 μmol/(min·mg protein))[19]。
β-半乳糖苷酶一般具有水解和转苷两种活性[2]。近年来,利用β-半乳糖苷酶的转苷活性生产具有特定生理功能的低聚糖已成为新的研究内容[20-21]。与其它研究报道相似,本研究所克隆与表达的3种β-半乳糖苷酶皆对其天然底物乳糖表现出水解和转苷活性,对其它天然底物均没有水解和转苷活性。此外,虽然戊聚糖、低聚木糖及果胶中含有半乳糖苷键,但是O158、AO和O76对它们均不起作用(表3)。
本文通过现代生物信息学与分子克隆等技术对米曲霉来源的4个β-半乳糖苷酶在毕赤酵母中进行了克隆和表达,并系统地解析了其酶学性质。其中重组酶O158和AO的最适pH偏酸性,且对乳糖有较好的亲和力和催化效率,适用于干酪和酸乳清等低pH的加工过程中。而偏中性的O76则可用于水解乳制品工业中的乳糖等。此外,它们对乳糖均具有较高的转糖基活性,这为其用于合成具有特定生理功能的新物质提供了可能。
[1]Park A R,Oh D K.Galacto-oligosaccharide production using microbialβ-galactosidase:current state and perspectives[J]. Applied Microbiology and Biotechnology,2010,85(5):1279-1286.
[2]Husain Q.β-Galactosidases and their potential applications:a review[J].Critical Reviews in Biotechnology,2010,30(1):41-62.
[3]刘芳宁,梁琪,张炎,等.微生物β-半乳糖苷酶的研究进展[J].中国酿造,2012,31(12):5-9.
[4]徐金利.产乳糖酶酵母菌株的遗传改良和乳糖酶的发酵生产[D].青岛:中国海洋大学,2012.
[5]Guerrero C,Vera C,Conejeros R,et al.Transgalactosylation and hydrolytic activities of commercial preparations ofβ-galactosidase for the synthesis of prebiotic carbohydrates[J]. Enzyme and Microbial Technology,2015(70):9-17.
[6]侯重文.基因工程法构建乳糖酶高产菌株及发酵条件优化的研究[D].济南:山东大学,2014.
[7]Friend B,Shahani K.Characterization and evaluation of Aspergillus oryzae lactase coupled to a regenerable support[J].Biotechnology and Bioengineering,1982,24(2):329-345.
[9]Guerrero C,Vera C,Araya E,et al.Repeated-batch operation for the synthesis of lactulose withβ-galactosidase immobilized by aggregation and crosslinking[J].Bioresource Technology,2015(190):122-131.
[10]Dragosits M,Pflügl S,Kurz S,et al.Recombinant Aspergillusβ-galactosidases as a robust glycomic and biotechnological tool[J].Applied Microbiology and Biotechnology,2014,98(8):3553-3567.
[11]潘渠.嗜酸乳杆菌lac基因簇两个β-半乳糖苷酶基因的克隆表达和功能研究[D].重庆:第三军医大学,2008.
[12]诸葛健,王正祥.工业微生物实验技术手册[M].北京:中国轻工业出版社,1994:413-450.
[13]Tamura K,Dudley J,Nei M,et al.MEGA4:molecular evolutionary genetics analysis(MEGA)software version 4.0[J]. Molecular Biology and Evolution,2007,24(8):1596-1599.
[14]Maksimainen M M,Lampio A,Mertanen M,et al.The crystal structure of acidicβ-galactosidase from Aspergillus oryzae[J]. International Journal of Biological Macromolecules,2013(60):109-115.
[15]Ly H D,Withers S G.Mutagenesis of glycosidases[J]. Annual Review of Biochemistry,1999,68(1):487-522.
[16]Tanaka Y,Kagamiishi A,Kiuchi A,et al.Purification and properties ofβ-galactosidase from Aspergillus oryzae[J].Journal of Biochemistry,1975,77(1):241-247.
[17]Gargova S,Pishtijski I,Stoilova I.Purification and properties ofβ-galactosidase from Aspergillus oryzae[J].Biotechnology & Biotechnological Equipment,1995,9(4):47-51.
[18]Otieno D O.Synthesis ofβ-galactooligosaccharides from lactose using microbialβ-galactosidases[J].Comprehensive Reviews in Food Science and Food Safety,2010,9(5):471-482.
[19]Pilipenko O,Atyaksheva L,Chukhrai E.Inhibition ofβ-galactosidases with mono-and disaccharides[J].Russian Journal of Physical Chemistry A,2010,84(1):118-122.
[20]González C P,Rodríguez E,Soule S,et al.Enzymatic synthesis of 3-aminopropyl-1-O-β-D-galactopyranoside catalyzed by Aspergillus oryzaeβ-galactosidase[J].Biocatalysis and Biotransformation,2015,33(4):197-207.
[21]Guerrero C,Vera C,Acevedo F,et al.Simultaneous synthesis of mixtures of lactulose and galacto-oligosaccharides and their selective fermentation[J].Journal of Biotechnology,2015(209):31-40.
College of Biotechnology,Tianjin University of Science & Technology,Tianjin 300457,China)
Inthisstudy,threegenes(O158,AOandO76)encodingβ-galactosidasesfromAspergillus oryzaewereclonedandexpressed.TherecombinantsGS115(pPIC-O158),GS115(pPIC-AO)andGS115(pPIC-O76)wereconstructedandtherecombinantenzymesweresubsequentlyobtained.FurtheranalysisshowedthatthepHoptimaofO158,AOandO76were4.0,5.5and7.0,respectively,andtheiroptimaltemperatureswereall50 ℃.TheserecombinantenzymeswerestableinthepHrangeof5.0~7.5orattemperaturesrangingfrom30to40 ℃.TheiractivitieswereenhancedbyMn2+,butsignificantlyinhibitedbyFe2+,Cu2+andZn2+.O158,AOandO76onlyexhibitedhydrolyticandtransgalactosylactivitiestowardlactose.TheaffinityandcatalyticefficiencyofAOtowardslactosewerehigherthanthoseofO158andO76.Besides,O42wasnotexistedintheteststrainalthoughitwaspredictedinthereferencegenomesequence.Theheterologousexpressionandbiochemicalpropertiesofthreeβ-galactosidasesfromA. oryzaewerecomprehensivelyinvestigatedinthisstudy,whichlaysasolidfoundationfortheirlarge-scaleproductionsandindustrialapplications.
Aspergillus oryzae;β-Galactosidase;Molecularcloning;Biochemicalproperties
2016-05-10
董自星(1986-),男,博士,助理研究员,研究方向:酶工程与技术,E-mail:star1987.com@163.com。
*通讯作者:王正祥(1964-),男,博士,教授,研究方向:工业微生物资源与开发、工业酶制剂的高效表达与分子改造,E-mail:zx.wang@tust.edu.cn。
TS201.3
A
1002-0306(2016)21-0172-07
10.13386/j.issn1002-0306.2016.21.025

