一种简易心肌细胞搏动压检测单元设计*
王钰安,李 宏,罗 杰,陈丰农
(杭州电子科技大学生命信息与仪器工程学院,杭州310018)
一种简易心肌细胞搏动压检测单元设计*
王钰安,李 宏*,罗 杰,陈丰农
(杭州电子科技大学生命信息与仪器工程学院,杭州310018)
提出并设计开发一套心肌细胞搏动压检测单元。基于压电薄膜传感器,设计心肌细胞搏动信号前端采集单元,并加入合理的数字滤波算法对采集到的信号进行滤波。经过CAN总线传输,将处理后的数据送到后端触摸屏显示;后端控制单元接受触摸屏输入信号,通过CAN总线将控制信号送到前端,从而实现培养液供给的智能控制。完成系统整体方案设计,前后端单元的硬件电路设计以及相应控制算法的软件开发,经初步试验,实现心肌细胞搏动参数实时检测和显示。该设计为心肌细胞搏动参数实时观察以及无菌、无污染的智能化小规模培养提供一种有效途径。
压电薄膜传感器;搏动检测;数字滤波;工业总线;心肌细胞
心脏疾病具有很高的发病率和死亡率,严重威胁人类生存和生活质量。全球每年约有1 730万人死于心脏疾病,且每年死于心脏疾病患者不断增加[1],心脏疾病的研究和治疗一直是医学、生物学领域的研究热点之一。心脏移植手术存在受体年龄限制、供体短缺、术后并发症、手术费用昂贵等问题。研究显示:心肌细胞的生理病变对心血管疾病发生起着非常重要的作用。利用干细胞心肌细胞来进行心脏局部修复或许是一种理想可行的方法。干细胞的多向分化潜能是诱导形成心肌细胞的主要来源[2-8]。但是,在心肌细胞逐渐形成过程中,如何检测心肌细胞的搏动频率和搏动压力大小,如何保证诱导的心肌细胞与病损心脏的搏动压力与搏动频率一致是保证心肌细胞修复心脏局部缺损的关键。
通过生理电信号直接检测虽然能得到心肌细胞的搏动情况,但是传统的细胞膜微电极穿刺或钳制技术会对细胞穿刺损坏,难以实现长期的测量[9];基于细胞传感器的微电极阵列等细胞芯片技术虽然能实现心肌细胞电生理特性的长期检测,但是这对细胞培养技术提出了很高的要求[10];传统的细胞阻抗传感器只能检测细胞生长,无法实现细胞搏动检测,会受到环境因素的干扰[11]。通过心肌细胞物理搏动检测的方法,可以大大减少周围环境因素的影响,简化操作和方案设计,降低成本。
为此,本文基于PVDF压电薄膜传感器,设计一种简易的心肌细胞搏动压检测单元,实现细胞全封闭无菌培养,并能实时检测心肌细胞的搏动信号(包括:搏动压大小、频率),显示在触摸屏上,完成了诱导心肌细胞的24 h无间断的智能监控,对干细胞诱导心肌细胞体外培养和临床应用具有重要意义。
1 材料与方法
1.1 压电薄膜传感器简介
压电薄膜传感器是一种新型的高分子压电换能材料,当受到拉伸或弯曲时,薄膜上下电极表面间就会以电压或电荷的形式产生电信号。压电薄膜对动态应力非常敏感(28 μm厚的压电薄膜具有10 mV~15 mV/微应变的灵敏度),且压电电压常数为压电陶瓷的20多倍,非常适合应用于人体皮肤表面或植入人体内部的生命信号监测。压电薄膜灵敏度高、质量轻、质地柔软,可加工性好、频带宽、耐疲劳性高、具有良好的热稳定性,且可以无源工作,已被广泛应用于医用传感器[12-15]。
根据压电薄膜传感器在检测细微信号变化时的优越传感性能,本文在设计时选用了如图1所示的美国MEAS传感器公司制造的PVDF压电薄膜传感器,该款器件不仅价格便宜,且性能突出,完全符合设计的需求。其主要参数如表1所示。

图1 PVDF压电薄膜传感器
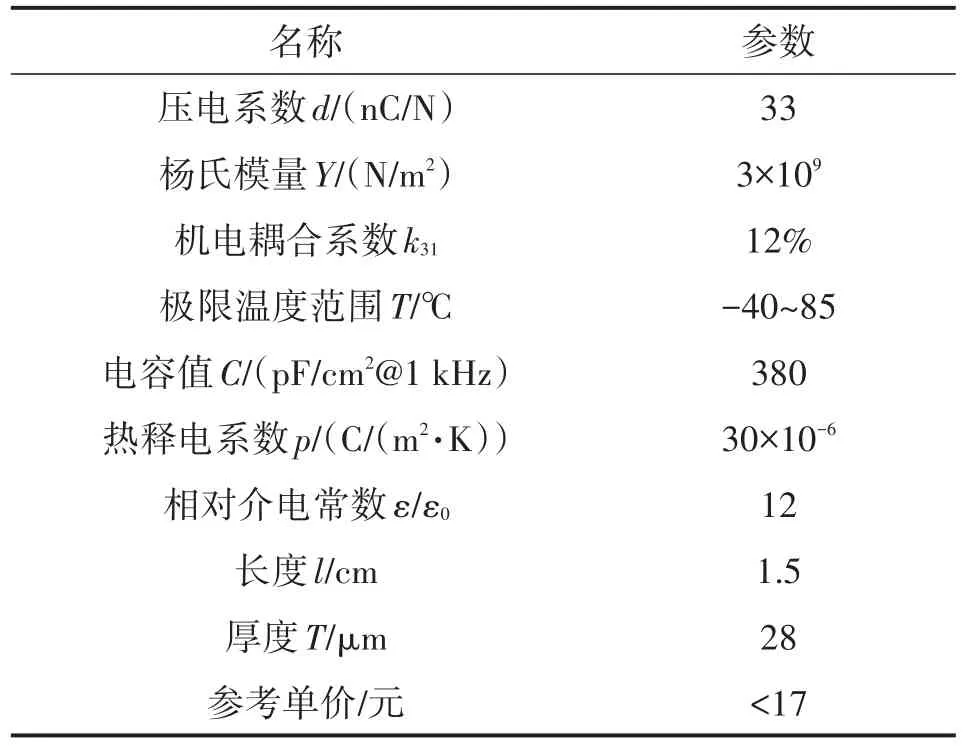
表1 PVDF传感器主要参数
根据器件说明书[16]可知LDT0-028K是十分灵敏的压电薄膜传感器组件,它是由带有银漆丝网印刷电极的28 μm厚的PVDF高分子聚合物薄膜所组成,并经0.125 mm的聚酯基材三级层压而成,并且配有两个柔性接触点[17]。由于PVDF压电薄膜属于高分子聚合物,其上限温度值为85℃(居里点),一旦超过该温度值,就可能导致器件的内部结构损坏,影响其压电特性,所以常规的电烙铁焊接并不适合压电薄膜的触点连接。本设计选用了具有良好导电特性的导电银漆凝胶来连接传感器和后续处理电路。值得注意的是,黏合处比较脆,应该防止外力撞击。
1.2 心肌细胞搏动压测量方法分析
当压电晶体材料在沿着一定方向上受到外力的作用后,其物理结构会发生极化,导致材料表面上出现符号相反,大小相等的电荷;当撤去外力后,材料又会发生复极化,表面上的电荷随之消失,变成不带电的状态。如果作用力方向与之前施加的力的方向相反,那么电荷的正负极也相反。因这种作用力产生的电荷量大小与外力的大小正好成正比关系[18],即式(1)所示:

式中,Q为电荷量,d为介电常数,F为作用力的大小。
根据上述压电特性理论,在图2中,当压电传感器的Z轴方向受到应力σz的作用而产生形变。由于其内部分子结构间距离发生变化,破坏了正负电子之间的平衡,从而在传感器内部发生了极化。在受外力作用下的压电传感器会在与Z轴方向垂直的平面上产生单位面积的正负电荷,即如式(2)所示:

式中:d为压电薄膜的压电系数;Q为传感器表面的电荷量;A为传感器表面积;可得在作用力Fz作用下,在压电薄膜表面产生的电荷总量为式(3):

由式(3)可见压电薄膜传感器表面所受作用力与电荷量成良好的线性关系。如果假设心肌细胞搏动力为0.5 N左右时,而选用的压电薄膜的压电系数为33 nC/N[16-17],就可以计算出压电薄膜表面产生的电荷量。
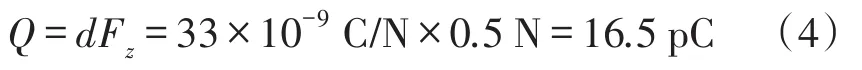
通过式(4)的计算可知,由搏动应力引起的电荷量为16.5 pC。
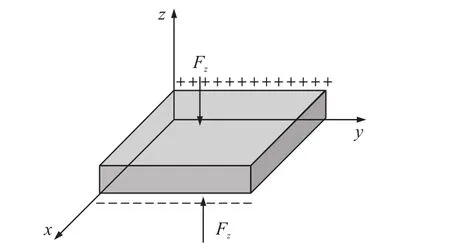
图2 压电薄膜的压电效应
1.3 总体方案设计
为了进一步提高系统的灵活性和检测的精度,本文采取前后端的设计方案,系统框图如图3所示。
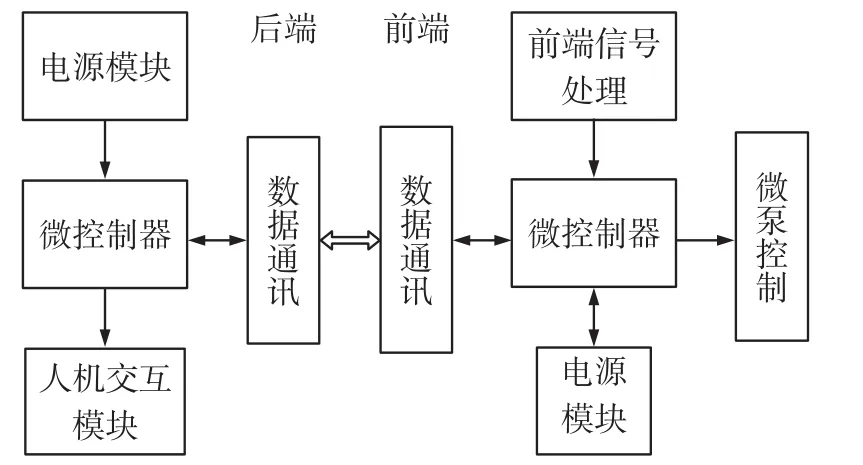
图3 系统框图
由上图可见,前端系统负责传感器模拟信号的采集和处理,培养液微泵控制(基于德州仪器生产的DRV8824电机驱动芯片设计相应的控制电路),后端系统主要负责人机交互(包括前端系统上传数据的触摸屏实时显示和向前端微泵发送控制指令)。前后端系统均采用工业级STM32F103系列芯片作为微控制器[19-20],它不仅在实时性、功耗控制、外设以及集成整合方面都显得非常不错,而且易于开发,可使产品快速进入市场。考虑到微控制器集成了CAN总线接口,前后端系统通过常用的工业级总线CAN总线进行实时通信,提高抗干扰能力,以确保数据的准确性。电源模块负责整个系统所需电平的转换。另外,微控制内部集成的FSMC(静态存储控制器)技术实现了触摸屏更加高效、灵活、方便的控制。
2 系统硬件实现
2.1 前端信号调理模块实现
前端放大器电路的主要作用就是阻抗变换(将传感器的高输出阻抗转化为低输出阻抗),其次就是将传感器输出的信号进行放大,交给后端进行采集。前端放大电路一般有两种形式:由电阻构成反馈的电压放大器,得到的输出电压与输入电压成正比;利用电容构成反馈的电荷放大器,其输出电压与传感器的电荷成正比。需要指出的是电荷放大器比电压放大器价格更高、电路也较复杂,导致调整比较困难,但其系统输出和灵敏度大小不太受电缆分布电容的影响;而电压放大器的系统输出会随着电缆分布电容及传感器自身电容的变化而变化,如果重新更换电缆则需要带来重新标定的麻烦。从实际工程应用和集成技术发现来看,选择电荷放大器电路作为压电传感器的前级放大比较合适[21]。同时,本设计选用的PVDF压电薄膜传感器输出的信号量形式正好是电荷量。
2.1.1 电荷放大器的理论设计
图4显示了一个比较典型的电荷放大器电路[22],电路中增加了一个反馈电阻RFB,这样设计是十分必要的。首先,在直流条件下,反馈电容两端相当于断路,对传感器连接线的噪声会非常敏感,而反馈电阻则会产生一个直流反馈来抵消噪声的影响;在低频信号情况下,反馈电容支路相当于开路,反馈电阻支路成为了主要的反馈电路,这样对低频信号能产生一个有效的响应。而在高频信号情况下,反馈电容支路变为阻抗较小的短路状态,这有效的消除了电阻反馈通路的影响。但同时也会将电路变成一个高通滤波器的响应,其极频如式(5)所示:
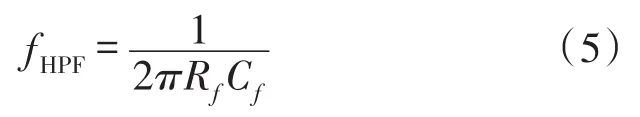
为了降低Cf来增加输出电压增益的同时,往往需要增加Rf的值来保持电路的低极频,但增加电阻的大小又会影响电路的噪声,并且电阻越高,在实际应用中越难获得。
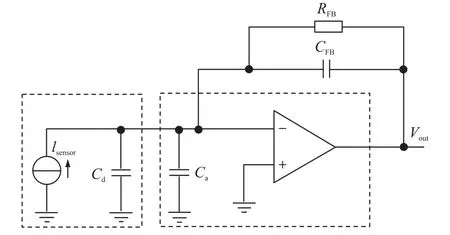
图4 电荷放大器电路图
2.1.2 实际电荷放大电路设计
考虑到偏置电流摆动经反馈电阻引起偏置电压的浮动,从而影响电路精度。本设计选用具有极低的输入偏置电流的轨至轨CMOS放大器OPA320作为电荷放大电路的核心器件,其偏置电流仅为0.2 pA~0.9 pA,具有114 dB的高共模抑制比。
由于一般的电荷放大器采用单端输入信号放大,在应用中很容易受到60 Hz的共模信号干扰(共模干扰信号被一同放大),而导致输出信号的严重失真。所以,本文设计了差分输入的电荷放大器电路结构,进行信号的前级处理。
由图5所示,传感器的上表面会产生正极电荷Q,下表面产生负极电荷-Q,因此产生的电荷分别在Cf+和Cf-上聚集,产生差分电压。于是,实际电荷放大输出为单端输入的两倍,而噪声也仅仅以平方根函数递增,大幅度削弱了噪声源。按照本文设计的电荷放大电路,我们可以简单计算出电荷放大器信号的极频为式(6):
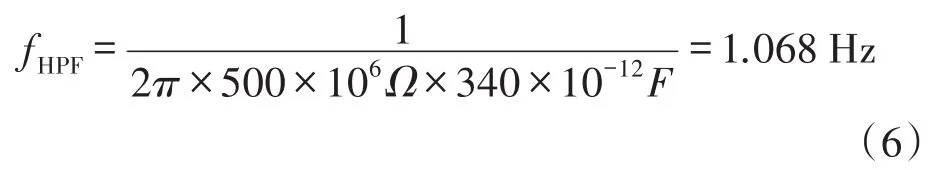
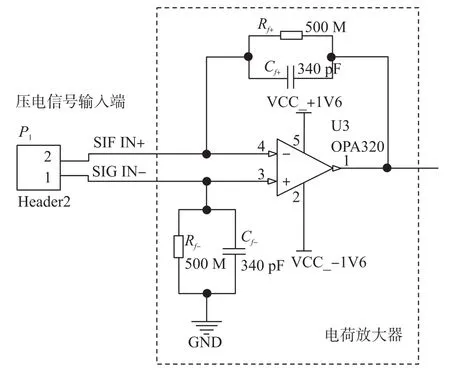
图5 实际电荷放大电路
结合PVDF压电薄膜传感器输出理论分析,以及电路设计中反馈电容的容值大小,我们可估算出此时的电压输出为式(7)所示:
此外,结合OPA320的数据手册以及电路设计需求,本文采用±1.6 V的双电源供电,也就意味着电荷放大器输出的电压值范围为电源轨-1.6 V~+1.6 V,当PVDF压电薄膜传感器没有信号输出的时候,电压值为0 V。当有电荷输出的时候,输出电压为Vo=2Q/Cf。
2.1.3 二级放大电路设计
压电薄膜传感器输出的电荷信号经OPA320构成的电荷放大电路处理后转化为电压信号输出,且进行了放大,其电压输出范围限制在±1.6 V之间,所以二级放大电路在满足设计要求的前提下,可稍微简化下电路,又因为本文采用了ARM微控制器,其AD采集的电压范围了0~3.3 V,所以,最后本文采用以微功耗、精密、零漂移的CMOS运算放大器OPA333为核心的加法放大电路,设计放大增益为1,并将-1.6 V~+1.6 V抬升至0~3.2 V,正好符合后续AD采样的要求。
图6为实际的同相加法放大电路,其中运放的同相输入端接前级的电荷放大器电路输出,最后信号从运放的6号脚输出端输出到微控制器的AD接口。由于R4,R5,R6,R7的阻值相等,根据虚短虚断原则,最后信号输出为Uo=1.6+U电荷放大输出。
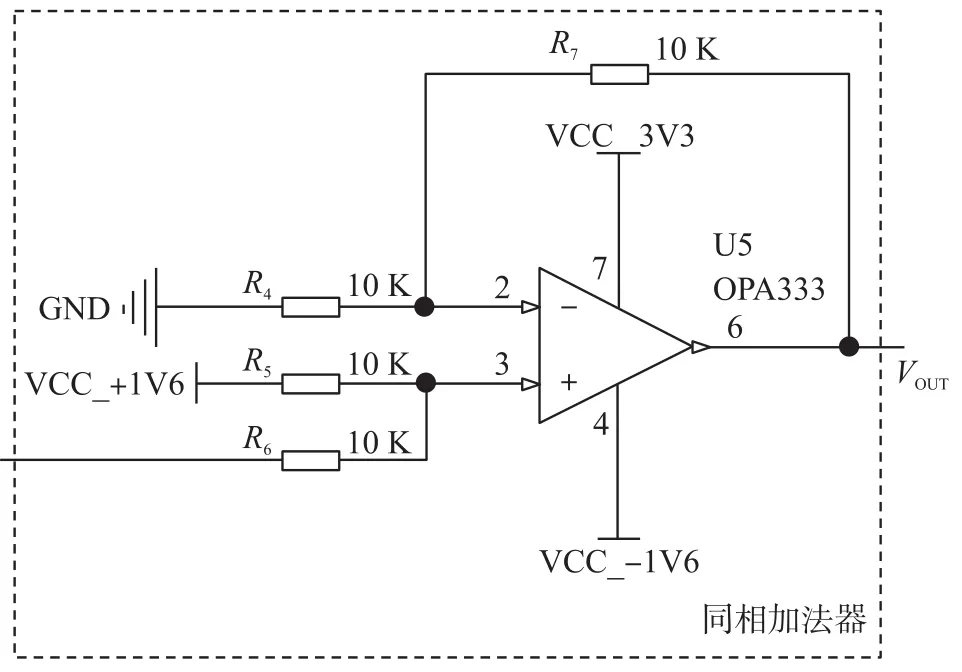
图6 同相加法放大电路
2.2 前端电源管理模块实现
由于前端系统的信号处理模块使用的3.3 V、1.6 V、-1.6 V双电源供电,微控制器采用3.3 V供电,微泵电机驱动芯片选用12 V供电,CAN收发器需要5 V的工作电压,所以电源管理模块比较复杂,且电源模块的好坏直接影响到运放的性能和AD采样精度。由于市面上没有超大电流的±12 V开关电源,该模块设计考虑先采用12 V的开关电源作为输入,然后采用常用的三端线性稳压器件LM7805得到5 V电压(前级电源输入端全部使用线性稳压器来保持系统的稳定),接着采用价格便宜、电路设计简单的稳压芯片AMS1117,输出3.3 V。考虑到系统中需要负电压供电,本设计选用了LM2663反向电荷泵芯片来产生负压-5 V,最后还采用了超低噪声TPS7A系列线性稳压芯片来实现±1.6 V电压。
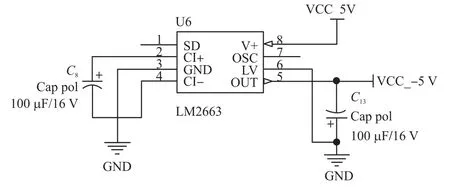
图7 基于LM2663的反向电荷泵电路
如图8和图9,基于TPS7A系列的正负电源超低噪声稳压电源电路通过外部可调电阻R24(R20)、R18(R21)来产生±1.6 V运放工作电源,其输出电压和阻值之间存在Vout=±1.184(R1+R2)R2=±1.6V的关系,输出电流为100 mA。
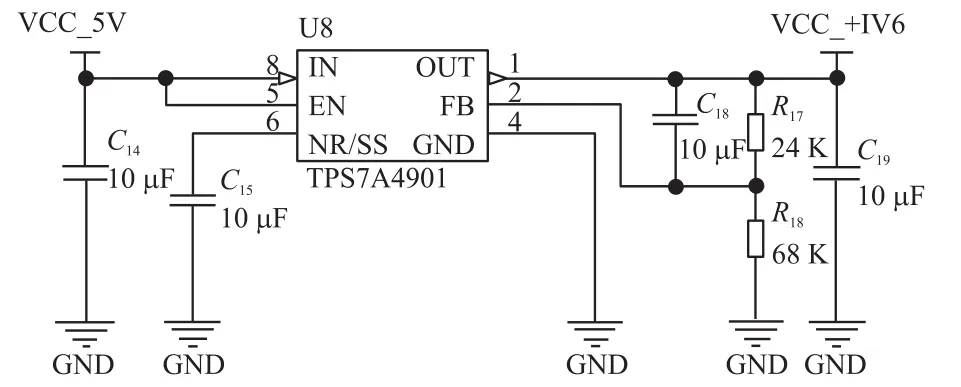
图8 基于TPS7A4901的线性可调稳压电路
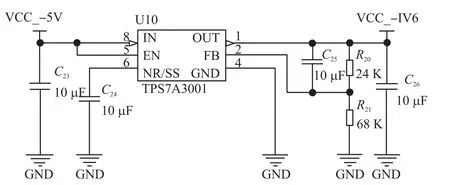
图9 基于TPS7A3001的线性可调稳压电路
3 系统软件实现
3.1 前端系统程序流程设计
如图10所示,一旦前端系统上电启动,就会主动向后端设备进行握手请求,后端设备响应请求握手成功后会给前端发送一个自枚举的ID号,前端收到ID号就即刻开始后续工作,即采集信号处理电路输出的模拟信号,并进行软件上的数字信号处理,以进一步滤除杂波的干扰,提高数据的真实性。最后,将较为精确的模拟电压值送入系统的缓存池内,当系统检测到发送缓存池内有数据,就会立即向后端系统发送采集到的数据;而当前端的接收缓存池内有数据,说明后端向前端发来了微泵控制命令,则进行相应的液泵控制。
3.2 后端系统程序流程设计
后端控制程序无论在有无前端采集设备接入的情况下均能正常运行。设备上电后,后端系统首先构建相应的数据结构(如数据队列、结构体)并初始化,然后构建GUI交互界面,并实时监听前端的握手请求。GUI交互界面上有用于设置的按钮控件和实时曲线显示的窗口控件,操作人员只需点击界面上相应按钮,就能进入相应的培养单元的前端界面,此时数据显示界面会详细的罗列出该设备的实时采样数据,比如心肌细胞搏动压曲线、搏动压幅值、搏动压周期、阀门控制信息等。操作人员也可以对微泵的各参数进行设置。后端系统流程图如图11所示。
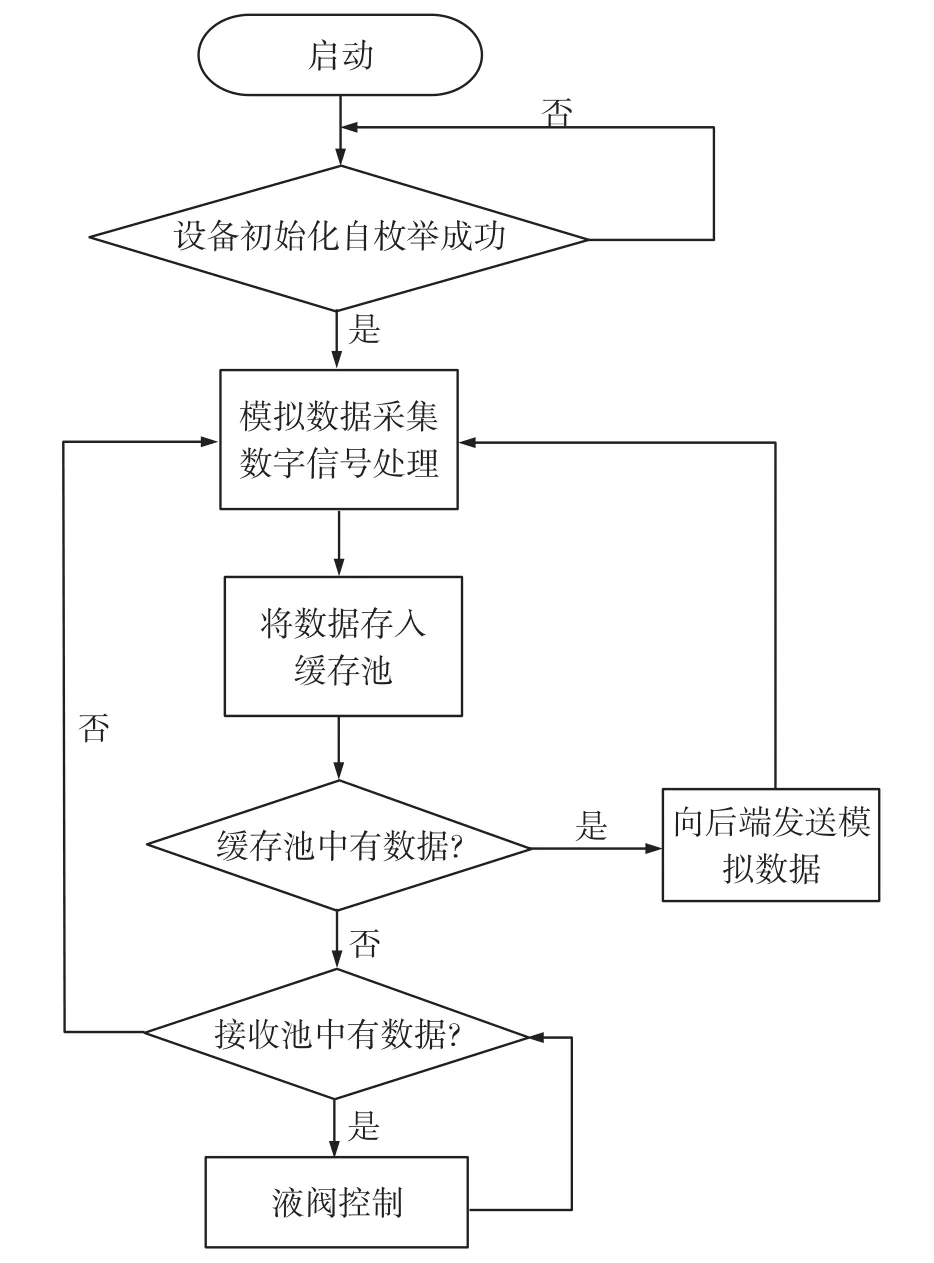
图10 前端系统程序流程图
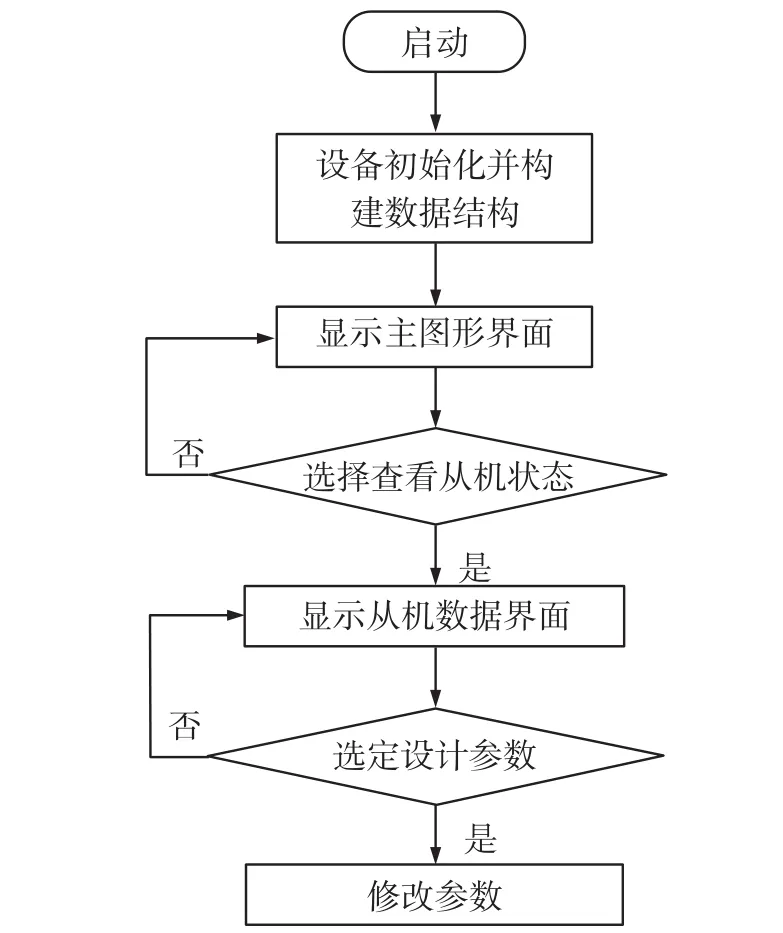
图11 后端系统程序流程图
3.3 数字滤波算法设计
通过PVDF压电薄膜传感器所获取的心肌细胞搏动电荷信号,经过前级信号调理电路将电荷量转化为电压信号,再经过同相加法运算器对电压进行偏置,最终产生0~3.2 V的电压信号送至ARM微控制器。但是图12波形图显示了传感器无输出的情况下,运算放大器输出存在典型的高斯白噪声电压信号,所以需要设计一定的数字滤波器对噪声进行滤除。
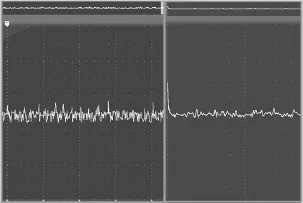
图12 放大器静态输出波形图
本文设计了如图13所示的两级滤波算法。
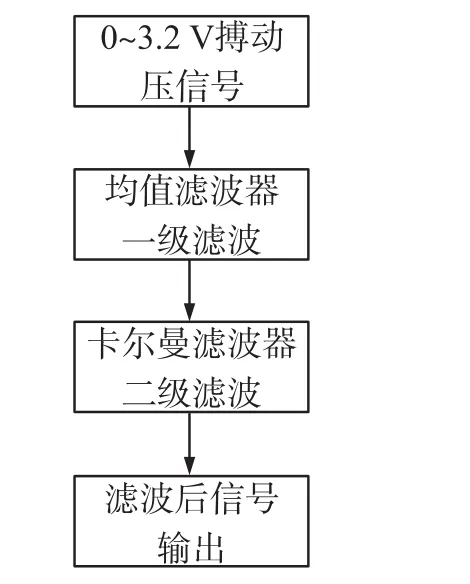
图13 两级滤波算法流程图
线性平滑滤波器对于消除系统噪声具有十分优越的性能。均值滤波器不像中值滤波器那样删除信号中的细节信息,而是在消除噪声的同时将真实信号中的细节和边缘进行平滑处理,其输出方差仅是随着系统信号出错概率的上升呈线性增长,比较适合高斯白噪声的前期滤波处理,可将其作为一级滤波器[23]。虽然一级滤波器能很好的去除部分系统噪声,但是信号中难免存在杂余噪声(诸如谐波噪声)。所以,本文增加了常用的时变线性系统的递归滤波器——卡尔曼滤波器作为二级滤波器来进一步提高数据的准确度。该滤波器可通过过去各种噪声中的数据,来预测现在系统的实时状态,从而实现现场数据的自我更新,对于动态变化信号具有最优预估能力[24-25]。结合两级数字滤波器,在实验中能准确的测得振动信号。
4 结果
4.1 硬件系统实物
从图14中左侧后端控制系统的白色接口可看出,图中右侧的前端信号采集系统系统及PVDF压电薄膜传感器,微泵电机等组件只负责其中的一个培养单元,后端控制系统可挂接多个培养单元,从而提高了系统的实用性。

图14 心肌细胞搏动压检测单元硬件电路实物图
4.2 初步试验
为了初步验证装置的合理性,本文进行了简单的验证试验,即对完成组装和调试的装置输入搏动压标准信号,在后端控制系统的触摸屏界面上显示了实时的振动信号,如图15中箭头所示的信号为检测出的振动信号。在实验条件准许的情况下,将进一步验证装置的实用性和合理性。
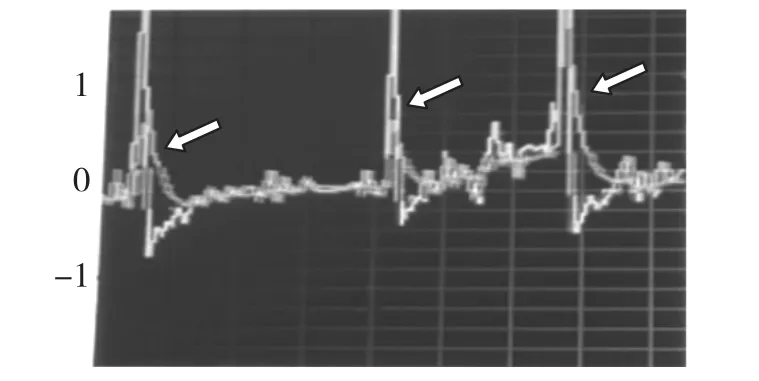
图15 实验结果图(箭头为振动信号)
5 结束语
本文利用压电薄膜传感器和CAN工业总线,提出并开发一套简易的心肌细胞搏动压检测方法与单元,专门针对离体心肌细胞搏动参数实时检测和触摸屏实时显示进行设计,提高了装置的针对性。通过合理的系统软硬件分析和设计,提高传感器采集信号的精确度,保证前后端系统间数据和控制指令的可靠传递,简化操作和方案设计,降低成本,希望能为心肌细胞搏动参数实时观察以及无菌、无污染的智能化小规模培养提供一种有效途径。
[1]世界卫生组织.2010年全球非传染性疾病现状报告[R].978-92-4-156422-9,2011.
[2]Zhao Y S,Wang C Y,Zhang X Z,et al.Construction of Unidirec⁃tionally Beating Cardiac Muscle[J].Journal of Heart&Lung Transplantation the Official Publication of the International Soci⁃ety for Heart Transplantation,2005,24(8):1091-1097.
[3]Eschenhagen T,Didie M,Munzel F,et al.3D Engineered Heart Tissue for Tissue Replacement Therapy[J].Basic Research in Cardiology,2002;97 Suppl 1(1):146-152.
[4]Menasche P,Hagege A A,Scorsin M,et al.Myoblast Transplanta⁃tion for Heart Failure[J].Lancet,2001,357(9252):279-280.
[5]Zandonella C.Tissue Engineering:The Beat Goes On[J].Nature,2003,421(6926):884-886.
[6]聂园园,仇小强.心肌细胞凋亡与心血管疾病关系的研究进展[J].实用医学杂志,2012,28(2):324-326.
[7]贾竹青,周春燕.心脏干/祖细胞与心肌损伤修复[J].中国生物化学与分子生物学报,2011,27(10):889-893.
[8]Bollini S,Smart N,Riley P R.Resident Cardiac Progenitor Cells:At the Heart of Regeneration[J].Journal of Molecular&Cellular Cardiology,2011,50(2):296-303.
[9]刘清君,余辉,肖丽丹,等.心肌细胞传感器及其在生物医学中的应用[J].仪表技术与传感器,2009(zl):291-294,298.
[10]肖丽丹,余辉,胡朝颖,等.多功能细胞传感器集成芯片的设计及实验研究[J].中国生物医学工程学报,2010,29(3):427-431.
[11]王天星,黎洪波,苏凯麒,等.基于细胞电阻抗传感器的细胞多生理参数分析系统设计[J].传感技术学报,2014,27(12):1589-1595.
[12]牛凤筠.基于PVDF压电薄膜传感器的生理信号检测系统研究[D].长春:长春理工大学,2011:1-3,8-10.
[13]Rathod V T,Roy D M,Anjana J,et al.Characterization of a Large-Area PVDF Thin Film for Electro-Mechanical and Ultrasonic Sensing Application[J].Sensors&Actuators A Physical,2010,163(1):164-171.
[14]樊程广,潘孟春,罗飞路,等.基于PVDF压电薄膜传感器的超声检测试验[J].无损检测,2012,34(1):27-30.
[15]乔予思.PVDF压电薄膜指套式电子血压计的研究[J].科技信息,2013(13):73-74.
[16]Measurement Specialties,Inc.Piezo Film Sensors Technical Man⁃ual[M].Measurement Specialties,2010:2-3.
[17]Measurement Specialties,Inc.LDT with Crimps Vibration Sensor/Switch[M].Measurement Specialties,2010:1-2.
[18]潘奇,万舟,易士晽.基于PVDF的三维力机器人触觉传感器的设计[J].传感技术学报,2015,28(5):648-653.
[19]Tao H,Feng X L,Wen L Y,et al.Energy-Saving Monitoring Sys⁃tem of Central Air-Conditioning Based on Dynamic Load[J].Ad⁃vanced Materials Research,2014,1039:409-414.
[20]Zhou Y H.Design of Light Intensity Detection System Based on STM32[J].Applied Mechanics&Materials,2013,462-463(1):104-107.
[21]仵征,郝屏.基于压电传感器的电荷放大测量电路的优化方案[J].河南科学,2012,30(12):1734-1737.
[22]Bartolome E.Signal Conditioning for Piezoelectric Sensors[M].Texas Instruments,2010:24-31.
[23]Xiao X S,Wei Q.Comparison Between Mean Filter and Median Filter Algorithm in Image Denoising Field[J].Applied Mechanics &Materials,2014,644-650(6):4112-4116.
[24]苗正戈,刘迪,梁成林.卡尔曼滤波器在PID控制中的仿真研究[J].电子设计工程,2011,19(18):11-13.
[25]吴涛,白茹,朱礼尧,等.基于卡尔曼滤波的航姿参考系统设计[J].传感技术学报,2016,29(4):531-535.

王钰安(1992-),男,浙江金华人,硕士研究生。现于杭州电子科技大学仪器科学与技术专业攻读硕士学位,主要研究方向为嵌入式系统与生物反应器,1428161076@qq.com;

李 宏(1966-),男,教授(高级工程师),硕士生导师。主要研究方向为组织工程与生物反应器,生物力学与医学仪器,lihong@hdu.edu.cn。
A Simple Design for Pulse Pressure Detection Unit of Cardiomyocytes*
WANG Yuan,LI Hong*,LUO Jie,CHEN Fengnong
(College of Life Information Science&Instrument Engineering,Hangzhou Dianzi University,Hangzhou 310018,China)
Propose and develop a simple pulse pressure detection unit of cardiomyocytes.Design the front acquisi⁃tion unit of cardiomyocytes thump signal based on the piezoelectric film sensor,which adds a suitable digital filter algorithm for filtering the collected signals.Through the CAN bus,the data after treatment will be sent to back-end touch screen to display;The back-end control unit can accept input signal of touch screen and send the correspond⁃ing control signal to front-end via the CAN bus,which is used to achieve intelligent control of supply for culture me⁃dium.Finish the overall system design,hardware circuit design of front and back-end unit,software development of relevant control algorithm.Then the design accomplished real-time pulse parameter detection and display of cardio⁃myocytes through preliminary test.This design provides an effective method of real-time observation of cardiomyo⁃cytes pulse parameter and sterile,non-pollution,small-scale intelligent cultivation.
piezoelectric film sensor;pulse detection;digital filter;industrial bus;cardiomyocytes
TP393
A
1004-1699(2016)11-1648-07
EEACC:7230 10.3969/j.issn.1004-1699.2016.11.004
项目来源:上海市自然科学基金项目(09ZR1432700)
2016-05-11 修改日期:2016-06-29

