板栗壳生药研究及有效成分没食子酸、绿原酸、芦丁含量测定
苏丽娜,王小庆
(曲靖医学高等专科学校药学系,云南曲靖 655000)
板栗壳生药研究及有效成分没食子酸、绿原酸、芦丁含量测定
苏丽娜,王小庆
(曲靖医学高等专科学校药学系,云南曲靖 655000)
采用性状鉴别、组织切片鉴别、粉末鉴别对板栗壳进行生药研究。建立HPLC法同时测定板栗壳中没食子酸、绿原酸和芦丁含量,色谱条件为C18柱,甲醇-0.4%磷酸为流动相梯度洗脱,检测波长275 nm,流速1 mL/min,柱温30 ℃。结果表明,板栗壳横切面、纵切面果皮细胞特点、中果皮的石细胞群和石细胞环带、内果皮较多的非腺毛、种脊部位的三角形维管束及粉末中果皮细胞、石细胞、非腺毛特征均可作为板栗壳的生药鉴别特征,为板栗壳生药学质量标准研究奠定基础。测定11批云南不同产地板栗壳样品中没食子酸含量为0.328~0.362 mg/g,绿原酸含量为0.129~0.141 mg/g,芦丁含量为0.180~0.230 mg/g。该含量测定方法操作简单,结果准确,专属性强,为板栗壳质量标准的建立提供依据。
板栗壳,没食子酸,绿原酸,芦丁,高效液相色谱,生药研究
板栗壳为壳斗科植物板栗(Castanea mollissima Blume)的外果皮,药性甘、涩、平,具有降逆、止血的功效,主治反胃、鼻衄、便血等症[1]。现代药理研究表明:板栗壳的乙醇、乙酸乙酯、氯仿、正丁醇和水提取液具有不同程度的抑菌、抗氧化及抑制α-葡萄糖苷酶活性的作用[2-8],因此板栗壳提取物在医药和保健品等领域有广阔的应用前景。板栗壳主要含有异泽兰黄素、酚类、黄酮(或其苷类)、有机酸、植物甾醇(或三萜)、内酯、香豆素(或其苷类)、糖、多糖(或苷类)、鞣质等成分[9-12],其中有机酸的主要成分没食子酸、绿原酸及黄酮类化合物芦丁均具有抗炎、抗菌、抗突变、抗氧化、抗自由基、抗肿瘤等药理活性[13-15],对其进行含量测定,对板栗壳药材质量标准的建立及应用研究有实际意义。
目前已有报道[16-18]板栗壳质量标准的研究,但研究对象主要是板栗总苞。韦琴[19]采用高效液相色谱法和铁盐催化比色法测定了板栗壳中原花青素的含量,而没食子酸、绿原酸和芦丁的含量测定未见报道。因此本实验采用反相高效液相色谱法同时测定板栗壳中没食子酸、绿原酸、芦丁三种有效成分的含量,并对板栗壳药材性状特征,组织切片特征、粉末特征进行生药学鉴别研究,为板栗壳质量标准的建立提供依据。
1 材料与方法
1.1 材料与仪器
11批云南不同产地板栗样品(见表3) 农贸市场,剔除栗仁,将板栗壳置于洁净阴凉处备用;没食子酸对照品 中国食品药品检定研究院,纯度为89.9%,批号110831-201204;绿原酸对照品 中国食品药品检定研究院,纯度为96.6%,批号110753-201314;芦丁对照品 中国食品药品检定研究院,纯度为90.5%,批号100080-200904;甲醇和乙腈 色谱纯,美国JT.Baker公司;超纯水为本实验室超纯水器自制 南京易普易达科技发展有限公司;其他试剂 均为分析纯。
1510系列高效液相色谱仪 包括高压四元泵,在线脱气机,自动进样器,PDA二极管阵列检测器,柱温箱,美国科学系统;NikonE400数码一体化显微镜系统和NikonDXM1200摄像头 日本尼康;KQ-250VDB超声波清洗器 昆山市超声仪器有限公司;MS105DU电子天平 瑞士梅特勒-托利多公司;DFY-200摇摆式高速万能粉碎机 温岭市林大机械有限公司;RE52CS-1旋转蒸发仪 上海亚荣生化仪器厂。
1.2 实验方法
1.2.1 板栗壳显微切片和粉末切片的制备 显微切片:选取适当材料放入丙三醇-50%乙醇(1∶1)溶液中软化48 h依次转移到70%乙醇、80%乙醇、90%乙醇中脱水各3 h后用无水乙醇浸泡两次使脱水完全,每次10 min。脱水后将材料依次放于正丁醇-无水乙醇(1∶1)1 h、正丁醇-无水乙醇(4∶1)30 min和正丁醇(重复1次)30 min透明。透明后在正丁醇溶液中少量多次加入已熔化的石蜡,待石蜡-正丁醇为1∶1时,倒出混合溶液,加入纯石蜡55 ℃浸蜡24~48 h。浸蜡完全后将材料包埋于石蜡中,待完全凝固后切成10~16 μm的切片,将切片放入滴有蒸馏水的干净载玻片上置于恒温台上展片,待切片完全展开用吸水纸吸去蒸馏水置于电热干燥箱中36 ℃烘片24 h,以二甲苯熔蜡两次,每次30 min,后依次放入二甲苯-无水乙醇(1∶1)、无水乙醇、95%乙醇、80%乙醇、70%乙醇中各15 min,然后放入0.5%番红(50%乙醇溶液)中染色24 h后依次放入50%乙醇、70%乙醇中各15 min后,放入0.1%固绿(95%乙醇溶液)中对染5 s,过95%乙醇、无水乙醇(两次)、二甲苯(两次)洗去残留的固绿。切片从二甲苯中取出后直接用中性树胶封片后数码摄影显微镜观察,拍照。
粉末切片:药材粉碎后过40目筛,取少许粉末放于干净的载玻片上,滴加水合氯醛溶液,于酒精灯外焰处加热透化,反复透化三次,再滴加稀甘油溶液,封片后数码摄影显微镜观察细胞形态特征,拍照。
1.2.2 色谱条件 采用反相高效液相色谱法测定没食子酸、绿原酸和芦丁的含量。Hypersil ODS2色谱柱(250 mm×4.6 mm,5 μm);参考文献[20-24]分别采用乙腈-水,甲醇-水,加入不同比例的冰醋酸或磷酸作流动相,利用等度洗脱或梯度洗脱分离没食子酸、绿原酸和芦丁。检测波长275 nm;流速1 mL/min,柱温30 ℃,进样体积10 μL。
1.2.3 对照品溶液的制备 取没食子酸、绿原酸、芦丁对照品适量,加甲醇溶解并定容,分别得1.44、1.76、1.35 mg/mL贮备液。量取贮备液适量,加50%甲醇制成对照品混合溶液,其中没食子酸、绿原酸、芦丁的质量浓度分别为53.33、65.18、50.00 μg/mL。所有对照溶液制备后避光储存于4 ℃备用。
1.2.4 供试品溶液的制备 板栗壳晾干粉碎过200目筛,干燥至恒重。精密称取板栗壳粉末0.2 g,分别加入极性不同的甲醇、75%甲醇、50%甲醇,95%乙醇、75%乙醇、50%乙醇、乙酸乙酯和石油醚各30 mL,40 ℃超声(频率20 kHz)间歇提取45 min,冷却,滤过,滤液旋转蒸发除去提取溶剂,残渣加适量甲醇溶解定容至25 mL,用0.22 μm有机滤膜过滤,即得。
1.2.5 标准曲线的绘制 精密量取1.2.3项下对照品混合溶液适量,加50%甲醇稀释使没食子酸的含量为10.67、5.34、2.66、1.34、0.67、0.34 μg/mL,绿原酸含量为13.04、6.52、3.26、1.63、0.81、0.41 μg/mL,芦丁含量为10.00、5.00、2.50、1.25、0.63、0.32 μg/mL。取10 μL注入高效液相色谱仪进样后以峰面积为纵坐标,对应的各对照品的浓度为横坐标,得出各对照品浓度与峰面积的线性关系式。
2 结果与分析
2.1 性状鉴别
本品破碎为大小不等的不规则块片,厚约1 mm。外表面褐色或棕褐色,顶端密被淡黄色绒毛,其余部位绒毛稀疏稍光滑,内表面淡黄色至淡褐色,被密集长绒毛。基底浅棕色,表面粗糙,无绒毛。质坚硬,易折断,断面凹凸不平。气微、味微涩。见图1。

图1 板栗壳性状图Fig.1 Characters of chestnut epicarp
2.2 显微鉴别
2.2.1 板栗壳组织切片 板栗壳横切面:外果皮细胞长圆柱形,淡黄色呈栅状排列,壁稍厚,外被角质层;中果皮由数列细胞构成,散有小型外韧型维管束;内果皮为一列小方形薄壁细胞。种皮由一列细胞构成,内可见外胚乳。见图2。板栗壳纵切面:外果皮由一列长方形细胞构成,外被角质层,中果皮层和内果皮层细胞呈黄棕色,多皱缩。见图3。
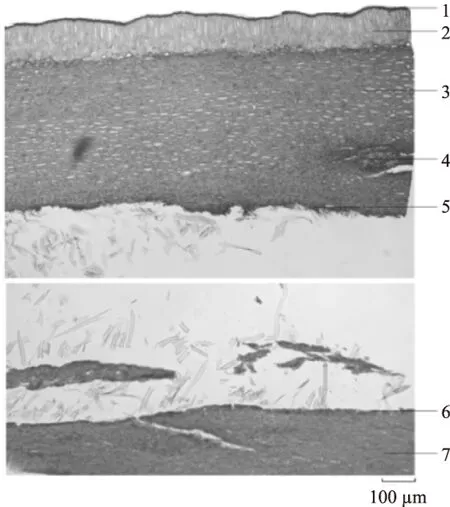
图2 板栗壳横切面图Fig.2 Transverse section micrographs of chestnut epicarp注:1角质层,2外果皮,3中果皮,4维管束, 5内果皮,6种皮,7外胚乳。
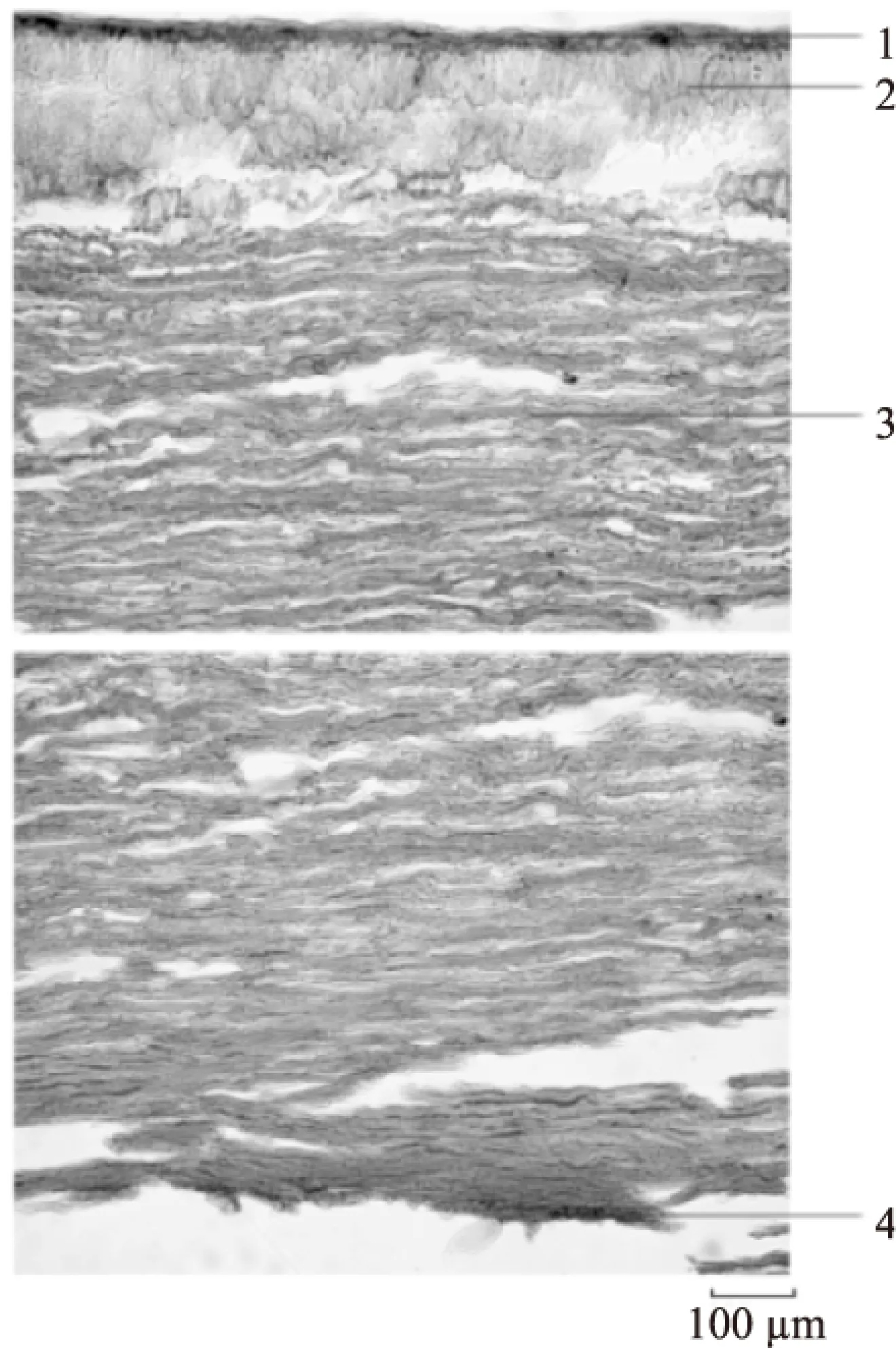
图3 板栗壳纵切面图Fig.3 Longitudinal section micrographs of chestnut epicarp注:1角质层,2外果皮,3中果皮,4内果皮。
2.2.2 板栗壳基底组织切片 板栗壳基底横切面:外果皮由数列细胞构成,可见草酸钙簇晶、方晶;外果皮内侧,中果皮外侧有较多石细胞群,石细胞较大,多为类圆形、不规则形、分枝状,层纹较明显,有的可见孔沟。中果皮由十余列薄壁细胞构成,内含棕色色素。中果皮内侧有一石细胞环带,石细胞较小,呈类圆形、类方形和不规则形,层纹和孔沟隐约可见。石细胞环带的上下两侧,均散在草酸钙簇晶。内果皮内侧有较多非腺毛,种脊部位有维管束。见图4。板栗壳基底纵切面:外果皮由数列细胞构成。中果皮外侧有较多石细胞群及少量小型维管束。石细胞群成类圆形散在,石细胞多为类圆形、不规则形,壁较厚,层纹明显,有的可见孔沟。石细胞群周围、维管束及种脊维管束旁可见草酸钙方晶。内果皮由一列细胞构成,内含棕色色素,可见较多非腺毛。见图5。
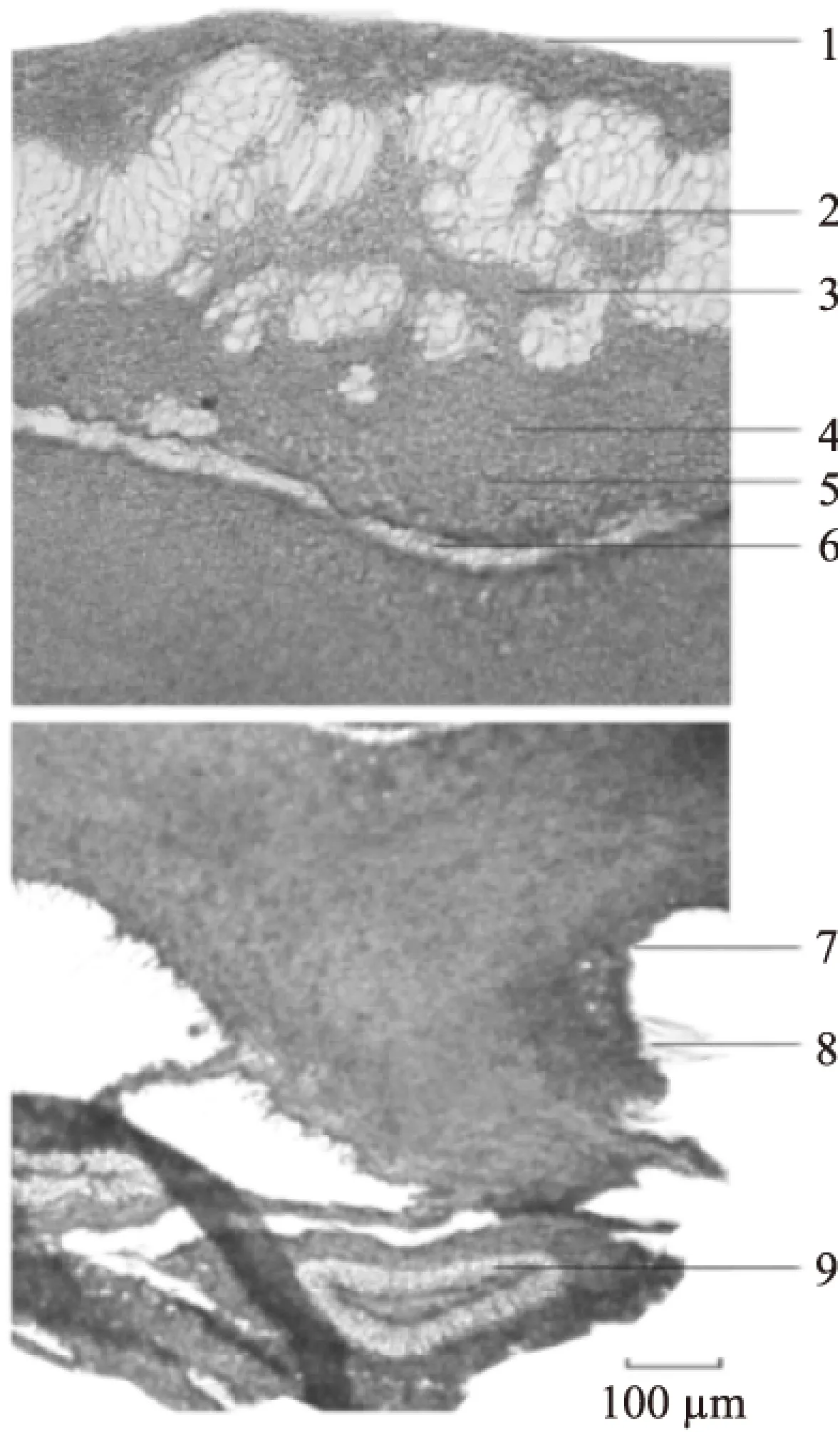
图4 板栗壳基底横切面图Fig.4 Base transverse section micrographs of chestnut epicarp注:1:外果皮,2:石细胞群,3:草酸钙方晶,4:草酸钙簇晶, 5:中果皮,6:石细胞带,7:内果皮,8:非腺毛,9:种脊维管束。
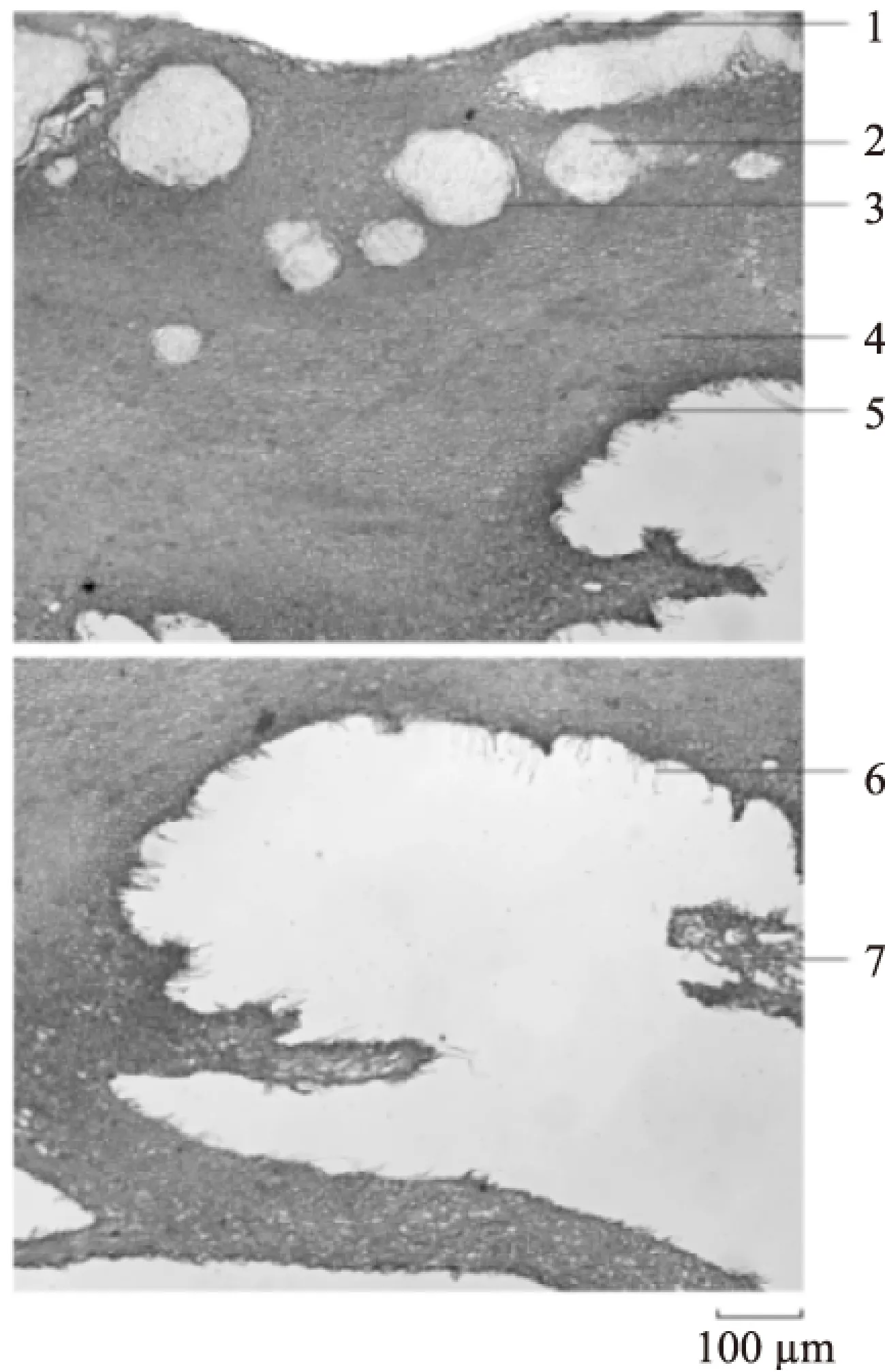
图5 板栗壳基底纵切面图Fig.5 Base longitudinal section micrographs of chestnut epicarp注:1:外果皮,2:维管束,3:石细胞群,4:中果皮, 5:内果皮,6:非腺毛,7:种脊维管束。
2.2.3 板栗壳粉末 粉末灰褐色,气微,味微涩。果皮表皮细胞表面观呈多角形,壁厚,表面有角质纹线,内含黄棕色物质。中果皮细胞多角形,呈淡黄色。内果皮细胞多为方形,有网状纹理。胚乳细胞呈黄褐色,含糊粉粒。中果皮外侧石细胞极多,较大,呈类圆形、不规则形、分枝状,壁厚,层纹较明显,有的可见孔沟及壁孔,大小约为60~100 μm。中果皮内侧石细胞较小,呈类圆形、类方形和不规则形,层纹和孔沟隐约可见,大小约为20~50 μm。导管多为螺纹导管,直径约为18~30 μm。非腺毛为单细胞,长80~400 μm,常弯曲,壁增厚。纤维呈束。草酸钙方晶直径约为6~50 μm。草酸钙簇晶直径约为15~80 μm。
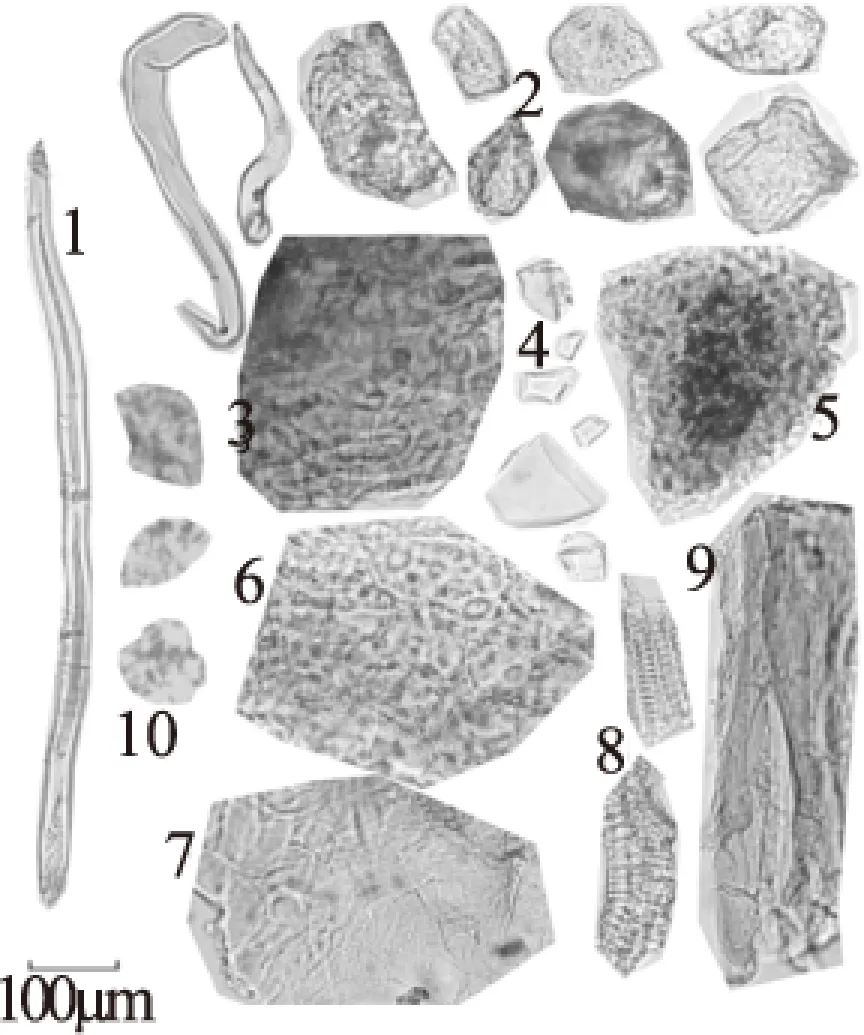
图6 板栗壳粉末显微图Fig.6 Microscopic images of tissue powder of chestnut epicarp注:1:非腺毛,2:石细胞,3:果皮表皮细胞,4:草酸钙方晶, 5:胚乳细胞,6:中果皮细胞,7:内果皮细胞, 8:导管,9:果皮纤维,10:草酸钙簇晶。
2.3 没食子酸、绿原酸和芦丁含量测定
2.3.1 样品处理条件的优化 实验中选用不同比例的甲醇或乙醇,板栗壳提取液颜色较深,存在大量板栗壳色素,干扰没食子酸、绿原酸及芦丁的含量测定,采用石油醚萃取后,效果仍然不佳。用石油醚浸泡后,再用乙酸乙酯超声提取,能减少色素及其他成分对测定的影响。
因此供试品的制备方法为:精密称取板栗壳粉末0.2 g,加30 mL石油醚浸泡24 h,弃去石油醚液,药渣挥干;加30 mL乙酸乙酯,超声间歇提取45 min,滤过,滤液旋转蒸发除去乙酸乙酯,残渣加适量甲醇溶解定容至25 mL,即得。
2.3.2 色谱条件的优化 流动相为乙腈-0.4%磷酸或甲醇-0.4%磷酸,采用梯度洗脱均能将三种成分分离且不受其它成分的干扰。最终确定色谱条件:流动相A(甲醇),流动相B(0.4%磷酸),梯度洗脱,见表1,检测波长275 nm;流速1 mL/min,柱温30 ℃,进样体积10 μL。此色谱条件下所测定各成分色谱峰与相邻色谱峰的分离最度均大于1.5,且各色谱峰的对称性良好,见图8。

表1 梯度洗脱Table 1 Gradient elution
2.3.3 检测波长的选择 本实验采用二极管阵列检测器多波长扫描(见图7),没食子酸在220 nm及270 nm处有最大吸收,绿原酸在218 nm及327 nm处有最大吸收,芦丁在257 nm及350 nm处有最大吸收,分别在各成分的最大紫外吸收附近即254,275,280,290,295,300,310,320 nm波长处进行检测,在275 nm三种成分检测灵敏度较好,故本实验确定检测波长为275 nm。
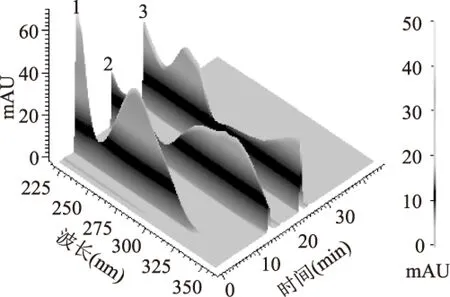
图7 三维光谱图Fig.7 Three-dimension spectrum注:1.没食子酸,2.绿原酸,3.芦丁,图8同。
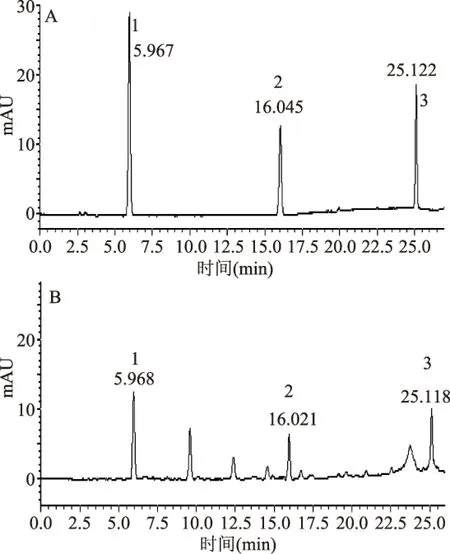
图8 对照品混合液(A)和板栗壳样品(B)HPLC色谱图Fig.8 HPLC chromatograms of reference substances(A)and Chestnut Epicarp(B)
2.3.4 方法学验证 线性范围与专属性:样品和对照品的HPLC图谱见图8。结果表明,没食子酸的保留时间约为6.0 min,线性回归方程为y=501.21x+2762.7,r=0.9998,0.34~10.67 μg/mL范围内线性关系良好;绿原酸的保留时间约为16.0 min,线性回归方程为y=357.58x+4018.4,r=0.9997,0.41~13.04 μg/mL范围内线性关系良好;芦丁的保留时间约为25.1 min,线性回归方程为y=1073.9x+2380.6,r=0.9997,0.32~10.00 μg/mL范围内线性关系良好。
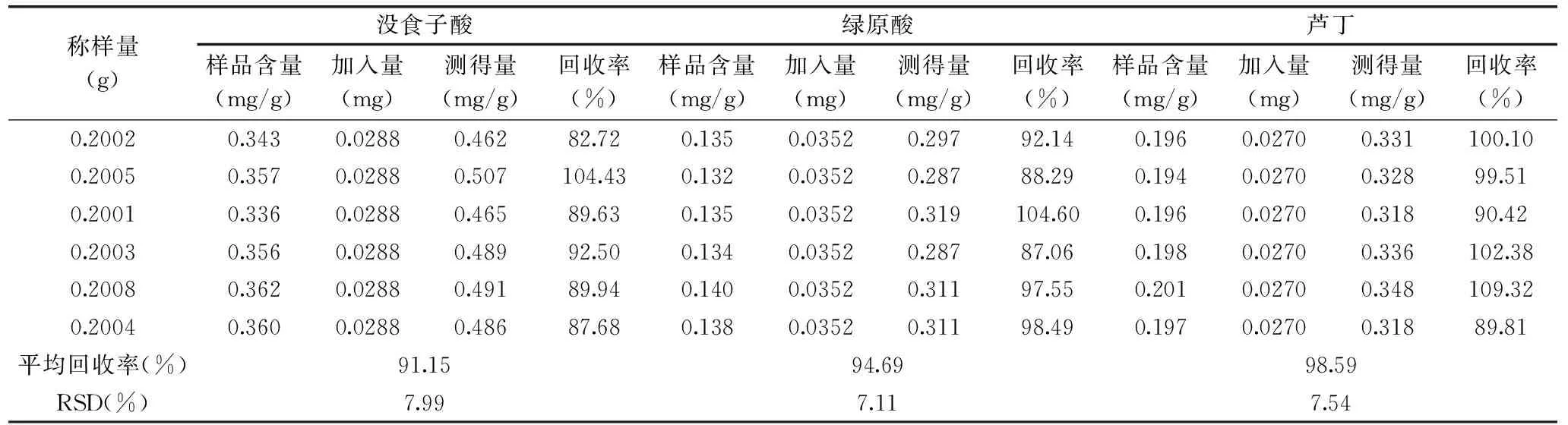
表2 加样回收率测定结果Table 2 Results of recovery tests
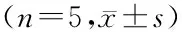
表3 样品测定结果Table 3 Analytical results of ±s)
精密度实验:精密吸取对照品混合溶液,用0.22 μm微孔滤膜滤过,取续滤液,每次进样10 μL,重复进样6次,测定峰面积,计算没食子酸峰面积RSD为1.54%,绿原酸峰面积RSD为1.81%,芦丁峰面积RSD为1.86%,结果表明仪器精密度良好。
重复性实验:精密吸取2.3.1项下制备的同一批次供试品溶液,用0.22 μm微孔滤膜滤过,弃去粗滤液,取续滤液,每次进样10 μL,重复进样6次,测定峰面积,没食子酸、绿原酸和芦丁峰面积RSD分别为1.23%、1.82%、2.35%,结果表明方法重复性良好。
稳定性实验:精密吸取重复性实验项下制备的供试品溶液室温避光放置,分别在0、2、4、6、8、12、24 h进样,按2.3.2项下色谱条件测定峰面积。没食子酸、绿原酸、芦丁的峰面积RSD分别为1.85%、2.02%、1.97%,结果表明供试品溶液在24 h内稳定。
加样回收率实验:精密称取6份已知含量的板栗壳粉末0.2 g,分别精密加入对照品混合溶液(每1 mL含没食子酸、绿原酸和芦丁1.44、1.76、1.35 mg)0.02 mL,按2.3.1项下制备供试品溶液,用0.22 μm微孔滤膜滤过,弃去粗滤液,取续滤液,按2.3.2项下色谱条件测定计算回收率。各成分平均回收率分别为91.15%、94.69%、98.59%,RSD%分别为7.99%、7.11%、7.54%,见表2,结果表明各成分加样回收率良好。
2.3.5 样品测定 按2.3.1项下制备11批云南不同产地供试品溶液,用0.22 μm微孔滤膜滤过,弃去粗滤液,取续滤液,按2.3.2项下色谱条件可同时测定供试品溶液中没食子酸、绿原酸和芦丁的具体含量值,结果见表3。11批云南不同产地板栗壳中没食子酸含量在0.328~0.362 mg/g,绿原酸含量在0.129~0.141 mg/g,芦丁含量在0.180~0.230 mg/g。
3 结论
生药研究实验结果表明板栗壳的主要显微鉴别特征为:板栗壳横切面外果皮细胞长圆柱形,呈栅状排列。板栗壳基底横切面中果皮外侧有较大石细胞构成的石细胞群,中果皮内侧有一石细胞环带,周围分布较多的草酸钙簇晶和方晶;内果皮内侧有较多非腺毛,种脊部位有一类三角形维管束。粉末特征中,果皮表皮细胞和中果皮细胞呈多角形,内果皮细胞多为方形,有较多层纹明显的大型厚壁分枝状石细胞及层纹和孔沟隐约可见的小型石细胞,非腺毛为厚壁单细胞。本文从板栗壳性状、组织切片、粉末特征对其做了全面的生药研究,这些特征在文献中未见报道,为板栗壳生药学质量标准研究奠定了基础。
采用反相HPLC法,梯度洗脱,可同时测定板栗壳样品中没食子酸、绿原酸和芦丁的含量,各成分质量浓度与峰面积在测定范围内均呈良好的线性关系(r≥0.9997),平均加样回收率分别为91.15%、94.69%、98.59%,RSD%分别为7.99%、7.11%、7.54%,该方法操作简单,结果准确,专属性强,为板栗壳质量标准的建立提供依据
[1]中华本草编辑委员会.中华本草(第二卷)[J].上海:科学技术出版社,1999:419-421.
[2]陈晓天,李俊卿,宋元达.栗壳抑菌物质的提取及其抑菌作用的研究[J].食品与生物技术学报,2016,35(8):54-58.
[3]郑佳欣,李怡婧,汪晨阳,等.板栗壳鞣质提取及其对 DPPH自由基清除活性的研究[J].食品工业科技,2016,37(3):211-215.
[4]韦琴,乐薇,吕凯波,等.板栗壳原花青素的提取及体外抑菌作用研究[J].食品与发酵工业,2016,42(4):214-219.
[5]金黎明,陈苛蒙,王宁,等.板栗壳棕色素的提取及性质研究[J].食品研究与开发,2016,37(6):50-54.
[6]冉靓,李素莲,杨庆,等.板栗壳不同溶剂提取物抗氧化活性的研究[J].食品工业,2013,34(5):156-158。
[7]许卫军,张红霞,吴长忠,等.板栗壳水提物对缺氧小鼠氧自由基的影响[J].临床医学,2012,32(4):104-105.
[8]刘莉,唐新玥,张欣珂,等.板栗壳中多酚的提取纯化及其抑制α-葡萄糖苷酶活性的研究[J].食品工业科技,2015,36(6):265-268.
[9]贾陆,席芳,王娜,等.栗壳化学成分研究[J].中国医药工业杂志,2010,41(2):98-102.
[10]赵德义,高文海,花成文,等. 板栗壳化学成分的初步研究[J].陕西林业科技,2003,2:14.
[11]卢川,吴兆华,高慧嫒,等.板栗种皮化学成分的分离与鉴定[J].沈阳药科大学学报,2009,26(5):357-360.
[12]卢川,吴迪,高慧媛,等.板栗种皮化学成分的分离与鉴定[J].沈阳药科大学学报,2010,27(6):440-442.
[13]常连举,张宗,黄嘉玲,等.没食子酸的制备与应用综述[J].生物质化学工程,2010,44(4):48-52.
[14]刘颖,郭明晔,白根本.绿原酸的研究进展[J].中药材,2012,35(7):1180-1185.
[15]艾凤伟,李诗莹,成效天,等.芦丁制剂的研究新进展[J]. 中成药,2012,34(7):1347-1350.
[16]王世伟,张小慧,刘霞,等. 板栗壳质量标准的研究[J].中国药物与临床,2015,15(7):947-9455.
[17]和静萍,武尉杰,谭睿,等.板栗壳的生药鉴别研究[J]. 世界科学技术—中医药现代,2014,16(9):1908-1911.
[18]刘淑萍,王蕾.栗蓬抗菌成分提取工艺的优化与联合测定[J]. 浙江大学学报:农业与生命科学版,2016,42(1):23-29.
[19]韦琴.板栗壳中原花青素含量检测方法的比较研究[J]. 食品与机械,2016,32(3):77-81.
[20]谢苗,杨淋,杨晓珍,等.HPLC 法同时测定紫地榆3 种提取物中4 种成分[J].中成药,2016,38(5):1066-1070.
[21]刘宇,张明明,刘墨祥.速效止泻胶囊质量标准的研究[J].中成药,2015,37(9):1969-1972.
[22]邸学,谷丽艳,王海波,等.HPLC同时测定桑叶中绿原酸、芦丁、异槲皮苷、紫云英苷、槲皮素含量[J].中国实验方剂学杂志,2014,20(15):92-95.
[23]陈晓鹏,鄂秀辉,夏忠庭,等.HPLC法同时定量测定养血清脑颗粒中7个主要成分[J].中成药,2013,35(9):1921-1924.
[24]章运典,周里欣,陈洪英.RP-HPLC法同时测定天智颗粒中天麻素、栀子苷、芦丁和黄芩苷[J].中成药,2014,36(8):1670-1673.
Pharmacognostical studies of Chestnut Epicarp and determination of active ingredients including gallic acid,chlorogenic acid and rutin
SU Li-na,WANG Xiao-qin
(Department of pharmacy,Qujing Medical College,Qujing 655000,China)
PharmacognosticalstudiesofChestnutEpicarpwerecarriedoutbyusingmorphologicalidentification,tissuesliceidentificationandpowderidentification.Gallicacid,chlorogenicacidandrutinweresimultaneousdeterminedbyHPLCequippedwithHypersilODS2columnandUVdetectionwasused,thedetectionwavelengthwassetat275nm.Themobilephasewasconsisitedofmethanoland0.4%phosphoricacidwithgradientelution.Theflowratewas1.0mL/minandthecolumntemperaturewasat30 ℃.TheresultsshowedthatthesefeaturesintransverseandlongitudinalsectionsofChestnutEpicarp,pericarpcell,stonecellsgroupsandstonecellringofsarcocarp,alargenumberofnon-glandularhairsofendocarpandtriangularvascularbundlelocatedattheraphesitecouldbeusedasChestnutEpicarppharmacognosticalcharacteristics,additionally,thepowdercharacteristicsofpericarpcell,stonecellsandnon-glandularhairswerepharmacognosticalcharacteristicsofChestnutEpicarp,whichlaidthefoundationtofurtherstudypharmacognosticalqualitystandardofchestnutepicarp.Thecontentrangeofgallicacidwas0.328~0.362mg/g,chlorogenicacidwas0.129~0.141mg/g,andrutinwas0.180~0.230mg/ginthechestnutepicarpproducedat11differentplacesinYunnan.Themethodwassimple,accurateandspecific.Itcanprovidebasisfortheestablishmentofqualitystandardofchestnutepicarp.
ChestnutEpicarp;gallicacid;chlorogenicacid;Rutin;HPLC;pharmacognosticalstudies
2016-04-21
苏丽娜(1980-), 硕士研究生,副教授,研究方向:药物质量控制及体内药物分析, E-mail:sulina828@163.com。
云南省教育厅科学研究基金项目(2012Y210)。
TS207.3
A
1002-0306(2016)21-0323-06
10.13386/j.issn1002-0306.2016.21.054

