AFLP引物组合数对准确分析马缨杜鹃遗传多样性的影响
沈德周 纵 丹 周安佩 颜璐茜 李 旦 何承忠,4
(1. 西南林业大学云南省高校林木遗传改良与繁育重点实验室,云南 昆明 650224; 2. 西南林业大学西南地区生物多样性保育国家林业局重点实验室,云南 昆明 650224; 3. 西南林业大学云南生物多样性研究院,云南 昆明 650224;4. 西南林业大学西南山地森林资源保育与利用省部共建教育部重点实验室,云南 昆明 650224)
AFLP引物组合数对准确分析马缨杜鹃遗传多样性的影响
沈德周1,2纵 丹1,2周安佩1,2颜璐茜1,2李 旦3何承忠1,2,4
(1. 西南林业大学云南省高校林木遗传改良与繁育重点实验室,云南 昆明 650224; 2. 西南林业大学西南地区生物多样性保育国家林业局重点实验室,云南 昆明 650224; 3. 西南林业大学云南生物多样性研究院,云南 昆明 650224;4. 西南林业大学西南山地森林资源保育与利用省部共建教育部重点实验室,云南 昆明 650224)
利用5、7、9、11和13对AFLP引物组合对4个居群马缨杜鹃遗传多样性进行分析,探讨不同引物组合数量对其遗传多样性参数指标的影响。结果表明:随着引物组合数量的增加,紫溪山居群遗传多样性的各参数指标变化趋势一致, 5对引物组合检测结果略高于其他引物组合数,但差异不显著,其余3个居群的变化规律不明显;不同引物组合数量对居群间遗传距离无显著影响,UPGMA聚类结果完全相同。由此可见,选用5对引物组合对马缨杜鹃进行遗传多样性分析就能够提供较为准确的结果。
马缨杜鹃;遗传多样性;AFLP标记;引物
马缨杜鹃 (Rhododendrondelavayi),又名马缨花,杜鹃花科 (Ericaceae),杜鹃属,常绿灌木或小乔木,树干直,最高可达12 m。叶革质,长圆状披针形或长圆状倒批针形,长7~16 cm,宽2~5 cm,侧脉14~18对。花序多花密集,有花10~20朵。花萼小,花冠钟形,深红色。蒴果长圆柱形。花期3—5月,果期9—11月。在我国广布于云南全省及贵州西部,海拔1 200~3 000 m处,生长于常绿阔叶林或云南松林下,局部地区形成马缨花纯林[1]。马缨杜鹃具有较高的观赏、药用价值和经济价值[2-4],吸引了众多学者的研究目光。但马缨杜鹃变种丰富,难以从形态学上加以鉴定区分[1],同时存在着同名异物,同物异名的现象,对马缨杜鹃良种的选育和繁育造成影响,不利于其大规模种植和加工利用[5-6]。因此,有必要对马缨杜鹃群体间和种内不同个体的遗传多样性进行全面的调查研究,为其遗传育种、种植资源收集及进一步的开发利用提供理论依据。
遗传多样性是指种内不同居群之间或同一居群内不同个体之间的遗传变异总和,它是物种适应自然并发生进化的基础[7]。而能够反映生物个体或居群间基因组中某种差异特征的DNA片段,即DNA分子标记,可以直接反映基因组DNA之间的差异[8]。近年来,采用分子标记技术分析物种遗传多样性的报道有很多,而所使用的标记种类、标记数量、引物数量不尽相同,如Demeke等[9]在使用RAPD技术对芸苔属植物进行研究时认为,要充分反映其亲缘关系,至少需要10对引物组合;陈新露等[10]认为至少13对引物组合才能使得RAPD分子标记的分析结果更加客观;李潞滨等[11]认为,利用AFLP技术在以系统学关系分析为目的的研究中,尤其是对基因组较大的植物,应采用尽可能多的引物组合分析供试样品。采用引物组合的数量不同,不仅在试验成本方面存在差异,也对研究结果的准确性和不同结果之间的可比性评价带来了一定的困扰。为此,本研究采用AFLP分子标记技术对马缨杜鹃4个自然居群的遗传多样性水平进行检测,探讨在不影响试验结果可靠性以及尽可能节省成本的情况下,可以准确揭示马缨杜鹃遗传多样性水平的合理引物组合数,旨在为其群体遗传学研究提供前期基础,也能够为其他物种遗传多样性的研究提供参考。
1 材料与方法
1.1 试验材料
供试的56份马缨杜鹃样本分别采自于紫溪山、马雄山、板凳山和小营地4个自然居群 (表1)。每一居群的采样数均为14份,单株间隔50 m以上,以避免采集到亲缘关系较近的个体。在每一样株上均采集位于植株中部且生长状况良好的健康嫩叶6~8片,放入装有变色硅胶的自封袋中干燥保存,带回实验室备用。

表1 供试4个马缨杜鹃居群的基本概况
1.2 试验方法
1.2.1 总DNA提取
采用改良的SDS法依照标准酚/氯仿流程提取分析样本的基因组总DNA[12],用0.8%的琼脂糖凝胶电泳和紫外分光光度计 (Spekol-1300) 共同检测其浓度和纯度,稀释至50 ng/μL的浓度,于-20 ℃冰箱保存备用。
1.2.2 AFLP体系建立
AFLP分析参照Vos等[13]的方法。使用EcoRI+MseI 2种限制性内切酶组合进行基因组DNA双酶切,预扩增反应采用EcoR I+00/MseI+00引物组合,将预扩增产物稀释20倍作为选择性扩增DNA模板,选择性扩增采用EcoR I+3/MseI+3引物组合共计15对,PCR扩增反应在PTC-100TMThermal PCR仪上进行。
1.2.3 电泳分离
选择性扩增产物加入1/3体积的双指示剂,于95 ℃变性5 min,随后立即放置于冰水混合物中。取6 μL上样于已预电泳30 min的6%变性聚丙烯酰胺凝胶中,70 W恒定功率电泳约2 h。电泳结束后采用银染检测法[14]进行AFLP显色反应。
1.2.4 数据处理与分析
本研究从15对引物组合中随机选取3对引物组合作为基数,在剩余的12对引物组合中,以随机抽取的2对引物组合 (不重复抽取) 为单位从3对引物组合逐级递增到13对,分别为5、7、9、11和13对,并设置3次重复。在电泳图谱上对迁移率相同的条带进行统计,有带记为 “1”,无带记为 “0”,形成0/1 矩阵。采用多态性信息含量 (polymorphism information content, PIC) 评价不同引物组合数量的标记效应,计算公式为 “PIC=∑PICi/N=∑2fi(1-fi)/N”[15],其中 “PICi” 表示第 “i” 个标记的多态性信息含量,“fi” 表示扩增条带 (记为 “1” 的条带)的出现频率, “1-fi” 表示无效带 (记为 “0” 的条带)的频率, “N” 表示检测到的多态性条带数 (NPB)。应用POPGENE 1.32软件对马缨杜鹃4个自然居群的多态位点百分率 (PPB)、观测等位基因数 (Na)、有效等位基因数 (Ne)、Nei′s基因多样性指数 (H)、Shannon′s信息指数 (I)、Nei′s总基因多样度 (Ht)、居群内基因多样度 (Hs)、遗传分化系数 (Gst)、基因流 (Nm)、以及4个居群间的Nei′s遗传距离等遗传参数进行分析,并应用SPSS 13软件对不同引物组合数量的遗传多样性参数进行方差分析。采用MEGA 5.0软件进行基于Nei′s遗传距离的UPGMA聚类分析,构建聚类图。
2 结果与分析
2.1 AFLP扩增结果
筛选出来的15对引物对4个居群56份马缨杜鹃样本的AFLP分析结果表明 (表2),15对引物组合共扩增出1 142条带,有效片段长度在75~580 bp之间,其中多态性条带 (NPB) 806条,多态带百分率 (PPB) 为70.58%,多态性信息含量 (PIC) 为0.304 6。不同引物组合扩增得到的多态带数 (NPB) 各不相同,最高的出现在引物组合E32-M36中,达79条,而E38-M46、E58-M64、E64-M49这3对引物组合扩增得到的多态性条带数较少,仅为29条;多态性条带百分率最高的是引物组合E45-M54,为82.72%,最低的是引物组合E38-M46,为46.03%;多态性信息含量PIC值在不同引物组合间的变动范围为0.255 2 (E53-M49)~0.370 6 (E32-M36)。平均每对引物扩增出的总条带数为76.1条,多态性条带为53.7条,多态性条带百分率为69.65%,多态性信息含量为0.302 6。

表2 AFLP分析的引物组合及扩增结果
2.2 遗传多样性水平分析
有效等位基因数 (Ne) 和Nei′s基因多样性指数(H) 是衡量物种遗传变异常用的2个指标,具有明显的遗传学意义,而Shannon′s信息指数 (I) 本身没有意义,但方便与同类研究进行比较[16-17]。利用POPGENE 1.32对不同引物组合数量的马缨杜鹃遗传多样性参数进行分析,结果见表3。从物种水平来看,不同引物组合数量的多态位点百分率变化范围为68.77% (11对引物组合) ~70.08% (5对引物组合)。Ne、H、I均是5对引物组合略高,分别为1.235 8、0.156 9和0.256 0,在9对引物组合中略低,依次为1.246 8、0.163 0和0.263 8。多态性信息含量 (PIC) 略有不同,在7对引物组合中最高,达0.329 5,5对引物组合次之,为0.319 9,9对引物最低,仅0.287 7。

表3 马缨杜鹃4个居群的遗传多样性参数
从居群水平来看,不同引物组合数量遗传参数变化趋势也不相同,随着引物数量的增加,4个居群所扩增的多态带数也逐渐增加。紫溪山居群中, PPB、Ne、H、I变化趋势一致,均在5对引物组合中最高 (50.10%、1.213 4、0.133 9和0.210 9),多态性信息含量 (PIC) 则在7对引物组合中最高 (0.350 3),它们在13对引物组合中最低 (47.41%、1.189 2、0.121 0、0.192 7,0.330 2);板凳山居群中,PPB、Ne、H、I最低值均出现在5对引物组合中,多态性信息含量 (PIC) 最低值 (0.324 2) 则出现在11对引物组合中,除有效等位基因数 (Ne) 最高值出现在9对引物组合中, PPB、H、I、PIC最高值均出现在7对引物组合中,分别为54.31%、0.132 3、0.213 6和0.342 1;马雄山居群中, PPB、Ne、H、I最大值均出现在5对引物组合中,分别为54.75%、1.216 8、0.139 4和0.222 4;最小值除Ne在7对引物组合中,其余均在9对引物组合中,分别为52.60%、0.126 1和0.203 9,而PIC的变动范围为0.320 8~0.341 1,分别出现于13对引物组合和7对引物组合中;小营地居群中, PPB的最高值 (63.51%) 出现在11对引物组合中,最低值 (61.59%) 出现在5对引物组合中,Ne和H最高值 (1.286 5和0.179 4) 在5对引物组合中,最低值 (1.275 9和0.174 8) 在9对引物组合中,I则在11对引物组合中最高 (0.280 3),最低值在9对引物组合中,为0.275 0, PIC的最高值 (0.372 5) 同前3个居群一样,出现于7对引物组合中,最低值出现于9对引物组合 (0.355 6)。由此可见,相同引物组合数对不同居群遗传多样性参数的作用规律具有一定的差异性,但对多态性信息含量 (PIC) 的影响不明显,且遗传多样性参数与引物组合的多态性信息含量之间无明显的相关性。
此外,5、7、9、11和13对引物组合数量所得出的Nei′s总基因多样度 (Ht) 依次为0.163 0、0.159 2、0.156 9、0.160 1、0.158 0;居群内基因多样度 (Hs) 依次为0.145 6、0.142 3、0.139 6、0.142 6、0.140 0;居群间遗传分化系数 (Gst) 分别为0.106 5、0.105 7、0.110 9、0.109 0、0.114 2,均表明马缨杜鹃的遗传变异主要存在居群内不同个体之间,居群间的遗传变异仅占总变异的11%左右;居群间基因流 (Nm) 分别为4.198 8、4.229 9、4.021 9、4.088 4、3.883 9,表明马缨杜鹃居群间基因交流频繁。
进一步应用SPSS软件对不同引物组合数量获得的马缨杜鹃遗传多样性参数进行方差分析,结果表明 (表4),引物组合数量的增加对马缨杜鹃遗传多样性参数 (PPB、Na、Ne、H、I、Ht、Hs、Gst、Nm) 的影响均不显著 (P> 0.05),表明使用5对引物组合就可以准确地对马缨杜鹃的遗传多样性水平进行分析。

表4 马缨杜鹃遗传多样性参数的方差分析
2.3 遗传距离与聚类分析
对4个不同自然居群的马缨杜鹃Nei′s遗传距离分析结果表明(表5),在5对引物组合中,遗传距离的范围为0.013 3~0.026 5;7对引物组合中,遗传距离的范围为0.015 0~0.027 5;9对引物组合中,遗传距离的范围为0.013 6~0.029 5;11对引物组合的遗传距离范围在0.013 8~0.030 3之间;13对引物组合的遗传距离范围在0.015 8~0.034 6之间。不同引物组合数所得的居群间遗传距离与引物组合数之间无明显相关性,但不同引物组合数揭示的居群之间遗传关系完全一致,即紫溪山居群与板凳山居群之间的遗传距离最小,表明二者之间的亲缘关系较近,而紫溪山居群与小营地居群之间的遗传距离最大,表明二者之间的遗传差异较大。
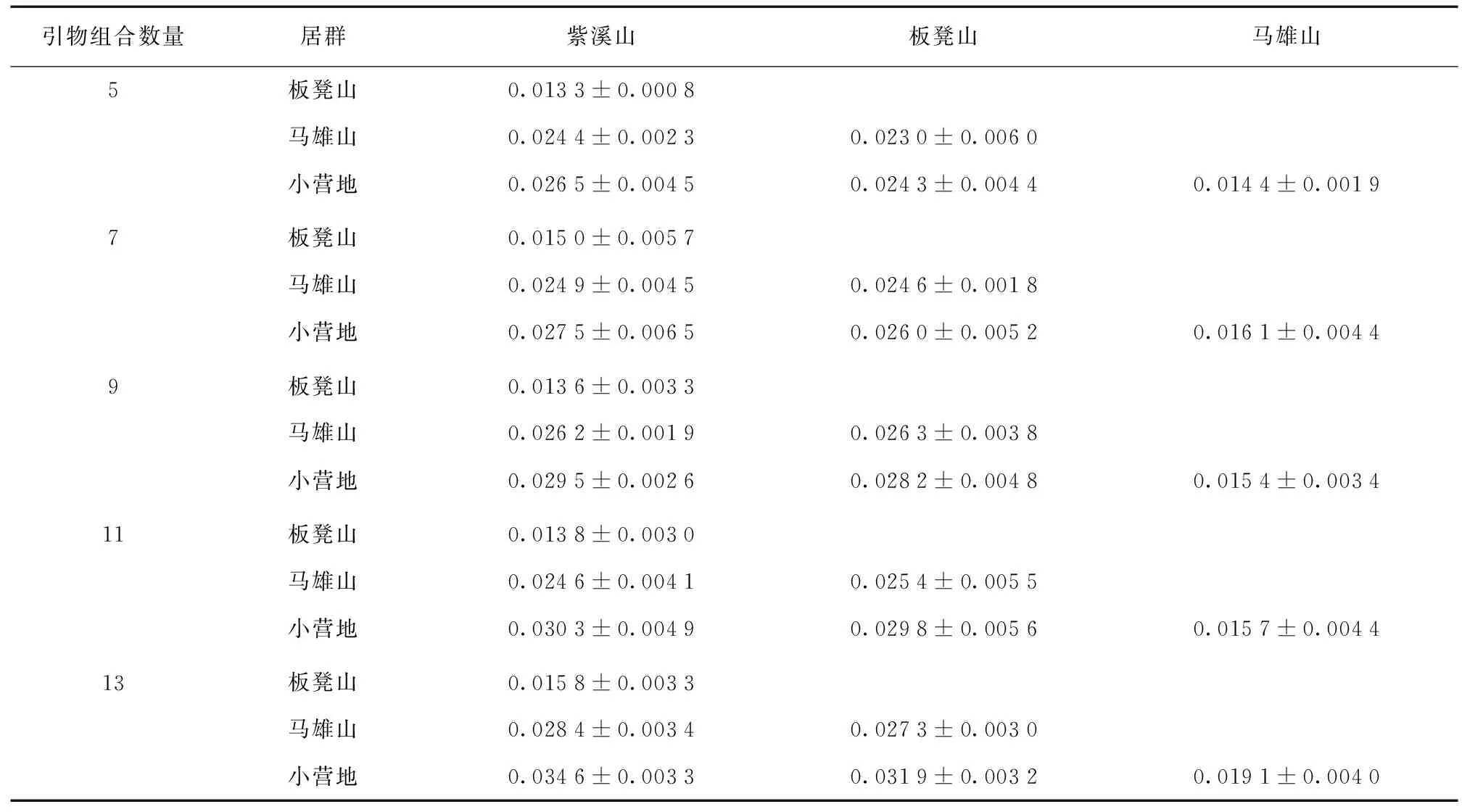
表5 马缨杜鹃居群间的遗传距离
采用MEGA 5.0软件进行基于居群间Nei′s遗传距离的UPGMA聚类分析,构建不同引物组合数下的马缨杜鹃4个居群聚类图 (图1)。由聚类图可见,AFLP共计5组引物组合数的聚类分析结果完合一致,马缨杜鹃4个居群可以划分为2个大组,第I组由来自楚雄市的紫溪山居群和板凳山居群构成,第II组包含了来自曲靖市的马雄山居群和小营地居群。
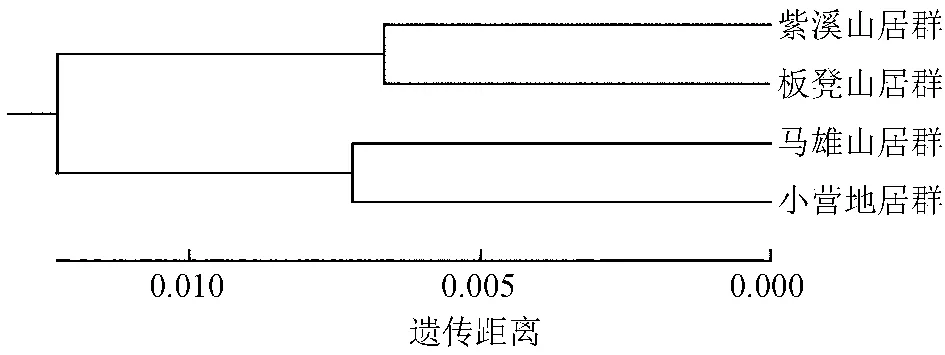
图1 AFLP 5对引物组合数的基于Nei′s遗传距离聚类图
Fig.1 Dendrogram of AFLP five primer combinations based on Nei′s genetic distance
3 讨 论
与其他同类型分子标记技术相比,AFLP标记通常能检测到更多的条带数目,多态性较高,一直以来都受到研究者的青睐,被不断用于研究生物种群的遗传结构、物种遗传多样性分析和系统进化等领域[18]。且相比其他标记,AFLP技术检测效率高,很少的引物组合即可达到研究目的,因此研究者在对植物遗传多样性和系统进化进行研究时,依据研究目的的不同,选用的引物组合数量也不同[11]。闫志峰等[19]采用AFLP标记的8对荧光引物对10个野生种群共计129个黄檗 (Phellodendronamurense) 个体进行了遗传多样性分析,索风梅等[20]同样也采用AFLP标记8对选择性扩增引物对唐古特大黄 (Rheumtanguticum)、掌叶大黄 (Rheumpalmatum) 和药用大黄 (Rheumofficinale) 的亲缘关系进行了分析,而吴扬等[21]则选用3对AFLP引物对黄金茶 (Camelliasinensis) 群体的111个株系进行了遗传多样性分析。
应用于品种的区分时,由于AFLP技术的高效性,仅用少数几对引物就可以达到研究目的。Cervera等[22]在对来自西班牙的67个葡萄 (Vitisvinifera) 品种进行AFLP分析时,使用2对引物就很好地解决了同名异物和同物异名的问题,Tignon等[23]采用AFLP技术对苹果 (Maluspumila) 品种进行鉴别时,仅用1对AFLP引物组合就能够鉴别28个待测苹果品种。李潞滨等[11]选用10对AFLP引物组合对竹子系统关系进行研究结果表明,仅用1对引物组合就能区分出26个竹种的差异,且随着引物数量的增加,26个供试竹种的聚类关系趋于一致。但应用于居群间和居群内个体遗传多样性的研究时,AFLP标记所用引物数量各不相同,季鹏章等[24]采用AFLP技术对云南南部及周边地区狭隘分布的大理茶 (Camelliataliensis) 11个居群共204个个体进行遗传多样性分析,结果表明,仅选用2对引物组合扩增获得的多态性条带百分率达100%,检测到大理茶的遗传多样性水平较低,且遗传变异主要存在于居群内。陈良华等[25]采用4对多态性高、分辨力强的引物组合对4个四川核桃 (Juglusregia) 居群共46个样品进行分析,结果表明群体内的遗传多样性大于群体间的遗传多样性。而黄骥[26]等选用7对AFLP引物组合对武陵山区蛇足石杉 (Huperziaserrata) 4个居群的遗传多样性进行分析,结果表明居群间遗传多样性有明显差别。王东升等[27]在对山东省5个地区共62份紫椴 (Tiliaamurensis) 遗传多样性分析时,选用了9对AFLP引物组合,分析结果表明紫椴具有较高的遗传多样性。由此可见,种内遗传多样研究所选用的引物数量没有统一的定论,选用引物数量较少时,会影响数据的判断,产生较大的随机误差,选用引物数量较多,会增加工作量,造成非必要的时间与成本上的损失。本研究分别选取AFLP标记的5、7、9、11和13对引物组合对4个不同自然居群的马缨杜鹃遗传多样性进行了分析,结果表明,随着引物组合数的增加,AFLP分析结果无论在物种水平,还是在居群水平,马缨杜鹃的遗传多样性参数差异均不显著,且聚类分析结果完全一致,表明在采用AFLP分子标记技术进行马缨杜鹃群体遗传学分析时,选择5对引物组合即可得到较为准确的分析结果。但将AFLP分子标记技术应用于不同物种的群体遗传学分析时,适宜的引物组合数是否相同或存在差异,尚有待于进一步研究。
[1] 中国科学院昆明植物研究所. 云南植物志: 第4卷[M]. 北京: 科学出版社, 1986.
[2] 程雪梅, 何承忠, 周敏, 等. 不同浸种方式对马缨杜鹃种子发茅率的影响[J]. 北方园艺, 2008(10): 106-109.
[3] 徐小蓉, 张习敏, 牛晓娟, 等. 赤霉素+2, 4-D及赤霉素+丁酰肼对马缨杜鹃光合作用日变化的影响[J]. 中南林业科技大学学报, 2011, 31(11): 131-136.
[4] 洪怡, 文晓鹏. 马缨杜鹃离体快繁体系的建立及优化[J]. 西南大学学报 (自然科学版), 2012, 34(8): 61-66.
[5] 中国科学院昆明植物研究所. 云南植物志: 第2卷[M]. 北京: 科学出版社, 1979.
[6] 中国科学院昆明植物研究所. 云南植物志: 第10卷[M]. 北京: 科学出版社, 2006.
[7] 陈灵芝, 马克平. 生物多样性科学: 原理与实践[M]. 上海: 上海科学技术出版社, 2001.
[8] 陈名红, 熊华斌, 李成云. 分子标记在百合属植物遗传多样性研究中的应用[J]. 生物技术通报, 2011(12): 65-69.
[9] Demeke T, Adams R P, Chibbar R. Potential taxonomic use of random amplified polymorphic DNA (RAPD): a case study in Brassica[J]. Theor Appl Genet, 1992, 84(7/8): 990-994.
[10] 陈新露, 赵祥云. 应用RAPD 技术评价丁香品种间遗传关系[J]. 园艺学报, 1995, 22(2): 171-175.
[11] 李潞滨, 郭晓军, 彭镇华, 等. AFLP引物组合数量对准确研究竹子系统关系的影响[J]. 植物学通报, 2008, 25(4): 449-454.
[12] Murray M G, Thompson W F. Rapid isolation of high molecular weight plant DNA [J]. Nucleic Acids Research, 1980, 8(19): 4321-4325.
[13] Vos P, Hogers R, Bleeker M, et al. AFLP: a new technique for DNA fingerprinting [J]. Nucleic Acids Research, 1995, 23(21): 4407-4414.
[14] Tixier M H, Sourdille R M, Leroy P, et al. Detection of wheat microsatellites using a non radioactive silver-nitrate staining method [J]. Journal of Genetic Breeding, 1997, 51(1): 175-177.
[15] Roldan-Ruiz I, Dendauw J, Van Bockstaele E, et al. AFLP markers reveal high polymorphic rates in ryegrasses (Loliumspp.) [J]. Molecular Breeding, 2000, 6(2): 125-134.
[16] Slatkin M, Barton N H. A comparison of three indirect methods for estimating average levels of gene flow [J]. Evolution, 1989, 43(7): 1349-1368.
[17] 宁静, 李健权, 黄丽娟, 等. “黄金茶” 特异种质资源遗传多样性和亲缘关系的ISSR分析[J]. 茶叶科学, 2010, 30(2): 149-156.
[18] 黄文坤, 郭建英, 万方浩, 等. AFLP标记在植物遗传多样性研究中的应用[J]. 中国农学通报, 2006, 22(8): 50-54.
[19] 闫志峰, 张本刚, 张昭. 等. 珍稀濒危药用植物黄檗野生种群遗传多样性的AFLP分析[J]. 生物多样性, 2006, 14(6): 488-497.
[20] 索风梅, 宋经元, 陈士林. 等. AFLP分析唐古特大黄、掌叶大黄和药用大黄的亲缘关系研究[J]. 中草药, 2010, 41(2): 292-296.
[21] 吴扬, 邓婷婷, 李娟, 等. 黄金茶种质资源遗传多样性的AFLP分析[J]. 茶叶科学, 2013, 33(6): 526- 531.
[22] Cervera M T, Cabezas J A, Sancha J C, et al. Application of AFLPs to the characterization of grapevineVitisviniferaL. genetic resources. A case study with accessions from Rioja (Spain) [J]. Theoretical & Applied Genetics, 1998, 97(1/2): 51-59.
[23] Tignon M, Kettmann R, Watillon B. AFLP use for the identification of apple cultivars and mutants[J]. Acta Hortic, 2000, 521(521): 219-226.
[24] 季鹏章, 汪云刚, 蒋会兵, 等. 云南大理茶资源遗传多样性的AFLP分析[J]. 茶叶科学, 2009, 29(5): 329-335.
[25] 陈良华, 胡庭兴, 张帆, 等. 用AFLP技术分析四川核桃资源的遗传多样性[J]. 植物生态学报, 2008, 32(6): 1362-1372.
[26] 黄骥, 陈浙, 李菁, 等. 武陵山区蛇足石杉遗传多样性的AFLP分析[J], 西北植物学报, 2014, 34(1): 83-92.
[27] 王东升, 辛红, 邢世岩, 等. 山东省紫椴遗传多样性AFLP分析[J]. 福建农林大学学报 (自然科学版), 2014, 43(1): 44-48.
(责任编辑 张 坤)
Effect of the Quantity of AFLP Primer Combinations on Accurately AnalyzingRhododendrondelavayiGenetic Diversity
Shen Dezhou1,2, Zong Dan1,2, Zhou Anpei1,2, Yan Luxi1,2, Li Dan3, He Chengzhong1,2,4
(1. Key Laboratory for Forest Genetic and Tree Improvement & Propagation in Universities of Yunnan Province, Southwest Forestry University,Kunming Yunnan 650224, China; 2. Key Laboratory of Biodiversity Conservation in Southwest China, State Forestry Administration,Southwest Forestry University, Kunming Yunnan 650224, China; 3. Yunnan Academy of Biodiversity, Southwest Forestry University,Kunming Yunnan 650224, China; 4. Key Laboratory for Forest Resources Conservation and Use in the Southwest Mountains of China,Ministry of Education, Southwest Forestry University, Kunming Yunnan 650224, China)
In order to investigate the effect of the quantity of primer combinations on genetic diversity parameters inRhododendrondelavayi, the amplified fragment length polymorphism (AFLP) was employed to test 4 natural populations ofRhododendrondelavayiwith 5, 7, 9, 11 and 13 AFLP primer combinations. The results showed that the genetic diversity parameters of Zixi Mountain population had same changing trends with the increase of primer combinations quantity, which indicated that the amplified resutls with 5 primer combinations were slightly higher than that with other primer combinations, but the differences were not significant. The changing trends of genetic diversity parameters in other 3 populations were not obvious. There was no significant effect on the genetic distance between populations and the cluster results were consistent based on unweighted pair group method analysis (UPGMA) with different numbers of primer combinations. So, it could be concluded that 5 primer combinations could provide accurate results ofR.delavayigenetic diversity.
Rhododendrondelavayi, genetic diversity, AFLP markers, primer

10. 11929/j. issn. 2095-1914. 2016. 06. 004
2015-12-14
云南省中青年学术与技术带头人后备人才培养项目 (2012HB021) 资助;西南林业大学云南省省级重点学科 (林学) 建设项目资助;西南林业大学大学生创新基金项目 (C15070) 资助;西南林业大学云南省高校林木遗传改良与繁育重点实验室开放基金项目 (YNGB201505) 资助。
何承忠 (1970—),男,博士,教授。研究方向:林木遗传育种与生物技术。Email: hcz70@163.com。
S718.46
A
2095-1914(2016)06-0022-07
第1作者:沈德周 (1992—),男,硕士生。研究方向:林木遗传育种及群体遗传学。Email: 1244339480@qq.com。

