布伦登卢普沙门菌耐药性与毒力基因分析
赵展,夏琳林,刘晓霞,杨杰,吴晓妹,张利娟,贾宇驰,王玉宝
布伦登卢普沙门菌耐药性与毒力基因分析
赵展,夏琳林,刘晓霞,杨杰,吴晓妹,张利娟,贾宇驰,王玉宝△
目的研究临床分离的非伤寒沙门菌布伦登卢普血清型(布伦登卢普沙门菌)对抗菌药物的耐药性及其携带的毒力基因特征。方法收集2012—2014年每年4—10月天津市两家教学医院肠道门诊急性腹泻患者的临床资料,将急性腹泻患者粪便标本进行沙门菌分离培养、生化及PCR鉴定、血清学分型,对得到的布伦登卢普沙门菌进行抗菌药物敏感性检测、PCR扩增沙门菌毒力岛(SPI)1~5的代表性基因和SPI的调节基因。结果3年共检测到非重复非伤寒沙门菌153株,其中8株(5.23%)为布伦登卢普沙门菌。8株invA-PCR鉴定均呈阳性,对萘啶酸耐药率100%,对环丙沙星和左氧氟沙星中介耐药率100%,对其余检测的抗菌药物敏感;8株均检测到了SPI 1~5代表性基因和SPI调节基因(sitC、hilA、sseL、sifA、mgtC、siiE、sopB和phoP)。结论天津地区布伦登卢普沙门菌临床株对氟喹诺酮耐药并携带SPI 1~5毒力基因与调节基因,对公众健康构成潜在威胁,应持续开展相关监测与研究。
腹泻;抗药性,微生物;喹诺酮类;氟喹诺酮;毒力;布伦登卢普沙门菌
在各种食源性病原体中,非伤寒沙门菌(Nontyphoidal Salmonella,NTS)造成的公共健康问题非常突出,在全球每年约导致9 380万人患急性胃肠炎和15.5万人死亡[1]。沙门菌毒力岛(Salmonella Pathogenicity Islands,SPI)是沙门菌染色体上的大片段DNA,可携带多种毒力基因,帮助其侵入人体并在免疫细胞中存活和复制,与伤寒或NTS的致病能力密切相关[2]。NTS包括近3 000种血清型,引起感染和暴发最常见的血清型是肠炎沙门菌和鼠伤寒沙门菌[3]。布伦登卢普沙门菌(S.Braenderup)在NTS中的分离比例虽然不高,但该血清型的大规模暴发感染在国内外均有报道[4-5]。国外已发现S.Braenderup对氟喹诺酮和三代头孢等抗菌药物的耐药株,但国内鲜见S.Braenderup对抗菌药物耐药性及携带毒力基因的研究报道。本研究对2012—2014年每年4—10月连续3年临床分离的S.Braenderup进行了相关分析,报告如下。
1 资料与方法
1.1 临床资料收集2012—2014年每年4—10月就诊于天津医科大学第二医院和天津医科大学总医院肠道门诊急性腹泻患者的临床资料。3年共153例NTS感染,其中8例为S.Braenderup;5例来自天津医科大学第二医院,3例来自天津医科大学总医院;包括男5例、女3例,年龄25~62岁,中位年龄(P25,P75)为40.50(28.75,60.75)岁。
1.2 主要试剂与仪器细菌生化鉴定试纸条API20E(法国梅里埃公司),沙门菌血清诊断试剂盒(丹麦国立血清研究所),氨苄西林、阿莫西林/克拉维酸钾、头孢曲松、头孢他啶、阿米卡星、链霉素、四环素、萘啶酸、环丙沙星、左氧氟沙星、复方磺胺甲和氯霉素等抗菌药物标准品或药敏纸片(北京天坛药物生物技术开发公司),厄他培南药敏纸片(上海赛默飞世尔科技有限公司),PCR仪(Mastercycler personal,德国eppendorf公司)。
1.3 方法
1.3.1 菌株的分离、培养及生化鉴定按照《食品卫生检验方法微生物学部分》GB/4789-2010中肠道致病菌检验方法对患者粪便标本进行分离培养和菌株生化鉴定。
1.3.2 菌株的PCR鉴定煮沸法提取细菌DNA,以沙门菌属特异性基因invA为靶基因进行PCR扩增。引物序列和PCR反应条件参照文献[6]。引物由生工生物工程(上海)股份有限公司合成(下同)。PCR阴性质控菌株大肠埃希菌ATCC25922和阳性质控菌株肠炎沙门菌1311均为本研究所保存。
1.3.3 菌株的血清学鉴定按照沙门菌血清诊断试剂盒说明书步骤操作,根据诊断血清与菌株O抗原、H抗原和Vi抗原的凝集反应结果比对Kauffmann-White抗原表确定沙门菌属的血清型[7]。S.Braenderup的抗原式为6,7,14:e,h:e,n,z15。
1.3.4 抗菌药物敏感性试验按照美国临床实验室标准化委员会(CLSI)2014年提供的方法[8],采用K-B纸片法和微量肉汤稀释法检测菌株对13种抗菌药物的敏感性。结果判读参照CLSI 2014年抗微生物药物敏感性试验执行标准,以大肠杆菌ATCC25922为质控菌株。
1.3.5 菌株毒力基因检测PCR扩增检测S.Braenderup SPI 1~5代表性基因sitC、hilA、sseL、sifA、mgtC、siiE、sopB及调节基因phoP。PCR阴性质控菌株大肠埃希菌ATCC25922和阳性质控菌株肠炎沙门菌1311同1.3.2。煮沸法提取菌株DNA模板,引物和PCR反应条件参照文献[9],引物序列及目的片段长度见表1。
2 结果
2.1 S.Braenderup的分离率2012—2014年自我市两所教学医院肠道门诊共分离出8株(5.23%)S.Braenderup,每年均有检出。该8株菌经PCR鉴定,均能扩增出符合预期大小(283 bp)的invA基因片段,见图1。

Tab.1Primer sequences of virulence genes表1 毒力基因引物序列

Fig.1Electrophoresis results of PCR products of invA genes图1 invA基因PCR产物电泳结果
2.2 S.Braenderup药敏结果该8株菌对萘啶酸耐药率100%,对环丙沙星和左氧氟沙星中介耐药率100%,对氨苄西林、阿莫西林/克拉维酸钾、头孢曲松、头孢他啶、厄他培南、阿米卡星、链霉素、四环素、复方磺胺甲、氯霉素等抗菌药物均敏感。
2.3 S.Braenderup毒力基因PCR扩增结果8株菌SPI代表性基因经PCR扩增均能得到符合预期大小的DNA片段,部分菌株PCR电泳结果见图2。
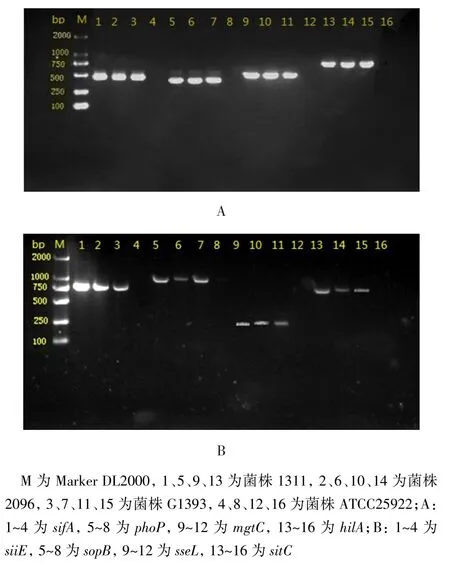
Fig.2Electrophoresis results of PCR products of representative virulence genes of SPI 1-5图2 SPI 1~5代表性毒力基因PCR产物电泳结果
3 讨论
3.1 S.Braenderup的临床分离率S.Braenderup属于NTS血清学分型中的C1群,因1937年在丹麦的布伦登卢普地区第1次被发现而得名,目前国内外从人及动物中均有分离出该沙门菌血清型的报道。S.Braenderup在不同国家和地区的流行程度不同。瑞士1989—1992年间NTS感染病例中仅有0.5%由S.Braenderup所致[10];而马来西亚北部对分离自患者的NTS研究中S.Braenderup所占比例高达11.25%[11]。我国福建省2006—2011年临床患者采集到449株沙门菌,包括381株NTS,其中有2株为S.Braenderup(0.52%)[12]。本研究3年间共分离到S.Braenderup 8株(5.23%),高于福建省,说明S.Braenderup感染在本地区并非少见。
3.3 临床株携带毒力基因的特征目前已经鉴定出23种SPI,研究比较深入的是SPI 1~5,而phoP与phoQ基因一起构成一个二元系统,可调节SPI在沙门菌中的表达。本研究对S.Braenderup SPI 1~5的各自代表性基因和phoP基因进行PCR扩增均得到阳性结果。提示这些临床分离的S.Braenderup均携带SPI 1~5和SPI调节基因,因而具有很强的致病能力。食品来源的NTS携带SPI的情形与本研究中临床分离的NTS有所不同。研究发现,市售鲜鸡蛋中NTS携带SPI 1~5中的一类或多类,只有部分菌株具有SPI-1+SPI-2+SPI-3+SPI-4+SPI-5的组合,与菌株的强致病性显著相关[15]。国外研究显示,分离自患者粪便和血液标本的NTS携带的SPI种类并无明显差别,这提示能引起人类胃肠炎的NTS均有导致血液感染的潜在能力[16]。
3.4 感染暴发的识别与监测S.Braenderup在瑞士、日本等国家均造成过大规模感染暴发[4,10]。在我国引起的数十至上百例的集体食物中毒也时有发生[5]。本研究中的8例患者虽然分散在2012—2014年,但是菌株的药敏谱完全一致,提示病例之间可能具有流行病学关联。由公共卫生部门主导的以菌株基因分型为基础的监测体系,例如国际食源性疾病分子分型网络PulseNet,可以帮助早期识别NTS感染暴发。2014年,美国疾病预防控制中心(CDC)通过PulseNet发现了6例S.Braenderup感染,虽然该6例分散在5个州、时间跨越4个月,但菌株PFGE基因分型完全一致,经过详细的流行病学调查后,最终确认这是一起感染暴发,感染源是一家食品加工厂制作的被S.Braenderup污染的杏仁和花生酱,之后立即采取相应措施及时避免了更多病例的出现[17]。目前,我国北京、上海、浙江等省市已加入了PulseNet China系统,为维护公众健康,天津市很有必要加入该监测系统。
综上所述,自2012—2014年本地区持续分离到对喹诺酮耐药并携带SPI 1~5毒力基因与调节基因的S.Braenderup,其对公众健康构成一定威胁。为有利于指导临床合理使用抗菌药物,早期识别并有效控制感染暴发,天津地区应长期开展NTS的耐药监测,并建立以分子分型为基础的食源性病原体监测体系和溯源体系。
致谢:感谢中国疾病预防控制中心腹泻病研究室和天津医科大学总医院感染性疾病科对本研究提供的大力支持和帮助。
[1]Majowicz SE,Musto J,Scallan E,et al.The global burden of nontyphoidalSalmonellagastroenteritis[J].ClincalInfectious Diseases,2010,50(6):882-889.doi:10.1086/650733/j.issn.1537-6591.
[2]Xue Y,Guo RX,Qian SS,et al.Research progress on Salmonella pathogenicity islands[J].Journal of Microbes and Infections,2015,10(6):381-389.[薛颖,郭荣显,钱珊珊,等.沙门菌毒力岛的研究进展[J].微生物与感染,2015,10(6):381-389].
[3]Ge HY,Wu XM,Wang Y,et al.Outbreak of Salmonella enterica serotypeenteritidisinfectionsandgenotyping[J].ChinJ Nosocomiol,2013,23(20):4865-4867.[戈红雨,吴晓妹,王悦,等.肠炎沙门菌感染暴发的病原学检测及基因分型研究[J].中华医院感染学杂志,2013,23(20):4865-4867].
[4]Mizoguchi Y,Suzuki E,Tsuchida H,et al.Outbreak of Salmonella Braenderup infection originating in boxed lunches in Japan in 2008[J].Acta Med Okayama,2011,65(2):63-69.
[5]Zheng YZ,Zhou YP,Yang CX,et al.An investigations on S. Braenderup food poisoning[J].Lit&Inf Prev Med,1999,5(1):14-17.[郑玉柱,周亚平,杨春秀,等.一起布伦登卢普沙门氏菌食物中毒调查[J].预防医学文献信息,1999,5(1):14-17].doi: 10.16406/j.pmt.issn.1672-9153.1999.01.008.
[6]Huan J,Ge HY,Zhang CL,et al.Establishment of double PCR method for detection of Salmonella and Proteus[J].Journal of Tianjin Medical University,2015,21(1):84-86.[郇娟,戈红雨,张成龙,等.双重PCR检测沙门氏菌和变形杆菌方法的建立[J].天津医科大学学报,2015,21(1):84-86].
[7]Shi W,Xia LL,Liu XX,et al.Antimicrobial resistance and mechanismsofceftriaxoneresistanceinclinicallyisolated nontyphoidal Salmonella[J].Chin J Infect Control,2016,15(4): 217-221.[师伟,夏琳林,刘晓霞,等.临床分离非伤寒沙门菌耐药性及对头孢曲松耐药机制[J].中国感染控制杂志,2016,15(4):217-221].doi:10.3969/j.issn.1671-9638.2016.04.001.
[8]Clinical and Laboratory Standards Institute.Performance standards for antimicrobial susceptibility testing,twenty-three in formational supplement[S].CLSI document Ml00-S24.2014.
[9]Zhang CL.Virulence-associated genes of Non-typhoidal Salmonella isolated from patients with diarrhea[D].Tianjin:Tianjin Medical University,2015.[张成龙.非伤寒沙门氏菌临床株毒力基因初步分析[D].天津:天津医科大学,2015].
[10]Urfer E,Rossier P,Mean F,et al.Outbreak of Salmonella braenderup gastroenteritis due to contaminated meat pies:clinical and molecular epidemiology[J].Clin Microbiol Infect,2000,6(10):536-542.
[11]Thong KL,Lai WL,Dhanoa A,et al.Antimicrobial susceptibility and pulsed:field Gel Electrophoretic analysis of Salmonella in a tertiary hospital in northern Malaysia[J].Infect Public Health,2011,4(2):65-72.doi:10.1016/j.jiph.2011.03.003.
[12]Chen JH,Ou JM,Yang JS,et al.Analysis on the distribution of serotypes and drug resistance with salmonalla strains,fujian province,2006-2011[J].Prev Med Trib,2014,20(2):81-87.[陈建辉,欧剑鸣,杨劲松,等.2006—2011年福建省沙门菌监测菌株血清型分布及耐药性分析[J].预防医学论坛,2014,20(2): 81-87].doi:10.16406/j.pmt.issn.1672-9153.2014.02.014.
[13]Aarestrup FM,Wiuff C,Molbak K,et al.Is it time to change fluoroquinolone breakpoints for Salmonella spp?[J].Antimicrob Agents Chemother,2003,47(2):827-829.
[14]Lin D,Chen K,Wai-Chi Chan E,et al.Increasing prevalence of ciprofloxacin-resistant food-borne Salmonella strains harboring multiple PMQR elements but not target gene mutations[J].Sci Rep,2015,5:14754.doi:10.1038/srep14754.
[15]Wang JY,Dong R,Wang LQ,et al.Isolation,identification and pathogenicity island gene detection of Salmonella in commercial eggs[J].Food Science,2012,33(16):154-158.[王晶钰,董睿,王利勤,等.市售鲜鸡蛋中沙门氏菌的分离鉴定及毒力岛基因检测[J].食品科学,2012,33(16):154-158].
[16]Suez J,Porwollik S,Dagan A,et al.Virulence gene profiling and pathogenicitycharacterizationofnon-typhoidalSalmonella accounted for invasive disease in humans[J].PLoS One,2013,8(3):e58449.doi:10.1371/journal.pone.0058449.
[17]CDC.Multistate Outbreak of Salmonella Braenderup Infections Linked to Nut Butter Manufactured by nSpired Natural Foods[EB/ OL].(2014-10-16)[2016-9-26].Inc.http://www.cdc.gov/ salmonella/braenderup-08-14.
(2016-07-08收稿2016-09-29修回)
(本文编辑李鹏)
Antimicrobial resistance and virulence gene profiling of Salmonella enterica serovars Braenderup
ZHAO Zhan,XIA Linlin,LIU Xiaoxia,YANG Jie,WU Xiaomei,ZHANG Lijuan,JIA Yuchi,WANG Yubao△
Institute of Infectious Diseases,Second Hospital of Tianjin Medical University,Tianjin 300211,China△
ObjectiveTo investigate antimicrobial resistance and virulence gene profiles of clinically isolated nontyphoidal Salmonella enterica serovars Braenderup(S.Braenderup).MethodsClinical date of patients with acute diarrhea from two teaching hospitals in our city were collected from April to October of 2012 to 2014.Salmonella from stool samples was screened by culture,and identified by biochemical,PCR and serotype methods.Isolates of S.Braenderup were examined with antibiotic susceptibilities.PCR amplification was used for representative genes of Salmonella pathogenicity islands (SPI)1-5 and SPI regulator.ResultsAmong 153 non-repetitive NTS isolates in the three years,8 isolates(5.23%)of S.Breanderup were identified.All 8 isolates were positive with invA gene.The resistance rate to nalidixic acid was 100%, and the same with the intermediate resistance rate to ciprofloxacin and levofloxacin.But they were susceptible to other antimicrobial agents.The 8 isolates were positive with the representative genes of SPI 1-5 and regulators(sitC,hilA,sseL, sifA,mgtC,siiE,sopB and phoP).ConclusionClinical isolates of S.Braenderup in Tianjin are resistant to fluoroquinolones and harbored genes of SPI 1-5 and regulator,and which can threaten public health.Continuous surveillance and research should be carried out in our city.
diarrhea;drug resistance,microbial;quinolones;fluoroquinolones;virulence;Salmonella Breanderup
R378.22
A
10.11958/20160630
天津市卫生局科研基金资助项目(2013KZ112)
天津医科大学第二医院感染性疾病研究所(邮编300211)
赵展(1992),女,硕士在读,主要从事细菌耐药及致病机制研究
△通讯作者E-mail:wyb2046@163.com

