下调HER2降低自噬活性抑制人肺癌细胞增殖转移作用的体外研究
冯媛媛,伍宏山,张志宏,龙新华,周扬,童未来,刘志礼,刘家明△
下调HER2降低自噬活性抑制人肺癌细胞增殖转移作用的体外研究
冯媛媛1,伍宏山2,张志宏2,龙新华2,周扬2,童未来2,刘志礼2,刘家明2△
目的探讨下调HER2表达是否抑制细胞自噬活性,从而影响人肺癌细胞的增殖、迁徙和侵袭。方法采用浓度5 μmol/L自噬抑制剂3-MA、10 μmol/L HER2抑制剂Neratinib分别作用人肺癌细胞A549。Western blot检测肺癌细胞A549中HER2、Beclin-1及LC3B(Ⅱ/Ⅰ)蛋白表达水平;Wound healing和Transwell invasion实验检测细胞迁徙、侵袭能力;四甲基偶氮唑盐(MTT)检测细胞的增殖能力。结果Neratinib和自噬抑制剂(3-MA)作用24 h后,细胞HER2、Beclin-1及LC3B(Ⅱ/Ⅰ)蛋白表达水平显著低于阴性对照组;Neratinib、自噬抑制剂(3-MA)处理组的细胞增殖、迁徙和侵袭能力显著低于阴性对照细胞。结论下调HER2能降低人肺癌细胞A549的自噬活性并抑制其增殖、迁徙和侵袭。
肺肿瘤;自噬;细胞增殖;受体,erbB-2;细胞侵袭;细胞迁徙
细胞自噬(autophagy or autophagocytosis)是细胞在自噬相关基因(autophagy related gene,Atg)的调控下利用溶酶体降解自身受损的细胞器和大分子物质的过程。有研究表明,包括肺癌在内多种肿瘤的形成与自噬过程密切相关[1-4]。同时也有研究显示,HER2信号通路激活能改变细胞的自噬水平[5]。但是,HER2是否通过改变细胞自噬活性影响肺癌细胞的迁徙和侵袭及其分子机制尚不明确。本研究以人肺癌细胞株A549细胞为研究对象,用Neratinib处理人肺癌细胞株A549细胞,观察A549细胞的自噬活性,为进一步探讨HER2在肺癌细胞中的作用提供新的研究方向。
1 材料与方法
1.1 材料(1)细胞株:人源肺癌细胞系A549细胞株购于上海中科院细胞库。(2)试剂:DMEM(高)培养基(Solarbio公司)、胎牛血清(Trans Gen公司)、Transwell侵袭小室(8.0 μm孔径PC膜,美国Corning公司)、基质胶(美国BD公司)、Western blot上样蛋白Marker和PVDF膜(美国Formentas公司)、一抗(美国Santa Cruz公司)、二抗(北京中杉金桥公司)、Neratinib、3-MA(美国abmole)。
1.2 方法
1.2.1 细胞培养将A549细胞置于DMEM高糖培养基中(内含10%胎牛血清、青霉素100 U/mL及链霉素100 mg/L),在37℃、5%CO2饱和湿度孵育箱中贴壁培养。
1.2.2Western blot检测HER2、Beclin-1及LC3B(Ⅱ/Ⅰ)蛋白表达水平10 μmol/L HER2抑制剂Neratinib、5 μmol/L自噬抑制剂(3-MA)作用人肺癌细胞A549 24 h(分别为Neratinib处理组、3-MA处理组),PBS替代药物作为阴性对照组,收集细胞,RIPA裂解,提取总蛋白,BCA法蛋白定量,10%SDS-PAGE凝胶电泳分离蛋白,转膜,5%脱脂奶粉封闭1 h,一抗(鼠抗人HER2,1∶2 000;兔抗人Beclin-1,1∶1 000;兔抗人LC3B,1∶3 000;鼠抗人β-actin,1∶2 500)4℃孵育过夜,TBST洗膜3次,二抗(山羊抗鼠和山羊抗兔,1∶5 000)室温孵育1 h,TBST洗膜3次,Pro-light HRP化学发光检测试剂(TIANGEN,PA112)化学发光、压片、拍照,用Image J软件对条带灰度值进行分析。实验重复3次。
1.2.3 Wound healing检测细胞迁徙能力取对数生长期细胞进行实验,常规消化细胞,调整细胞浓度为5×105个/mL,接种于6孔细胞培养板,待细胞形成单层贴壁细胞,用10 μmol/L Neratinib、5 μmol/L 3-MA分别作用细胞(PBS替代药物为阴性对照组)24 h后,用10 μL枪头在单层细胞表面划一直线。用PBS漂洗2次去除划落的细胞;加入无血清DMEM高糖培养液继续培养24 h,倒置显微镜下观察划痕中细胞迁移情况并拍照,Image J软件测量迁徙距离,计算各组细胞迁徙率。实验重复3次。
1.2.4 Transwell invasion检测细胞侵袭能力应用Transwell小室进行细胞侵袭实验。将用10 μmol/L Neratinib及5 μmol/L 3-MA作用24 h后的细胞用无血清DMEM高糖培养基重悬,调整细胞浓度为5×105个/mL,取150 μL细胞悬液接种小室,然后将小室放入加有600 μL/孔含10%胎牛血清的DMEM高糖培养基的24孔板中,常规培养24 h。取出小室,吸弃上室液体,用PBS漂洗2次,95%乙醇固定10 min,用棉签擦净小室膜上侧未迁移的细胞,4 g/L结晶紫染色20 min,PBS漂洗2次。倒置显微镜下随机读取10个视野,观察细胞穿膜情况并拍照,Image J分析软件计数。实验重复3次。
1.2.5 四甲基偶氮唑盐(MTT)检测细胞增殖能力根据预实验的结果,选取效果最好的10 μmol/L Neratinib、5 μmol/L 3-MA作为最终实验浓度。取对数生长期细胞进行实验,常规消化贴壁细胞,调整细胞浓度为1×104/mL接种于无菌96孔培养板,每孔100 μL,常规培养12 h。待细胞贴壁良好,分别加入浓度10 μmol/L Neratinib、5 μmol/L 3-MA作用24、48、72、96 h后,每孔加入5 g/L的MTT 20 μL。孵育4 h后,吸弃各孔培养液,每孔加入二甲基亚砜(DMSO)150 μL。微振荡10 min,用酶标仪检测波长490 nm处光密度(OD)值。实验重复3次。
1.3 统计学方法用SPSS 19.0软件进行统计学分析,数据以表示,各组细胞迁徙、侵袭及增殖能力差异情况比较采用方差分析和LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 Neratinib及3-MA对A549细胞自噬相关蛋白Beclin-1及LC3B(Ⅱ/Ⅰ)表达的影响与阴性对照组相比,3-MA处理组的Beclin-1蛋白及LC3BⅡ/Ⅰ表达水平明显降低;Neratinib处理组的HER2、Beclin-1蛋白及LC3BⅡ/Ⅰ表达水平明显降低(P<0.05),见图1。提示在人源肺癌A549细胞中,改变HER2的表达能调控细胞自噬的活性。

Fig.1The effect of Neratinib and 3-MA on Beclin-1 and LC3B(Ⅱ/Ⅰ)protein expressions in A549 cells图1 Neratinib及3-MA对A549细胞蛋白Beclin-1及LC3B(Ⅱ/Ⅰ)表达水平的影响
2.2 Neratinib及3-MA对A549细胞迁徙能力的影响Neratinib处理组、3-MA处理组24 h迁徙率分别为11.1%±1.4%、10.5%±1.2%,均低于阴性对照组的42.9%±2.4%,差异均有统计学意义(F=27.430,P<0.05),见图2。提示HER2低表达及细胞自噬活性水平能降低抑制肺癌细胞系A549细胞迁徙。
2.3 Neratinib及3-MA对A549细胞侵袭能力的影响Neratinib处理组、3-MA处理组穿膜细胞数分别为40±8、59±10,均显著低于阴性对照组的113± 13,差异均有统计学意义(F=18.246,P<0.05),见图3。提示HER2低表达及细胞自噬活性水平降低能抑制肺癌细胞系A549细胞侵袭。
2.4 Neratinib及3-MA对A549细胞增殖能力的影响与阴性对照组比较,在作用48、72、96 h后Neratinib及3-MA能有效抑制A549细胞的增殖(F分别为15.213、4.965、5.366,均P<0.05),见图4。
3 讨论
细胞自噬作为真核生物界一种普遍存在的生命现象,对生物的发育、生长等多种过程具有重要的生理意义[6]。细胞自噬(又称为Ⅱ型细胞死亡),是细胞在自噬相关基因的调控下,膜包裹部分胞质和细胞内需降解的细胞器、蛋白质等形成自噬体[7],最后与溶酶体融合形成自噬溶酶体,降解其所包裹的内容物,以实现细胞稳态和细胞器的更新[8-10]。无论是肿瘤细胞还是正常细胞,保持一种基础、低水平的自噬活性是至关重要的。生物体内破损或衰老的细胞器、长寿命蛋白质、错误合成或折叠的蛋白质等都需要及时清除,而这主要靠自噬来完成,因此,自噬具有维持细胞自稳的功能。同时,自噬的产物,如氨基酸、脂肪酸等小分子物质又可为细胞提供一定的能量和合成底物。而肿瘤细胞本身具有高代谢的特点,对营养和能量的需求比正常细胞更高,所以细胞自噬水平对肿瘤细胞的形成具有重要意义。
Beclin-1基因是酵母Atg6基因的同源体,作为一种抑癌基因,在肿瘤的形成中起着重要作用[11]。有研究表明上调Beclin-1可以促进自噬的发生[12]。进一步研究发现,Beclin-1主要通过与PI3K结合后与之形成复合体,调节其他自噬相关基因,进而调节细胞自噬水平,因此,Beclin-1与细胞的自噬活性具有密切联系[13-14]。

Fig.2The cell migration ability detected by Wound healing assay in three groups of A549 cells图2 Wound healing实验检测3组A549细胞的迁徙能力

Fig.3The cell invasion ability detected by Tanswell invasion assay in three groups of A549 cells图3 Transwell invasion实验检测3组A549细胞的侵袭能力
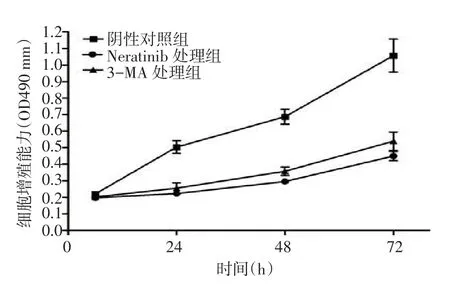
Fig.4The cell proliferation detected by MTT assay in three groups of A549 cells图4 MTT实验检测3组A549细胞的增殖能力
LC3是一种可以用来示踪自噬形成的蛋白,对细胞自噬体的形成至关重要,其存在两种形式:LC3-Ⅰ(胞浆型)与LC3-Ⅱ(膜型)。当细胞内自噬水平被激活时,胞浆型LC3经过泛素样的加工修饰后形成膜型LC3[15],而LC3有3种同源基因,即LC3A、LC3B及LC3C,其中LC3B已被证实位于自噬溶酶体上,因此LC3B-Ⅱ/Ⅰ比值的大小可作为检验自噬发生的指标[16-17]。
人类表皮生长因子受体2(HER2/neu)是由位于染色体17q21上的原癌基因ErbB2/HER2/neu编码的一种跨膜受体酪氨酸激酶,激活胞内信号通路从而参与细胞内信号的传导[18-19]。且HER2在多种肿瘤组织中呈现高表达,与肿瘤的不良预后密切相关[20-21]。也有研究表明,HER2激活RAS-MAPK和PI3K分别促进和抑制细胞的自噬活性[5]。但是HER2是否通过改变自噬活性从而影响肺癌细胞的恶性表型尚不明确。笔者推测HER2可能通过调节肺癌细胞的自噬水平,从而改变其恶性表型。
为了证实此推测,本组实验利用自噬抑制剂3-MA处理人肺癌细胞系A549,PBS替代作为阴性对照,结果显示经3-MA处理后的肺癌A549细胞的增殖迁徙和侵袭能力明显被抑制,且自噬相关蛋白Beclin-1、LC3B(Ⅱ/Ⅰ)表达降低,这提示下调自噬水平能抑制肺癌细胞A549的增殖、迁徙和侵袭能力。同时利用HER2抑制剂Neratinib处理人肺癌细胞系A549,PBS替代作为阴性对照,经Western blot检测显示在处理的细胞中HER2、Beclin-1及LC3B(Ⅱ/Ⅰ)蛋白表达水平显著低于阴性对照组,这提示改变HER2在肺癌A549细胞中的表达水平能显著改变肺癌细胞的自噬水平。采用MTT、Wound healing和Transwell invasion实验检测细胞增殖、迁徙和侵袭情况,结果显示Neratinib处理的细胞增殖、迁徙和侵袭能力显著低于阴性对照组细胞,这些结果表明HER2在肺癌细胞迁徙侵袭中起着重要作用。
综上,下调HER2可使肺癌细胞的自噬活性下降,进而抑制肺癌细胞的增殖、迁徙和侵袭,为肺癌的转移防治提供了新思路。但是,本研究仅采用一种细胞系进行体外研究,而细胞的自噬水平还需更多的相关实验检测。此外,体内微环境对肿瘤细胞的增殖侵袭转移非常重要,因此还需进一步的体内、外实验来证实HER2调控细胞自噬的水平对肺癌细胞增殖、迁徙和侵袭的影响。
[1]Fu T,Wang L,Jin XN,et al.Hyperoside induces both autophagy and apoptosis in non-small cell lung cancer cells in vitro[J].Acta Pharmacol Sin,2016,37(4):505-518.doi:10.1038/aps.2015.148.
[2]Zhao F,Huang W,Zhang Z,et al.Triptolide induces protective autophagy through activation of the CaMKKβ-AMPK signaling pathway in prostate cancer cells[J].Oncotarget,2016,7(5):5366-5382.
[3]Kim KM,Yu TK,Chu HH,et al.Expression of ER stress and autophagy-related molecules in human non-small cell lung cancer and premalignant lesions[J].Int J Cancer,2012,131(4):E362-E370.doi:10.1002/ijc.26463.
[4]Bhutia SK,Kegelman TP,Das SK,et al.Astrocyte elevated gene-1 induces protective autophagy[J].Proc Natl Acad Sci USA,2010,107(51):22243-22248.doi:10.1073/pnas.1009479107.
[5]Lozy FJ,Reddy A,Miles G,et al.Abstract 3777:Autophagy and HER2 interaction in mammary tumorigenesis[J].Cancer Res,2011,71(8 Supplement):3777.doi:10.1158/1538-7445.AM2011-3777.
[6]Cao Y,Klionsky DJ.Physiological functions of Atg6/Beclin 1:a unique autophagy-related protein[J].Cell Res,2007,17(10):839-849.
[7]Hara T,Nakamura K,Matsui M,et al.Suppression of basal autophagy in neural cells causes neurodegenerative disease in mice[J].Nature,2006,441(7095):885-889.
[8]Virgin HW,Levine B.Autophagy genes in immunity[J].Nat Immunol,2009,10(5):461-470.doi:10.1038/ni.1726.
[9]Kuma A,Hatano M,Matsui M,et al.The role of autophagy during the early neonatal starvation period[J].Nature,2004,432(7020):1032-1036.
[10]Maiuri MC,Zalckvar E,Kimchi A,et al.Self-eating and selfkilling:crosstalk between autophagy and apoptosis[J].Nat Rev Mol Cell Biol,2007,8(9):741-752.
[11]Jin S,White E.Role of autophagy in cancer:management of metabolic stress[J].Autophagy,2007,3(1):28-31.
[12]Liang XH,Jackson S,Seaman M,et al.Induction of autophagy and inhibition of tumorigenesis by beclin 1[J].Nature,1999,402(6762):672-676.
[13]Klionsky DJ,Abdalla FC,Abeliovich H,et al.Guidelines for the use and interpretation of assays for monitoring autophagy[J]. Autophagy,2012,8(4):445-544.
[14]Kihara A,Kabeya Y,Ohsumi Y,et al.Beclin-phosphatidylinositol 3-kinase complex functions at the trans-Golgi network[J].EMBO Reports,2001,2(4):330-335.
[15]Kabeya Y,Mizushima N,Uero T,et al.LC3,a mammalian homologueofyeastApg8p,islocalizedinautophagosome membranes after processing[J].EMBO J,2000,19(21):5720-5728.
[16]Wu J,Dang Y,Su W,et al.Molecular cloning and characterization of rat LC3A,and LC3B-two novel markers of autophagosome[J]. Biochem Biophys Res Commun,2006,339(1):437-442.
[17]Tanida I,Ueno T,Korninami E.Human light chain 3/MAP1LC3B is cleaved at its carboxyl-terminal Met121 to expose Gly120 for lipidation and targeting to autophagosomal membranes[J].J Biol Chem,2004,279(46):47704-47710.
[18]Coussens L,Yang-Feng TL,Liao YC,et al.Tyrosine kinase receptor with extensive homology to EGF receptor shares chromosomal location with neu oncogene[J].Science,1985,230(4730):1132-1139.
[19]Prenzel N,Fischer OM,Streit S,et al.The epidermal growth factor receptorfamily as a central element for cellular signal transduction and diversification[J].Endocr Relat Cancer,2001,8(1):11-31.
[20]Artac M,Koral L,Toy H,et al.Complete response and long-term remission to anti-HER2 combined therapy in a patient with breast cancer presented with bone marrow metastases[J].J Oncol Pharm Pract,2014,20(2):141-145.
[21]Nuciforo P,Thyparambil S,Aura C,et al.High HER2 protein levels correlate with increased survival in breast cancer patients treated with anti-HER2 therapy[J].Mol Oncol,2016,10(1):138-147. doi:10.1016/j.molonc.2015.09.002.
(2016-07-10收稿2016-08-30修回)
(本文编辑闫娟)
The inhibition of autophagy suppresses proliferation and metastasis of lung cancer cells via down-regulation of HER2
FENG Yuanyuan1,WU Hongshan2,ZHANG Zhihong2,LONG Xinhua2,ZHOU Yang2, TONG Weilai2,LIU Zhili2,LIU Jiaming2△
1 Department of Basic Medicine,Nanchang University,Nanchang 330006,China; 2 Department of Orthopdeics,the First Affiliated Hospital of Nanchang University△
ObjectiveTo investigate whether the down-regulation of HER2 can inhibit the autophagy of cells and influence the proliferation and metastasis of lung cancer cells.MethodsThe 5 μmol/L of autophagy inhibitor(3-MA)and 10 μmol/L of HER2 inhibitor(Neratinib)were used to treat human lung cancer A549 cells.Western blot assay was used to detect the protein expressions of HER2,Beclin-1 and LC3B(Ⅱ/Ⅰ)in A549 cells.Wound healing and Transwell invasion methods were used to detect the invasion and migration ability of A549 cells.MTT assay was performed to evaluate the cell proliferation.ResultsWestern blot analysis showed that the protein expressions of HER2,Beclin-1 and LC3B(Ⅱ/Ⅰ) were significantly declined in A549 cells treated with Neratinib and 3-MA for 24 h compared to cells in control group.The cell proliferation,migration and invasion ability were significantly decreased in A549 cells treated with Neratinib and 3-MA thanthoseofcontrolcells.ConclusionTheinhibitionofHER2proteincansuppresstheautophagyandproliferationofA549cells.
lung neoplasms;autophagy;cell proliferation;receptor,erbB-2;cell invasion;cell migration
R734.2
A
10.11958/20160610
江西省自然科学基金项目(2014ZBAB205012,20151BAB215026)
1南昌大学基础医学部(邮编330006);2南昌大学第一附属医院骨科
冯媛媛(1994),女,硕士研究生,主要从事肿瘤的分子机制方面研究
△通讯作者E-mail:liujiamingdr@hotmail.com

