LMO2蛋白在前列腺基质细胞中介导的IL-11、FGF-9旁分泌促进前列腺癌细胞增殖与侵袭
姜辰一,俞俊杰,阮 渊,赵 炜,韩邦旻,夏术阶,赵福军
1.上海交通大学附属第一人民医院泌尿外科,上海 200080;2.扬州大学医学院附属苏北人民医院泌尿外科,江苏 扬州225001;
LMO2蛋白在前列腺基质细胞中介导的IL-11、FGF-9旁分泌促进前列腺癌细胞增殖与侵袭
姜辰一1,俞俊杰2,阮渊1,赵炜1,韩邦旻1,夏术阶1,赵福军1
1.上海交通大学附属第一人民医院泌尿外科,上海 200080;2.扬州大学医学院附属苏北人民医院泌尿外科,江苏 扬州225001;
背景与目的:前列腺癌多发生于前列腺外周带,前列腺增生多发于前列腺移行带。前列腺疾病的带性差异机制可能与前列腺组织微环境有关。该研究的前期研究提示,不同区带来源的前列腺基质细胞对上皮细胞的作用存在明显差异,基因芯片筛查发现LMO2蛋白在前列腺外周带基质细胞高表达与前列腺癌发生、发展密切相关。该研究旨在分析前列腺基质细胞LMO2基因的表达对前列腺癌细胞系增殖、侵袭能力的影响及其机制。方法:分别应用慢病毒过表达载体和短发卡RNA(shRNA)建立过表达和低表达LMO2的前列基质细胞,利用实时荧光定量聚合酶链反应(real-time fluorescent quantitative polymerase chain reaction,RTFQ-PCR)、蛋白[质]印迹法(Western blot)分别检测LMO2 mRNA和蛋白的表达;将不同处理的前列腺基质细胞分别同PC-3细胞共培养,利用CCK-8检测PC-3的增殖能力,利用基质胶侵袭实验检测PC-3的侵袭能力;利用生物素标记的人蛋白抗体芯片检测过表达LMO2的前列腺基质细胞条件培养基中蛋白因子表达变化。结果:成功建立过表达及低表达LMO2的前列腺基质细胞;CCK-8实验及基质胶实验提示,与过表达LMO2的前列腺WPMY-1基质细胞共培养后,PC-3细胞的增殖和侵袭能力增强;与低表达LMO2的CAFs细胞共培养后,PC-3细胞的增殖和侵袭能力降低;蛋白芯片检测发现过表达LMO2后,前列腺外周带基质细胞分泌白介素-11(interleukin-11,IL-11)和成纤维细胞生长因子-9(fibroblast grouth factor-9,FGF-9)增多。结论:LMO2基因在前列腺外周基质细胞中的高表达可能与前列腺癌的发生、发展有关;过表达LMO2的前列腺基质细胞通过旁分泌IL-11、FGF-9等细胞因子促进前列腺癌细胞增殖与侵袭。
前列腺肿瘤;基质细胞;LMO2基因;旁分泌
在前列腺中,由成纤维细胞、炎性细胞和血管内皮细胞等多种细胞与腺上皮细胞共同组成了前列腺组织微环境,同时微环境中各种细胞之间通过复杂的信号调控网络进行信息交流。前列腺基质细胞主要由成纤维细胞、肌成纤维细胞和平滑肌细胞组成,在正常前列腺的生长、发育过程中,基质细胞和上皮细胞之间存在复杂但平衡的信息交流;然而,当前列腺癌(prostate cancer,PCa)发生后,既定的信息交流平衡被打破,癌细胞分泌多种细胞因子至细胞外基质(extracellular matrix,ECM),创造有利于自身生长的肿瘤微环境,正常的基质细胞受到微环境变化的刺激后会发生基质反应,部分细胞转化为癌相关成纤维细胞(cancer associated fibroblast,CAFs),CAFs对癌细胞生长起到多方面的作用,主要包括促进癌细胞生长和转移。
Olumi等[1]研究发现,CAFs与正常前列腺来源基质细胞在致肿瘤方面存在差异,CAFs能够使正常前列腺上皮细胞发生恶性转化,而正常组织来源的基质细胞则不能。我们的前期研究也提示,正常前列腺外周带来源的基质细胞(peripheral zone derived stromal cell,PZSCs)和CAFs细胞之间除生物学功能存在差异[2]以外,基因表达谱也不尽相同,通过基因芯片筛查,我们发现LMO2基因表达在CAFs中高于PZSCs,这与Zhao等[3]的研究结果一致,于是我们进一步研究了前列腺基质细胞中LMO2在前列腺基质-上皮对话中的作用。
1 材料和方法
1.1细胞培养
CAFs原代培养自上海交通大学附属第一人民医院前列腺癌根治术获得的组织标本(前列腺癌经病理证实),培养时将组织切碎至约1 mm3大小,经胶原酶消化后采用差异梯度离心法分离上皮细胞与基质细胞,基质细胞接种于含10%胎牛血清(美国Gibco公司)的RPMI-1640培养基(美国Hyclone公司)中,在37 ℃、CO2体积分数为5%的条件下培养,每2天更换新鲜培养基,原代培养基质细胞培养代数不超过5代。本实验已通过上海交通大学附属第一人民医院医学伦理委员会批准。WPMY-1前列腺基质细胞系购自中国科学院上海生命科学研究院生物化学与细胞生物学研究所细胞库;PC-3前列腺癌细胞系购自美国典型培养物保藏中心(American Type Culture Collection,ATCC)。WPMY-1、PC-3细胞使用含10%胎牛血清的RPMI-1640培养基,在37 ℃、CO2体积分数为5%的条件下培养,传代时以0.25%胰蛋白酶-EDTA(美国Hyclone公司)消化。
1.2短发卡RNA(shRNA)质粒构建及转染
设计3条靶向抑制LMO2表达的shRNA以及阴性对照sh-NC(表1),进行BLAST分析,确保干扰位点的特异性。设计带有shRNA正义链、反义链、酶切位点及环形序列的DNA链,插入酶切后的pGPHI/GFP/Neo质粒,导入感受态大肠杆菌,筛选后挑取测序正确的单克隆菌群进一步扩增及质粒抽提。利用LipofectamineTM2000(美国Invitrogen公司),将表达shRNA的质粒转染入CAFs细胞,培养6 h后换液。

表1 shRNA序列Tab. 1 shRNA sequences
慢病毒过表达载体构建、包装及转染调取LMO2的cDNA序列,化学合成带有酶切位点的LMO2全长cDNA,插入pLenti6.3/MCS/IRES2/ EGFP慢病毒质粒,测序正确后扩增并抽提质粒,对Lenti6.3-LMO2质粒及Lenti6.3空载体质粒进行慢病毒包装。将细胞分为实验组WPMY-1-LMO2(过表达LMO2的WPMY-1细胞)、阴性对照组WPMY-1-NC(空载体慢病毒转染WPMY-1细胞)和空白对照组亲本WPMY-1细胞。按照MOI=100稀释慢病毒原液,分别加入各组细胞进行慢病毒转染,利用含有杀稻瘟素的培养基进行筛选。
1.3实时荧光定量聚合酶链反应(realtime fluorescent quantitative polymerase chain reaction,RTFQ-PCR)
TRIzol(美国Invitrogen公司)法提取细胞总RNA,逆转录合成cDNA。以GAPDH为内参,通过SYBR Green Ⅰ荧光法检测各组LMO2 mRNA表达水平。每组分别设3个复孔,采ΔΔCt法分析数据,以2-ΔΔCt计算相对表达倍数。LMO2上游引物序列:5’-CTGAAGGCCATCGACCAGTA-3’,下游引物序列:5’-TTGTCACAGGATG CGCAGAG-3’; GAPDH上游引物序列:5’-GAAGGTCGGAGTCAACGGATT-3’,下游引物序列:5’-CGCTCCTGGAAGATGGTGAT-3’。
1.4蛋白[质]印迹法(Western blot)检测
RIPA裂解液购自上海碧云天生物技术有限公司。用RIPA裂解液裂解细胞并提取细胞总蛋白,利用BCA法测定浓度,按每条泳道50 μg计算后上样,于SDS-PAGE凝胶电泳后,转移蛋白至PVDF膜,5%脱脂奶粉室温封闭2 h,LMO2一抗(购自美国Abcam公司)和GAPDH内参一抗(购自美国Santa Cruz公司)按1∶1 000稀释,4 ℃温育过夜,辣根过氧化物酶标记的二抗(购自美国Cell Signaling Technology公司)按1∶2 000稀释,室温温育1.5 h,ECL化学发光法显影。
1.5CCK-8细胞增殖实验
各组CAFs或WPMY-1细胞以每孔5×103个细胞接种于Transwell小室(6.5 mm直径,0.4 µm孔径,购自美国Corning公司)中,每组设3个复孔,每孔加入完全培养基200 μL;PC-3细胞以5×103个细胞/孔接种于24孔板上,每孔加入完全培养基500 μL;将Transwell小室嵌套于24孔板上建立共培养体系。检测增殖时,丢弃上室,下室更换无酚红RPMI-1640培养基500 μL,每孔加入50 μL CCK-8溶液(购自日本同仁化学株式会社)温育3 h,吸取反应液至96孔板,测定450 nm吸光度,连续5天分别检测PC-3细胞的增殖情况。
1.6基质胶细胞侵袭实验
实验前12 h使用Matrigel基质胶(美国BD公司)包被Transwell小室(6.5 mm直径,8 µm孔径)。以含1%胎牛血清的培养基重悬PC-3细胞,制成细胞悬液,取200 μL共1×105个细胞加入Transwell小室,下室以每孔5×104个细胞分别加入各组CAFs或WPMY-1细胞,共培养24 h。检测时以棉签擦除上室Matrigel基质胶及未侵袭的细胞,采用甲醛固定,结晶紫[生工生物工程(上海)股份有限公司]染色,在显微镜下随机选取5个视野计数,实验独立重复3次。
1.7生物素标记的人蛋白抗体芯片检测
人蛋白抗体芯片购自美国RayBiotech公司。待细胞生长至60 mm培养皿80%时更换无血清培养基,继续培养48 h,每组取300 μL培养基,按照广州瑞博奥生物科技有限公司蛋白提取操作说明提取培养基上清液中蛋白并测定浓度,对样本进行生物素标记后,按照蛋白芯片检测说明进行封闭、杂交、洗涤操作,用芯片扫描仪(GenePix 4000B,美国Axon Instruments公司)扫描芯片,GenePix Pro 6.0软件读取原始数据。
1.8统计学处理
2 结果
2.1RTFQ-PCR检测各组细胞LMO2 mRNA的表达
shRNA的质粒转染CAFs细胞 48 h后,提取RNA。用RTFQ-PCR检测LMO2 mRNA的表达量。3条shLMO2干扰序列相对shNC序列均能抑制CAFs中LMO2的表达,其中CAFshLMO2-1组LMO2 mRNA表达是对照组的0.343倍,CAFshLMO2-2组LMO2表达是对照组的0.392倍,CAFshLMO2-3组LMO2表达是对照组的0.752倍(图1A)。可见shLMO2-1对LMO2 mRNA抑制效果最好,CAFshLMO2-1用于后续实验。
利用过表达LMO2的慢病毒感染WPMY-1细胞建立过表达LMO2蛋白的WPMY-1-LMO2细胞系,空载体慢病毒感染WPMY-1细胞建立阴性对照组WPMY-1-NC细胞系,未经处理的WPMY-1细胞作为空白对照,细胞进一步培养并提取RNA,RTFQ-PCR检测各组LMO2 mRNA表达情况。WPMY-1-NC细胞的LMO2 mRNA表达量是空白对照组细胞的1.08倍,WPMY-1-LMO2细胞LMO2 mRNA表达量是空白对照组细胞的1209.37倍(图1B)。慢病毒浸染前列腺基质细胞WPMY-1细胞后,目的基因LMO2 mRNA的表达明显上调。
2.2Western blot检测各组细胞LMO2蛋白的表达
检测不同shRNA转染CAF细胞48h后各组细胞LMO2蛋白的表达水平,shLMO2-1和shLMO2-2均能有效干扰LMO2蛋白的表达(图1C)。检测慢病毒感染各组WPMY-1细胞后LMO2蛋白的表达水平,WPMY-1-LMO2细胞的LMO2蛋白表达量明显高于WPMY-1-NC阴性对照组和WPMY-1空白对照组(图1D)。
2.3CCK-8实验检测各组基质细胞对PC-3细胞增殖能力的影响
PC-3单独培养以及同CAFshLMO2-1、CAFshNC分别共培养5天。第1、2和3天,各组间细胞增殖差异无统计学意义;在第4、5天时PC-3/ CAFshLMO2-1共培养组与PC-3/CAFshNC共培养组相比,PC-3细胞增殖能力降低,差异有统计学意义(P<0.05,图2A)。可见,抑制CAF细胞LMO2表达后,PC-3细胞增殖能力降低。
PC-3单独培养及同WPMY-1-LMO2、WPMY-1-NC分别共培养5天。第1、2、5天,组间细胞增殖差异无统计学意义(P>0.05);在第3、4和5天时PC-3/WPMY-1-LMO2共培养组的PC-3细胞增殖速度快于PC-3/WPMY-1-NC共培养组及PC3单独培养组(P<0.05,图2B)。可见,过表达WPMY-1细胞LMO2表达可促进PC-3细胞增殖。
2.4基质胶侵袭实验检测各组基质细胞对PC-3细胞侵袭能力的影响
PC-3/CAFshLMO2-1共培养组PC-3细胞侵袭数为(33±5)个;PC-3/CAFshNC共培养组PC-3细胞侵袭数为(22±6)个;实验组与对照组相比,差异有统计学意义(P<0.05,图2C)。PC-3/WPMY-1-LMO2共培养组PC-3细胞侵袭数为(38±5)个;PC-3/WPMY-1-NC共培养组PC-3细胞侵袭数为(23±4)个;实验组与对照组相比,差异有统计学意义(P<0.05,图2D)。
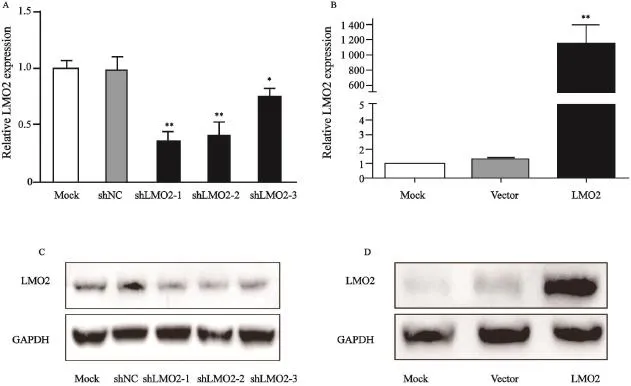
图1 低表达和过表达LMO2的前列腺基质细胞系的建立Fig. 1 Construction of LMO2 overexpressed and LMO2 low-expressed prostate stromal cells. A: LMO2 mRNA expression in CAFs after shRNA plasmids transfection; B: LMO2 mRNA expression in WPMY-1 after lentivirus transfection; C: LMO2 protein levels in CAFs after shRNA plasmids transfection; D: LMO2 protein levels in WPMY-1 after lentivirus transfection
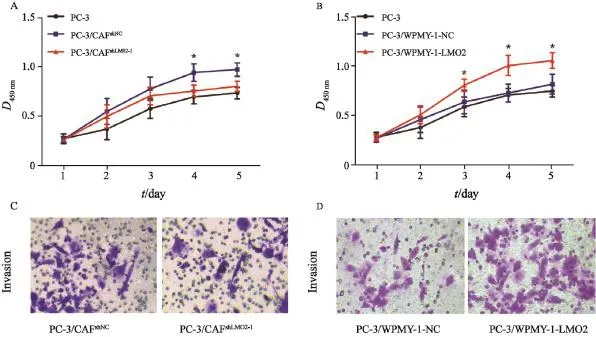
图2 细胞增殖与侵袭实验Fig. 2 Cells proliferation and invasion assay A: PC-3 proliferation reduced after co-culture with CAFshLMO2-1; B: PC-3 proliferation increased after co-culture with WPMY-1-LMO2 cells; C: PC-3 invasive down-regulated after knockdown of LMO2 in co-culture system; D: WPMY-1-LMO2 cells promoted PC-3 invasive after coculturing
2.5蛋白芯片检测WPMY-1-LMO2分泌细胞因子含量的变化
分别提取WPMY-1-LMO2、WPMY-1-NC细胞培养上清液并进行蛋白芯片检测,共检测出507种蛋白信号,去除背景信号,根据各组内参均一化数据,计算组间蛋白表达量比值。在WPMY-1-LMO2细胞培养基上清液中,28种细胞因子与对照组上调大于2倍,20种细胞因子下调大于2倍,其中两个重要的细胞因子IL-11和FGF-9表达量较对照组分别上调21.99倍和20.49倍,122种蛋白因子可能在WPMY-1-LMO2细胞中特异性表达(图3)。
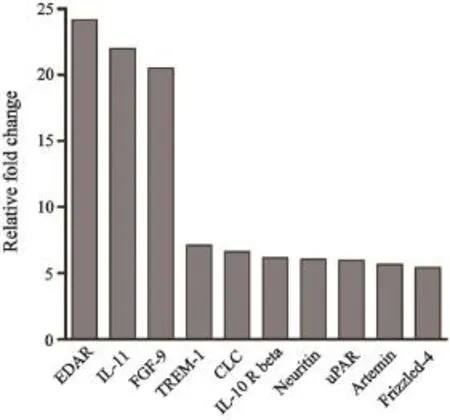
图3 蛋白芯片检测结果Fig. 3 The concentration of IL-11 and FGF-9 up-regulated in supernatant of LMO2 overexpressed WPMY-1-LMO2 cells compared with that in supernatant of WPMY-1-NC cells
3 讨论
前列腺组织微环境由腺上皮细胞及多种基质细胞构成,其中基质细胞主要包括成纤维细胞、肌成纤维细胞及平滑肌细胞。正常前列腺的生长、发育依赖组织微环境的稳态:基质细胞能促使上皮细胞分化,腺腔形成,而上皮细胞则介导间充质细胞向成熟基质细胞分化。而当前列腺癌发生后,基质-上皮间稳定的信息交流被打破,癌细胞释放多种物质刺激基质细胞发生转变,癌细胞旁的基质细胞受到“激活”而转化为CAFs,它们通过分泌生长因子、蛋白酶及激素等活性产物,以旁分泌的方式广泛影响前列腺癌的生长。研究发现,CAFs与正常前列腺来源的基质细胞在致肿瘤方面存在差异,CAFs能够使正常前列腺BPH-1上皮细胞发生恶性转化,而正常组织来源的基质细胞则不能[1,4];此外,不同来源的前列腺基质细胞对前列腺癌细胞的作用也存在明显差异[2]。基质-上皮之间复杂的信号通路是当今前列腺癌研究的重点之一,其中,CAFs异常分泌的TGF、IGF、CXCL等多种细胞因子已被证实与前列腺癌的增殖和转移有关[5],随着人们对前列腺癌相关微环境研究的深入,以基质-上皮间信号交流为靶点的治疗研究开始受到人们的重视[6]。CAFs与正常前列腺PZSCs除了在形态和功能上有明显的区别外,在基因表达谱也存在差异。我们前期利用基因芯片筛选了正常前列腺移行带来源的基质细胞(TZSCs)、PZSCs和CAFs之间的差异基因,发现了LMO2基因在CAFs中表达明显高于PZSCs和TZSCs。Zhao等[3]也通过cDNA芯片筛查了CAFs与正常基质细胞之间的差异基因,其中LMO2的差异表达与我们的结果一致。因此我们推测,前列腺基质细胞中的LMO2差异性表达对前列腺癌的发生、发展可能产生重要影响。
LMO2基因是LIM-only(LMO)家族的一个成员,首先发现于携带t(11;14)(p13;q11)易位的急性T淋巴细胞白血病(T-ALL)[7]。LMO2蛋白属于锌指结构域转录调控因子,能与GATA1、E47、TAL1和Ldb1等转录因子结合形成复合体,识别DNA上相邻的GATA和E-box序列,对下游基因的转录起到调控作用[8]。有研究发现,LMO2在T-ALL染色体易位的发生中起到重要的作用,因此被认为是一种重要的癌基因[9-10]。LMO2在血细胞分化[11]及血液系统肿瘤[12]中的机制研究较为透彻,近几年也有研究发现,LMO2在前列腺癌[13]、胃癌[14]、血管瘤[15]中对肿瘤的发生、发展也可能发挥重要的作用,然而,LMO2在前列腺癌CAFs中通过基质-上皮对话作用于癌细胞的机制尚未见报道。
本研究首先利用shRNA特异性的抑制了前列腺癌相关CAFs中LMO2的表达,建立了低表达LMO2蛋白的CAFshLMO2基质细胞;利用慢病毒过表达载体成功建立了稳定过表达LMO2的前列腺基质细胞株WPMY-1-LMO2;然后分别将各组不同处理的前列腺基质细胞与前列腺癌PC-3细胞建立体外共培养系统;通过CCK-8细胞增殖实验及基质胶侵袭实验发现,LMO2在前列腺基质细胞中过表达能促进PC-3细胞增殖与侵袭,抑制LMO2的表达,基质细胞对PC-3增殖、侵袭能力有所降低。由于Transwell双室共培养体系是一种非直接接触的共培养系统,基质细胞对PC-3细胞增殖侵袭能力的影响必然通过旁分泌细胞因子实现,因此我们利用蛋白芯片分析了过表达LMO2的WPMY-1-LMO2细胞与对照组培养基上清中细胞因子表达量的差异,发现多种细胞因子上调(图3),另有多种细胞因子可能在WPMY-1-LMO2细胞特异表达。其中,白介素-11(interleukin-11,IL-11)和成纤维细胞生长因子-9(fibroblast growth factor-9,FGF-9)两种细胞因子的分泌量在WPMY-1-LMO2细胞培养基上清中显著增加。IL-11是IL-6家族的成员之一,可特异性结合其受体IL-11Rα,继而通过与IL-11Rα结合的gp130蛋白激活细胞内JAK/STAT3、PI3K/mTOR等重要信号通路,促进细胞生长。Putoczki等[16]研究发现,IL-11在胃肠道肿瘤中促进癌细胞生长的作用较IL-6更加重要;Onnis等[17]研究发现,缺氧条件下前列腺癌细胞分泌IL-11增加,通过自分泌作用促进自身生长;Marusyk等[18]建立了过表达不同细胞因子的乳腺癌细胞,通过建立不同的共培养体系发现IL-11在肿瘤微环境中发挥重要作用。FGF-9是FGFs家族成员之一,主要与FGF受体-2/3(FGFR-2/3)结合,进而激活RAS/ RAF/MAPK、PI3K/AKT等信号通路,广泛调节细胞活性。FGF-9作为性别决定的重要信号分子,对胚胎期睾丸的形成和发育也起到重要作用[19];在前列腺癌中,Teishima等[20]研究发现,FGF-9能促进前列腺癌增殖与侵袭,Li等[21]研究发现,前列腺癌细胞旁分泌的FGF-9在骨转移微环境中发挥重要的成骨作用。可见,IL-11和FGF-9两种细胞因子在肿瘤微环境中都起到重要作用,因此,我们认为过表达LMO2的前列腺基质细胞主要通过旁分泌以上两种细胞因子促进前列腺癌细胞的增殖与侵袭;LMO2在不同来源前列腺基质细胞中的差异表达及相关信号通路可能成为以前列腺微环境为靶向治疗前列腺癌的潜在靶点,然而,对于前列腺基质细胞中LMO2的上调机制及其对下游靶基因的调控机制有待进一步研究。
[1] OLUMI A F, GROSSFELD G D, HAYWARD S W, et al. Carcinoma-associated fibroblasts direct tumor progression of initiated human prostatic epithelium[J]. Cancer Res, 1999, 59(19): 5002-11.
[2] 王小海, 韩邦旻, 赵福军, 等. 正常前列腺不同区带及癌组织来源原代基质细胞的生物学特性及其对前列腺癌细胞株C4-2B的作用[J]. 中华实验外科杂志, 2010, 27(12): 1774-1777.
[3] ZHAO H, RAMOS C F, BROOKS J D, et al. Distinctive gene expression of prostatic stromal cells cultured from diseased versus normal tissues[J]. J Cell Physiol, 2007, 210(1): 111-121.
[4] BARCLAY W W, WOODRUFF R D, HALL M C, et al. A system for studying epithelial-stromal interactions reveals distinct inductive abilities of stromal cells from benign prostatic hyperplasia and prostate cancer[J]. Endocrinology, 2005, 146(1): 13-18.
[5] BARRON D A, ROWLEY D R. The reactive stroma microenvironment and prostate cancer progression[J]. Endocr Relat Cancer, 2012, 19(6): 187-204.
[6] KARLOU M, TZELEPI V, EFSTATHIOU E. Therapeutic targeting of the prostate cancer microenvironment[J]. Nat Rev Urol, 2010, 7(9): 494-509.
[7] ROYER-POKORA B, LOOS U, LUDWIG W D. TTG-2, a new gene encoding a cysteine-rich protein with the LIM motif, is overexpressed in acute T-cell leukaemia with the t(11;14) (p13;q11)[J]. Oncogene, 1991, 6(10): 1887-1893.
[8] WADMAN I A, OSADA H, GRUTZ G G, et al. The LIM-only protein LMO2 is a bridging molecule assembling an erythroid, DNA-binding complex which includes the TAL1, E47, GATA-1 and Ldb1/NLI proteins[J]. EMBO J, 1997, 16(11): 3145-3157.
[9] HWANG L Y, BAER R J. The role of chromosome translocations in T cell acute leukemia[J]. Curr Opin Immunol, 1995, 7(5): 659-664.
[10] CURTIS D J, MCCORMACK M P. The molecular basis of Lmo2-induced T-cell acute lymphoblastic leukemia[J]. Clin Cancer Res, 2010, 16(23): 5618-5623.
[11] INOUE A, FUJIWARA T, OKITSU Y, et al. Elucidation of the role of LMO2 in human erythroid cells[J]. Exp Hematol, 2013, 41(12): 1062-1076.
[12] EL OMARI K, HOOSDALLY S J, TULADHAR K, et al. Structure of the leukemia oncogene LMO2: implications for the assembly of a hematopoietic transcription factor complex[J]. Blood, 2011, 117(7): 2146-2156.
[13] MA S, GUAN X Y, BEH P S, et al. The significance of LMO2 expression in the progression of prostate cancer[J]. J Pathol, 2007, 211(3): 278-285.
[14] FENG D, YE X, ZHU Z, et al. Comparative transcriptome analysis between metastatic and non-metastatic gastric cancer reveals potential biomarkers[J]. Mol Med Rep, 2015, 11(1): 386-392.
[15] GRATZINGER D, ZHAO S, WEST R, et al. The transcription factor LMO2 is a robust marker of vascular endothelium and vascular neoplasms and selected other entities[J]. Am J Clin Pathol, 2009, 131(2): 264-278.
[16] PUTOCZKI T L, DOBSON R C, GRIFFIN M D. The structure of human interleukin-11 reveals receptor-binding site features and structural differences from interleukin-6[J]. Acta Crystallogr D Biol Crystallogr, 2014, 70(Pt 9): 2277-2285.
[17] ONNIS B, FER N, RAPISARDA A, et al. Autocrine production of IL-11 mediates tumorigenicity in hypoxic cancer cells[J]. J Clin Invest, 2013, 123(4): 1615-1629.
[18] MARUSYK A, TABASSUM D P, ALTROCK P M, et al. Noncell-autonomous driving of tumour growth supports sub-clonal heterogeneity[J]. Nature, 2014, 514(7520): 54-58.
[19] LIN Y M, TSAI C C, CHUNG C L, et al. Fibroblast growth factor 9 stimulates steroidogenesis in postnatal Leydig cells[J]. Int J Androl, 2010, 33(3): 545-553.
[20] TEISHIMA J, SHOJI K, HAYASHI T, et al. Relationship between the localization of fibroblast growth factor 9 in prostate cancer cells and postoperative recurrence[J]. Prostate Cancer Prostatic Dis, 2012, 15(1): 8-14.
[21] LI Z G, MATHEW P, YANG J, et al. Androgen receptornegative human prostate cancer cells induce osteogenesis in mice through FGF9-mediated mechanisms[J]. J Clin Invest, 2008, 118(8): 2697-2710.
LMO2 in prostate stromal cells promotes prostate cancer cells proliferation and invasion through paracrine of IL-11 and FGF-9
JIANG Chenyi1, YU Junjie2, RUAN Yuan1,3, ZHAO Wei1, HAN Bangmin1,XIA Shujie1, ZHAO Fujun1
(1. Department of Urology, Shanghai General Hospital, Shanghai Jiao Tong University, Shanghai 200080, China; 2. Department of Urology, Subei People’s Hospital, Medical School of Yangzhou University, Yangzhou 225001, Jiangsu Province, China)
Correspondence to: ZHAO Fujun E-mail: drzhaofujun@yahoo.com
Background and purpose: The previous research has found that the prostate stromal cells derived from different prostate zones have distinct effect on prostate epithelial cells. We also revealed that LMO2 protein was highly expressed in PZ stromal cells (PZSCs) and prostate cancer associated fibroblasts (CAFs) compared with TZ stromal cells. This study investigated the effect of LMO2 protein in prostate stromal cells on proliferation and invasion of prostate cancer PC-3 cells and its mechanisms. Methods: Lentivirus overexpression vectors were used to establish LMO2-overexpressed prostate WPMY-1 stromal cell line. shRNA plasmids were used to suppress LMO2 in CAFs. LMO2 mRNA and protein level of both WPMY-1 and CAFs were evaluated by real-time fluorescent quantitativepolymerase chain reaction (RTFQ-PCR) and Western blot. Then, PC-3 cells were co-cultured with different prostate stromal cells and the in vitro proliferation and invasion of PC-3 were measured by CCK-8 and matrigel invasion assays respectively. Results: When co-cultured with LMO2-overexpressed prostate stromal cells, both proliferation and invasion of PC-3 were improved. However, when co-cultured with CAFs which have inhibited expression of LMO2, the proliferation and invasion of PC-3 were reduced. The protein array profiling found that both interleukin-11 (IL-11) and fibroblast growth factor-9 (FGF-9) were enhanced extensively in the supernatant collected from LMO2-overexpressed WPMY-1 cells. Conclusion: The expression of LMO2 in prostate stromal cells could be responsible for development of prostate cancer. Paracrine of cytokines, such as IL-11 and FGF-9, from LMO2-overexpressed stromal cells had effects on the proliferation and invasion of prostate cancer cells.
Prostatic neoplasms; Stromal cells; LMO2 gene; Paracrine
10.19401/j.cnki.1007-3639.2016.11.003
R737.25
A
1007-3639(2016)11-0894 -08
国家自然科学基金(81072114, 81300625)。
赵福军E-mail: drzhaofujun@yahoo.com
(2015-09-05
2016-11-29)

