纳米炭在早期低位直肠癌根治手术中的应用价值
杨 洋,李良庆,陈思曾,王 密
1.福建医科大学附属第一医院胃肠外科一区,福建 福州 350005;2.福建医科大学附属第一医院病理科,福建 福州 350005
纳米炭在早期低位直肠癌根治手术中的应用价值
杨洋1,李良庆1,陈思曾1,王密2
1.福建医科大学附属第一医院胃肠外科一区,福建 福州 350005;2.福建医科大学附属第一医院病理科,福建 福州 350005
背景与目的:纳米炭混悬注射液是新近出现的一种淋巴结示踪剂,该研究旨在评价其在早期低位直肠癌根治手术中淋巴结清扫的应用价值。方法:分析2013年1月—2015年12月收治的早期低位直肠癌患者66例,随机分为研究组(术前肠镜下注射纳米炭)和对照组,观察两组平均淋巴结检出数和微小淋巴结比例等指标。研究组还获取前哨淋巴结(sentinel lymph node,SLN)行病理学检查。结果:两组平均淋巴结检出数和微小淋巴结比例对比,差异均有统计学意义(P<0.05),前哨淋巴结检出准确率达90.9%,假阴性率为3.8%,无明显并发症。结论:术前注射纳米炭混悬液是有助于早期低位直肠癌淋巴结清扫,同时SLN活检是可行的。
直肠癌;纳米炭;前哨淋巴结
直肠癌在我国是最常见的恶性肿瘤之一,淋巴结转移引起局部复发和远处转移是决定预后情况的一个重要独立指标[1]。因此,区域淋巴结的彻底清除和病理标本的准确检查,对指导术后个体化治疗、提高患者的5年生存率有重要意义。多年前国外研制了纳米炭混悬液,应用于各种肿瘤引流区域淋巴结的示踪[2]。近年来,福建医科大学附属第一医院亦开始了纳米炭对早期低位直肠癌淋巴结清扫的应用研究,并且评估纳米炭示踪引流区域淋巴结的临床价值,了解前哨淋巴结(sentinel lymph node,SLN)转移情况的可行性。
1 资料和方法
1.1纳入标准
纳入标准为经术前肠镜病理活检及内镜超声、CT或MRI诊断的T1-2期且暂未发现淋巴结转移的直肠癌患者(cTNM分期为Ⅰ期),距离肛门7 cm以下,并接受根治切除。无远处转移,术前未接受过放化疗。需要排除因肿瘤出血,肠梗阻或肠穿孔的急诊病例。
1.2一般资料
本研究共纳入2013年1月—2015年12月收治的早期低位直肠癌患者66例,其中研究组36例,对照组30例,两组间性别、年龄、术前分期和手术方法差异均无统计学意义(P>0.05,表1)。
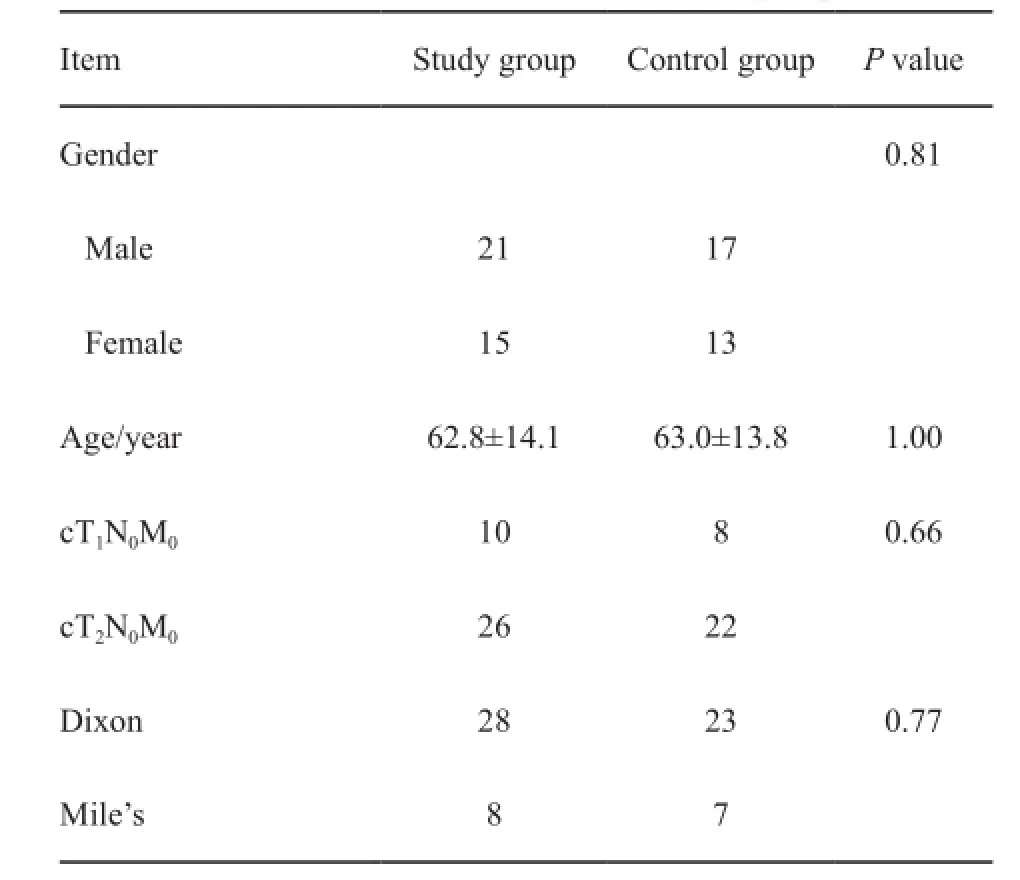
表1 研究组与对照组的一般资料比较Tab. 1 Clinical characteristics of two groups
1.3操作方法
1.3.1注射纳米炭
本研究于手术前1天在肠镜下将1 mL纳米炭混悬液在原发病灶四周(距离肿瘤1 cm内)取3~5个点注入黏膜下层。患者行腔镜或者开腹直肠癌根治术,即在直肠系膜及盆腔筋膜之间的平面进行解剖并切除了全直肠系膜(total mesorectal excision,TME)。
1.3.2SLN检出
根治手术切取大体标本后,用γ-探测仪对准系膜进行扫描,将距病灶最近、黑染明显、放射活性超过背景10倍以上淋巴结标记为SLN。术后送病理检查(HE染色),分别对SLN、清扫区域淋巴结进行病理诊断(图1)。其中微小淋巴结定义为显微镜下直径小于2 mm。
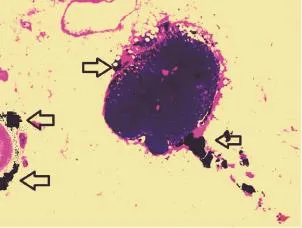
图1 纳米炭染色的淋巴结病理切片Fig. 1 Pathologic picture of lymph node with carbon nanoparticles
1.4观测指标
观察两组患者的平均淋巴结检出数和微小淋巴结所占比例,并计算研究组检出的SLN准确率和假阴性率。观察并发症,包括注射纳米炭引起的局部出血、穿孔和全身毒性反应。
1.5统计学处理
采用SPSS l6.0统计软件对数据进行分析。计量资料以采用t检验,计数资料以n(%)表示,采用χ2检验。P<0.05为差异有统计学意义。
2 结果
比较两组平均每例淋巴结检出数、微小淋巴结所占比例,差异均有统计学意义(P<0.05,表2)。术前cTNM分期为Ⅰ期的患者,对照组术后pTNM分期分别为Ⅰ期15例,Ⅱ期5例,Ⅲ期10例;同时,研究组术后pTNM分期分别为Ⅰ期18例,Ⅱ期7例,Ⅲ期11例。研究组术后病理区域淋巴结转移11例,总共检出10例SLN为阳性,准确率达到90.9%,假阴性率为3.8%(表3)。此外,注射纳米炭均未出现明显并发症,包括局部出血、穿孔和全身毒性反应。
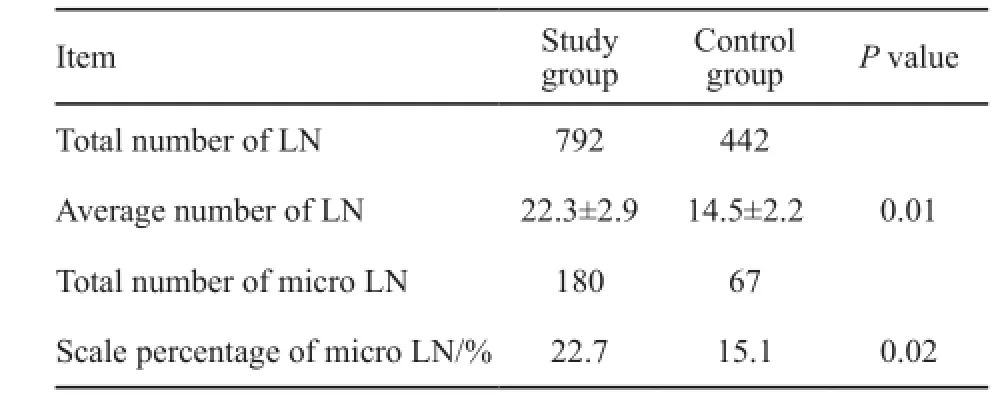
表2 研究组与对照组观察指标比较Tab. 2 Comparison of the number and size of lymph node
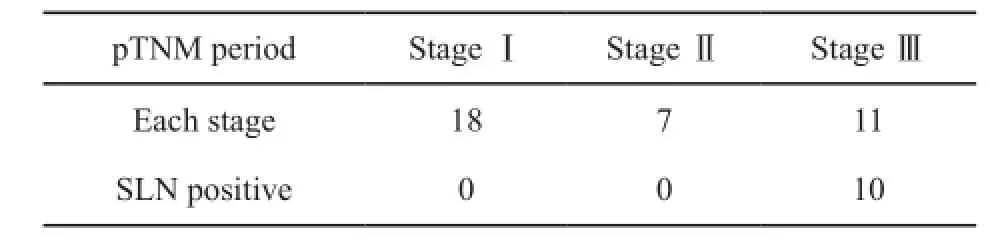
表3 研究组术后pTNM分期与SLN结果Tab. 3 The pTNM stage of the study group and the result of SLN
3 讨论
从20世纪50年代起,各种示踪剂尝试用于多种恶性肿瘤是否淋巴结转移的显示。Morl[3]用印度染色(India ink)显示了乳腺腋窝的淋巴引流,随后各种生物染料示踪剂(如亚甲蓝)被用于恶性肿瘤淋巴组织转移的研究和诊治。之后放射性核素标记物开始应用于淋巴显影技术并逐渐成熟,但其需要较高级的设备、专业的技术人员及必要的防护。活性炭作为示踪剂从20世纪70年代后期开始研究。近年来纳米技术发展,新型的纳米炭示踪剂出现,它由纳米级的炭颗粒组成,在内镜或直视下注射到肿瘤局部组织后,被巨噬细胞吞噬。由于毛细淋巴管内皮细胞间隙较毛细血管大,且基膜不完整,因此纳米炭不进入血管,对人体基本无不良反应,而是进入淋巴回流系统,并在淋巴组织中聚集并使之染色[4]。在其病理切片中,可见到纳米炭在SLN阴性的淋巴管、淋巴窦及巨噬细胞内沉积,而SLN阳性时,淋巴结内可见纳米炭环形包绕着肿瘤细胞。
手术中靠肉眼或者触摸判定淋巴结是否有转移,决定淋巴结廓清和切除范围(尤其低位直肠癌的保留肠管长度)是非常困难和盲目的,使用有效的淋巴结示踪剂能够提高淋巴组织与周围组织的对比,使肉眼更易识别,从而让医生能够直观准确地检取区域淋巴结。而检获足够数量的淋巴结和避免遗漏微小淋巴结对直肠癌准确的术后病理分期十分重要,并能指导随后的个体化治疗方案。不同研究包括NCCN指南都提出了直肠癌病理确认报告的最少淋巴结检获数,即12个以上[5-6],而多项研究证实了在术中使用淋巴示踪剂可以提高手术淋巴结的检获数量[6-7]。本研究两组对比,研究组淋巴结检出数为(22.3±2.9)个,数量与文献报道基本一致,明显高于对照组的(14.5±2.2)个,显示了其详尽的病理学价值。同时有报道指出,15%~25%被诊断为T1-2期结直肠癌患者,尽管接受了标准根治术,但仍在5年内出现局部复发或远处转移,最可能的原因是有隐蔽的微小淋巴结在术中以及术后未被发现,从而导致病理分期错误而未行化疗所致[8]。本研究的两组对比发现,研究组微小淋巴结占22.7%,明显高于对照组的15.1%,这是常规病理检查难以达到的,可以有效地避免淋巴结微转移的漏诊。
此前在乳腺癌的研究中,利用示踪剂进行术中淋巴造影,SLN是预测区域淋巴结整体情况有效而特异的指标,准确率达到95%以上[9]。已经能够指导医生进行合理地切除和必要的淋巴结清扫,既能防止残留癌细胞,也能避免因手术切除范围过大引起不必要的并发症。当然,目前直肠癌手术中选择性清扫淋巴结并非标准术式,但对于直肠肿瘤SLN的研究在近年逐渐得到关注。在日本,通常依靠病理学诊断结果来决定结肠恶性肿瘤的手术方案,若为早期大肠癌,则可考虑作内镜黏膜下切除[10]。可考虑通过有针对性的个别SLN检查,来预测整个引流区域淋巴结群的肿瘤转移情况,尤其对低位早期直肠癌,有望提高保肛率。即术前γ-探测仪结合B超、CT定位SLN穿刺活检,或术中暂不离断肠系膜下血管,稍游离系膜取出SLN[11],如果SLN是阴性,那么对于较小的原发病灶,确保了术前分期的准确性,可能就只需要在内镜下行固有肌层剥离切除,或腹腔镜下行全层切除;如果SLN是阳性,那么术前分期不准确,pTNM分期变为Ⅲ期,可考虑行根治性手术,或待新辅助治疗降期[12]。本研究中SLN检出数一般为3~5枚,术中冰冻证实阳性与清扫区域淋巴结术后病理结果相比,准确率达到90.9%,假阴性率为3.8%,但样本量偏少。Saha等[13]曾组织大样本多中心的临床试验,证实运用淋巴示踪剂进行结直肠肿瘤SLN判断的成功率达到98%。但进展期的直肠癌,尤其是腹膜返折以下的病灶,由于盆底解剖相对复杂及周围淋巴结融合成团,癌栓堵塞淋巴管,会影响纳米炭染色,导致假阴性发生[14]。此外,术前注射方法不准确也会降低SLN检出,如示踪剂进入肠壁浆膜外的疏松结缔组织内将影响术中对解剖层次的游离及注射纳米炭剂量不足将影响引流区域淋巴结的染色效果。
总之,术前肠镜下注射纳米炭有助于早期低位直肠癌的淋巴结清扫和病理学检查的精准评估,同时通过SLN活检预测整个引流区域淋巴结群的转移情况是可行的,有望提高患者的保肛率,但仍需进一步的大样本研究。
[1] 龚杨明, 吴春晓, 张敏璐, 等. 上海人群结直肠癌生存率分析[J]. 中国癌症杂志, 2015, 25(7): 497-504.
[2] VATHER R, SAMMOUR T, KAHOKEHR A. Quantitative lymph node evaluation as an independent marker of long-term prognosis in stage Ⅲ rectal cancer [J]. Anz J Surg, 2011, 81(12): 883-888.
[3] MORL F. Importance of the sternal lymph vessels for metastases of cancer of the breast [J]. Chirurg, 1952, 23(7): 298-300.
[4] CAI H K, HE H F, TIAN W. Colorectal cancer lymph node staining by activated carbon nanoparticles suspension in vivo or methylene blue in vivo [J]. World J Gastroenterol, 2012, 18(42): 6148-6154.
[5] WANG C, ZHOU Z, WANG Z, et al. Patterns of neoplastic foci and lymph node micrometastasis within the mesorectum [J]. Langenbecks Arch Surg, 2005, 390(4): 312.
[6] NAGTEGAAL I D, QUIRKE P. What is the role for the circumferential margin in the modern treatment of rectal cancer [J]. J Clin Oncol, 2008, 26(2): 303-312.
[7] 王亚楠, 李贵平, 龚 伟, 等. 单光子发射型计算机断层扫描-同机CT融合技术联合纳米炭混悬液注射法在直肠癌前哨淋巴结示踪中的应用 [J]. 中华胃肠外科杂志, 2011, 14(5): 352-355.
[8] KIRIYAMA S, SAITO Y, YAMAMOTO S, et al. Comparison of endoscopic submucosal dissection with laparoscopicassisted colorectal surgery for early-stage colorectal cancer: a retrospective analysis [J]. Endoscopy, 2012, 44(11): 1024-1030.
[9] BESLIC N. The role of sentinel lymph node detection in management of patients with breast cancer [J]. Med Arh, 2008, 62(4): 240-241.
[10] NAKAHARA T. Tracers used for the detection of sentinel lymphnodes [J]. Nippon Geka Gakkai Zasshi, 2009, 110(2): 86-89.
[11] 张相春, 王延磊, 晏 伟, 等. 纳米碳淋巴示踪剂在腹腔镜结直肠癌手术中的应用探讨 [J]. 中华医学杂志, 2015, 95(32): 2612-2615.
[12] JUN Y, FANG X, HUI Z, et al. A multi-center study of using carbon nanoparticles to track lymph node metastasis in T1-2colorectal cancer [J]. Surg Endosc, 2014, 28(12): 3315-3321.
[13] SAHA S, BILCHIK A, WIESE D, et al. Ultrastaging of colorectal cancer by sentinel lymph node mapping techniquea multicenter trial [J]. Ann Surg Oncol, 2001, 8(9 Suppl): 94S-98S.
[14] SAHA S, JOHNSTON G, KORANT A, et al. Aberrant drainage of sentinel lymph nodes in colon cancer and its impact on staging and extent of operation [J].Am J Surg, 2013, 205(3): 302-305.
The application of domestic nanometer activated carbon in the radical operation for early stage low-lying rectal cancer
YANG Yang1, LI Liangqing1, CHEN Sizeng1, WANG Mi2
(1.Department of General
Surgery, the First Affiliated Hospital of Fujian Medical University, Fuzhou 350005, Fujian Province, China; 2.Department of Pathology, the First Affiliated Hospital of Fujian Medical University, Fuzhou 350005, Fujian Province, China)
Correspondence to: LI Liangqing E-mail: lqli@msn.com
Background and purpose: This study aimed to estimate the spike-effect of domestic nanometer activated carbon on the radical operation for early stage low-lying rectal cancer. Methods: From Jan. 2013 to Dec. 2015, 66 patients with early stage low-lying rectal cancer were randomly divided into two groups: study group and control group. The patients of study group were treated with injection of carbon nanoparticles suspension in tumor vicinity before the operation. This study compared the total number of lymph node, the scale percentage of micro lymph node between two groups. SLNs of study group were obtained for pathological examination. Results: The differences in the total number of lymph node and the scale percentage of micro lymph node between two groups were statistically significant (P<0.05). The diagnostic sensitivity and false-negative rate were 90.9% and 3.8%, respectively. Conclusion: Local injection of nanometer activated carbon around the tumor is important to the metastasis lymph node resection, especially to SLN biopsy in the radical operation for rectal cancer.
Rectal cancer; Carbon nanoparticles; Sentinel lymph node
10.19401/j.cnki.1007-3639.2016.11.007
R735.3+7
A
1007-3639(2016)11-0922-04
国家临床重点专科建设项目;国家自然科学基金(81272465)。
李良庆E-mail: lqli@msn.com
(2016-04-16
2016-07-12)

