同型半胱氨酸对实验性结肠炎大鼠血栓调节蛋白和内皮细胞蛋白C受体表达的影响
陈 义,丁少桢,梅 俏,刘晓昌,胡 静,韩 玮,许建明
同型半胱氨酸对实验性结肠炎大鼠血栓调节蛋白和内皮细胞蛋白C受体表达的影响
陈 义,丁少桢,梅 俏,刘晓昌,胡 静,韩 玮,许建明
目的 探讨同型半胱氨酸(Hcy)对实验性结肠炎大鼠结肠黏膜中可溶性血栓调节蛋白(sTM)、蛋白C(PC)、游离蛋白S(fPS)水平及血栓调节蛋白(TM)、内皮细胞蛋白C受体(EPCR)mRNA表达的影响。方法 SD大鼠分为正常组:组1[生理盐水(NS)皮下注射+NS灌肠]、组2(Hcy皮下注射+NS灌肠);TNBS模型组:组1(NS皮下注射+TNBS灌肠)、组2(Hcy皮下注射+TNBS灌肠)。实验结束时采用ELISA法检测大鼠结肠黏膜中sTM、fPS、PC水平,采用RT-qPCR法检测大鼠结肠黏膜中TM、EPCR mRNA的表达水平。结果 与TNBS模型组1相比,TNBS模型组2大鼠血浆及结肠Hcy水平均显著增高,大鼠结肠黏膜中sTM、PC和fPS水平降低(P<0.05),大鼠结肠黏膜中TM、EPCR mRNA表达水平降低(P<0.05)。结论 Hcy可以加重大鼠结肠炎症损伤,其机制可能是影响PC的抗炎与抗凝功能,引起肠道微循环血栓前状态。
同型半胱氨酸;可溶性血栓调节蛋白;蛋白C;游离蛋白S;内皮细胞蛋白C受体
在炎症性肠病(inflammatory bowel disease,IBD)的病理生理过程中,肠道炎症合成的炎症介质加重炎症损伤,同时刺激内皮细胞激活机体凝血系统,形成血栓前状态,内皮细胞在炎症与血栓前状态之间具有重要作用。在生理条件下,由血栓调节蛋白(thrombomodulin,TM)、内皮细胞蛋白C受体(endothelial protein C receptor,EPCR)、蛋白C( protein C,PC)和蛋白S(protein S, PS)等组成的PC系统是机体调控凝血机制的重要途径。TM是表达于血管内皮细胞表面的一种糖蛋白,TM与凝血酶结合,在PS和EPCR的作用下激活PC转化为具有抗凝和抗炎作用的活性蛋白C(activiated protein C,aPC)[1]。因此,PC途径在IBD 的发病机制中发挥抗凝和抗炎的重要作用。同型半胱氨酸(homocysteine,Hcy)是一种含硫氨基酸,是体内蛋氨酸代谢的重要中间产物。IBD患者血栓性疾病发生率较高,可能与IBD患者血浆和结肠黏膜组织中Hcy含量增高有关[2]。研究[3-5]表明,Hcy可以损伤血管内皮细胞,引起血管平滑肌细胞增生和血小板凝集等作用,同时Hcy参与血管内皮细胞炎症,上调血管细胞黏附分子-1(vascular cell adhesion molecule 1,VCAM-1)和单核细胞趋化蛋白-1(monocyte chemotactic protein 1,MCP-1)的表达,促进p38磷酸化[6]。Hcy作为促凝血因子,通过抑制TM和EPCR的表达,降低PC抗凝和抗炎作用,在心脑血管系统疾病的血栓形成过程中具有重要影响。由于IBD患者肠道黏膜中Hcy水平较高,并且微血栓形成在IBD病理进程中具有重要作用[7],Hcy是否通过影响肠道黏膜组织中微血栓形成过程中的相关因素如可溶性血栓调节蛋白(soluble thrombomodulin,sTM)、PC、游离蛋白S(free protein S,fPS)及EPCR的表达,加重结肠炎症过程目前尚不明确,因此,该研究拟在建立大鼠三硝基苯磺酸(trinitro-benzene-sulfonic acid,TNBS)/乙醇结肠炎模型的基础上,探讨Hcy对实验性结肠炎大鼠结肠黏膜中sTM、PC、fPS水平和EPCR表达的影响。
1 材料与方法
1.1 实验动物与药品 SD大鼠,SPF级,雄性,(200±20) g,由安徽医科大学实验动物中心提供,在室温、光照周期12 h:12 h条件下适应性饲养1周后使用。TNBS(货号:031M5021)、DL-同型半胱氨酸(货号:121M39044)均购自美国Sigma公司。
1.2 实验分组 大鼠分为4组,每组8只。正常组:组1[生理盐水(NS)皮下注射+NS灌肠]、组2(Hcy皮下注射+NS灌肠);TNBS模型组:组1(NS皮下注射+TNBS灌肠)、组2(Hcy皮下注射+TNBS灌肠)。各组给药剂量见下文。
1.3 模型制备和给药方法 参照文献[8]方法,10%水合氯醛腹腔注射麻醉,用橡胶管经肛门插入大鼠结肠内约8 cm,注入以等体积乙醇溶解的TNBS(100 mg/kg)溶液。正常组灌肠等体积NS。DL-Hcy溶于NS,滴定pH至7.4,参照文献[9]剂量自TNBS模型制备后第1天起皮下注射Hcy(0.03 μmol/g),每天2次,间隔8 h,连续30 d。正常组1及TNBS模型组1皮下注射等体积NS。
1.4 标本采集 大鼠经10%水合氯醛腹腔注射麻醉,腹主动脉采血后以3 000 r/min离心10 min,取上清液保存于-80 ℃。分别切取远端结肠,沿纵轴剪开肠管,冰生理盐水冲洗干净后取部分结肠进行检测。
1.5 样品检测 ELISA法检测大鼠结肠黏膜中sTM、PC、fPS水平。实时荧光扩增检测(Real-Time quantitative polymerase chain reaction,RT-qPCR)法检测大鼠结肠黏膜组织TM和EPCR mRNA表达:提取结肠黏膜组织mRNA、去除基因组DNA、合成cDNA后,按试剂盒说明书进行加样:95 ℃ 5 min,95 ℃ 10 s,60 ℃ 10 s退火,72 ℃延伸,40个循环。分析方法为:相对定量试验,分析指标为2-ΔΔCt。TM引物序列F:5′-TGCAAAGGATGTGGTTGTCT-3′,R:5′-ACGACCCATAGGACACTTCC-3′,产物长度122 bp;EPCR引物序列F:5′-GGACACCTGTGTGCAGTACC-3′,R:5′-TGAAACAGCCCATCAGGATA-3′,产物长度113 bp。

2 结果
2.1 各组大鼠血浆和结肠黏膜组织中Hcy水平的变化 与正常组1比较,TNBS模型组1的大鼠血浆(3.59±0.49vs11.40±0.94)和结肠组织Hcy(1.22±0.10vs1.69±0.20)的水平明显增高(P<0.01)。与正常组2比较,TNBS模型组2大鼠血浆(20.73±0.94vs2.26±0.16)及结肠组织Hcy水平(23.44±1.40vs3.06±0.30)显著增加(P<0.01)。各组血浆Hcy水平比较差异有统计学意义(F=432.915,P<0.01);各组结肠Hcy水平比较差异有统计学意义(F=69.819,P<0.01)。
2.2 Hcy对结肠炎大鼠结肠黏膜中sTM、fPS和PC水平的影响 与正常组1相比,TNBS模型组1大鼠结肠黏膜sTM、PC水平明显降低,fPS水平亦降低,但差异无统计学意义,与TNBS模型组1相比,TNBS模型组2大鼠结肠黏膜sTM、PC、fPS水平显著下降(P<0.05)。各组间sTM水平差异有统计学意义(F=5.633,P<0.01);各组间PC水平差异有统计学意义(F=6.97,P<0.01);各组之间fPS水平差异有统计学意义(F=10.542,P<0.01)。见表1。
2.3 Hcy对结肠炎大鼠结肠黏膜中TM和EPCR mRNA表达的影响 经单因素方差分析,各组结肠黏膜中TM和EPCR mRNA表达的差异有统计学意义(F=11.112,9.798,P<0.05)。见图1、2。
3 讨论
正常血管内皮细胞表面表达TM,与凝血酶结合激活PC系统,形成aPC发挥抗凝和抗炎功能,PS可增强PC的抗凝功能。aPC具有抑制核转录因子kappaB(NF-κB)活性,降低血管内皮细胞凋亡和稳定血管内皮细胞屏障作用,抑制炎细胞对血管内皮细胞的黏附等[10]。降低TM表达可引起低水平aPC,促进肠道局部炎症和凝血紊乱状态。炎症条件加重时,PS和PC水平降低,凝血级联反应增强,炎性介质可引起血管内皮细胞合成和释放纤溶酶原激活抑制物,促进血栓形成。

表1 Hcy对实验性结肠炎大鼠结肠黏膜sTM、PC、fPS水平的影响
与正常组1比较:**P<0.01;与TNBS模型组1比较:#P<0.05,###P<0.01
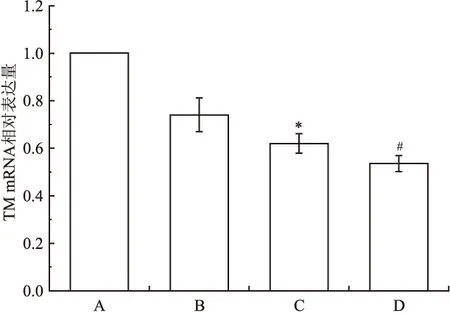
图1 Hcy对实验性结肠炎大鼠结肠黏膜中TM mRNA表达的影响
A:正常组1;B:正常组2;C:TNBS模型组1;D:TNBS模型组2;与正常组1比较:*P<0.05;与TNBS模型组1比较:#P<0.05

图2 Hcy对实验性结肠炎大鼠结肠黏膜中EPCR mRNA表达的影响
A:正常组1;B:正常组2;C:TNBS模型组1;D:TNBS模型2;与正常组1比较:*P<0.05;与TNBS模型组1比较:#P<0.05
IBD具有局部微循环高凝和血栓前状态的特征,肠道炎症和凝血机制存在相互联系。肠道炎症通过合成促凝物质,抑制抗凝物质等机制加重微循环高凝状态,肠道炎症加重时可出现凝血物质水平改变,如包括凝血因子V、VIII以及vWF因子水平增加,抗凝物质(包括PC、PS以及抗凝血酶)水平降低以及纤溶系统紊乱。同时,凝血酶通过促进MCP-1合成以及IL-6、IL-8等炎症介质形成[2]。IBD中肠道炎症与凝血功能是互相影响的生理和病理过程,通过PC系统调控肠道黏膜微血管炎症过程。研究[11]显示,IBD患者肠道微血管TM及EPCR等表达降低,经TNF-α及IL-1β处理人肠微血管内皮细胞(HIMEC),发现HIMEC中TM和EPCR表达水平下降[12]。aPC可通过抑制TNF-α上调细胞黏附分子(CAM)表达发挥抗炎作用。因此,PC系统对IBD肠道局部高凝状态和炎症具有重要的调节作用。
研究[13]表明,Hcy处理血管内皮细胞可引起VCAM-1和MCP-1表达增加以及p38磷酸化,使血管内皮细胞与炎细胞更易黏附。同时,Hcy可以改变血管屏障功能,引起组织因子(TF)表达增加,降低TM、组织型纤溶酶元复合物(tPA)及aPC表达发挥促凝作用。Hcy可以抑制人脐静脉内皮细胞(HUVEC)中TM表达,降低aPC水平。有高Hcy血症的动物表现出TM活性降低,Hcy同时影响TM活化,促进血栓形成[14]。
本研究显示,与TNBS模型组1比较,TNBS模型组2大鼠结肠黏膜中sTM、fPS、PC水平降低,大鼠结肠黏膜中TM与EPCR mRNA表达降低,初步提示Hcy可能通过影响PC途径,引起肠道局部抗炎和抗凝功能紊乱,加重结肠炎大鼠肠道微循环高凝状态和炎症损伤,但Hcy如何调控肠道中PC途径的具体机制有待进一步研究,因此,降低IBD中肠道黏膜Hcy水平有助于改善肠道PC系统功能,可能成为调控肠道炎症的新靶点。
[1] Lust M, Vulcano M, Danese S. The protein C pathway in inflammatory bowel disease: the missing link between inflammation and coagulation[J]. Trends Mol Med,2008,14(6):237-44.
[2] Zezos P, Kouklakis G,Saibil F. Inflammatory bowel disease and thromboembolism[J].World J Gastroenterol, 2014, 20(38):13863-78.
[3] Austin R C,Lentz S R,Werstuck G H. Role of hyperhomocysteinemia in endothelial dysfunction and atherothrombotic disease[J]. Cell Death Differ, 2014,11(1): S56-64.
[4] Ricart J M,Vayá A,Todolí J,et al.Thrombophilic risk factors and homocysteine levels in Behcet′s disease in eastern Spain and their association with thrombotic events[J]. Thromb Haemost, 2006, 95(4):618-24.
[5] Macy P A.Homocysteine:predictor of thrombotic disease[J].Clin Lab Sci,2001,14(4):272-5.
[6] Danese S,Sgambato A,Papa A, et al. Homocysteine triggers mucosalmicrovascular activation in inflammatory bowel disease[J]. Am J Gastroenterol,2005,100(4):886-95.
[7] Bjerregaard L T,Nederby N J,Fredholm L,et al.Hyperhomocysteinaemia, coagulation pathway activation and thrombophilia in patients with inflammatory bowel disease[J]. Scand J Gastroenterol,2002,37(1):62-7.
[8] Morris G P, Beck P L, Herridge M S,et al. Hapten induced model of chronic inflammation and ulceration in the rat colon[J]. Gastroenterology, 1989, 96(3):795-803.
[9] Scherer E B, da Cunha A A, Kolling J, et al. Development of an animal model for chronic mild hyperhomocysteinemia and its response to oxidative damage[J]. Int J Dev Neuroscience, 2011, 29(7):693-9.
[10]D′Alessio S, Genua M, Vetrano S. The protein C pathway in intestinal barrier function:challenging the hemostasis paradigm[J]. Ann N Y Acad Sci,2012, 1258:78-85.
[11]Scaldaferri F, Sans M,Vetrano S,et al.Crucial role of the protein C pathway in governing microvascular inflammation in inflammatory bowel disease[J]. J Mol Cell Cardiol,2012,52(3):753-60.
[12]Danese S,Papa A,Saibeni S,et al.Inflammation and cogulation in inflammatory bowel disease:The clot thickens[J].Am J Gastroenterol,2007,102(1):174-86.
[13]Xu S,Song H,Huang M,et al.Telmisartan inhibits the proinflammatory effectsof homocysteine on human endothelial cells through activation of the peroxisomeproliferator-activated receptor-δ pathway.[J]. Int J Mol Med,2014,34(3):828-34.
[14]Harpel P C,Zhang X,Borth W. Homocysteine and hemostasis: pathogenic mechanisms predisposing to thrombosis[J]. J Nutr,1996,126(4 Suppl):1285S-9S.
Effects of homocysteine on the expression of TM and EPCR in rats colitis
Chen Yi, Ding Shaozhen, Mei Qiao, et al
(DeptofGastroenterology,TheFirstAffiliatedHospitalofAnhuiMedicalUniversity,TheKeyLaboratoryofDigestiveDiseasesofAnhuiProvince,Hefei230022)
ObjectiveToinvestigatetheeffectsofhomocysteine(Hcy)onlevelofsolublethrombomodulin(sTM),proteinC(PC),freeproteinS(fPS)andmRNAexpressionsofthrombomodulin(TM)andendothelialproteinCreceptor(EPCR)inratswithexperimentalcolitis.MethodsSDratsweredividedinto4groups:normalgroup,normal+Hcygroup,TNBS/ethanolgroup,TNBS/ethanol+Hcygroup.ExperimentalcolitismodelwithhyperhomocystinemiawasestablishedinratswithintracolonicadministrationofTNBSandsubcutaneousinjectionofHcy.ThemRNAexpressionofTMandEPCRwasdetectedbyRT-qPCRmethod.ThelevelsofsTM,PCandfPSincolonmucosatissuesofratsweremeasuredbyELISAmethod.ResultsComparedwiththenormalgroup,thelevelsofHcyinplasmaandcolonmucosawereincreasedremarkablyinTNBS-inducedcolitisratswithHcyinjectionsimultaneously.Furthermore,thelevelsofsTM,PC,andfPSincolonmucosaweredecreasedsignificantly.RT-qPCRmethodshowedsignificantdecreaseinmRNAexpressionsofTMandEPCRincolonmucosatissuesinTNBS/ethanol+Hcygroup.ConclusionHcycouldpromotepathologicaldamageinTNBS-inducedcolitisrats,whichmayberelatedtoitseffectsontheanti-inflammatoryandanticoagulationofPCsystem,resultinginprothrombosisconditionincolonicmucosalmicrocirculation.
homocysteine;solublethrombomodulin;proteinC;proteinS;endothelialproteinCreceptor
国家自然科学基金(编号:81470809);安徽省自然科学基金(编号:1308085MH146)
安徽医科大学第一附属医院消化内科,合肥 230022
陈 义,男,主治医师,硕士研究生; 梅 俏,男,主任医师,硕士生导师,责任作者,E-mail:meiqiao@hotmail.com
时间:2016-10-12 13:23:00
http://www.cnki.net/kcms/detail/34.1065.R.20161012.1323.015.html
R 322;R 322.45;R 341.7;R 364.5;R 574.62;R 977.4
A
1000-1492(2016)11-1621-04
10.19405/j.cnki.issn1000-1492.2016.11.015
2016-06-27接收

