人参皂苷Rk3对肝癌HepG2细胞凋亡的影响
范 洁,张 磊,王 啸
人参皂苷Rk3对肝癌HepG2细胞凋亡的影响
范 洁1,2,3,张 磊1,2,王 啸4
目的 研究人参皂苷Rk3对肝癌HepG2细胞凋亡影响。方法 体内实验采用HepG2细胞裸鼠腋部皮下接种,制备荷瘤鼠肝癌模型,分为生理盐水组、人参皂苷Rk3 (25、50、100 mg/kg)组和5-氟尿嘧啶(5-Fu,20 mg/kg)组;体外实验分为正常组、人参皂苷Rk3 (20、40、80 μmol/L)组和5-Fu(50 μg/ml)组;MTT法检测HepG2细胞增殖;流式细胞术检测HepG2细胞凋亡;RT-PCR法检测HepG2细胞中Bax、Bcl-2,cleaved-Caspase-3、DR4和DR5 mRNA表达;Western blot法检测HepG2细胞中Bax、Bcl-2、cleaved-Caspase-3、DR4和DR5蛋白表达。结果 人参皂苷Rk3(100 mg/kg)够明显抑制瘤体重量(P<0.05);人参皂苷Rk3(20、40、80 μmol/L )能明显抑制HepG2细胞增殖,诱导HepG2细胞凋亡;人参皂苷Rk3(20、40、80 μmol/L)能显著增加Bax、cleved-Caspase-3、DR4和DR5蛋白和mRNA的表达,降低Bcl-2蛋白和mRNA的表达(P<0.05)。结论 人参皂苷Rk3可能通过DR4、DR5诱导HepG2细胞凋亡。
人参皂苷Rk3;HepG2;凋亡
肝癌的发生发展经历了肝炎-肝硬化-肝癌三个病变过程,是一个多步骤、多阶段的病理学过程[1-2]。肝癌因其恶性程度高、进展迅速以及治疗复杂造成的疗效预后差[3]一直是临床研究的热点。目前治疗肝癌最有效的方法是手术切除或肝移植,但是多数患者并不具备手术指征和条件,术后发病率高也导致治疗困难。研究[4-5]表明,通过诱导肝癌细胞的凋亡能够有效控制肿瘤,因此,诱导肝癌细胞凋亡是抗肝癌药物研究的重要思路之一。人参皂苷Rk3是人参在蒸制成红参过程中生成的一种重要的稀有人参皂苷,研究[6]表明,红参提取物能明显抑制DMBA诱导的肿瘤细胞增殖,延长荷瘤小鼠的存活时间。近年来,关于人参皂苷抗肿瘤活性的研究取得了重大进展,体内外抗肿瘤研究[7-10]表明,具有肿瘤细胞毒性作用的人参皂苷多为一些稀有皂苷,研究较多的是稀有人参皂苷Rg3、Rh2、Rh1以及苷元原人参二醇和原人参三醇,在促进肿瘤细胞凋亡、促使肿瘤细胞分化、提高肿瘤细胞对化疗药物的敏感性以及提高机体抗肿瘤免疫力方面均有显著作用。然而,稀有人参皂苷Rk3的抗肿瘤药理活性尚未见报道。该研究通过体内体外实验探讨人参皂苷Rk3对肝癌的作用。体内采用裸鼠建立肝癌模型,观察人参皂苷Rk3对肿瘤大小的影响;体外观察其对HepG2细胞株凋亡的影响。
1 材料与方法
1.1 材料
1.1.1 细胞株和动物 人肝癌细胞株(HepG2)购自中国科学院上海细胞库;清洁级Balb/c裸鼠,16~20 g,雌雄各半,购自北京维通利华实验动物技术有限公司。
1.1.2 试剂 人参皂苷Rk3购自大连美仑生物技术有限公司,有效成分≥98%;5-氟尿嘧啶(5-Fluorouracil, 5-Fu)购于上海阿拉丁生化科技股份有限公司,有效成分=99%;胎牛血清购自杭州四季青公司;DMEM高糖培养基购自美国Hyclone公司;TRIzol购自美国Sigma公司;Reverse Transcription System逆转录试剂盒购自日本Ferments公司;小鼠抗β-actin抗体购自美国 Santa Cruze公司;Bax、Bcl-2、cleaved-Caspase-3、DR4和DR5抗体购自武汉博士德公司;Bax、Bcl-2、cleaved-Caspase-3、DR4、DR5引物由上海生工生物工程有限公司合成。
1.1.3 主要仪器 MK3型酶标仪(荷兰雷勃公司);SW-CJ-IF型超净工作台(江苏苏净集团苏州安泰空气技术有限公司);PCR扩增仪(德国Eppedorf公司);Bio-rad电泳仪(美国伯乐公司);COULTZER EPICS XL-MCL流式细胞仪(美国Beckman Coulter公司)。
1.2 方法
1.2.1 HepG2细胞的培养 采用含10%胎牛血清的DMEM培养液,在37 ℃、5% CO2及饱和湿度条件下培养,待细胞生长至70%~80%密度时进行传代。
1.2.2 HepG2荷瘤鼠肝癌模型的建立 取对数期细胞1×107~5×107/ml 200 μl接种于裸鼠右腋部皮下。第4周给予人参皂苷Rk3(25、50、100 mg/kg)和5-Fu(20 mg/kg)灌胃,生理盐水组给予等体积的生理盐水,连续灌胃4周;8周后处死裸鼠取出瘤体,测量瘤体重量。
1.2.3 细胞增殖试验 取对数生长期的HepG2细胞制成单细胞悬液,以1×108/ml的细胞密度接种于96孔板,每孔约100 μl,37 ℃过夜。待细胞完全贴壁后加入人参皂苷Rk3(0、5、10、20、40、80 μmol/L),分别作用6、12、24、48 h后,弃去培养基,换无血清培养液,然后每孔加MTT(5 mg/ml) 20 μl,37 ℃继续孵育4 h后,弃上清液并每孔加150 μl DMSO溶解细胞内结晶,室温振荡溶解10 min后,于492 nm波长处测吸光度(absorbance,A)值。
1.2.4 流式细胞术检测细胞凋亡 取不同浓度的人参皂苷处理后的HepG2细胞制成细胞悬液后;1 200 r/min离心5 min,收集细胞,弃培养基,用PBS洗涤2次;用400 μl Binding Buffer悬浮细胞;加入5 μl Annexin V染液,轻轻混匀后于2~8 ℃避光孵育15 min;加入10 μl PI后轻轻混匀,于2~8 ℃避光条件下孵育5 min;上流式细胞仪检测细胞凋亡,实验重复3次。
1.2.5 Western blot法检测Bax、Bcl-2、cleaved-Caspase-3、DR4和DR5的蛋白表达 取对数生长期HepG2细胞,加入400 μl含PMSF的RIPA细胞裂解液,冰上裂解30 min后;4 ℃、12 000 r/min离心30 min;取上清液加入SDS上样缓冲液,99.9 ℃变性10 min。样品经SDS-聚丙烯酰胺凝胶电泳分离,将蛋白转移至PVDF膜上,室温5%脱脂牛奶孵育3 h后;一抗孵育过夜后,二抗孵育1 h,ECL发光试剂盒显影。
1.2.6 RT-PCR法检测Bax、Bcl-2、cleaved-Caspase-3、DR4和DR5的mRNA表达 使用TRIzol法提取HepG2细胞总RNA,逆转录得到cDNA。PCR扩增反应条件为94 ℃变性40 s,51~58 ℃ 复性40 s,72 ℃延伸 1 min,35个循环。引物序列见表1。PCR产物在琼脂糖凝胶上电泳,凝胶图像分析系统检测光密度。

2 结果
2.1 人参皂苷Rk3对HepG2荷瘤鼠瘤体重量的影响 与生理盐水组比较,人参皂苷Rk3(100 mg/kg)能够明显降低肿瘤的重量(F=56.6,P<0.05)。 见表2。

表1 引物序列

表2 人参皂苷Rk3对HepG2荷瘤鼠瘤体重量的影响
2.2 人参皂苷Rk3对HepG2细胞增殖的影响 与未加人参皂苷Rk3比较,人参皂苷Rk3(20、40、80 μmol/L)在24、48、72 h能够明显抑制HepG2细胞增殖(F=38.4、48.5、69.7,P<0.05)。人参皂苷Rk3随着药物作用时间延长和浓度增加抑制HepG2细胞增殖作用增强。见图1。
2.3 人参皂苷Rk3对HepG2细胞凋亡的影响 Annexin V和PI双标经流式细胞仪检测显示,与正常组(3±0.32)%比较,人参皂苷Rk3 20 μmol/L组(13±1.31)%、40 μmol/L组(17±1.92)%和80 μmol/L组(25±2.92)%能够明显诱导HepG2细胞凋亡,差异有统计学意义(P<0.01)。 见图2。

图1 人参皂苷Rk3对HepG2细胞增殖的影响
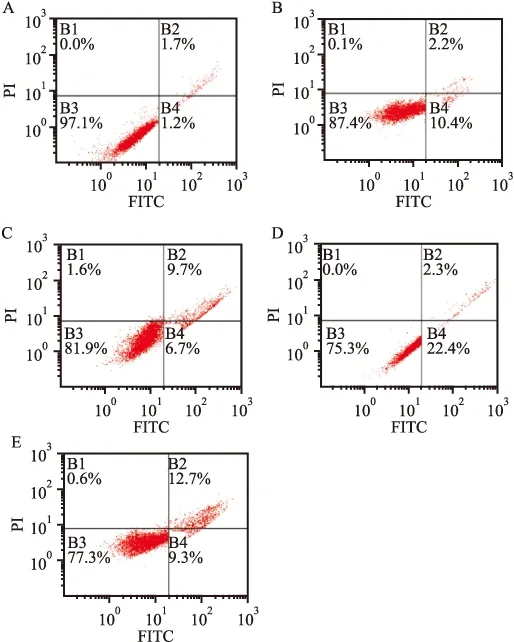
图2 人参皂苷Rk3对HepG2细胞凋亡的影响
2.4 人参皂苷Rk3对HepG2细胞中Bax、Bcl-2、cleaved-Caspase-3、DR4和DR5 mRNA和蛋白表达的影响 RT-PCR和Western blot结果见图3、4,给予不同浓度的人参皂苷Rk3(20、40、80 μmol/L)后,Bax、cleved-Caspase-3、DR4和DR5 mRNA和蛋白明显增加(P<0.05);Bcl-2的mRNA和蛋白显著减少,差异有统计学意义(P<0.01)。
3 讨论
人参皂苷 Rk3是从人参炮制品红参药材中分离提纯的一种单体,为四环三萜类人参二醇型皂苷。

图3 人参皂苷Rk3对HepG2细胞中Bax、Bcl-2、cleaved-Caspase-3、DR4和DR5 mRNA表达的影响
M:Marker;A~D:人参皂苷Rk3 0、20、40、80 μmol/L; E: 5-Fu 50 μg/ml;与人参皂苷Rk3 0 μmol/L比较:**P<0.01
Quan et al[11]通过体外实验证明,稀有人参皂苷Rk3对胰腺癌、白血病、结肠癌等细胞株的增殖有明显抑制作用。
本研究显示,人参皂苷Rk3能够显著抑制HepG2荷瘤鼠肝癌模型中肿瘤的重量。同时, MTT结果显示人参皂苷Rk3 (20、40、80 μmol/L)在24、48、72 h能够明显抑制HepG2细胞增殖,并随着药物作用时间延长和浓度增加抑制HepG2细胞增殖作用增强。为了观察人参皂苷Rk3对HepG2凋亡的影响,本研究使用Annexin V和PI双标经流式细胞仪检测,结果显示人参皂苷Rk3(20、40、80 μmol/L)能够增加HepG2细胞凋亡,同时cleaved-Caspase-3的mRNA和蛋白表达显著升高。
死亡受体分子DR4和DR5与TRAIL结合后,通过招募Caspase-8传递死亡信号,能够诱导肿瘤细胞凋亡[12]。本研究显示给予人参皂苷Rk3后,DR4和DR5的表达明显增加,提示人参皂苷Rk3能够诱导HepG2的凋亡可能与DR4和DR5有关。Bcl-2是一种原癌基因,能够增强细胞对大多数DNA损伤因子的抵抗性,抑制细胞的凋亡,而其同源的Bax能够促进细胞凋亡[13]。Bax的过表达可拮抗Bcl-2的保护效应而使细胞凋亡。本研究结果表明人参皂苷Rk3能够降低Bcl-2的mRNA和蛋白表达,增加Bax的表达。上述结果提示,人参皂苷Rk3诱导HepG2细胞的凋亡可能是通过上调DR4、DR5及调控凋亡相关蛋白的表达。

图4 人参皂苷Rk3对HepG2细胞中Bax、Bcl-2、cleaved-Caspase-3、DR4和DR5 蛋白表达的影响
A~D:人参皂苷Rk3 0、20、40、80 μmol/L; E: 5-Fu 50 μg/ml; 与人参皂苷Rk3 0 μmol/L比较:*P<0.05,**P<0.01
综上所述,本研究结果证实人参皂苷Rk3对荷瘤鼠肝癌有一定的抑制作用,并可能通过影响DR4、DR5和凋亡相关蛋白的表达诱导HepG2细胞的凋亡,但具体机制尚需进一步研究。
[1] 陈建国. 中国肝癌发病趋势和一级防护[J]. 临床肝胆病杂志, 2012,28(4):256-60.
[2] 白阳秋, 丁光伟, 杨玉秀, 等. 肝癌发生过程中的差异基因表达[J]. 世界华人消化杂志, 2008, 16(22):2537-41.
[3] 陈建斌, 魏思东, 陈国勇, 等. 索拉菲尼联合雷帕霉素治疗肝癌肝移植术后肿瘤复发的疗效观察[J]. 中国现代医学杂志, 2015,25(2):56-9.
[4] Wang Y, Wang C M, Jiang Z Z, et al. MicroRNA-34c targets TGFB-induced factor homeobox 2, represses cell proliferation and induces apoptosis in hepatitis B virus-related hepatocellular carcinoma[J]. Oncol Lett, 2015, 10(5):3095-102.
[5] 何金花, 黎毓光, 张 鹏, 等. 原花青素联合Apollon siRNA抑制肝癌HepG2细胞增殖及凋亡[J]. 安徽医药, 2013, 17(4):552-5.
[6] Yun T K, Lee Y S, Lee Y H, et al. Antcarcinogenic effect of Panax ginseng C.A. Meyer and identification of active compounds[J]. J Korean Med Sci, 2001, 12(16): 6-18.
[7] Junmin S,Hongxiang L,Zhen L, et al. Ginsenoside Rg3 inhibits colon cancer cell migration by suppressing nuclear factor kappa B activity[J]. J Tradit Chin Med,2015, 35(4):440-4.
[8] Guan N,Huo X,Zhang Z, et al. Ginsenoside Rh2 inhibits metastasis of glioblastoma multiforme through Akt-regulated MMP13[J]. Tumour Biol,2015, 36(9):6789-95.
[9] 张树臣.中国人参[M]. 上海:上海科技教育出版社,1992:93.
[10]王本祥.人参的研究[M]. 北京:科学技术出版社,1984:1-101.
[11]Quan K, Liu Q, Wan J Y, et al. Rapid preparation of rare ginsenosides by acid transformation and their structure-activity relationships against cancer cells[J]. Sci Rep, 2015, 16(5):8598-604.
[12]Park C, Jeong J S, Jeong J W, et al. Ethanol extract of Kalopanax septemlobus leaf induces caspase-dependent apoptosis associated with activation of AMPK in human hepatocellular carcinoma cells[J]. Int J Oncol, 2016, 48(1):261-70.
[13]刘郁东, 郑启新, 吴宏斌, 等. 雷帕霉素对不同肿瘤Bax/Bcl-2和活性caspase-3表达的影响[J]. 肿瘤, 2013, 33(2):138-43.
Effect of ginsenoside Rk3 on apoptosis of HepG2
Fan Jie1,2,3, Zhang Lei1,2, Wang Xiao4
(1SchoolofPharmacy,AnhuiMedicalUniversity,Hefei230032;2AnhuiProvincialKeyLaboratoryofNatureMedicines,Hefei230032;3PharmaceuticalPreparationSection,TonglingPeople’sHospital,Tongling244000;4DeptofRadiology,TheFirstAffiliatedHospitalofAnhuiMedicalUniversity,Hefei230022)
ObjectiveTostudytheeffectofginsenosideRk3onapoptosisofHepG2.MethodsTumorbearingmice model of liver cancer was prepared inoculating HepG2 cells in axilla of nude mice subcutaneously. The nude mice were grouped into saline group, ginsenoside Rk3 (25, 50 ,100 mg/kg) group and 5-Fu (20 mg/kg) groupinvivo. And the HepG2 cells were divided into normal group, ginsenoside Rk3(20, 40, 80 μmol/L) group and 5-Fu(50 μg/ml) groupinvitro. The inhibition rate of HepG2 cells was evaluated by MTT assay. The apoptosis distribution of HepG2 cells was detected by flow cytomtric analysis. The mRNA expressions of Bax, Bcl-2, cleaved- Caspase-3, DR4 and DR5 in HepG2 cells were detected by RT-PCR. The protein expressions of Bax, Bcl-2 cleaved-Caspase-3, DR4 and protein in HepG2 cells were observed by Western blot.ResultsGinsenoside Rk3(100 mg/kg) significantly inhibited tumor weight(P<0.05). Ginsenoside Rk3(20, 40 and 80 μmol/L) significantly inhibited the proliferation and induced apoptosis in HepG2 cells. Ginsenoside Rk3(20, 40 and 80 μmol/L) significantly increased Bax, cleaved-Caspase-3 DR4 expression and DR5 mRNA and protein, reduced the expression of Bcl-2 mRNA and protein. The difference was statistically significant.ConclusionGinsenoside Rk3 can induce apoptosis of HepG2 cells possibly through the DR4 and DR5.
ginsenoside Rk3; HepG2; apoptosis
国家自然科学基金青年科学基金项目(编号:81100302);安徽高校省级自然科学研究重点项目(编号:KJ2014A124)
1安徽医科大学药学院,合肥 2300322安徽省天然药物活性成分研究重点实验室,合肥 2300323铜陵市人民医院药剂科,铜陵 2440004安徽医科大学第一附属医院放射科,合肥 230022
范 洁,女,主管药师,硕士研究生; 张 磊,女,副教授,硕士生导师,责任作者,E-mail:zhangl@ahmu.edu.cn; 王 啸,男,博士,副主任医师,责任作者,E-mail:hfwangxiao@aliyun.com
时间:2016-10-12 13:23:00
http://www.cnki.net/kcms/detail/34.1065.R.20161012.1323.011.html
R -332; R 735.7
A
1000-1492(2016)11-1604-05
10.19405/j.cnki.issn1000-1492.2016.11.011
2016-06-10接收

