基于微囊细胞耦合发酵生产Nisin泡沫分离条件的研究
贺小贤,胡瑾,魏洁茹,刘望,宇文亚焕
(陕西科技大学食品与生物工程学院,陕西西安710021)
基于微囊细胞耦合发酵生产Nisin泡沫分离条件的研究
贺小贤,胡瑾,魏洁茹,刘望,宇文亚焕
(陕西科技大学食品与生物工程学院,陕西西安710021)
研究嗜热乳链球菌(Streptococcus thermophilus)6032海藻酸盐-壳聚糖-海藻酸盐(ACA)液芯微囊细胞发酵生产Nisin泡沫分离的影响因素,探索最佳分离条件。在单因素试验的基础上,以Nisin富集比作为评价指标,采用正交试验对泡沫分离Nisin的条件进行优化。结果表明,通气速率和泡沫层高度是影响分离效果的显著因素。为获得较多的Nisin,且不影响发酵,同时兼顾分离效果,确定最佳分离条件为:分离pH值为6,泡沫层高11 cm,通气速率为0.15 L/min,分离时间60 min。在该最佳条件下,Nisin回收率为83.89%,Nisin富集比为8.4,细胞富集比为0.221。
嗜热链球菌;微囊细胞;ACA液芯;Nisin;泡沫分离
嗜热乳链球菌(Streptococcus thermophilus)6032 ACA液芯微囊细胞具有发酵生产Nisin的能力。Nisin的生产效率除与微囊细胞特征、发酵培养基的组成有关外,更重要的是提取和分离的效果。Nisin是一种小分子多肽物质,许多学者对其分离进行研究,胡滨等[1]对阳离子交换树脂D113吸附、解吸Nisin的特性进行了研究,并进一步研究了其吸附的动力学和热力学。徐浩等[2]对吸附分离耦合发酵进行研究,在发酵过程中加入树脂,提高乳链菌素效价达54%。彭光杰[3]研究不同类型树脂动态和静态的吸附效果,并对树脂类型进行筛选,吸附率可达70%。刘立毅等[4]不仅从5种树脂中筛选出性能较好的HZM-3树脂用于吸附Nisin Z,且Nisin总回收率可达到71.39%。郭凯敏等[5]对补料发酵泡沫分离进行研究。刘伟[6]对发酵泡沫耦合生产工艺进行研究,均提高了Nisin的总效价,同时研究了Ca2+和乙醇对耦合发酵的影响。结果表明,Ca2+可刺激菌体从而提高Nisin生产能力。刘云菲等[7]研究了气速、温度、分布器孔径对空气泡沫分离Nisin的影响,结果表明随着通气速度的增加,Nisin的富集率减低,失活严重,回收的情况则反之。薛建伟等[8]对CO2分离Nisin进行了研究,表明在装液量为800 mL、气速为100 mL/min、pH 2.5的条件下,与空气泡沫分离相比,CO2泡沫分离的收率高了14%,富集比高了1.5,分离时间缩短1 h。NICORESCU I等[9-10]研究显示,pH、离子强度对蛋白质类物质分离有影响。这些研究均基于游离细胞的发酵,而对嗜热乳链球菌ACA液芯微囊细胞发酵泡沫分离研究报道较少。基于此,本研究在嗜热乳链球菌(Streptococcus thermophilus)6032液芯微囊发酵的基础上,采用正交试验设计,以细胞富集比、Nisin的富集比、Nisin回收率为评价指标,对泡沫分离的条件进行优化,目的是提高分离微囊细胞耦合发酵生产Nisin的收率。
1 材料与方法
1.1 材料与试剂
嗜热乳链球菌(Streptococcus thermophilus)6032海藻酸盐-壳聚糖-海藻酸盐(alginate-chitosan-alginate,ACA)液芯微囊、金黄色葡萄球菌(Staphylococcus aureus):本实验室保存并制备。
MRS培养基:酪蛋白胨10 g/L,牛肉粉10 g/L,酵母浸粉5 g/L,葡萄糖5 g/L,乙酸钠5 g/L,柠檬酸氢二铵2 g/L,吐温80 1 mL/L,K2HPO42 g/L,MgSO4·7H2O 0.02 g/L,MnSO4·H2O 0.05 g/L,琼脂粉15 g/L,蒸馏水1 L,pH 6.8。
效价检测菌发酵培养基:酪蛋白胨10g/L,牛肉粉10 g/L,酵母浸粉5 g/L,葡萄糖5 g/L,乙酸钠5 g/L,柠檬酸氢二铵2g/L,吐温80 1 mL/L,K2HPO42 g/L,MgSO4·7H2O 0.02 g/L,MnSO4·H2O 0.05 g/L,蒸馏水1 L,pH 6.8。
效价检测培养基:组分同效价检测菌发酵培养基,加琼脂粉15 g/L,pH 6.8。
蛋白胨、葡萄糖、酵母浸粉、琼脂粉、磷酸氢二钠、氯化钠等(均为生化试剂或分析纯):北京奥博星生物技术有限公司。
1.2 仪器与设备
HL-2恒流泵:上海驰唐电子有限公司;pH-3C酸度计:上海康仪仪器有限公司;VD650HD超净工作台:上海苏净实业有限公司;YP3102电子天平:上海光正医疗器械有限公司;YXQ-SG46-280SA电热压力蒸汽灭菌器:上海中安电子信息科技有限公司;空气压缩机:广东海利有限公司;MJ-250生化培养箱:郑州宏朗仪器设备有限公司;SZK-750光栅分光光度计:上海精密科学仪器有限公司。
1.3 方法
1.3.1 种子培养
将活化菌种接入经高压灭菌后的种子培养基中,在35℃条件下,培养12 h,菌体浓度为6.7×109CFU/mL。
1.3.2 ACA液芯微胶囊的制备及发酵
ACA液芯微囊发酵生产Nisin,按文献[11]进行。将制备好的乳酸菌ACA液芯微囊,以接种量5.0%接入到灭菌好的一定pH值发酵培养基中,放入培养箱,在一定温度下培养一定时间。
1.3.3 泡沫分离方法
(1)泡沫产生方式的研究
方式I:通过向发酵结束后的发酵液中通入无菌空气产生泡沫并对其进行收集,再分别测定发酵原液、泡沫分离液、剩余残液的效价。
方式II:通过向发酵结束后的发酵液中流加饱和的NaHCO3溶液,利用发酵过程中产生的副产物乳酸等酸性物质与其发生反应,生成CO2气体,收集CO2泡沫并测量其效价。
比较方式I和方式II两种方法的富集比、回收率的大小。
(2)泡沫分离条件优化的单因素试验
在泡沫层高度为10 cm,分离时间为60 min,分离温度为34℃,pH值为5,通气速率为0.15 L/min的基础上,对分离温度(28~38℃)、泡沫层高度(7~12 cm)、分离时间(30~90 min)、pH(3~7)和通气速率(0.10~0.40 L/min)进行单因素试验,分析各因素对泡沫分离Nisin的影响。
(3)泡沫分离条件的优化正交试验
根据单因素试验的结果,对pH(A)、泡沫层高(B)、通气速率(C)和分离时间(D)进行4因素3水平L9(34)正交试验,测定Nisin回收率、Nisin富集比、细胞富集比,确定泡沫分离的最佳条件。

表1 泡沫分离条件优化正交试验因素与水平Table 1 Factors and levels of orthogonal experiments for foam separation conditions optimization
1.3.4 分析测定方法
Nisin效价测定方法:琼脂扩散法[12-13];吸光度值OD600nm的测量:分光光度法;细胞生物量的测定:将样品的细胞干质量(x)和与其相应的OD600nm值(y)作图,拟合得到一条直线,获得直线回归方程为:y=6.070x+0.017 2,相关系数R2=0.996。
对发酵结束后的发酵液进行泡沫分离,以Nisin富集比(E)、Nisin回收率(R)和细胞富集比(C)对泡沫分离的效果进行评价并表征,其计算公式如下:
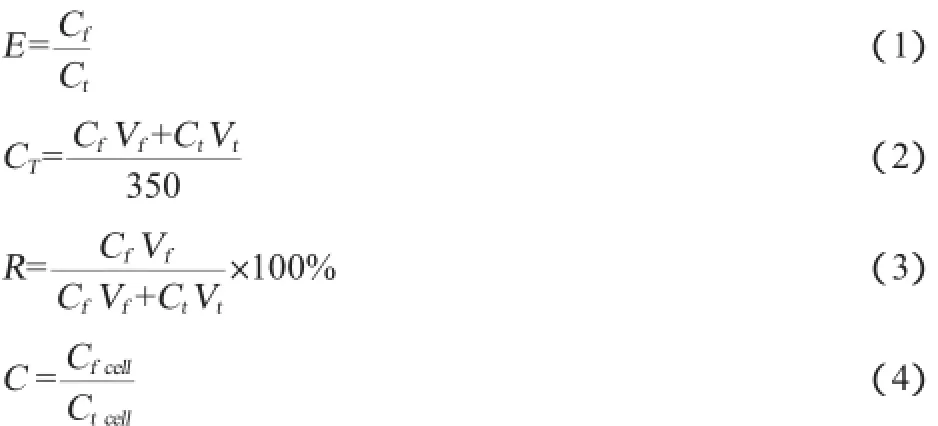
式中:Cf为泡沫液中的Nisin效价,IU/mL;Ct为发酵液中剩余的Nisin效价,IU/mL;CT为原发酵液中Nisin的效价,IU/mL;Vf为收集的泡沫液体积,mL;Vt为剩余发酵液的体积,mL;350为原发酵液的体积,mL;Cfcell为泡沫液中的细胞浓度,CFU/mL;Ctcell为细胞发酵液中的细胞浓度,CFU/mL。
2 结果与分析
2.1 泡沫产生方式的研究
2.1.1 对两种起泡方式比较分析
起泡方式的不同,会对微囊细胞耦合发酵生产Nisin产生影响,也对泡沫分离Nisin的效果有很大的影响,故需要选择合适的起泡方式。不同起泡方式产生泡沫的性能以及分离的效果,结果见表2,不同起泡方式下产生的泡沫的抑菌圈情况,结果见图1。

表2 两种泡沫分离效果的比较Table 2 Comparison of two kinds of foam separation effect
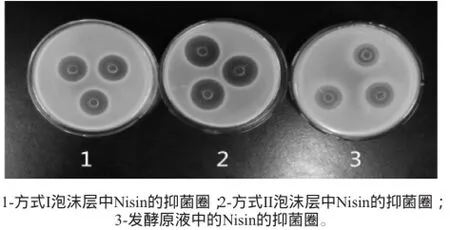
图1 不同情况下Nisin的抑菌圈比较Fig.1 Comparison of inhibition zone of Nisin under different conditions
由表2和图1可知,起泡方式II的泡沫更稳定性、Nisin的富集比、Nisin回收率以及效价(抑菌圈的直径与Nisin效价的对数值成正比关系,所以抑菌圈的直径越大,Nisin的效价越大)均高于方式I,但起泡较慢。为了使发酵系统有足够的泡沫溢出,达到泡沫分离Nisin的效果,通入NaHCO3溶液的时间相对要较长一些,这样大量的CO2不能及时溢出会容易造成气封,不利于菌体生长繁殖和代谢,影响发酵,且长时间通入NaHCO3饱和溶液,发酵液体积过大不适于耦合生产。方式I虽然效果差一些,但是考虑无菌空气对发酵液的化学性质影响较小,而且无菌空气来源方便,综合考虑,采用通入无菌空气的起泡方式,有利于发酵的正常进行,更适于耦合发酵。
2.1.2 通入空气对微囊发酵的影响
为了考察空气对微囊细胞发酵生产Nisin的影响,在发酵pH值控制为6.0时,不同时期通入一定量的无菌空气。试验从发酵的第4小时开始至第20小时(Nisin的效价最高时),每隔2 h、以气速为0.05 L/min,通气5 min。从第10小时开始每隔2 h取样,并对起泡分离液中的Nisin的效价进行检测,与不通气状态相比,结果见图2。
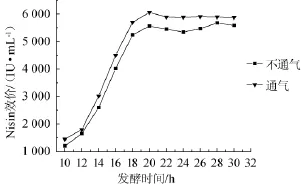
图2 通气与不通气时微囊化发酵Nisin的比较Fig.2 Comparison of microcapsule fermentation of Nisin in aeration and stuffiness
由图2可知,发酵时间在10~30 h时,通气和不通气两种情况下Nisin的效价变化趋势基本相同。在10~20 h时,发酵产物处于迅速的积累时期;在发酵时间>20 h后,Nisin效价趋于稳定。与不通气发酵相比,通气发酵时,微囊细胞发酵产生的Nisin效价略高一些,表明通入一定量的空气对微囊细胞发酵生产Nisin没有不利的影响,适量的空气对Nisin效价的提高有一定的促进作用。因此,间歇通入一定量的无菌空气,可以达到泡沫分离的效果。
2.2 不同因素对Nisin泡沫分离效果的影响
2.2.1 分离温度对Nisin泡沫分离的影响
分离温度对泡沫分离Nisin具有一定的影响。发酵液的黏度影响泡沫的性能,随着分离温度的增加,溶液的黏度降低,Nisin在泡沫中的吸附阻力下降,加上分子的热运动,吸附率会加快,同时,又使Nisin分子间的亲和力下降,导致泡沫不稳定、破裂、富集液体积下降,进而影响泡沫的性能。所以,分离温度越高,气泡越大,液膜厚度变薄,泡沫液体积分率相对减少,持气率相对增加,Nisin富集比增加,但分离温度过高,泡沫的稳定性降低,容易破裂,难以实现在线分离Nisin且对菌体细胞生长不利。不同分离温度的泡沫分离实验,结果见图3。
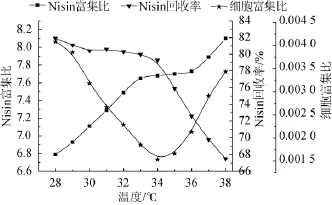
图3 分离温度对Nisin泡沫分离的影响Fig.3 Effect of separation temperature on Nisin foam separation
由图3可知,分离温度在28~38℃时,随着分离温度的升高,Nisin的富集比增大;Nisin回收率在28~34℃时,回收率缓慢下降,在分离温度>34℃时,回收率急剧下降;菌体细胞富集比随着温度的升高,先减少后增大,在分离温度为34℃时,细胞富集比最小,泡沫将细胞微囊带出发酵体系的量最少,有利于细胞微囊持续发酵。此外,考虑到耦合发酵生产Nisin时,发酵与分离同时进行,分离温度不仅影响Nisin的分离效果,更会影响菌体细胞的生长。因此,确定最佳分离温度为34℃。
2.2.2 泡沫层高对Nisin泡沫分离的影响
泡沫层高度对泡沫分离的影响,主要是通过改变泡沫停留时间、泡沫排水量,进而对富集比和回收率产生影响[14]。泡沫层高度高,使其含水量减少,富集比增大,但回收率减小;反之泡沫层高度低,其含水量大,富集比较少,回收率增大,但起不到较好的分离效果。泡沫层高对泡沫分离发酵液中Nisin的影响,结果见图4。

图4 泡沫层高对Nisin泡沫分离的影响Fig.4 Effectof foam layer height on Nisin foam separation
由图4可知,泡沫层高度在7~12 cm时,随着泡沫层高度的增加,Nisin富集比一直增大;泡沫层高度在7~10 cm,Nisin回收率随着泡沫层高度的增加而增大,并在泡沫层高度为10 cm时,Nisin回收率达到最大值,泡沫层高度>10 cm之后,Nisin回收率也随之下降;而细胞富集比随着泡沫层高度的增加而下降,可能是泡沫层越高泡沫壁越薄,不利于微囊细胞吸附,降低微囊细胞离开发酵体系的比率,利于其持续发酵。因此,选择最佳的泡沫层高度为10 cm。
2.2.3 分离时间对Nisin泡沫分离的影响
分离时间对泡沫分离的影响主要是通过改变泡沫液的体积而影响泡沫分离的效果。分离时间长,Nisin回收率高;但同时会使溶氧量增大,对菌体细胞微囊的影响可能会越大。反之,分离时间短,Nisin回收率低。泡沫分离时间对分离效果的影响试验结果见图5。
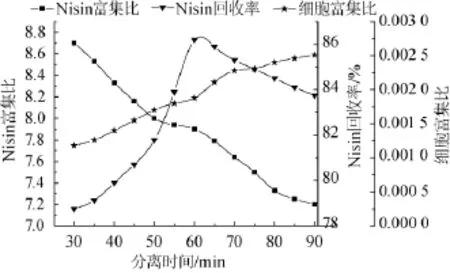
图5 分离时间对Nisin泡沫分离的影响Fig.5 Effect of separation time on Nisin foam separation
由图5可知,分离时间在30~90 min时,随着泡沫分离时间的延长,Nisin的富集比降低;而Nisin回收率在分离时间30~90 min内先增加后下降,并在第60分钟时有最大值出现;同时微囊细胞的富集比在分离时间30~90 min内,随时间延长逐渐增大,可能的原因是随着发酵液中Nisin浓度的较少,起泡性较差,泡沫量越少,微囊菌体细胞被带出的速度和量较少。因此,选择最优的分离时间为60 min。
2.2.4 pH对Nisin泡沫分离的影响
pH值影响Nisin泡沫分离的效果,当pH接近Nisin的等电点时,泡沫对Nisin的吸附作用越强[15]。pH变化可改变发酵液体系中的离子强度,进而影响发酵体系的表面张力和泡沫的稳定性。所以对pH进行研究,对微囊细胞发酵泡沫分离Nisin有一定的意义。pH影响分离效果的试验结果见图6。
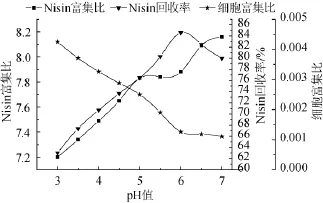
图6 pH对Nisin泡沫分离的影响Fig.6 Effect of pH on Nisin foam separation
由图6可知,pH值为3~7时,随着pH增大,Nisin的富集比也随着增大,当pH值越大,Nisin在发酵液中的溶解度越小,越利于其吸附在泡沫上;对Nisin回收率而言,随着pH值的增大,先呈上升趋势后又下降,并在pH值为6.0时,Nisin回收率最大;细胞富集比与pH值的变化成反比,在pH值为6.0时,细胞富集比为最小,这个pH正好是嗜热乳链球菌6032的ACA微囊细胞生长、繁殖的最适pH值。因此,确定最佳的泡沫分离pH值为6。
2.2.5 通气速率对Nisin泡沫分离的影响
通气速率对微囊细胞的破损、Nisin的富集比和回收率都会产生影响。通气速率大,虽可缩短分离时间,减少发酵液中Nisin的浓度,提高回收率,但泡沫含水量增加,会使得Nisin富集比有所降低,同时较大的通气速率,会将更多的微囊细胞带出发酵体系,分离液中细胞富集比增大,不利于后续的发酵生产。通气速率小,虽然不易将细胞微囊带出发酵体系,利于持续的发酵生产,Nisin富集比增大,但是发酵液中Nisin的浓度相对增大,回收率较低。通气速率对分离效果的试验结果见图7。
由图7可知,通气速率在0.10~0.40 L/min时,随着通气速率的增大,Nisin富集比减少,Nisin回收率缓慢增加;但对菌体细胞富集比,在通气速率0.10~0.15L/min时,细胞富集比不变,通气速率>0.15L/min之后,通气速率的增加,细胞富集比迅速增大。因此,选择最适的通气速率为0.15 L/min。
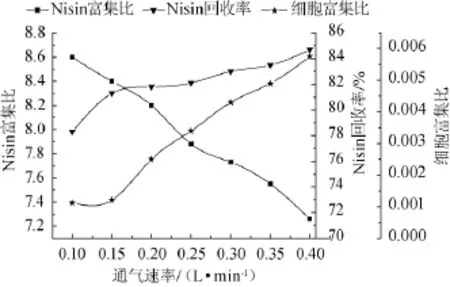
图7 通气速率对Nisin泡沫分离的影响Fig.7 Effect of aeration rate on Nisin foam separation
2.3 正交试验法优化Nisin泡沫分离条件
在固定泡沫分离温度34℃的条件下,根据单因素试验的结果,采用正交试验优化泡沫分离的适宜条件,以pH(A)、泡沫层高(B)、通气速率(C)和分离时间(D)为试验因子,每个因素取3个水平,以Nisin的富集比为评价指标,试验结果与分析见表3,方差分析见表4。
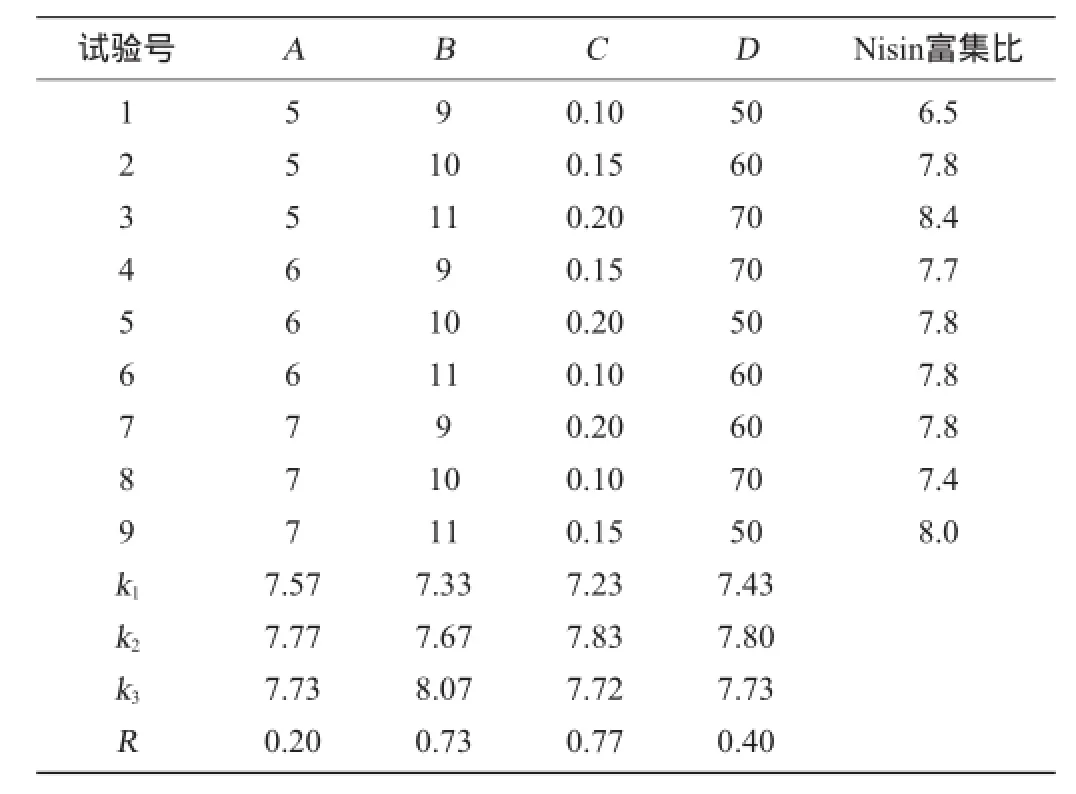
表3 泡沫分离条件优化正交试验结果与分析Table 3 Results and analysis of orthogonal experiments for foam separation conditions optimization
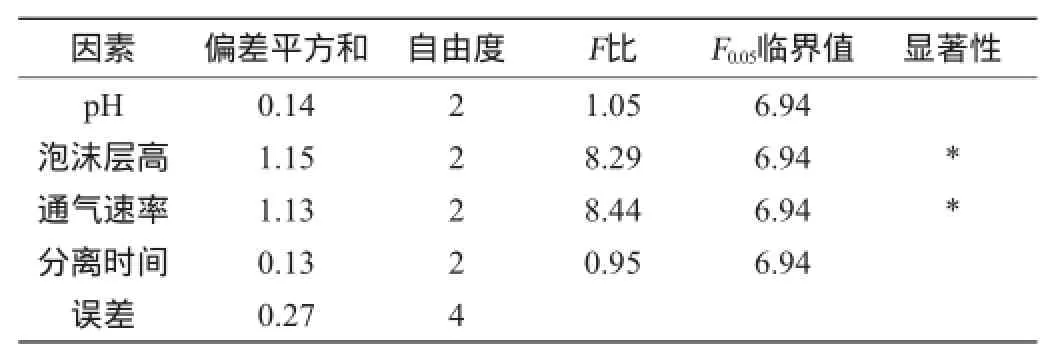
表4 正交试验结果方差分析Table 4 Variance analysis of orthogonal experiments results
由表3得知,以Nisin的富集比作为考察指标,4个因素影响的主次顺序为通气速率(C)>泡沫层高(B)>分离时间(D)>pH值(A),从均值获得较好的组合为A2B3C2D2,在此最佳分离条件下进行3次平行验证试验,得到回收率为83.89%、Nisin富集比为8.4、细胞富集比为0.221。由表4可知,泡沫层高和通气速率为对结果影响显著(P<0.05),pH和分离时间对结果影响不显著(P>0.05)。
3 结论
作为一种具有起泡性能良好的肽类物质Nisin,可以通过泡沫分离法进行在线分离。考虑耦合发酵的实际情况,方式I更适合于泡沫分离技术产生气泡,即采用间歇通入无菌空气产生气泡,使发酵液中的Nisin被气泡携带,随着气泡溢出,达到分离的效果。
在单因素试验基础上,通过正交试验结果的极差分析以及方差分析,表明通气速率和泡沫层高度是主要的影响因素,其他为次要影响因素。基于耦合发酵的目的,以不影响发酵为原则,同时兼顾分离效果,选定合适泡沫分离条件为分离pH值为6,泡沫层高度为11 cm,通气速率为0.15 L/min、分离时间为60 min,在该最佳条件下,Nisin回收率为83.89%,Nisin的富集比为8.4、细胞富集比为0.221。
[1]胡滨,王晖,赵艳丽,等.离子交换树脂分离发酵液中乳链菌肽工艺[J].离子交换与吸附,2008,24(4):313-329.
[2]徐浩,吴兆亮,殷昊,等.发酵吸附分离耦合生产乳酸链球菌素工艺[J].高分子材料科学与工程,2010,26(10):156-158.
[3]彭光杰.树脂吸附发酵分离耦合生产乳链菌肽的研究[D].西安:陕西科技大学,2015.
[4]刘立毅,宁方红,徐环昕,等.乳酸链球菌素Z纯化脱色小试工艺研究[J].离子交换与吸附,2014,5(5):429-437.
[5]郭凯敏,崔小颖,张达.补料分批发酵泡沫分离耦合对乳链菌肽生产的影响[J].食品与发酵工业,2013,39(3):22-26.
[6]刘伟.泡沫分离发酵耦合生产乳链菌肽工艺初探[D].天津:河北工业大学,2010.
[7]刘云菲,胡滨,吴兆亮.泡沫分离发酵液中乳链菌肽的工艺和活性研究[J].河北工业大学学报,2012,41(5):56-60.
[8]薛建伟,刘晓光,张艳,等.二氧化碳用于Nisin浓缩分离的研究[J].中国食品添加剂,2011(5):134-138.
[9]NICORESCU I,LOISEL C,VIAL C,et al.Combined effect of dynamic heat treatment and ionic strength on the properties of whey protein foams-PartII[J].Food Res Int,2008,41(2):980-988.
[10]ZHANG Z,DALGLEISH D G,GOFF H D.Effect of pH and ionic strength on competitive protein adsorption to air/water interfaces in aqueous foams made with mixed milk proteins[J].Colloid Surface B, 2004,34(2):113-121.
[11]贺小贤,宇文亚焕,尹宁,等.影响乳酸菌液芯微囊发酵性能的制备工艺研究[J].陕西科技大学学报,2015,33(6):132-137.
[12]张国只,陈林海,杨天佑,等.琼脂扩散法测定乳链菌肽效价的优化[J].食品科学,2003,24(9):103-106.
[13]ZHANG G Z,CHEN L H,YANG T Y.Optimization of determination of Nisin byagar diffusion method[J].Food Sci,2007,28(3):176-178.
[14]钱少瑜,李雪良,吴兆亮,等.泡沫分离过程中泡沫层总高度对持液率的影响[J].高校化学工程学报,2009,23(3):543-546.
[15]宇文亚焕.嗜热链球菌微囊化发酵分离耦合生产Nisin的研究[D].西安:陕西科技大学,2016.
Optimization of foam separation conditions of Nisin production by coupling fermentation based on microcapsule cells
HE Xiaoxian,HU Jin,WEI Jieru,LIU Wang,YUWEN Yahuan
(School of Food and Biological Engineering,Shaanxi University of Science and Technology,Xi'an 710021,China)
The influence factors of Nisin foam separation by alginate-chitosan-alginate(ACA)liquid-core microcapsule cell ofStreptococcus thermophiles6032 and the optimal separation conditions were researched.On the basis of single factor experiments,using the Nisin enrichment ratio as the evaluation index,the conditions of Nisin foam separation were optimized by orthogonal experiments.The results showed that aeration rate and the foam layer height were the significant factors affecting separation effect.In order to obtain more Nisin but not affect the fermentation and good separation effect,the optimal separation conditions were separation pH 6,the foam layer height 11 cm,aeration rate 0.15 L/min,separation time 60 min. Under the optimal conditions,the recovery rate of Nisin was 83.89%,the Nisin enrichment ratio was 8.4,cell enrichment ratio was 0.221.
Streptococcus thermophilus;microcapsule cell;ACA liquid-core;Nisin;foam separation
TQ920.1
0254-5071(2016)11-0088-05
10.11882/j.issn.0254-5071.2016.11.018
2016-07-28
陕西省教育厅自然科学专项科研计划项目(14JK1089)
贺小贤(1962-),女,教授,硕士,研究方向为发酵工程、生物化工。

