甘肃玉米大斑病菌对吡唑醚菌酯的敏感性监测分析
杨凤珍,郭建国,杜 蕙,王春明,郭 成,金社林,王生荣
(1.甘肃农业大学 草业学院,兰州 730070;2.甘肃省农业科学院 植物保护研究所,兰州 730070)
甘肃玉米大斑病菌对吡唑醚菌酯的敏感性监测分析
杨凤珍1,2,郭建国2,杜 蕙2,王春明2,郭 成2,金社林2,王生荣1
(1.甘肃农业大学 草业学院,兰州 730070;2.甘肃省农业科学院 植物保护研究所,兰州 730070)
为明确甘肃玉米大斑病菌对吡唑醚菌酯的敏感基线和抗药性水平,采用平皿法测定甘肃省4个典型生态区57株玉米大斑病菌对吡唑醚菌酯的敏感性。结果表明,甘肃玉米大斑病菌对吡唑醚菌酯的敏感性差异较小,EC50为0.10~1.56 mg/L,EC50平均值为0.66 mg/L,49株菌株EC50连续性正态分布时的EC50平均值 0.61 mg/L即为甘肃玉米大斑病菌对吡唑醚菌酯的敏感基线;基于此发现,甘肃玉米大斑病菌对吡唑醚菌酯的平均抗性为1.08,最高抗性为2.55,暂未出现抗药性,其中中部干旱雨养生态区5株菌株十分敏感,平均抗性和最高抗性分别为0.84和1.11,而河西干旱灌溉生态区15株菌株敏感性较低,平均抗性和最高抗性分别为1.23和2.55,需警惕其抗药性。
玉米大斑病菌;吡唑醚菌酯;敏感性
玉米大斑病(Northern Corn Leaf Blight)是中国北方春玉米区的一种严重叶枯病害,一般发病年份减产20%左右,严重年份减产50%以上,发病时可加重玉米根病流行,严重影响玉米的产量和品质。国内外研究表明,玉米大斑病菌具有明显生理分化现象[1],小种变异是品种抗性丧失的主要原因[2]。Strobilurins类杀菌剂[3]是防治该病害化学防治的一种重要手段,其是在研究天然活性物质嗜球果伞菌素结构和作用机理基础上发现的单点β-甲氧基丙烯酸酯类杀菌剂[4],因其不易与其他类杀菌剂产生交互抗性而成为新型农药开发研究的热点[5]。吡唑醚菌酯(Pyraclostrobin)是该类杀菌剂的典型代表,由巴斯夫公司于2002年开发,目前已广泛应用于玉米叶部病害防治[6]。有研究显示,吡唑醚菌酯已对尾孢属(Cercospora)[7]、葡萄孢属(Botrytis)[8]和核盘菌属(Sclerotinia)[9]等15属20余种病原菌普遍产生抗药性,但有关其对玉米大斑病菌敏感性监测方面的研究暂未见报道。甘肃省是中国西部内陆省份,由东南向西北降雨量依次递减,气候呈现东南湿润、中部干旱和西北高寒的特征[10],玉米种植形成了河西制种与河东高产栽培的两翼结构,中东部和南部中、晚熟玉米种植数量较多,生育期偏长。环境条件多样和物候期延长为玉米大斑病害发生提供了良好环境,致使玉米叶部病原产孢量增加,变异速率加快,侵染循环周期缩短,发生普遍率和严重度日益增加,已严重影响甘肃玉米生产安全[11]。为此,本研究于2013-2014年采集甘肃河西干旱灌溉、中部干旱雨养、陇东半湿润半干旱和陇南湿润气候区的玉米大斑病标样,分离纯化后测定其对吡唑醚菌酯的敏感性,旨在明确甘肃玉米大斑病菌对吡唑醚菌酯的敏感基线和抗性水平,为甘肃玉米大斑病科学防治提供参考依据。
1 材料与方法
1.1 材 料
供试菌株:2013-2014年采集甘肃河西干旱灌溉农业区(酒泉、张掖和武威3市)、中部干旱雨养生态区(定西市)、陇东半湿润半干旱生态区(平凉、庆阳2市)和南部湿润生态区(天水、陇南2市)的玉米大斑病样,带回室内冲洗干净并晾干后,剪取病健交界处0.5 cm×0.5 cm叶片4~5块,用φ=75%酒精表面消毒2~3 min,灭菌水冲洗3~4次,灭菌滤纸吸水后置于PDA平板,25 ℃光照培养,待菌丝产孢后在显微镜下挑取单孢进行分离纯化,获得57株菌株,其中,从酒泉、张掖、武威和定西地区采集的病样中获得的菌株均为5株,天水、陇南地区样品中获得的菌株均为6株,平凉地区和庆阳地区样品中获得的菌株分别为8株和17株,各菌株均于4 ℃冰箱保存,备用。
药剂:将51.5 g吡唑醚菌酯原药(97.5%吡唑醚菌酯,巴斯夫欧洲公司生产)溶解于948.5 mL丙酮配制成50 g/L的近似饱和溶液,再将此药液稀释1 000倍配制成50 mg/L药液,备用。
马铃薯葡萄糖琼脂(Potato dextrose agar,PDA)培养基:马铃薯 2 kg、琼脂粉150 g、葡萄糖200 g,补水至10 L,分别量取995、990、980、960和920 mL培养基分装至2 000 mL三角瓶,加塞、包扎,121 ℃灭菌20 min,冷却后贮存,备用。
1.2 方 法
1.2.1 病菌敏感性测定 采用菌丝生长速率法[12]测定玉米大斑病菌对吡唑醚菌酯的敏感性,首先分别将995、990、980、960和920 mL PDA培养基加热融化、待冷却至45 ℃左右时,依次吸取50 mg/L药液5、10、20、40和80 mL 加入到三角瓶配制成0.25、0.5、1.0、2和4 mg/L的含吡唑醚菌酯培养基,摇匀后倒入直径75 mm培养皿,以不含吡唑醚菌酯的等量丙酮PDA平板为溶剂对照,以等量清水PDA平板为空白对照。待培养基完全凝固后,用直径5 mm的打孔器在纯化培养的菌落边缘打取菌饼,单个菌碟菌丝面朝下贴于含药PDA平板中央,25 ℃光照培养6 d,第7 天采用十字交叉法垂直测量记录各质量浓度下的菌落直径,计算出平均值。每质量浓度重复测定4次。
1.2.2 病菌抗性分析 依据不同质量浓度下菌落直径,计算各处理浓度对菌丝的生长抑制率。计算公式:D=D1-D2,D为菌落增长直径,D1为菌落直径,D2为菌饼直径;I=(D0-Dt0-Dt)/D0×100,I为处理菌丝生长抑制率,D0为空白对照菌落增长直径,Dt0为溶剂对照菌落增长直径,Dt为药剂处理菌落增长直径。采用DPS 3.01软件的数量型数据机值分析法对各质量浓度对数值和菌丝生长抑制率进行回归分析,计算回归方程、相关系数、EC50及95%置信区间,获得57株菌株的EC50。采用SPSS Statistic 19.0软件对EC50进行分布频率直方图正态性检验分析,依据偏度与其标准误和峰度与其标准误计算偏度系数(Sk=|g1/σg1|)和峰度系数(Ku=|g2/σg2|)进行T检验,2种检验的Sk和Ku
2 结果与分析
2.1 甘肃玉米大斑病菌对吡唑醚菌酯的敏感基线
甘肃玉米大斑病菌对吡唑醚菌酯的敏感性差异较小,EC50为0.10~1.56 mg/L,57株病菌的EC50平均值为0.66 mg/L,其中,最敏感菌株为天水清水红堡Tsqshb-1-2,最不敏感菌株为酒泉肃州清水镇Jqszqs-1(表1)。正态性检验表明,57株病菌的EC50呈现偏正态非连续性分布(图1),曲线平缓[g1=0.82>0,σg1=0.32,Sk=2.58>T0.05=1.96(P<0.05);g2=1.27>0,σg2=0.62,Ku=2.04>T0.05=1.96(P<0.05)],表明甘肃玉米大斑病菌对吡唑醚菌酯的敏感性存在一定分化;49株菌株的EC50呈现连续性正态分布(图2),曲线平缓[g1=0.17>0,σg1=0.34,Sk=0.50
2.2 甘肃玉米大斑病菌对吡唑醚菌酯的抗性水平
甘肃玉米大斑病菌对吡唑醚菌酯的EC50平均值、平均抗性和最高抗性的高低顺序依次为河西干旱灌溉生态区>南部湿润生态区>陇东半湿润半干旱生态区>中部干旱雨养生态区;57株病菌的平均抗性为1.08,最高抗性为2.55,全部属于敏感性菌株,暂未出现抗药性,其中,中部干旱雨养生态区玉米大斑病菌对吡唑醚菌酯十分敏感,EC50为0.32~0.68 mg/L, EC50平均值为0.51 mg/L,平均抗性为0.84,最高抗性为1.11,而河西干旱灌溉生态区菌株对吡唑醚菌酯的敏感性相对较低,EC50为0.34~1.56 mg/L,EC50平均值为0.75 mg/L,平均抗性为1.23,最高抗性为2.55(表2)。

表1 甘肃玉米大斑病菌对吡唑醚菌酯的敏感性
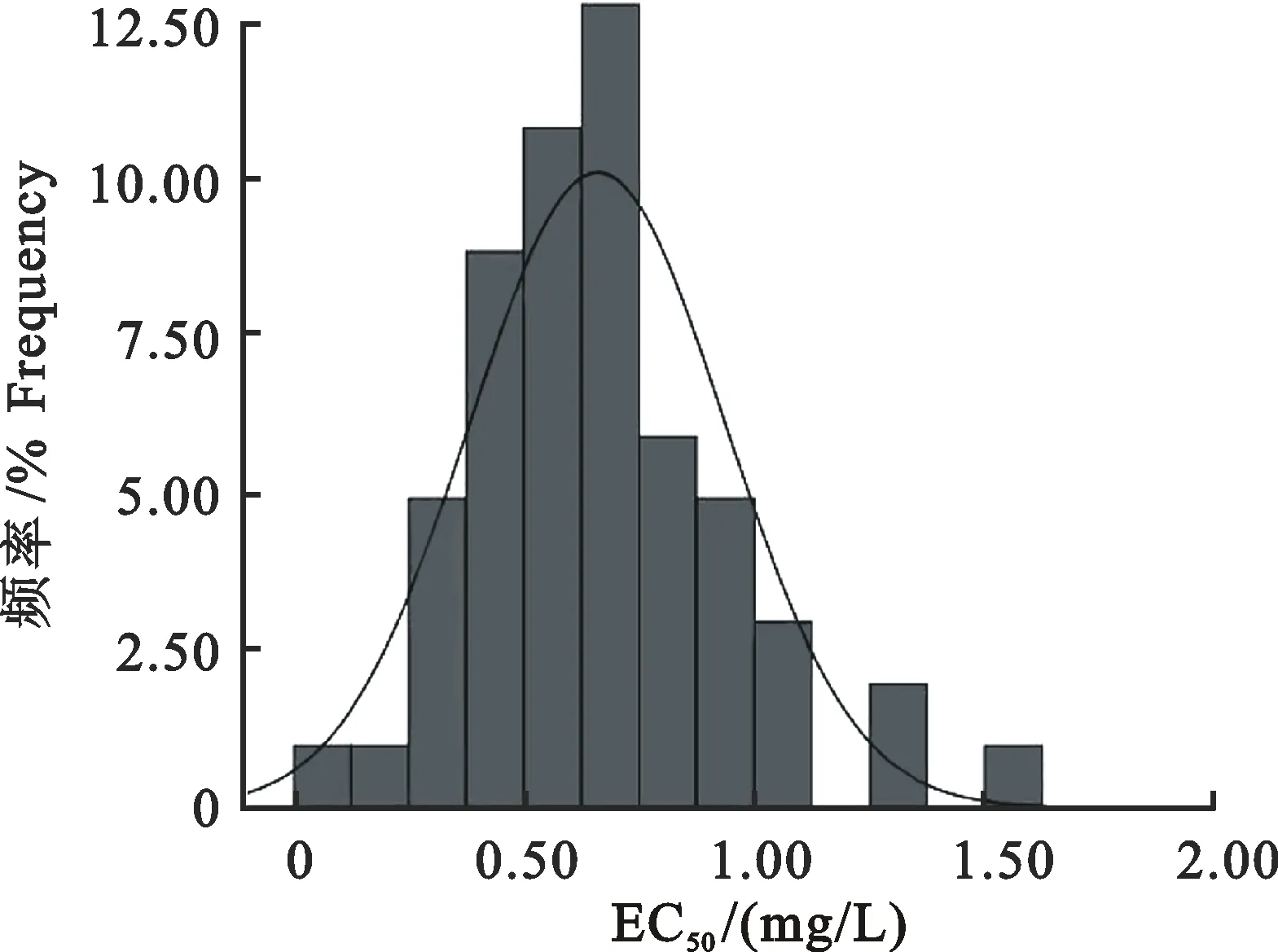
图1 57株病菌EC50非连续性正态分布

图2 49株菌株EC50连续性正态分布

表2 甘肃玉米大斑病菌对吡唑醚菌酯的抗性水平
3 结论与讨论
玉米大斑病是影响中后期产量形成的一种严重叶枯病害,主要危害叶片、叶鞘和苞叶,喇叭口前期喷雾施药防治技术是该病害化学防控的有效手段,而杀菌剂对病菌敏感性的监测是病害控制的前期基础工作,通常不同来源病原菌对同一种类杀菌剂的敏感性存在地理尺度差异性[14],这与本研究结果一致。本研究发现,甘肃57株玉米大斑病菌对吡唑醚菌酯的敏感性差异均较小, EC50为0.10~1.56 mg/L,其中,中部干旱雨养生态区5株病菌对吡唑醚菌酯十分敏感,平均抗性水平和最高抗性水平分别为0.84和1.11,而河西干旱灌溉生态区15株病菌对吡唑醚菌酯敏感性均较低,平均抗性水平和最高抗性水平分别为1.23和2.55,说明,甘肃玉米大斑病菌对Strobilurins类杀菌剂吡唑醚菌酯的敏感性具有显著地理尺度差异性。
有研究显示,EC50呈连续性正态分布时的EC50平均值可作为衡量杀菌剂对病害是否敏感的敏感基线[15],因此,本研究将49株菌株的EC50呈连续性正态分布时的EC50平均值0.61 mg/L作为甘肃玉米大斑病菌对吡唑醚菌酯的敏感基线。基于此发现,甘肃57株玉米大斑病菌对吡唑醚菌酯的平均抗性水平和最高抗性水平分别为1.08和2.55,全部属于敏感性菌株,无抗药性产生,这与本研究确定的敏感基线有关。本研究选择病原群体呈连续性正态分布时的EC50平均值为敏感基线,未将甘肃玉米大斑病菌对吡唑醚菌酯EC50最小值 0.10 mg/L视为敏感基线,基线水平较高,因此所有菌株表现为敏感菌株,这对甘肃玉米大斑病菌抗药性水平分布有一定的影响,但不影响它们对吡唑醚菌酯的敏感水平。因此,究竟是以病原群体对杀菌剂EC50的最小值为敏感基线还是以病原群体连续性正态分布时的EC50平均值为敏感基线还值得商榷,有待进一步分析研究。
病原对杀菌剂的敏感性降低是菌株抗药的外在表现形式,内在原因则是真菌对有毒化学物解毒代谢能力的增强。Strobilurins类杀菌剂可作用于真菌呼吸系统复合体Ⅲ细胞色素bcⅠ的Qo部位,通过阻止细胞色素b至c1的电子传递抑制真菌能量循环,而氨基酸残基位点突变则是其抗药的主要分子机制[16]。有研究显示,接触Strobilurins类杀菌剂后,植株的Cyt b基因129位点的苯丙氨酸可突变为亮氨酸[17]、137位点的甘氨酸可突变为精氨酸[18]和143位点的甘氨酸可突变为丙氨酸[19]。本研究仅在菌丝生物量水平对甘肃玉米大斑病菌对吡唑醚菌酯的敏感性进行监测分析,取得的阶段性研究成果需在分子水平进一步验证。
Reference:
[1]张明会,徐秀德,刘可杰,等.我国玉米大斑病菌生理分化及小种分布研究[J].玉米科学,2011,19(4):138-141.
ZHANG M H,XIU X D,LIU K J,etal.Physiological differentiation and races distribution ofExserhilumturcicumin China[J].JournalofMaizeSciences,2011,19(4):138-141(in Chinese with English abstract).
[2]王玉萍,王晓鸣,马青.我国玉米大斑病菌生理小种组成变异研究[J].玉米科学,2007,15(2):123-126.
WANG Y P,WANG X M,MA Q.Races ofExserohihumturcicum,causal agent of northern leaf blight in China[J].JournalofMaizeSciences,2007,15(2):123-126 (in Chinese with English abstract).
[3]SHAH D A,DILLARD H R.Managing foliar diseases of processing sweet corn in New York with strobilurin fungicides[J].PlantDisease,2010,94(2):213-220.
[4]金丽华,陈长军,王建新,等.嘧菌酯及SHAM对4种植物病原真菌的活性和作用方式研究[J].中国农业科学,2007,40(10):2206-2213.
JIN L H,CHEN CH J,WANG J X,etal.Activity of azoxystrobin and SHAM of four plant pathogens[J].ScientiaAgriculturaSinica,2007,40(10):2206-2213 (in Chinese with English abstract).
[5]詹家绥,吴娥娇,刘西莉,等.植物病原真菌对几类重要单位点杀菌剂的抗药性分子机制[J].中国农业科学,2014,47(17):3392-3404.
ZHAN J S,WU E J,LIU X L,etal.Molecular basis of resistance of phytopathogenic fungi to several site-specific fungicides[J].ScientiaAgriculturaSinica,2014,47(17):3392-3404 (in Chinese with English abstract).
[6]BLANDINO M,GALEAZZI M,SAVOIA W,etal.Timing of azoxystrobin + propiconazole application on maize to control northern corn leaf blight and maximize grain yield [J].FieldCropsResearch,2012,139(12):20-29.
[7]BRADLEY C A,PEDERSEN D K.Baseline sensitivity ofCercosporazeae-maydis to quinone outside inhibitor fungicides [J].PlantDisease,2011,95(2):189-194.
[8]YIN Y N,KIM Y K,XIAO C L.Molecular characterization of pyraclostrobin resistance and structural diversity of the cytochromebgene inBotrytiscinerea from apple[J].Phytopathology,2012,102(3):315-322.
[9]LIANG H J,DI Y L,LI J L,etal.Baseline sensitivity of pyraclostrobin and toxicity of SHAM toSclerotiniasclerotiorum[J].PlantDisease,2015,99(2):267-273.
[10]宋连春,杨兴国,韩永翔,等.甘肃气象灾害与气候变化问题的初步研究[J].干旱气象,2006,24(2):63-69.
SONG L CH,YANG X G,HAN Y X,etal.The primary study of meteorological disasters and climate change in Gansu Province[J].AridMeteorology,2006,24(2):63-69 (in Chinese with English abstract).
[11]李青青,郭满库,郭 成,等.甘肃玉米主要病害发生动态调查[J].植物保护,2014,40(3):161-164.
LI Q Q,GUO M K,GUO CH,etal.Occurrence dynamics of maize diseases in Gansu Province[J].PlantProtection,2014,40(3):161-164 (in Chinese with English abstract).
[12]中华人民共和国农业部.NY/T 1156.2-2006 农药室内生物生物测定试验准则 杀菌剂 第2部分:抑制病原真菌菌丝生长试验 平皿法[S].北京:中国标准出版社,2006.
Ministry of Agriculture of the People’s Republic of China.NY/T 1156.2-2006 Pesticides Guidelines for Laboratory Bioactivity Tests Parts 2:Petri Plate Test for Determining Fungicide Inhibition of Mycelia Growth[S].Beijing:China Standards Press,2006(in Chinese).
[13]王 丽,陈 鹏,周益林,等.2009年我国部分麦区小麦白粉菌群体对三唑酮和嘧菌酯的敏感性测定[J].植物病理学报,2011,41(6):654-658.
WANG L,CHEN P,ZHOU Y L,etal.Sensitivity ofBlumeriagraminisf.sp.triticiisolates to triadimefon and azoxystrobin in 2009 in China[J].ActaPhytopathologicaSinica,2011,41(6):654-658 (in Chinese with English abstract).
[14]YUAN S K,LIU X L,SI N G,etal.Sensitivity ofPhytophthorainfestansto flumorph:invitrodetermination of baseline sensitivity and the risk of resistance[J].PlantPathology,2006,55(2):258-263.
[15]LIANG H J,LI J L,DI Y L,etal.Logarithmic transformation is essential for statistical analysis of fungicide EC50values[J].JournalofPhytopathology,2015,163(6):456-464
[16]贾俊超,马 琳,范志金,等.病原菌对strobilurin类杀菌剂抗药性机理的研究进展[J].农药学学报,2008,10(1):1-9.
JIA J CH,MA L,FAN ZH J,etal.Progress on study of resistance mechanism of strobilurin fungicides[J].ChineseJournalofPesticideScience,2008,10(1):1-9(in Chinese with English abstract).
[17]ESTEP L E,ZALA M,ANDERSON N P,etal.First report of resistance to QoI fungicides in north American populations ofZymoseptoriatritici,causal agent of Septoria Tritici blotch of wheat [J].PlantDisease,2013,97(11):1511.
[18]KIM Y S,DIXON E W,VINCELLI P,etal.Field resistance to strobilurin (QoI) fungicides inPyriculariagriseacaused by mutations in the mitochondrial cytochrome b gene[J].Phytopathology,2003,93(7):891-900.
[19]SIEROTZKI H,FREY R,WULLSCHLEGER J,etal.Cytochrome b gene sequence and structure ofPyrenophorateresandP.tritici-repentisand implications for QoI resistance[J].PestManagementScience,2007,63(3):225-233.
(责任编辑:郭柏寿 Responsible editor:GUO Baishou)
Monitoring and Analyzing Sensitivity ofSetosphaeriaturcicato Pyraclostrobin in Gansu
YANG Fengzhen1,2,GUO Jianguo2,DU Hui2,WANG Chunming2,GUO Cheng2,JIN Shelin2and WANG Shengrong1
(1.College of Grassland Science,Gansu Agricultural University,Lanzhou 730070,China; 2. Institute of plant protection,Gansu Academy of Agricultural Sciences,Lanzhou 730070,China)
The sensitivity of 57 isolates ofSetosphaeriaturcicato pyraclostrobin on four typical ecological regions in Gansu was tested by Petri plate in order to determine their sensitive baseline and resistance factor.The results showed that the sensitivity ofS.turcicato pyraclostrobin in Gansu is little different,EC50range is 0.10-1.56 mg/L,mean EC50is 0.66 mg/L.The sensitive baseline ofS.turcicato azoxystrobin in Gansu is 0.61 mg/L only when normality test of EC50on 49 isolates ofS.turcicais continuously normal distribution.On the base of sensitive baseline,we find that the highest and mean resistance factor for 57 isolates to pyraclostrobin is respectively 2.55 and 1.08 in Gansu,and there is no resistance.5 isolates from rainfed dryland in Central is sensitive to pyraclostrobin,the highest and mean resistance factor for resistance to pyraclostrobin is respectively 1.11 and 0.84,as well as 15 isolates from irrigated dryland in Hexi is lowly sensitive to pyraclostrobin,the highest and mean resistance factor for resistance to pyraclostrobin is respectively 2.55 and 1.23,we need to be wary of the resistance.
Setosphaeriaturcica; Pyraclostrobin; Sensitivity
YANG Fengzhen,female,master student.Research area:phytopathology.E-mail:1078056640@qq.com
GUO Jianguo,male,master,associate research fellow.Research area:plant protection.E-mail:jguo1001@163.com
2015-11-04
2015-12-28 基金项目:国家十二五科技支撑计划(2012BAD19B04-11);甘肃省自然科学基金(145RJZA164);甘肃省农业科学院科技创新专项(2012GAAS07-3)。
杨凤珍,女,硕士研究生,从事植物病理学方面研究。E-mail:1078056640@qq.com
郭建国,男,硕士,副研究员,从事植物保护学研究。E-mail:jguo1001@163.com 王生荣,男,博士,教授,从事植物病理学方面研究。E-mail:wangsr@gsau.edu.cn
日期:2016-10-20
S432.4
A
1004-1389(2016)10-1548-06
WANG Shengrong,male,Ph.D,professor.Research area:plant protection.E-mail:wangsr@gsau.edu.cn
网络出版地址:http://www.cnki.net/kcms/detail/61.1220.S.20161020.1655.037.html
Received 2015-11-04 Returned 2015-12-28
Foundation item Key Projects in the National Science & Technology Pillar Program during the Twelfth Five-year Plan Period (No.2012BAD19B04-11); The Natural Science Foundation of Gansu Province (No.145RJZA164 ); Technological Innovation Foundation of Gansu Academy of Agricultural Sciences(No.2012GAAS07-3).

