盐碱土类型对花生种子萌发过程中种子际土壤菌群结构的影响
张 岱,杨吉顺,宋文武,丁 红,张冠初,李 瀚,刘国利,张智猛*,慈敦伟*
(1. 河北农业大学植物保护学院,河北 保定 071001; 2. 山东省花生研究所,山东 青岛 266100;3. 无棣县小泊头镇林业站,山东 无棣 251911)
盐碱土类型对花生种子萌发过程中种子际土壤菌群结构的影响
张 岱1,杨吉顺2,宋文武2,丁 红2,张冠初2,李 瀚2,刘国利3,张智猛2*,慈敦伟2*
(1. 河北农业大学植物保护学院,河北 保定 071001; 2. 山东省花生研究所,山东 青岛 266100;3. 无棣县小泊头镇林业站,山东 无棣 251911)
本研究以不同含盐量的滨海盐土、内陆盐碱土和中等肥力非盐碱土壤为实验对象,探讨花生种子在吸水膨胀与萌发过程中,不同类型盐碱土对种子际土壤微生物多样性变化的影响。本实验对不同土壤样品中细菌的16S rRNA基因的V3-V4区进行PCR扩增;利用高通量测序的方法对12份V3-V4高变区PCR产物进行测序,并对测序数据进行生物信息学分析。结果显示:(1)东营青坨滨海盐土种子际土壤细菌群落多样性大于聊城高唐内陆盐碱土花生种子际土壤细菌群落多样性。(2)不同类型土壤样本微生物群落结构在纲水平存在明显差异。4种土壤中的种子际细菌共分属于6个菌纲,分别为Proteobacteria、Actinobacteria、Actinobacteria、Bacteroidetes、Acidobacteria和Firmicutes菌纲,并均以Proteobacteria和Actinobacteria菌纲为主要菌纲。全样本菌落结构分析结果表明,4种类型土壤中不同吸胀时间内种子际微生物菌落在门、属水平上的类型和丰度差异最为显著(p<0.05)。(3)beta多样性分析和各样本遗传距离(phylogenetic distances)聚类树图分析表明,4个土壤类型的12个土壤样本种子际土壤中微生物群落均可聚为2大类。上述研究结果为盐碱地花生保全苗、促早发提供了重要的理论依据。
花生;盐碱土;种子萌发;种子际;细菌多样性;16S rRNA
种子萌发是一个复杂的多步骤过程,容易受到机械伤害、病害和环境胁迫的影响,也被认为是植物生活周期中最重要和最脆弱的阶段[1],环境变更或管理分异对土壤微域结构的影响以及微域环境对土壤微生物多样性的调控都是非常重要的因素[2]。“种子际”是指距离种子表面1~10 mm内受到种子萌发影响的区域[3],种子际固有微生物群落是种子微生物生态的重要组成部分,它们与种子萌发过程的分泌物和土壤微生物群落密切相关[3-4]。由于盐碱土壤的有机质含量、酸碱度、水分及土壤母质的不同,与此环境相适应的土壤微生物种类各异,加之盐碱胁迫危害,缺苗断垄是盐碱地作物生产中常见的现象,也是限制作物高产高效的重要制约因素。
花生属中等耐盐作物,苗全、苗齐是盐碱地花生高产高效的重要环节。花生种子较大,单粒种子约是小麦、玉米种子的18~45倍和2~6倍,是耐盐碱作物谷子、高粱种子的256~466倍和30~50倍,其萌发出苗历时长、吸水量大、种子与种子际土壤环境密切,开展盐碱土花生种子吸水萌发过程中种子际土壤微生物多样性、菌群结构和功能的研究具有重要意义。本试验以不同类型盐碱土壤和非盐碱土壤为对象,利用高通量测序技术直接从土壤中提取总DNA,构建细菌16S rRNA基因文库,对盐碱地花生种子吸水萌发过程中种子际土壤微生物的菌群结构比较分析,旨在为进一步了解盐碱土壤微生物多样性,并为盐碱地花生保全苗、促早发和建立盐碱地高产优质栽培技术规程提供理论依据。
1 材料与方法
1.1 土样采集
盐碱地土壤样品分别采自山东省东营市利津县汀罗镇毛坨村和垦利县青坨村,非盐碱土壤采自山东省花生研究所莱西试验站。其中山东省东营市利津县汀罗镇毛坨村和垦利县青坨村的土壤类型均为潮土、青岛莱西和聊城高唐土壤类型为褐土。各土壤样本盐分含量、有机质含量和pH值如表1。供试品种为大花生品种花育25号,百仁重102.5g。
将风干后的土壤过3 mm筛后分别装入高12 cm、内径10 cm同批次、同重量塑料盆,每盆装土量780g,每种土壤装15盆,之后每盆中浇入同等体积的水,使土壤含水量刚好控制在田间持水量范围内,人工气候室内自然蒸发至土壤含水量为60%~70%时进行播种。每盆播种10粒花生种子,每粒种子间距控制在1cm,播深一致控制在3cm。于播种后2h计为种子吸水膨胀开始并计时,分别于吸水膨胀24h、48h和72h采集种子际(种子0.5cm区域内)周围土壤样品,每次采集5盆即5个重复,将采集的5个重复的样品混匀,装入无菌袋中,置于-20°C冰箱保存备用。低温保存土壤样品由北京诺赛基因公司进行测定。
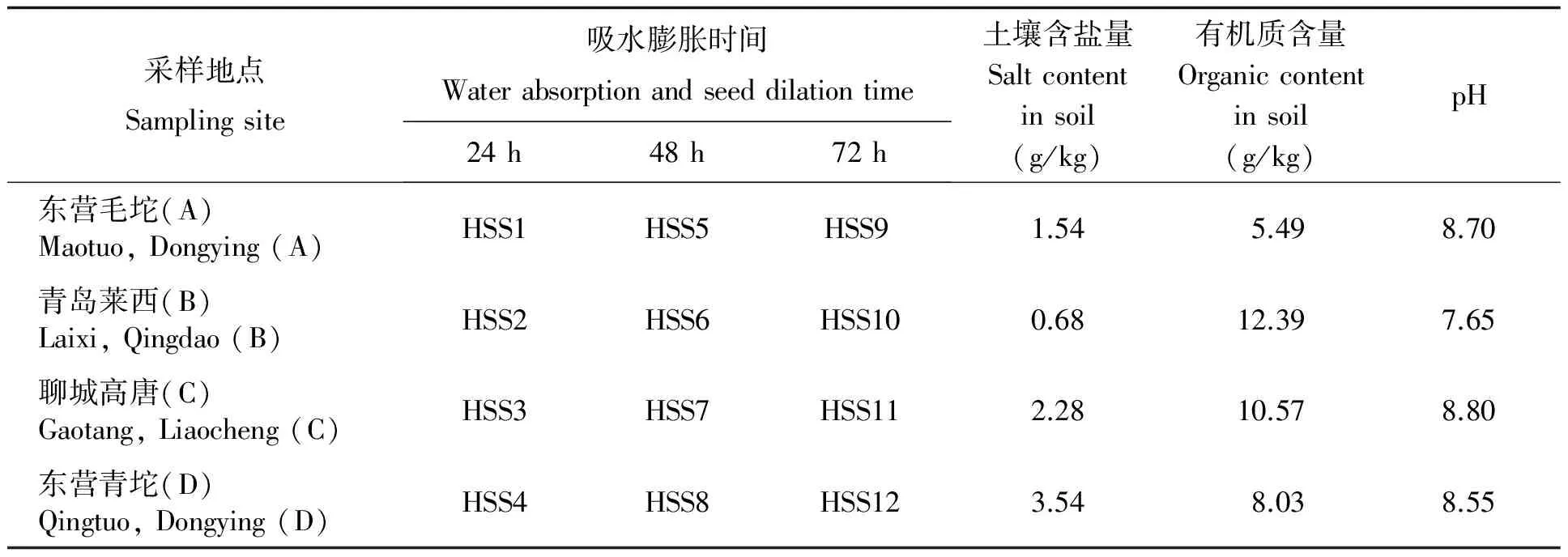
表 1 供试土壤样品性状与处理
1.2 土壤DNA提取
利用OMEGA土壤总DNA提取试剂(OMEGA soil DNA kit)盒进行土壤样品DNA提取。所得DNA采用1.5%琼脂糖凝胶电泳和Nanodrop2000分光光度计检测DNA的纯度和浓度。
1.3 16S rRNA文库构建及高通量测序
稀释后的基因组DNA利用引物340F:CCTACGGGNBGCASCAG以及805R:GACTACNVGGGTATCTAATCC对16S rRNA基因的V3-V4区进行扩增。扩增程序如下:95℃预变性3 min;30 个循环包括(95℃,30 sec;50 ℃,30 sec;72 ℃,60 sec);72 ℃,7 min。PCR 产物使用1.5%浓度的琼脂糖凝胶进行电泳检测;根据PCR 产物浓度进行等浓度混样,充分混匀后使用0.5×TBE 浓度1.5 %的琼脂糖胶电泳纯化PCR产物,割胶回收目标条带。产物纯化试剂盒使用QIAGEN公司的MinElute胶回收试剂盒。最后使用HiSeq2500测序平台进行250PE测序。
1.4 生物信息学分析
测序得到的原始数据(Raw Data),存在一定比例的干扰数据(Dirty Data),为了使信息分析的结果更加准确、可靠,使用SOAPdenovo对原始数据进行拼接、过滤,得到有效数据(Clean Data)。
然后基于有效数据进行OTUs(Operational taxonomic units)聚类和物种分类分析,并将OTU和物种注释结合,从而得到每个样品的OTUs 和分类谱系的基本分析结果。再对OTUs 进行丰度、多样性指数等分析,同时对物种注释在各个分类水平上进行群落结构的统计分析。最后在以上分析的基础上,可以进行一系列的基于OTUs、物种组成的聚类分析和相关统计比较分析,挖掘样品之间的物种组成差异,并结合环境因素进行关联分析。
2 结果与分析
2.1 样本的有效序列数据量
对所得原始测序序列进行过滤后发现,供试样本有效序列条数在86,211~179,138间,HSS6样品有效序列条数最小,HSS12样品最大,12个样本的有效序列条数总和为1,592,117(表2)。样品序列平均长度相近,在437.7579~451.8319 bp间。

表 2 土壤样本的有效序列统计
2.2 Alpha多样性分析
Alpha多样性(α diversity)是指单个样本的多样性。不同的多样性指数反映土壤微生物群落功能多样性的不同方面,Shannon-Wiener指数[5]用来估算样本中微生物多样性指数。
利用各样本在不同的测序量时微生物多样性指数构建曲线,以此来反映各样本的物种多样性随着测序量的变化情况。如果每一个体都属于不同的种,多样性指数就最大,反之最小。图1可看出,HSS12纵轴值最大,表明其样本群落多样性最高,HSS3纵轴值最小,HSS7和HSS11两样品的H值也明显小于其他样品H值,表明其样本群落多样性较小,聊城高唐内陆盐碱土花生种子际土壤细菌群落多样性较小,而东营青坨土壤种子际土壤细菌群落多样性较大,尤以种子吸胀72h后种子际土壤细菌群落多样性最大。随种子吸胀萌发时间延长各类型土壤种子际微生物群落多样性有增大趋势。
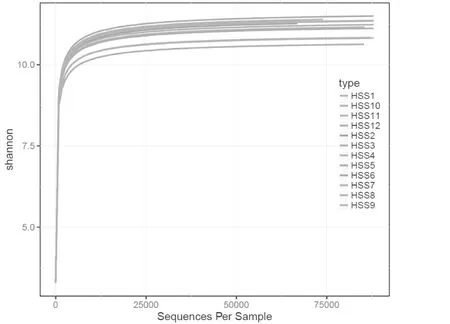
图 1 各花生种子际土壤样本中微生物群落Shannon指数曲线Fig. 1 Shannon index curve of microbial colonies from 12 soil samples in the spermosphere of peanut seeds

图 2 花生种子萌发72 h种子际土壤中微生物群落分类结果Fig. 2 Calssification resuts of soil microbial colonies in the spermosphere after 72h of seed germination
2.3 物种分类及样本间差异比较
2.3.1 单样本物种分类 根据OTU分类学注释结果对每个样品进行物种分类鉴定。选用第二分类纲水平的分类结果,绘制不同土壤类型花生种子萌发种子际物种分类图(图2)。以4种类型土壤上花生种子萌发72 h时种子际土壤样品进行物种分类鉴定为例。图中显示的是样本中各个纲所占的比例,同时为了更好显示,将丰度极低的纲类合并成others显示在图上。
图2可看出,东营毛坨、青岛莱西、聊城高唐和东营青坨4种土壤类型中花生种子萌发72 h时种子际土壤中将丰度极低的菌纲类合并成的others所占比例均在1/3左右,分别为32.2%、26.9%、39.8%和30.7%,非盐碱土壤中的比例较小。且4种土壤类型种子际土壤菌群结构共分属于6个菌纲,分别为Proteobacteria、Actinobacteria、Actinobacteria、Bacteroidetes、Acidobacteria和Firmicutes菌纲,并均以Proteobacteria和Actinobacteria菌纲为主要菌纲,所占比例分别为36.2%、33.1%、37.5%、31.9%和19.1%、28.7%、21.3%、16.8%,Acidobacteria菌纲所占比例分别为3.2%、7.9%、4.1%和6.7%,且Proteobacteria菌纲多以alphaproteobacteria、gammaproteobacteria、deltaproteobacteria和betaproteobacteria菌纲存在。4种土壤类型种子际土壤中采自东营毛坨的盐碱土壤中Bacteroidetes菌纲占比3.8%,其余3种土壤中未发现,而Firmicutes菌纲在青岛莱西的非盐碱土壤中占比为零。可见,不同类型土壤样本微生物菌落结构在纲水平存在明显差异,盐碱土壤中菌群结构在纲水平更丰富。

图 3 各组样本在门水平的菌落结构柱状图Fig. 3 Histogram of microflora structure from 12 samples at the level of phylum
2.3.2 全样本菌落结构分析
(一) 门水平的菌落结构分析:与单样品物种纲水平的分类结果相似(图3),4种类型土壤种子际细菌群落在门水平上的丰度均以Proteobacteria和Actinobacteria菌门丰度较高,平均丰度分别为35%和25%左右,二者丰度差异主要表现在采自青岛莱西的非盐碱土壤和东营青坨盐碱种子际土壤,青岛莱西的非盐碱土壤种子际Proteobacteria丰度小于Actinobacteria,位居第二,其丰度分别为30%和40%左右,而东营青坨盐碱土壤Proteobacteria丰度相对低于东营毛坨。随花生种子吸胀萌发,非盐碱土壤和聊城高唐土壤种子际Actinobacteria和Proteobacteria菌门丰度分别呈降低趋势。表明4种类型土壤种子际微生物菌落在门水平上的类型、丰度间差异明显,且随花生种子吸胀萌发时间的变化,种子际细菌丰度在门水平上有较明显变化。
(二) 属水平全样本属水平的菌落结构分析:图4表明,4种类型土壤种子际微生物菌落在属水平上的类型和丰度均明显不同,其中未分类的(unclassified)菌属丰度均在68%以上,并以采自聊城高唐和东营青坨的土壤未分类菌属丰度较高,分别为83%和72%左右,其余2种土壤中的丰度不足70%,而且未分类菌属的丰度均随花生种子吸胀萌发时间延长而提高。4种类型土壤种子际微生物主要菌属类型差别较大,除Sphingomonadaceae属在4种类型土壤中丰度均较大且在青岛莱西土壤种子际最高、聊城高唐土壤种子际最低外,其余菌属类型、丰度均不同,表现出花生种子际土壤细菌群落在属水平上的多样性和对土壤环境变更或管理分异对土壤微域结构的影响以及微域环境对土壤微生物多样性的调控。
2.4 beta多样性分析
2.4.1 物种丰度heatmap图 Heatmap图是利用颜色变化来反映二维矩阵或者表格中的数据信息,可以直观地以数值的大小来定义颜色的深浅,并将高丰度和低丰度的物种分块聚类,通过颜色梯度及相似程度来反映多个样本在分类水平上的群落组成的相似性和差异性。图5可见,4个土壤类型的12个土壤样本丰度可聚为2大类,HSS5、HSS9、HSS1、HSS7、HSS3、HSS11六个样本聚为一类,HSS4、HSS12、HSS8、HSS2、HSS6、HSS10聚为一类,即东营毛坨土壤和聊城高唐土壤聚为一类,东营青坨和青岛莱西土壤聚为一类。除HSS4样品稍有不同外其余样品的聚类均以土壤类型有关,而与花生种子吸胀萌发时间无关,即相同土壤类型聚为一类。
2.4.2 样本聚类树图 树状图可以通过树枝结构比较直观地描述和比较多个样品间的相似性和差异关系。UniFrac[7]是用于比较生物群落的一种距离度量,不同于其他距离度量,它在计算过程中包含了遗传距离(phylogenetic distances)的信息。图6表明,4种土壤类型12个样本的遗传距离(phylogenetic distances)亦聚为2大类4小类,非盐碱土壤的HSS10、HSS6和HSS2的3个样品的遗传距离相近而聚为一类,其余3个盐碱土壤花生根际样本聚为一类,且相同土壤类型的不同萌发时间样品遗传距离相近而聚为一类。

图 5 样本在属水平的菌落丰度Fig. 5 Colony abundance of 12 samples at the level of genus
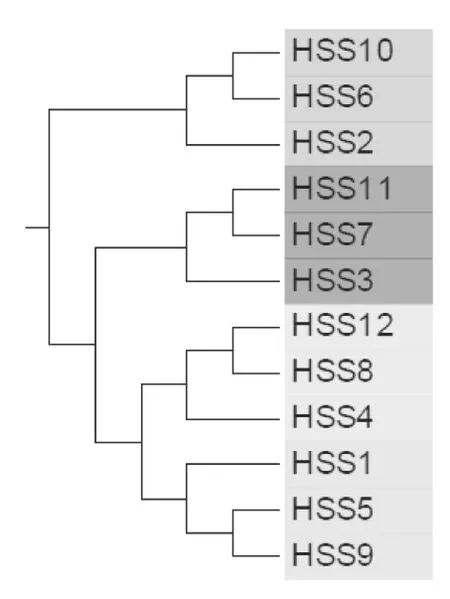
图 6 各样本遗传距离聚类树图Fig. 6 Phylogenetic distances clutering tree based on the 16S rRNA sequences of the clones obtained from four types of soil
3 讨论与结论
土壤微生物物种的多样性是指土壤生态系统中微生物的物种丰富度和均一度,是微生物多样性的最直接表现形式。根据原位的、不经培养的微生物系统发育学研究发现,自然界中95%~99%的微生物种群尚未被分离培养或描述过,从而推算地球上仅细菌就有10万~50万种[7]。水稻旱育栽培下变形菌门α-变形菌纲和γ-变形菌纲、拟杆菌门、绿弯菌门、硝化螺旋菌门、酸杆菌门、芽单胞菌门、浮霉菌门和放线菌门比例上升,而厚壁菌门、变形菌门β-变形菌纲的比例下降[8]。
在盐碱土的细菌、放线菌和真菌三大类群中,细菌占绝对优势,其次是放线菌,真菌数量最少;天津滨海盐碱土、河西走廊东端盐碱土壤中和新疆平原荒漠盐渍草地中微生物数量均以细菌占绝对优势,占总菌数的99%,真菌和放线菌占1%[9-11]。本研究结果表明,聊城高唐内陆盐碱土花生种子际土壤细菌群落多样性较小,而东营青坨土壤种子际土壤细菌群落多样性较大,尤以种子吸胀72 h后种子际土壤细菌群落多样性最大。盐碱土壤中菌群结构在纲水平更为丰富且不同类型土壤样本种子际微生物菌落结构在纲水平存在明显差异。在Proteobacteria、Actinobacteria、Actinobacteria、Bacteroidetes、Acidobacteria和Firmicutes6个优势菌纲中,以Proteobacteria和Actinobacteria为主要菌纲,其所占比例分别在31.9%和16.8%以上,东营毛坨盐碱土壤中Bacteroidetes菌纲占比3.8%,其余3种土壤中未发现,Firmicutes菌纲在非盐碱土壤中占比为零。在门水平上丰度均以Proteobacteria和Actinobacteria菌门丰度较高,平均丰度分别为35%和25%左右,二者丰度差异主要表现在非盐碱土壤和东营青坨盐碱土壤种子际。在属水平上,未分类的(unclassified)菌属丰度均在68%以上,除Sphingomonadaceae属在4种类型土壤中丰度均较大且在非盐碱土壤种子际最高、聊城高唐土壤种子际最低。
种子际(Spermosphere)是植物微生态系统的重要组成部分,在种子萌发的短暂时间内富于微生物群落的形成和功能的瞬时演替特性。不同种类植物的种子萌发过程中分泌物的性质和数量会有所不同,在靠近萌发的胚根处的微生物活性高于邻近的种子表面,种子际对某些微生物的影响在一定程度上具有时间、品种和环境的特异性[5]。百脉根(LotuscorniculatusL.)种子际细菌在24 h的短时间内可以游动2 cm到达种子[12]。本试验条件下,随种子吸胀萌发时间延长各类型土壤种子际微生物群落多样性有增大趋势,而非盐碱土壤和聊城高唐土壤种子际Actinobacteria和Proteobacteria菌门丰度呈降低趋势。不同类型土壤花生种子际微生物依据其群落丰度可聚为2大类,东营毛坨土壤和聊城高唐土壤聚为一类,东营青坨和青岛莱西土壤聚为一类。但依其遗传距离也聚为2大类4小类,非盐碱土壤的3个不同吸胀时间种子际样品的遗传距离相近而聚为一类,其余3个盐碱土壤花生种子际样本聚为一类,且相同土壤类型的不同萌发时间样品遗传距离相近而聚为一类。
[1] Rajjou L, Duval M, Gallardo K, et al. Seed germination and vigor[J] . Annu Rev Plant Biol, 2012, 63:507-533.
[2] 林先贵,胡君利. 土壤微生物多样性的科学内涵及其生态服务功能[J] . 土壤学报,2008,45(5):892-900.
[3] Nelson E B. Microbial dynamics and interactions in the spermosphere [J]. Annual Review of Phytopathology, 2004, 42:271-309.
[4] 刘琳,刘洋,邱服斌,等. 植物种子际微生态学研究进展[J]. 微生物学通报,2008,35(11):1811-1816.
[5] Shannon C E, Weaver W. A mathematical theory of communication [J].The Bell System Technical Journal,1948,27:379-423.
[6] Lozupone C, Knight R. UniFrac: a new phylogenetic method for comparing microbial communities [J]. Applied and environmental microbiology, 2005, 71:8228-8235.
[7] Amann R L, Ludwig W, Schleifer K H. Phylogenetic identification and insitudetection of individual microbial cells without cultivation [J]. Microbiological Reviews, 1995, 59:143-169.
[8] 张志兴,林芸青,戴沛良,等. 水稻旱育壮秧的根际生态学特性分析[J]. 中国农业生态学报,2015,23(12):1552-1561.
[9] 孙佳杰,尹建道,解玉红,等. 天津滨海盐碱土壤微生物生态特性研究[J]. 南京林业大学学报(自然科学版),2010,34(3):57-61.
[10] 李凤霞,王学琴,郭永忠,等. 宁夏不同类型盐渍化土壤微生物区系及多样性[J]. 水土保持学报,2011,25(5):107-111.
[11] 牛世全,景彩虹,廖世齐,等. 河西走廊盐碱土细菌种群结构多样性的研究[J]. 西北师范大学学报(自然科学版),2013,49(2):90-95.
[12] Begonia M F, Kremer R J. Chemotaxis of deleterious rhizobacteria to birdsfoot trefoil [J]. Appl Soil Ecol, 1999, 11:35-42.
Effect of Saline-alkali Soil Types on the Microflora Structure in the Spermosphere during Germination of Peanut Seeds
ZHANG Dai1, YANG Ji-shun2, SONG Wen-wu2, DING Hong2, ZHANG Guan-chu2,LI Han2, LIU Guo-li3, ZHANG Zhi-meng2*, CI Dun-wei2*
(1. College of Plant Protection, Agr. Univ. of Hebei, Baoding 071001, China; 2. Shandong PeanutResearchInstitute,Qingdao266100,China; 3.XiaobotouForestrySationofWudi,Wudi251911,China)
The salt contents in various types of soil are significantly different. The coastal saline soil, inland saline-alkali soil and nonsaline-alkali soil, as the experimental objectives, have the effect on microbial diversity in the spermosphere in the process of water absorption and germination of peanut seeds. In this paper, the V3-V4 region of 16S ribosomal RNA genes in 12 soil samples was amplified using PCR, and the PCR products were then sequenced and analyzed. The results showed that there was a higher diversity of bacteria community compositions in the spermosphere from Qingtuo than that from Gaotang. The microflora structures in different soil patterns were distinct at the class level. The soil bacteria in four kinds of samples were classified into six classes, includingProteobacteria、Actinobacteria、Actinobacteria、Bacteroidetes、AcidobacteriaandFirmicutes, among whichProteobacteriaandActinobacteriaaccounted for major proportion. The microbial colonies in the spermosphere of 12 samples showed a high diversity at the level of phylum and genus. The analysis of beta diversity and phylogenetic distances revealed that the sequenced clones fell into 2 major groups within the domain bacteria. The research provides important and theoretical basis for the preservation of seedlings and promotion of plant early growth.
peanut; saline-alkali soil; seed germination; spermosphere; bacterial diversity; 16S rRNA
10.14001/j.issn.1002-4093.2016.03.002
2016-07-06
山东省农业科学院青年科研基金(2014QNM06);国家科技支撑计划(2014BAD11B04);山东省农业重大应用技术创新课题(2014);山东省现代农业产业技术体系创新团队岗位专家(SDAIT-04-06);青岛市民生科技计划(14-2-3-34-nsh);山东省农业科学院科技创新重点项目(2014CXZ06-2)
张岱(1987-),女,河北衡水人,河北农业大学植物保护学院助理实验师,硕士,主要从事植物病理方面研究。
*通讯作者:张智猛(1963-),研究员,主要从事作物逆境生理与生态方面研究。E-mail: qinhdao@126.com
S565.2; S154.37
A
慈敦伟(1979-),副研究员,主要从事作物逆境生理与生态方面研究。E-mail: cdw_2007@126.com

