SLE患者DNA低甲基化对DNMT1启动子表观修饰负反馈调控的研究①
朱小华 徐金华
(复旦大学附属华山医院皮肤科,上海200040)
·临床免疫学·
SLE患者DNA低甲基化对DNMT1启动子表观修饰负反馈调控的研究①
朱小华 徐金华
(复旦大学附属华山医院皮肤科,上海200040)
目的:检测并分析系统性红斑狼疮患者(SLE)外周血CD4+T淋巴细胞DNA甲基转移酶1(DNMT1)的表达水平与DNMT1启动子甲基化水平、总体DNA甲基化水平的相关性,探讨DNA甲基化对DNMT1启动子表观修饰的负反馈调控作用。方法:收集34例SLE患者与23名健康对照者,取外周血T淋巴细胞,分别用反转录一聚合酶链反应(real time RT-PCR)分析DNMT1的表达水平、亚硫酸氢钠处理后测序分析DNMT1启动子甲基化水平、5-甲基胞嘧啶抗体分析总体DNA甲基化水平。结果:SLE患者总体DNA甲基化水平明显低于正常人(P<0.05),总体DNA甲基化水平与狼疮疾病活动指数(SLE-DAI)负相关(P<0.05)。SLE患者DNMT1启动子甲基化水平与正常人无差异(P>0.05),DNMT1启动子甲基化水平与DNMT1表达水平没有明显的相关性(P>0.05)。结论:SLE患者的总体DNA低甲基化状态未影响DNMT1启动子的表观修饰,总体DNA低甲基化状态对DNMT1的表达无明显负反馈调控作用。
系统性红斑狼疮;表观遗传;负反馈
系统性红斑狼疮(Systemic lupus erythematosus,SLE)是一种病因未明的累及全身多器官的慢性进行性病谱性自身免疫病。SLE表观遗传学的研究显示,DNA低甲基化为解释SLE发病机制和开发新的治疗策略提供了新的线索。DNA低甲基化通过促进CD11a/CD18、CD70等共刺激分子的表达,首先使T细胞具有自身反应性,活化的T细胞一方面促使B细胞活化、分泌免疫球蛋白,生了大量的针对自身抗原的抗体[1]。目前对于SLE中DNA甲基化异常的形成和调控机制尚不十分清楚 ,涉及甲基化调控因素的研究很少。
DNA甲基化转移酶1(DNA methyltransferase 1,DNMT1)起着维持DNA甲基化的作用,即根据模板链上特异的甲基化位点,在DNA半保留复制出的新生链相应的胞嘧啶上进行甲基化修饰的过程。目前有研究发现SLE患者存在DNA低甲基化,DNMT1表达水平明显下降[2]。SLE患者DNMT1与DNA甲基化是否存在相关性,DNA甲基化是否具有负反馈调控作用,影响DNMT1启动子的表观修饰,进而影响DNMT1的表达,目前尚未见报道。本研究通过分析SLE患者外周血CD4+T淋巴细胞DNMT1的表达水平与DNMT1启动子甲基化水平、总体DNA甲基化水平的相关性,探讨DNA甲基化对DNMT1启动子表观修饰的负反馈调控作用。
1 材料与方法
1.1 材料 淋巴细胞分离液购自上海国药集团。CD3免疫磁珠分离器购自德国Mitenyi Biotec公司。RNA抽提试剂盒购自美国Promega公司。RNA抽取试剂盒购自荷兰Qiagen 公司。DNA抽取试剂盒购自中国Tiangen 公司。5-甲基胞嘧啶抗体购自美国Aviva Systems Biology。FITC标记的羊抗鼠二抗购自美国 Santa Cruz。MethylCodeTMBisulfite Conversion Kit试剂盒由中国Invitrogen公司提供。引物由上海生工合成。
1.2 方法
1.2.1 临床病例收集 SLE患者34例,为门诊与住院病人,诊断标准依据1997年美国风湿病学会(ARA)修订的SLE标准,并根据系统性红斑狼疮疾病活动指数(SLE-DAI)进行评分。其中活动期患者17例,诊断依据典型的临床表现、异常的实验室指标及SLE-DAI≥5;缓解期患者17例,诊断依据SLE病史,实验室指标及SLE-DAI<5。正常对照组23名,男性2名,女性21名,采用年龄段、性别匹配。
1.2.2 淋巴细胞的分离 将SLE患者和正常人外周血采用Ficoll密度梯度离心法后再采用Mitenyi Biotec公司的CD3免疫磁珠分离(按免疫磁珠及分离柱的说明书操作)。将分离的细胞分成两份,分别用于总体DNA甲基化与DNMT1的表达分析。
1.2.3 细胞基因组DNA抽提 DNA抽提采用Tiangen Genomic DNA kit(血液/组织/细胞基因组DNA提取试剂盒)提取,按如下步骤操作:(1)从-80℃冰箱取出冻干细胞;(2)加入200 μl缓冲液GA,振荡至彻底混匀;(3)加入20 μl蛋白酶K(20 mg/ml)溶液,混匀;(4)加入220 μl缓冲液GB,充分颠倒混匀,70℃水浴箱中放置10 min,溶液应变清亮,简短离心以去除管盖内壁的水珠;(5)加220 μl无水乙醇,充分振荡混匀15 s,此时可能会出现絮状沉淀,简短离心以去除管盖内壁的水珠;(6)将上一步所得溶液和絮状沉淀都加入一个吸附柱CB3中(吸附柱放入收集管中),12 000 r/min离心30 s,倒掉废液,吸附柱CB3放入收集管中;(7)向吸附柱CB3中加入500 μl去蛋白液GD,12 000 r/min离心30 s,倒掉废液,吸附柱CB3放入收集管中;(8)向吸附柱CB3中加入700 μl漂洗液PW,12 000 r/min离心30 s,倒掉废液,吸附柱CB3放入收集管中;(9)向吸附柱CB3中加入500 μl漂洗液PW,12 000 r/min离心30 s,倒掉废液,吸附柱CB3放入收集管中;(10)将吸附柱CB3放回废液收集管中,12 000 r/min离心2 min,将吸附柱中残余的漂洗液去除。将吸附柱CB3置于室温或50℃温箱放置数分钟,以彻底晾干吸附材料中残余的漂洗液;(11)将吸附柱CB3转入一个干净的离心管中,向吸附膜的中间部位悬空滴加50~200 μl经65~70℃水浴预热的洗脱缓冲液TE,室温放置2~5 min,12 000 r/min离心30 s;(12)离心得到的溶液再加入吸附柱CB3中,室温放置2 min,12 000 r/min离心2 min;(13)紫外/可见光分光光度计测定浓度及A260/A280比值以判定DNA纯度,置于-80℃冰箱保存。
1.2.4 总体DNA甲基化检测 将分离的一份外周血T淋巴细胞,在离心管中调细胞浓度为1×106ml-1。按下述方法:(1)用PBS清洗一次;(2)4%的多聚甲醛PBS在室温固定20 min;(3)用PBS在室温清洗三次;(4)用含0.5%曲拉通100的PBS在室温通透化处理15 min;(5)用PBS在室温清洗三次;(6)在室温用含10%NGS的PBS封闭60 min;(7)在37℃用5-甲基胞嘧啶抗体(终浓度,1 μg/ml)孵育30 min;(8)用含0.1% Tween-20的PBS在室温清洗三次;(9)用铝箔包裹后在室温下用FITC标记的羊抗鼠二抗孵育60 min以上;(10)用含0.1% Tween-20的PBS在室温清洗三次;(11)在流式细胞仪中检测平均荧光强度,设立不加5-甲基胞嘧啶抗体的阳性对照。用荧光指数表示DNA总体甲基化:荧光指数=(样品荧光强度-阳性对照荧光强度)∕阳性对照荧光强度。
1.2.5 启动子DNA甲基化检测 用MethylCode Bisulfite Conversion Kit试剂盒对DNA样本进行处理,按如下步骤操作:(1)准备DNA样品,总体积为20 μl,如果需要可以补去离子水使总体积为20 μl;(2)在20 μl的样品中加入130 μl的CT转换试剂,混匀;(3)在PCR仪上进行以下程序:98℃ 10 min,64℃ 2.5 h,4℃ 放置20 h;(4)在制备管中加入600 μl的Binding buffer,将制备管置于离心管中;(5)将步骤3中的溶液加入到(4)的Binding buffer中,混合均匀;(6)离心10 000 r/min,30 s,弃滤液;(7)加入100 μl Wash buffer,离心10 000 r/min,30 s,弃滤液;(8)加入200 μl Desulphonation Buffer ,室温放置15~20 min;(9)离心10 000 r/min,30 s,弃滤液;(10)加入200 μl Wash buffer ,10 000 r/min,30 s,弃滤液;(11)重复步骤10 ,将制备管置于干净的1.5 ml离心管中;(12) 制备管中加入15 μl的Elution buffer,10 000 r/min,30 s洗脱DNA;(13)引物设计合成,正向引物: 5′-AGAGGGAAATTAGTGTTTT-GTTTTT-3′;反向引物:5′-AATTTCTTAACACTTCCCTACTATAAC-3′,共297 bp;(14)第一轮PCR扩增,扩增条件:95℃ 预变性3 min→(95℃ 30 s,50℃ 30 s,72℃30 s)共25个循环,72℃ 5 min。用第一轮的PCR产物作为模板(稀释20 倍)进行第二轮PCR扩增,扩增条件:95℃ 预变性3 min→(95℃ 30 s,50℃ 30 s,72℃30 s)共40个循环,72℃ 5 min;(15)用Axygen 凝胶回收试剂盒对PCR产物进行回收纯化,转化到冻存的DH5α(200 μl/tube)感受态细胞,在恒温培养箱中37℃倒置培养过夜,至克隆长出,每板挑5个克隆送测。
1.2.6 DNM1表达水平检测 将分离的CD3+T细胞用Trizol法提取总RNA,反转录为cDNA。real time RT-PCR扩增DNMT1与内参照β-actin。引物序列:DNMT1:正向引物: 5′-GATTTGTCCTTGGAGAA-CGGTG-3′;反向引物:5′-TGAGATGTGATGGTGG-TTTGCC-3′,共245 bp。β-actin:正向引物:5′-GCACCACACCTTCTACAATGAGC-3′;反向引物:5′-GGATAGCACAGCCTGGATAGCAAC-3′,共156 bp。PCR反应扩增条件:94℃预变性5 min;50个循环(94℃,变性30 s;55℃,退火30 s;72℃,延伸30 s);95 ℃ 保温1 min 后制作熔点曲线,确定扩增产物的特异性。
1.3 统计学处理 使用Stata7.0统计软件,采用两样本均数差别的t检验分别比较SLE活动期、缓解期患者与正常对照组中总体DNA甲基化状态和P53基因表达的差异。总体DNA甲基化状态和P53基因表达水平两者的相关性及与SLE-DAI的相关性采用相关与回归分析。以P<0.05具有统计学意义。
2 结果
2.1 SLE患者与正常人的总体DNA甲基化状态 SLE患者活动期(8.50±1.42)与正常人(11.31±1.34)相比,差异有统计学意义(P<0.01)。SLE患者缓解期(11.30±1.34)与正常人相比,差异无明显统计学意义(P>0.05)。SLE患者活动期与缓解期相比,差异有统计学意义(P<0.05)。
2.2 SLE患者总体DNA甲基化与狼疮疾病活动指数(SLE-DAI)的相关性 SLE患者的DNA甲基化水平与疾病活动指数(SLE-DAI)的线性回归分析,显示DNA甲基化水平与SLE-DAI成负相关,r=-0.78,P<0.01(图1)。
2.3 DNMT1在SLE患者与正常人中的表达 SLE患者及正常人CD4+T淋巴细胞的DNMT1 Real time PCR扩增曲线图(图2)。SLE患者CD4+T淋巴细胞的DNMT1mRNA表达(0.465 7±0.057 4)与正常人(0.743 9±0.137 7)相比,差异有统计学意义(P<0.01)。
2.4 SLE患者DNMT1的表达水平与总体DNA甲基化水平的相关性 SLE患者DNMT1的表达水平与总体DNA甲基化水平的线性回归分析显示:DNMT1的表达水平与总体DNA甲基化水平没有明显的相关性(r=0.14,P>0.05),见图3。
2.5 SLE患者与正常人的DNMT1启动子DNA甲基化状态 SLE患者DNMT1启动子DNA甲基化水平(0.138±0.065)与正常人(0.155±0.064)相比,差异无明显统计学意义(P>0.05)。
2.6 SLE患者DNMT1启动子DNA甲基化水平与DNMT1表达水平的相关性 SLE患者的总体DNMT1表达水平与其启动子DNA甲基化程度的线性回归分析,显示总体DNMT1表达水平与与其启动子DNA甲基化程度无明显相关性,r=-0.083,P>0.05,见图4。

图1 SLE患者DNA甲基化水平与SLE-DAI的相关性Fig.1 Correlation between whole methylation and SLEDAI in patients with SLE
图2 DNMT1 Real time PCR扩增曲线图Fig.2 Real time PCR amplification curve of DNMT1
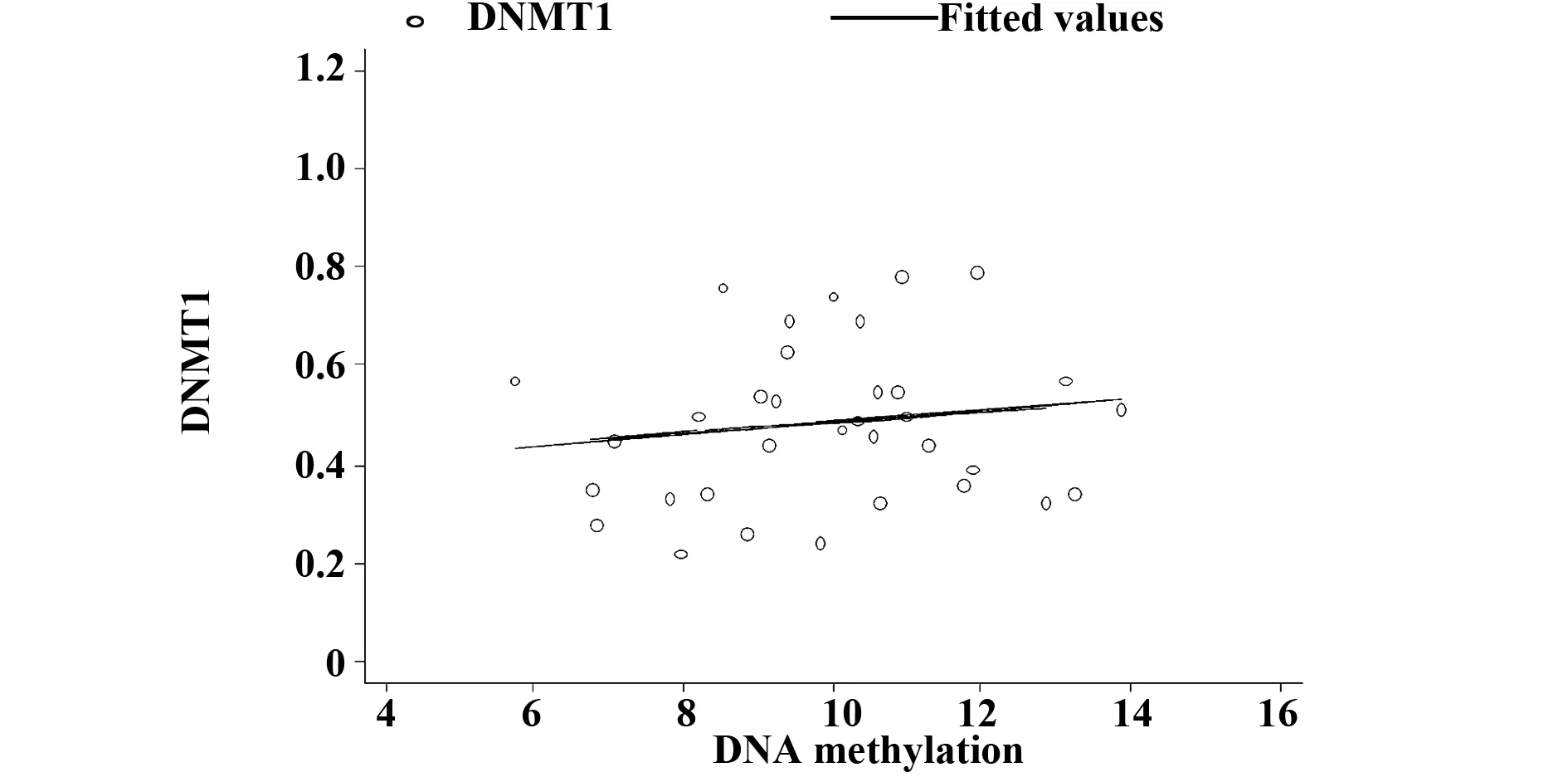
图3 SLE患者DNMT1的表达水平与总体DNA甲基化的相关性Fig.3 Correlation between whole methylation and DNMT1 mRNA in patients with SLE

图4 SLE患者DNMT1的表达水平与DNMT1启动子甲基化水平的相关性Fig.4 Correlation between DNA methylation status of DNMT1 promoter and DNMT1 mRNA in patients with SLE
3 讨论
表观遗传学是研究DNA序列没有发生改变的情况下,通过修饰而改变基因表达与活性,是一种基因外调节方式的遗传变化。人类基因组中约有70%组织特异表达的基因5′端上游区有富含CpG二核苷酸对的CpG岛。CpG岛的甲基化及其去除的状态,对维持与调节相关基因的表达起着重要作用,当某些CpG岛的甲基化去除可引起细胞相关基因的表达异常,从而造成各种疾病的发生[3]。研究表明,表观遗传学变化与几类疾病的发病机制有关,主要包括癌症、免疫缺陷病及自身免疫性疾病[4]。
我们的研究证实SLE患者体内DNA甲基化水平显著降低,并且DNA甲基化的降低水平与SLE-DAI呈正相关,说明表观遗传学的改变是SLE发病的重要机制。
目前已有研究证实DNA低甲基化通过促进LFA-1、CD70等共刺激分子的表达,首先使T细胞具有自身反应性,活化的T细胞一方面促使B细胞活化、分泌免疫球蛋白;另一方面,大量杀伤巨噬细胞,增加血液循环中的自身抗原,降低了对免疫复合物的清除,两者相互促进,这样便产生了大量的针对自身抗原的抗体[1]。
DNA甲基转移酶是DNA甲基化反应的催化剂,在染色质重构和基因表达调控中起关键作用。DNMT1是DNMT中最为重要的一员,起着维持甲基化的作用,即根据模板链上特异的甲基化位点,在DNA半保留复制出的新生链相应的胞嘧啶上进行甲基化修饰的过程[5]。我们的研究结果显示,SLE患者DNMT1的表达水平明显下降,这说明SLE患者DNMT1的低表达是总体DNA低甲基化水平的重要因素。
在本研究中我们重点探讨影响DNMT1表达的调控因素,有研究显示启动子的表位修饰直接影响了DNA的转录与表达,也会影响DNMT的转录。研究发现DNMT存在启动子的表位修饰,DNMT启动子区域发生高甲基化后,DNMT的转录活性明显下降[6]。因此,我们研究了SLE患者在存在总体DNA低甲基化的状态下是否存在DNMT1启动子区域的表位修饰,即SLE患者的DNA低甲基化是否具有负反馈调控DNMT1表达的作用。
我们的研究结果显示SLE患者DNMT1启动子DNA甲基化水平与正常人相比,差异无明显统计学意义。SLE患者的DNMT1表达水平与其启动子DNA甲基化程度的线性回归分析,显示DNMT1表达水平与其启动子DNA甲基化程度无明显相关性。
有研究发现信号传导与转录激活因子3(STAT3)诱导DNMT1的表达,用STAT3 siRNA处理恶性T淋巴细胞后DNMT1的表达明显下降[7]。肿瘤抑制基因p53通过与DNA特异性结合而抑制DNMT1的mRNA表达[8]。p53缺失的B6/lpr狼疮小鼠自身免疫性下降,同时自身抗体产生减少[9]。Sp蛋白属于与基因启动子区域顺式元素结合的转录因子家族,Sp1、Sp3蛋白与DNMT1启动子区域顺式元素的结合呈剂量依赖性,并能控制DNMT1 基因的表达[10]。因此,我们推测SLE患者的DNMT1的表达可能还有其他因素的调控。
我们的研究表明SLE患者存在明显的DNA低甲基化状态,DNMT1的表达与DNA低甲基化相关,DNA低甲基化未影响DNMT1启动子的表观修饰,DNA甲基化对DNMT1的表达无明显负反馈调控作用。DNMT1在SLE表观遗传学发病机制的作用及其调控因素有待进一步研究。
[1] Jeffries MA,Sawalha AH.Epigenetics in systemic lupus erythematosus:leading the way for specific therapeutic agents[J].Int J Clin Rheumtol,2011,6(4):423-439.
[2] Gorelik G,Fang JY,Wu A,etal.Impaired T cell protein kinase C delta activation decreases ERK pathway signaling in idiopathic and hydralazine-induced lupus[J].J Immunol,2007,179(8):5553-5563.
[3] Chang C,Gershwin ME.Drugs and autoimmunity--a contemporary review and mechanistic approach[J].J Autoimmun,2010,34(3):J266-J275.
[4] Gupta B,Hawkins RD.Epigenomics of autoimmune diseases[J].Immunol Cell Biol,2015,93(3):271-276.
[5] Izbicka E,Davidson KK,Lawrence RA,etal.5,6-Dihydro-5′-azacytidine(DHAC)affects estrogen sensitivity in estrogen-refractory human breast carcinoma cell lines[J].Anticancer Res,1999,19(2A):1293-1298.
[6] Aapola U,Menp K,Kaipia A,etal.Epigenetic modifications affect Dnmt3L expression[J].Biochem J,2004,380(Pt 3):705-713.
[7] Zhang Q,Wang HY,Woetmann A,etal.STAT3 induces transcription of the DNA methyltransferase 1 gene(DNMT1)in malignant T lymphocytes[J].Blood,2006,108(3):1058-1064.
[8] Peterson EJ,Bögler O,Taylor SM.p53-mediated repression of DNA methyltransferase 1 expression by specific DNA binding[J].Cancer Res,2003,63(20):6579-6582.
[9] Kuan AP,Cohen PL.p53 is required for spontaneous autoantibody production in B6/lpr lupus mice[J].Eur J Immunol,2005,35(5):1653-1660.
[10] Kishikawa S,Murata T,Kimura H,etal.Regulation of transcription of the Dnmt1 gene by Sp1 and Sp3 zinc finger proteins[J].Eur J Biochem,2002 ,269(12):2961-2970.
[收稿2015-06-24 修回2015-07-15]
(编辑 张晓舟)
Negative feedback effection of DNA methylation on expression of DNMT1 in patients with systemic lupus erythematosus
ZHU Xiao-Hua,XU Jin-Hua.Department of Dermatology,Huashan Hospital,Fudan University,Shanghai 200040,China
Objective:To analyse the whole DNA methylation status,expression of DNMT1 and DNA methylation status of DNMT1 promoter from patients with systemic lupus erythematosus(SLE).To assess the negative feedback effection of DNA methylation on the expression of DNMT1 in the patients with SLE.Methods: The whole DNA methylation status in T cells from 34 SLE patients and 23 healthy controls was assessed by the specific monoclonal antibodies to 5-methylcytosine(5-mc)and the DNA methylation status of DNMT1 promoter was assessed by the Bisulfite Conversion Kit and sequencing.Real time RT-PCR was applied to analyse DNMT1 mRNA levels in T cells from the patients and controls.Results: SLE patients had siginificantly whole DNA hypomethylation than controls(P<0.05),and the whole DNA methylation was negative correlated with the SLE-DAI.There was no difference in levels of DNA methylation of DNMT1 promoter between patients and controls,also no correlation between the levels of DNA methylation of DNMT1 promoter and DNMT1 mRNA.Conclusion: There was no negative feedback effection of DNA methylation on the expression of DNMT1 in the patients with SLE.The mechanism of lower expression of DNMT1 in patients with SLE should be studied further.
Systemic lupus erythematosus;Epignetics;Negative feedback
10.3969/j.issn.1000-484X.2016.04.020
①本文受国家自然科学基金(81371745)资助。
朱小华(1976年-),男,博士,主治医师,主要从事自身免疫性疾病的研究。
及指导教师:徐金华(1963年-),男,博士,教授,主要从事自身免疫性疾病和过敏性皮肤病的研究, E-mail:hsyyxjh@163.com。
R593.24+1
A
1000-484X(2016)04-0542-05