大蒜素对心肌纤维化的影响及对TLR4/NF-κB信号通路的作用
蓝景生 张 震 罗 薇 覃梓庆 赵艳英
(广西民族医院心血管内科,南宁530001)
大蒜素对心肌纤维化的影响及对TLR4/NF-κB信号通路的作用
蓝景生 张 震①罗 薇①覃梓庆 赵艳英
(广西民族医院心血管内科,南宁530001)
目的:研究大蒜素对AngⅡ诱导心肌成纤维细胞增殖和胶原蛋白分泌的作用,并探讨其对TLR4/NF-κB信号通路的影响。方法:采用体外AngⅡ诱导心肌成纤维细胞增殖模型,用MTT法检测细胞增殖能力,采用ELISA法观察细胞Ⅰ型和Ⅲ型胶原蛋白的分泌,采用RT-PCR技术测定TLR4和NF-κB mRNA的表达,采用Western blot法检测TLR4和NF-κB 蛋白的表达。结果:(1)大蒜素可以抑制AngⅡ诱导CF增殖,并且具有剂量依赖性(P<0.01);(2) 大蒜素可以抑制AngⅡ诱导CF分泌Ⅰ型和Ⅲ型胶原蛋白,并且具有剂量依赖性(P<0.01);(3)大蒜素可以抑制AngⅡ诱导CF表达TLR4和NF-κB mRNA;(4)大蒜素可以抑制AngⅡ诱导CF表达TLR4和NF-κB 蛋白。结论:大蒜素可通过抑制心肌成纤维细胞增殖和减少胶原蛋白分泌而具有潜在的抗心肌纤维化作用,其作用可能与抑制TLR4/NF-κB信号通路有关。
大蒜素;心肌成纤维细胞;TLR4/NF-κB信号通路
心肌纤维化(Myocardial fibrosis,MF)是心血管疾病心肌重构的重要机制[1]。尽管目前对于MF发生的机制尚不十分明确,心肌成纤维细胞(Cardiac fibroblasts,CF)的异常增殖和胶原合成过度增加是其主要病理特征。CF在心肌组织中含量最多,在维持心脏结构和功能发挥方面起重要作用[2]。肾素-血管紧张素-醛固酮系统的过度激活是导致心肌纤维化的重要因素之一,血管紧张素Ⅱ(AngiotensinⅡ,AngⅡ)可刺激胶原合成,诱导CF增殖,在心肌纤维化中发挥重要作用[3,4]。大蒜素是大蒜中的主要生物活性物质,是多种含硫化合物的复合体。大蒜素在对心血管保护作用方面已有诸多研究,此外已有研究显示大蒜素可抑制大鼠心肌肥厚过程中的反应性纤维化,其作用可能与TGFβ-Smads信号通路有关[5]。炎性反应在心肌纤维化的形成过程中发挥重要的作用,心肌组织在炎性因子的作用下发生纤维化,而心肌纤维化后进一步刺激炎性因子的分泌,从而导致恶性循环。Toll样受体4/转录因子-κB(Toll-like receptor 4/nuclear factor-κB,TLR4/NF-κB)是与炎症密切相关的信号通路[6]。TLR是心血管疾病发展与免疫系统之间的桥梁,其中TLR4被认为与人类心血管疾病关系最为密切,TLR4是介导心肌炎症信号的重要受体,TLR4的活化可使NF-κB的表达增加,进而引起一系列炎性因子的表达,并且NF-κB的活性对TLR4也具有调节作用。大蒜素调节CF是否有TLR4/NF-κB信号通路的参与目前尚无研究报告。
1 材料与方法
1.1 材料
1.1.1 试验动物 Wistar大鼠乳鼠,年龄为1~3 d,雌雄各半,由广西医科大学实验动物中心提供,实验动物生产许可证号SCXK桂2003-0003。
1.1.2 主要药物 大蒜素注射液(15 mg/ml,徐州莱恩药业有限公司,批号201401016);TAK242(TRL4拮抗剂,日本Takeda公司,100 μg/L),LPS(TRL4激动剂,美国R&D 公司产品,100 ng/ml)。
1.1.3 主要试剂 胰蛋白酶、AngⅡ、DMEM培养液、MTT试剂(美国Sigma公司),胶原酶(美国Sigma-Aldrich),胎牛血清(英国Gibco公司),鼠抗人波形蛋白单克隆抗体、对氨基联苯胺(DBA)底物显色试剂盒、鼠抗人平滑肌肌动蛋白(北京中杉金桥生物公司),Ⅰ型前胶原羧基端肽酶联免疫吸附测定(Enzyme-linked immunosorbent assay,ELISA)试剂盒、Ⅲ型前胶原羧基端肽ELISA试剂盒(美国BPB 公司),Trizol试剂(美国Invitrogen公司),反转录试剂盒、Real-Time PCR 试剂盒(日本TaKaRa公司),兔抗人TRL4单克隆抗体(Cell signaling公司),兔抗人NF-κB 单克隆抗体(美国Santa Cruz公司),HRP-羊抗鼠二抗、FITC-羊抗鼠二抗、β-actin多克隆抗体(美国Abgent公司),ECL化学发光试剂(碧云天生物技术公司),低温高速离心机(德国Heraeus公司)。
1.1.4 主要仪器 GI6-2恒温培养箱(美国SHELLAB公司),CK2型倒置显微镜(日本Olympus公司),ABI 7500 PCR 扩增仪、凝胶成像系统、Western blot电泳仪(美国Bio-Rad公司),酶标仪(德国BMG公司),FluorChemQ蛋白印迹成像和定量分析系统(美国Alpha公司)。
1.2 方法
1.2.1 大鼠CF细胞培养 将领回的乳鼠立即处死,在无菌条件下打开胸腔,取出心室,用冷PBS溶液洗净心腔内残血,剪碎,反复冲洗后,加入胰蛋白酶和胶原酶消化,每8 min收集1次细胞,直至组织块消失。将所得全部细胞加入含胎牛血清的DMEM培养液中于5 %CO2、37℃恒温培养箱中培养。由于CF和心肌细胞贴壁速度不同,差速贴壁2 h,倾去上清液可得CF,重新加入培养液培养,经倒置显微镜、免疫组化、纤维黏连蛋白染色阳性和平滑肌肌动蛋白染色阴性鉴定为CF,纯度达98%。待原代细胞长满瓶壁后加入胰蛋白酶消化并进行传代培养,实验采用第3~5代的细胞。取对数生长期CF制备为单细胞悬液,调整细胞浓度为5×107L-1后接种于96孔板,每孔接种1 ml,培养48 h后换无血清DMEM同步化24 h后进行实验。每组均设6个复孔,除正常对照组外其他各组培养基均含1 μmol/L Ang Ⅱ。
1.2.2 MTT测定CF增殖 实验分为5组,分别为正常对照组,模型对照组,大蒜素10、20和40 μg/L组。各组细胞培养12、24、48 h后每孔加入MTT溶液(5 mg/ml) 20 μl,37℃培养4 h,弃上清,加入100 μl DMSO,酶标仪450 nm波长测吸光度A值。
1.2.3 ELISA测定胶原蛋白的表达 实验分为5组,分别为正常对照组,模型对照组,大蒜素10、20和40 μg/L组。将96孔板置于5 % CO2、37 ℃培养箱内分别培养48 h,分别吸取细胞上清液,根据Ⅰ型胶原和Ⅲ型胶原的ELISA试剂盒说明书的操作说明进行检测。
1.2.4 RT-PCR法测定TLR4和NF-κB mRNA的表达 实验分为3组,分别为正常对照组,模型对照组和大蒜素20 μg/L组。将培养板置于5%CO2、37 ℃培养箱内分别培养48 h。Trizol提取细胞总RNA,用酶标仪进行定量,控制A260/A280在1.9~2.1,逆转录成cDNA。逆转录条件:30℃10 min,42℃ 30 min,95℃ 5 min。PCR引物序列见表1,RT-PCR操作按照说明书进行扩增。反应条件:94℃ 5 min,94℃ 30 s,72℃ 10 min,循环35次。PCR产物进行1.5%琼脂糖凝胶电泳,凝胶自动成像仪进行成像并分析,各目的基因的表达量以内参物GAPDH的相对定量表示。
1.2.5 Western blot法测定TLR4和NF-κB蛋白的表达 取对数生长期CF悬液,制备单细胞悬液调整细胞浓度为5×107L-1接种于96孔板,每孔接种1 ml,培养48 h后换无血清DMEM同步化24 h,分组进行实验。实验分为3组,分别为正常对照组,模型对照组和大蒜素20 μg/L组,每组设6个复孔。除正常对照组外,其他2组培养基均含10-3mol/Ang Ⅱ。将96孔板置于5%CO2、37 ℃培养箱内分别培养48 h。收集各组细胞,加入RIPA裂解液(含1 mmol/L PMSF,)于冰浴30 min,离心(2 000 r/min,30 min)后取上清液,用BCA法测定蛋白浓度。制备10%的分离胶和 5%浓缩胶,每孔加30 μg总蛋白进行SDS-PAGE垂直凝胶电泳分离不同相对分子质量蛋白质,将蛋白质转载到硝酸纤维素(PVDF)膜上,经过5%脱脂奶粉在室温条件下封闭2 h,洗膜并在4℃分别加入一抗(TRL4抗体、兔抗人NF-κB抗体、和羊抗鼠β-actin抗体)孵化过夜。复温后洗膜,加二抗封闭90 min,洗膜,化学发光、显影和定影,采用FluorChemQ多功能成像和定量分析系统曝光、采集图像。以β-actin为内参,用目的蛋白吸光值与内参吸光度值的比值代表目的蛋白的相对表达含量。
表1 引物序列和产物长度
Tab.1 Primer sequence and product length

PrimerSequenceProductlength(pb)TLR4Forward:5'-GACCCAGATCATGTTTGAGA-3'295Reverse:5'-ATCTCCTTCTGCATCCTGTCG-3'NF-κBForward:5'-CCAAAGACCCACCTCACC-3'236Reverse:5'-CGCATTCAAGTCATAGTC-3'GAPDHForward:5'-ACCACAGTCCATGCCATCAC-3'450Reverse:5'-TCCACCACCCTGTTGCTGTA-3'
2 结果
2.1 对AngⅡ诱导CF增殖的影响 与正常对照组比较,模型对照组在培养12、24和48h时吸光度OD值较正常对照组显著升高(P<0.01),说明AngⅡ可显著诱导CF细胞增殖。大蒜素10μg/L组在培养12、24和48h时吸光度OD值与模型对照组比较差异均无统计学意义(P>0.05),而大蒜素20和40μg/L组在培养12、24和48h时吸光度OD值均较模型对照组显著降低(P<0.01),并且大蒜素40μg/L组的吸光度OD值均较大蒜素20μg/L组显著降低(P<0.01),说明大蒜素20和40μg/L可显著抑制AngⅡ诱导的CF增殖,并且具有剂量依赖性。见表2。
2.2 对AngⅡ诱导CF表达Ⅰ和Ⅲ型胶原蛋白的影响 与正常对照组比较,模型对照组在48h时Ⅰ和Ⅲ型胶原蛋白较正常对照组显著升高(P<0.01),说明AngⅡ可显著诱导CF细胞表达Ⅰ和Ⅲ型胶原蛋白。大蒜素10μg/L组在培养12、24和48h时Ⅰ和Ⅲ型胶原蛋白与模型对照组比较差异均无统计学意义(P>0.05),而大蒜素20和40μg/L组在培养12、24和48h时Ⅰ和Ⅲ型胶原蛋白均较模型对照组显著降低(P<0.01),并且大蒜素40μg/L组的Ⅰ和Ⅲ型胶原蛋白均较大蒜素20μg/L组显著降低(P<0.01),说明大蒜素20和40μg/L可显著抑制CF细胞表达Ⅰ和Ⅲ型胶原蛋白,并且具有剂量依赖性。见表3。
2.3 对AngⅡ诱导CF表达TLR4和NF-κBmRNA的影响 与正常对照组比较,模型对照组在培养48h时TLR4和NF-κBmRNA较正常对照组显著升高(P<0.01),说明AngⅡ可显著诱导CF细胞表达TLR4和NF-κBmRNA。大蒜素20μg/L组在培养48h时TLR4和NF-κBmRNA均较模型对照组显著降低(P<0.01),说明大蒜素20μg/L可显著抑制CF细胞表达TLR4和NF-κBmRNA。见表4。
2.4 对AngⅡ诱导CF表达TLR4和NF-κB蛋白的影响 与正常对照组比较,模型对照组在培养48h时TLR4和NF-κB蛋白较正常对照组显著升高(P<0.01),说明AngⅡ可显著诱导CF细胞表达TLR4和NF-κB 蛋白。大蒜素20 μg/L组在培养48 h时TLR4和NF-κB 蛋白均较模型对照组显著降低(P<0.01),说明大蒜素20 μg/L可显著抑制CF细胞表达TLR4和NF-κB 蛋白。见表5。
表2 大蒜素对AngⅡ诱导CF增殖的影响(n=6)
Tab.2 Effect of allicin to proliferation of CF induced by Ang Ⅱ(n=6)

GroupsAngⅡODofabsorbanceCulturefor12hCulturefor24hCulturefor48hNormalcontrol-0.224±0.0180.384±0.0350.397±0.032Modelcontrol1μmol/L0.312±0.0211)0.565±0.0471)0.584±0.0421)Allicin10μg/L1μmol/L0.308±0.0210.557±0.0340.576±0.034Allicin20μg/L1μmol/L0.267±0.0252)3)0.468±0.0322)3)0.482±0.0412)3)Allicin40μg/L1μmol/L0.211±0.0112)3)4)0.363±0.0312)3)4)0.386±0.0362)3)4)
Note:Compared with normal control group,1)P<0.01;compared with model control group,2)P<0.01;compared with Allicin 10 μg/L group,3)P<0.01;compared with Allicin 20 μg/L group,4)P<0.01.
表3 大蒜素对AngⅡ诱导CF表达Ⅰ和Ⅲ型胶原蛋白的影响(n=6)
Tab.3 Effect of allicin to collagen Ⅰ and Ⅲ in CF induced by Ang Ⅱ (n=6)
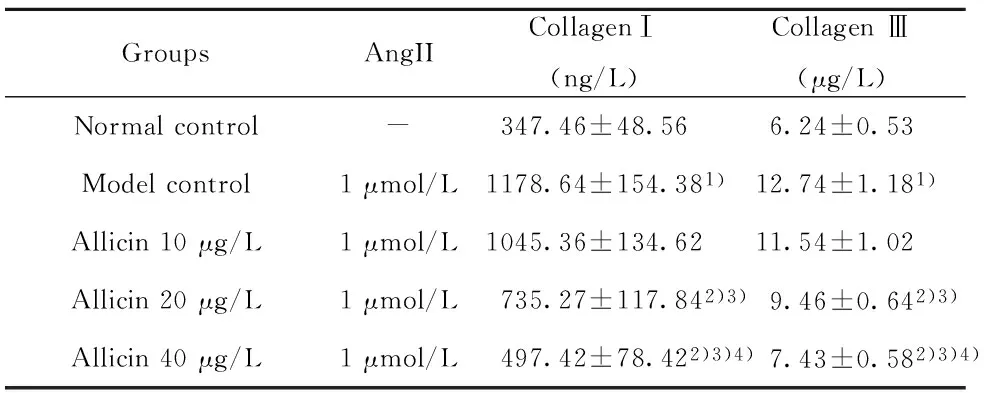
GroupsAngIICollagenⅠ(ng/L)CollagenⅢ(μg/L)Normalcontrol-347.46±48.566.24±0.53Modelcontrol1μmol/L1178.64±154.381)12.74±1.181)Allicin10μg/L1μmol/L1045.36±134.6211.54±1.02Allicin20μg/L1μmol/L735.27±117.842)3)9.46±0.642)3)Allicin40μg/L1μmol/L497.42±78.422)3)4)7.43±0.582)3)4)
Note:Compared with normal control group,1)P<0.01;compared with model control group,2)P<0.01;compared with Allicin 10 μg/L group,3)P<0.01;compared with Allicin 20 μg/L group,4)P<0.01.
表4 大蒜素对AngⅡ诱导CF表达TLR4和NF-κB mRNA的影响(n=6)
Tab.4 Effect of allicin to TLR4 and NF-κB mRNA in CF induced by Ang Ⅱ(n=6)
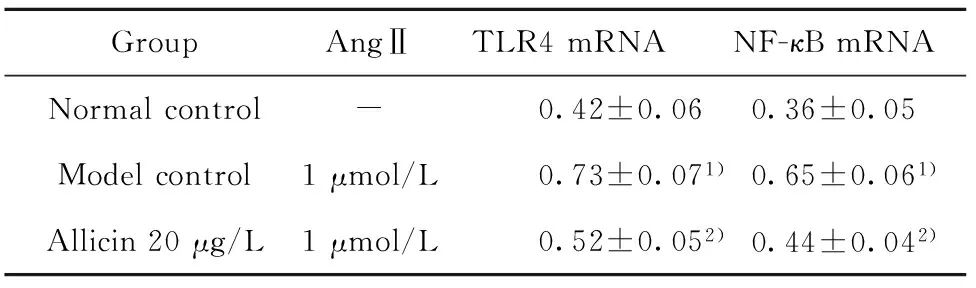
GroupAngⅡTLR4mRNANF-κBmRNANormalcontrol-0.42±0.060.36±0.05Modelcontrol1μmol/L0.73±0.071)0.65±0.061)Allicin20μg/L1μmol/L0.52±0.052)0.44±0.042)
Note:Compared with normal control group,1)P<0.01;compared with model control group,2)P<0.01.
表5 大蒜素对AngⅡ诱导CF表达TLR4和NF-κB 蛋白的影响(n=6)
Tab.5 Effect of allicin to TLR4 and NF-κB protein in CF induced by Ang Ⅱ(n=6)
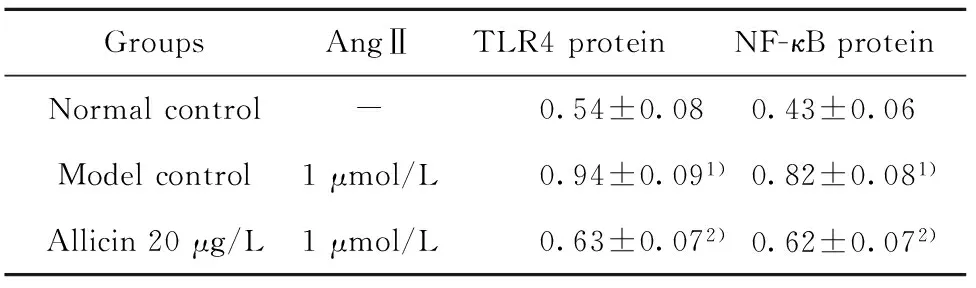
GroupsAngⅡTLR4proteinNF-κBproteinNormalcontrol-0.54±0.080.43±0.06Modelcontrol1μmol/L0.94±0.091)0.82±0.081)Allicin20μg/L1μmol/L0.63±0.072)0.62±0.072)
Note:Compared with normal control group,1)P<0.01;compared with model control group,2)P<0.01.
3 讨论
正常心肌结构的2/3是非心肌细胞,其中CF占非心肌细胞总数的90%。CF遍布于整个心肌组织,包绕心肌细胞并连接细胞间质[7]。除了对心肌细胞的结构支持和保护作用外,CF还具有自分泌和旁分泌功能[8]。心脏胶原细胞主要由CF分泌,因此是维持心脏重塑的主要调节因素[9,10]。当各种原因引起心肌损伤时,心肌细胞体积增大、成纤维细胞增殖及分化、胶原分泌增加,参与组织修复并且成为主要的代偿方式维持正常的心脏功能。但是CF异常增殖、胶原合成过度将导致进行性MF,降低心肌顺应性,导致心脏功能障碍[11]。MF是多种心脏疾病的病理基础,可致心力衰竭、心律失常、心源性猝死等[12]。因此,如何防止CF异常增殖及胶原过度合成,逆转心肌纤维化,是保护心脏的关键因素之一,具有重要的研究意义。大蒜素是大蒜中存在的一种含硫化合物的特有成分,是多种含硫化合物的复合体。大蒜素是大蒜的主要有效成分,具有抗病原微生物、抗肿瘤、提高机体免疫力、预防心脑血管疾病、抗氧化、抑制肝纤维化[13]。但是目前关于大蒜素抑制心脏纤维化作用尚无研究报告。心肌成纤维细胞是MF的主要效应细胞,在MF发生、发展中起着重要作用[14]。本研究结果显示,大蒜素可以抑制AngⅡ诱导CF增殖以及分泌Ⅰ型、Ⅲ型胶原蛋白,并且具有剂量依赖性(P<0.01),说明大蒜素具有潜在的抗心脏纤维化作用。
在心血管疾病的发生和发展过程中炎症反应的作用不容忽视,已有研究显示炎症反应可导致高血压病人心肌纤维化,表现为间质中胶原沉积增多以及各型胶原比率、排列紊乱[15]。心肌纤维化进程中由于免疫机制的激活而产生和释放多种活性炎性因子,从而引起一系列与心肌纤维化有关的病理生理变化。TLR4是信号转导家族的成员之一,在外源性LPS或内源性配体的刺激下,TLR4与接头蛋白MyD88结合后再与白细胞介素相关激酶(IRAKs)结合,启动与天然免疫和炎症反应有关的基因转录,诱导机体免疫应答效应[16,17]。NF-κB位于TLR下游信号通路,是炎症反应中最关键的转录调控因子之一,参与免疫反应及细胞增殖与分化等过程,在细胞代谢和免疫反应中均起重要作用。本研究结果显示,大蒜素可以抑制Ang Ⅱ诱导CF细胞TLR4和NF-κB mRNA和蛋白的表达(P<0.01),说明大蒜素对CF的作用可能参与了TLR4/NF-κB信号通路。
总之,大蒜素可通过抑制心肌成纤维细胞增殖和减少胶原蛋白分泌而具有潜在的抗心肌纤维化作用,其作用可能与抑制TLR4/NF-κB信号通路有关。
[1] Porter KE,Turner NA.Cardiac fibroblasts:at the heart of myocardial remodeling[J].Pharmacol Ther,2009,123(2):255-278.
[2] Banerjee K,Yekkala K,Borg TK,etal.Dynamic interactions between myocytes,fibroblasts,and extracellular matrix [J]. Ann NY Acad Sci,2006,108:76-84.
[3] Olson ER,Shamhart PE,Naugle JE,etal.Angiotensin II-induced extracellular signal-regulated kinase 1/2 activation is mediated by protein kinase Cdelta and intracellular Calcium in adult rat cardiac fibroblasts[J].Hypertension,2008,51(3):704-711.
[4] Wang LP,Wang Y,Zhao LM,etal.Angiotensin Ⅱ upregulatesKCa3.1 channels and stimulates cell effort in rat cardiac fibroblasts[J].J Biochem Pharmacol,2013,85(10):1486-1494.
[5] 张海啸,史载祥,贾海忠,等.大蒜素通过部分阻抑TGF-β_1介导的Smads信号改善压力超负荷大鼠心肌反应性纤维化[J].中国中西医结合杂志,2012,32(5):666-670.[6] 姚 岚,肖 扬,刘石平,等.肥胖症患者血清对人源单核细胞细胞上Toll样受体4/转录因子-κB信号通路的影响[J].中华医学杂志,2010,90(44):3119-3123.
[7] Souders CA,Bowers SL,Baudino TA.Cardiac fibroblast:the Renaissance cell[J].Circ Res,2009,105(12):1164-1176.
[8] Brown RD,Ambler SK,Mitchell MD,etal.The cardiac fibroblast:therapeutic target in myocardial remodeling and failure[J].Annu Rev Pharmacol Toxicol,2005,45(5):657-687.
[9] Mir SA,Chatterjee A,Mitra A,etal.Inhibition of signal transducer and activator of transcription 3 (STAT3) attenuates interleukin-6 (IL-6)-induced collagen synthesis and resultant hypertrophy in rat heart[J].J Biol Chem,2012,287(4):2666-2677.
[10] Wu W,Muchir A,Shan J,etal.Mitogen-activated protein kinase inhibitors improve heart function and prevent fibrosis in cardiomyopathy caused by mutation in lamin A/C gene[J].Circulation,2011,123(1):53-61.
[11] Cheng S,Vasan RS.Advances in the epidemiology of heart failure and left ventricular remodeling[J].Circulation,2011,124(20):e516-e519.
[12] Ruige JB,Mahmoud AM,De Bacquer D,etal.Endogenous testosterone and cardiovascular disease in healthy men:a meta-analysis[J].Heart,2011,97(11):870-875.
[13] 叶 静,周晓明,张 立,等.大蒜素防治大鼠肝纤维化的效果及其机制探讨[J].山东医药,2015,55(16):5-7,111.
[14] 戴 斌,崔 猛,张 宏.高糖状态下心肌成纤维细胞Ⅰ、Ⅲ型胶原表达变化的观察[J].重庆医学,2013,42(15):1724-1726.
[15] 吴金风.Binay KA,孟晓萍.CD8+效应性T细胞促高血压心肌纤维化的炎性反应[J].中国实验诊断学,2012,16(2):276-277.
[16] Kaushal V,Schlichter LC.Mechanisms of microglia-mediated neurotoxicity in a new model of the stroke penumbra[J].J Neurosci,2008,28(9):2221-2230.
[17] O′Neill LA,Bryant CE,Doyle SL.Therapeutic targeting of Toll-like receptors for infectious and inflammatory diseases andcancer,Pharmacol Rev,2009,61:177-197.
[收稿2015-08-20 修回2015-09-15]
(编辑 倪 鹏)
Effects of Allicin on myocardial fibrosis and TLR4/NF-κB pathway
LAN Jing-Sheng,ZHANG Zhen,LUO Wei,QIN Zi-Qing,ZHAO Yan-Ying.Department of Cardiovascular,Guangxi Nationalities Hospital,Nanning 530001,China
Objective:To observe the effect of Allicin in cardial fibroblasts(CFs) proliferation and Collagen secretion,and to explore its role on TLR4/NF-κB signal pathway.Methods: CFs of neonatal Wistar rats were isolated and cultured,then was stimulated with AngⅡ.CFs proliferation was measured by thiazolyl blue(MTT) assay.The expression of collagenⅠ,collagenⅢ was measured by ELISA.mRNA expression of TLR4 and NF-κB were detected by reverse transcription-polymerase chain reaction,protein expression of TLR4 and NF-κB were detected with Western blot.Results: Allicin could reduced MTT value of cardial fibroblasts(P<0.01),and inhibited expression of collagenⅠ,collagenⅢ(P<0.01),which in a dose-dependent manner.Allicin could reduced mRNA expression of TLR4 and NF-κB and protein expression of TLR4 and NF-κB in CF induced by Ang Ⅱ (allP<0.01) .Conclusion: Allicin can inhibit Myocardial fibrosis ,which mechanism is possible by inhibiting TLR4/NF-κB signal pathway.
Allicin;Cardiac fibroblasts; Toll like receptor-4/Nuclear factor-κB
10.3969/j.issn.1000-484X.2016.04.011
蓝景生(1969年-),男,博士,主任医师,主要从事心肌疾病炎症反应方面的研究。
R285.5
A
1000-484X(2016)04-0500-05
①右江民族医学院附属医院心血管内科,百色533000。