沉积物中芘对泥鳅和霍甫水丝蚓的毒性效应研究
沈兆爽,张彦峰,祝凌燕
南开大学环境科学与工程学院 环境污染过程与基准教育部重点实验室 天津市生态环境修复与防治重点实验室,天津 300071
沉积物中芘对泥鳅和霍甫水丝蚓的毒性效应研究
沈兆爽,张彦峰*,祝凌燕
南开大学环境科学与工程学院 环境污染过程与基准教育部重点实验室 天津市生态环境修复与防治重点实验室,天津 300071
积累在沉积物中的外源化合物会对底栖生物产生危害。本研究以泥鳅(Misgurnus anguillicaudatus)和霍甫水丝蚓(Limnodrilus hoffmeisteri)为受试生物,研究了沉积物中代表性多环芳烃类物质芘(pyrene)对这2种生物的急/慢性毒性效应。芘对泥鳅96 h的半数致死浓度LC50、平衡受损效应浓度EC10和EC50分别为548.9、63.1、254.8 mg·kg-1干重,21 d的LC50为4.6 mg·kg-1。沉积物中芘会导致泥鳅活动异常、泥鳅体色加深、抑制泥鳅生长。芘对霍甫水丝蚓28 d的LC50、自断效应浓度EC10和EC50分别为>1 000、5.1、85.4 mg·kg-1。芘也会抑制霍甫水丝蚓的生长,引起霍甫水丝蚓挖掘深度变浅、挖掘长度变短、挖掘密度变小,导致霍甫水丝蚓产生沉积物回避行为,降低霍甫水丝蚓筑巢密度和大小。霍甫水丝蚓的挖掘、沉积物回避和筑巢等行为产生不同程度的影响。泥鳅对芘的毒害响应较霍甫水丝蚓更加敏感。研究结果丰富了我国本土底栖生物毒性效应数据,为沉积物质量基准的制定奠定了基础。
芘;沉积物;泥鳅;霍甫水丝蚓;毒性效应
Received 18 August 2015 accepted 23 October 2015
多环芳烃(polycyclic aromatic hydrocarbons, PAHs)是一类由两个或两个以上苯环按线性、角形或簇状等方式相连而成的有机污染物。PAHs对生物体具有致癌、致畸、致突变等危害,并通过食物链间接危及人体健康。已经有16种PAHs被美国环保局(USEPA)列为优先控制污染物[1]。研究表明,16种优控PAHs在我国环境介质中广泛分布,其中水体已普遍受PAHs污染,部分水体污染严重[2-4]。芘是典型的四元环PAHs,对水生生物和人体健康都有潜在毒性效应。由于具有较强的疏水性(logKow=5.13)和较低的溶解度,水体中的芘主要分布在沉积物中,成为我国淡水沉积物中重要的有机污染物。研究证实,芘具有广泛的生物毒性,可以对微藻[5-6]、桡足类生物[7]、贻贝[8]和鱼类等产生毒性[9-11]。但是,有关沉积物中芘对淡水底栖生物尤其是我国本土底栖生物毒性效应的研究较少。研究沉积物中芘对底栖生物的毒性效应,对于推导其沉积物质量基准,从而完善水质基准具有重要意义。
淡水底栖动物主要包括环节动物、软体动物及节肢动物等无脊椎底栖动物和部分底栖鱼类,广泛分布于各种水体中[12],是水生生态系统的重要组成部分。泥鳅(Misgurnus anguillicaudatus)和霍甫水丝蚓(Limnodrilus hoffmeisteri)分别属于脊椎动物门和环节动物门,是我国水体中常见的底栖动物和优势种。霍甫水丝蚓属于水生寡毛类内底栖生物,穴居于沉积物中,通过接触、摄食污染沉积物颗粒、间隙水和上覆水而暴露于污染物中[13]。越来越多的研究将寡毛类生物用于淡水沉积物毒性试验[14]。泥鳅(Misgurnus anguillicaudatus)隶属于鲤形目(Cypriniformes),鳅科(Cobitidae),花鳅亚科(Cobitinae),泥鳅属(Misgurnus),在我国各水系均有分布。泥鳅在自然环境中营底栖生活,主要通过摄食沉积物颗粒或内底栖生物为食。本文以淡水底栖生物霍甫水丝蚓(淡水水体优势种)和泥鳅(有机污染物敏感种)为受试生物,研究沉积物中芘对泥鳅和霍甫水丝蚓的急/慢性毒性效应,丰富我国沉积物生物毒性效应数据,以期为淡水沉积物质量基准制定奠定基础。
1 材料与方法 (Materials and methods)
1.1 供试材料
1.1.1 沉积物
采用Pasteris等[15]的方法,用表层土壤(总有机碳(TOC) 7.99%,含水率2.02%,pH 7.4)经过加水平衡后用以模拟自然沉积物。表层土采自天津西青区农田,无工业污染历史,自然风干后去除砾石、木屑、草屑等杂物,研磨粉碎过450 μm孔径(40目)筛,室温保存,待用。芘未检出。
TOC的测定方法:称取适量风干、研磨、过筛的土壤,用1.00 mol·L-1的HCl溶液滴定至不冒气泡,再滴加2滴,放入105 ℃烘箱干燥。称取0.10 g处理样品,用multi N/C 3100型TOC分析仪(德国耶拿)进行测定。
1.1.2 化学试剂
芘工业品(98%,产自北京化工厂)、芘标准溶液(产自德国Dr. Ehrenstorfer GmbH公司),丙酮(分析纯)、正己烷(色谱纯)、甲醇(色谱纯),购自天津市康科德科技有限公司。
1.2 沉积物中芘含量测定和仪器分析
取芘加标沉积物,冷冻干燥、研磨、过筛、称重后。采用甲醇作为提取液,超声萃取,离心。取上清液过0.45 μm有机相膜,进行仪器分析。
分析仪器采用Agilent 1260 Infinity型高效液相色谱仪,配有荧光检测器(FLD),色谱柱型号Eclipse plus C18 (Φ5 μm, 4.6 mm×150 mm)。流动相为H2O(10%)和CH3OH(90%);激发波长为250 nm,发射波长为400 nm,流速为0.2 mL·min-1,进样量为7.5 μL。采用外标法定量。目标化合物加标回收率为93.9% ~ 111%。
1.3 毒性试验
1.3.1 加标沉积物制备
加标沉积物制备参考经济合作发展组织(OECD) 225[13]中建议的方法。丙酮作助溶剂,配备不同浓度的试验溶液。将溶液分别加入到少许沉积物中(每次取总重量的1/10),搅拌均匀,置于通风橱内。待溶剂挥发完全,将剩余沉积物逐步(每次取总量的1/10左右)加入到加标沉积物中,搅拌均匀,重复此过程,直至所有的沉积物都混合均匀,形成不同浓度的芘加标沉积物。均分沉积物(泥鳅试验每个平行样含约150 g土,霍甫水丝蚓试验含约50 g土)并置于烧杯(泥鳅1 000 mL,霍甫水丝蚓250 mL)中。加入适量曝气水,搅拌混匀,使沉积物与上覆水的体积比约为1:4,室温下避光静置1周,使泥水平衡。同时设置完全空白(只有相同量沉积物)和溶剂空白(沉积物中只加相同体积丙酮)对照组。
为了确定加标沉积物中芘的实际浓度,毒性试验前需用1.2节所述方法分析测定沉积物中芘含量,结果如表1所示。
1.3.2 毒性试验系统
泥鳅和霍甫水丝蚓均采用静态试验系统,保证试验过程通风良好。整个试验周期内,上覆水水质参数为pH为8.0~8.1、温度19.6~21.0 ℃、溶解氧DO为6.10~7.30 mg·L-1(DO>30% ASV(空气溶解氧饱和值))。整个试验在光暗比为16 h:8 h的环境下进行,试验过程不曝气。每天用去离子水或蒸馏水补足蒸发掉的水分,保证试验过程中上覆水与沉积物比例为4:1。霍甫水丝蚓慢性试验周期参照OECD 225[13]选择28 d,泥鳅参照鱼类的水体毒性试验方法和预试验选择21 d。
1.3.3 泥鳅毒性试验
泥鳅购自天津市花鸟鱼虫市场。试验前,于实验室内用曝气脱氯的自来水驯养至少2周。水温(20±1) ℃,水体pH(7.5±0.3),自然光照(16 h:8 h)。每周投饵2次,看水质情况不定期换水,并及时清理粪便及残饵。试验选取体色一致、健康、强壮、体长约5~6 cm、湿重约0.7~1.0 g的泥鳅幼苗进行。试验前泥鳅禁食24 h。
根据生态毒理学方法原理和预试验结果,分别设定芘对泥鳅96 h和21 d毒性试验的加标浓度,并分别检测其实际浓度。试验设计参考文献[16]和相关OECD毒性试验导则,随机在每个试验烧杯中放置10条泥鳅。96 h急性试验过程不喂食,21 d慢性试验期间喂食一次,主要靠土壤中有机质维持生活。每天观察记录泥鳅的死亡以及平衡受损、游泳行为、呼吸能力以及色素积淀等不正常的毒性效应。及时清除死亡泥鳅[17]。试验结束后,将泥鳅取出,记录泥鳅的死亡、失衡、干重变化[18]。泥鳅毒性试验过程中,以其头和尾部对玻璃棒30 s碰触无反应视为死亡。将泥鳅取出放于干净的曝气水中,如果泥鳅在静止的情况下,出现翻身,支撑能力减弱而浮于水位中部情况,则记为平衡受损,如图3所示。泥鳅干重为洗净后,于105 ℃烘箱内干燥12 h的烘干干重。整个试验过程,用透气纱布将烧杯口罩住,防止泥鳅因中毒,行为异常,跳出试验装置。
1.3.4 霍甫水丝蚓毒性试验
霍甫水丝蚓购自济南市花鸟鱼虫市场,试验前长期驯养在实验室干净水体中,以脱脂棉作基质。用微型曝气泵连续曝气,水体pH为7.8±0.2,采用自然光照(16 h:8 h),温度为(20±1) ℃,每月投饵(玉米粉)2次。试验挑选大小一致、成熟度一致、健康敏捷,尤其是尾部完整的霍甫水丝蚓。生物测试前,清肠24 h,选择清肠后仍然健康的霍甫水丝蚓进行。
根据已有研究[14,19]和实验室前期试验结果[20],设定芘对霍甫水丝蚓的28 d毒性试验沉积物加标浓度。试验设计参照OECD 225[13]和文献[21]进行,随机选取12条霍甫水丝蚓于芘加标沉积物烧杯中进行试验。由于沉积物中有机质丰富,能够保证试验过程中水丝蚓有足够的食物来源,试验过程不喂食。定期观察,记录霍甫水丝蚓行为(沉积物回避、挖掘、筑巢等)及死亡情况。试验结束后,拍照记录霍甫水丝蚓挖掘、筑巢等行为,之后将沉积物过筛,将存活的霍甫水丝蚓转移到培养皿中观察其运动及自断情况。然后将存活的霍甫水丝蚓于曝气水中清肠2 h,放于锡箔纸上,烘箱105 ℃干燥12 h[13],称重。
表1 沉积物对泥鳅和霍甫水丝蚓毒性试验中芘的实际测定浓度
Table 1 Concentrations of pyrene in spiked sediment tests using Misgurnus anguillicaudatus and Limnodrilus hoffmeisteri
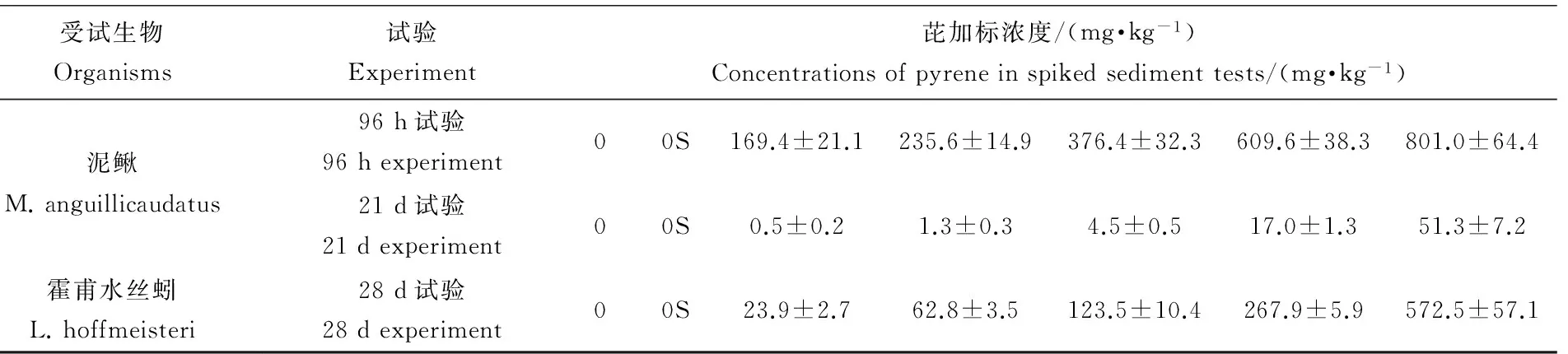
受试生物Organisms试验Experiment芘加标浓度/(mg·kg-1)Concentrationsofpyreneinspikedsedimenttests/(mg·kg-1)泥鳅M.anguillicaudatus96h试验96hexperiment00S169.4±21.1235.6±14.9376.4±32.3609.6±38.3801.0±64.421d试验21dexperiment00S0.5±0.21.3±0.34.5±0.517.0±1.351.3±7.2霍甫水丝蚓L.hoffmeisteri28d试验28dexperiment00S23.9±2.762.8±3.5123.5±10.4267.9±5.9572.5±57.1
注:每个处理4个平行,表中数值为平均值±标准偏差。“0”代表完全空白,“0S”代表溶剂空白。
Note: Every treatment has 4 parallels and values in the table are mean value ± standard deviation. “0”=full control, “0S”=solvent control.
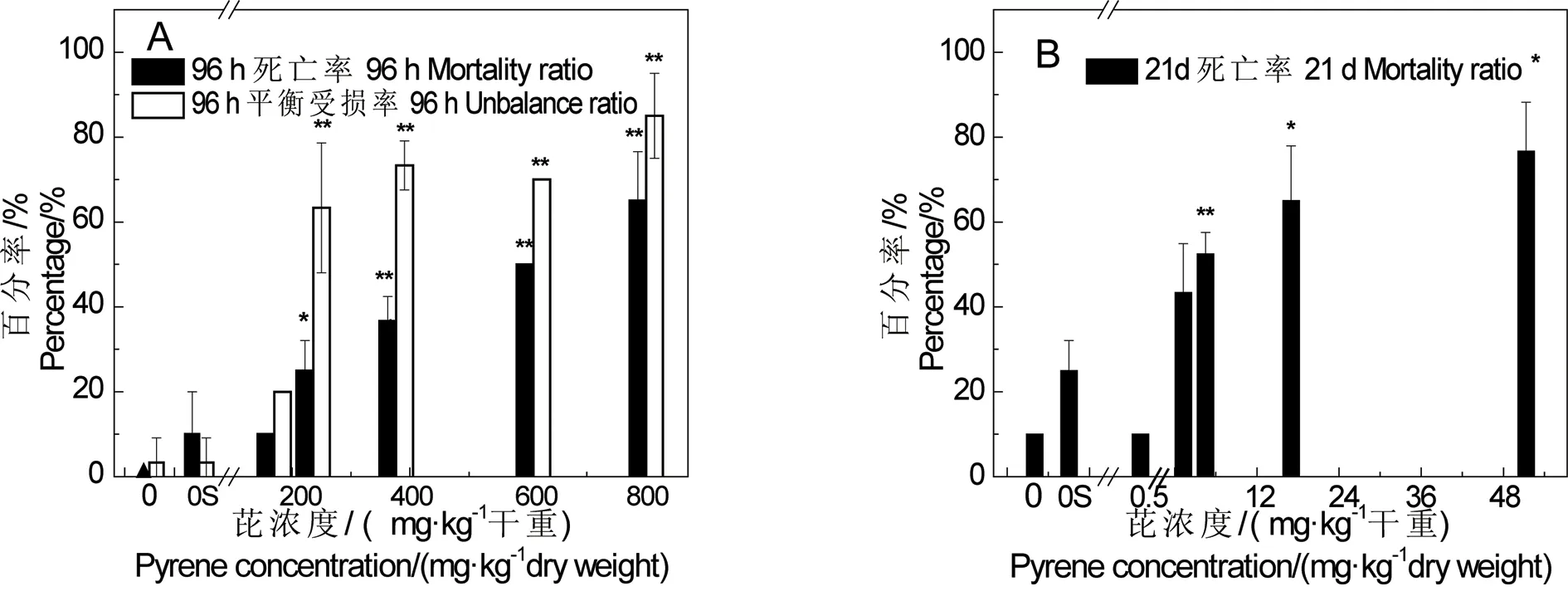
图1 芘对泥鳅96 h死亡率/平衡受损率(A)和21 d死亡率(B)的影响 注:▲代表无泥鳅死亡;*、 **代表与对照相比的显著性差异P﹤0.05,P﹤0.01。Fig. 1 The effect of pyrene in sediment on mortality and unbalance of Misgurnus anguillicaudatus in the 96 h (A) and the 21 d (B) experimentNote: ▲represents no mortality; * and ** represent significant difference from control P﹤0.05, P﹤0.01.

图2 泥鳅平衡受损现象Fig. 2 Unbalance of Misgurnus anguillicaudatus
1.3.5 数理统计分析
采用统计软件SPSS 20.0概率单位分析法计算沉积物中芘对泥鳅和霍甫水丝蚓的LC50、泥鳅的平衡受损效应浓度EC10和EC50以及霍甫水丝蚓的自断效应浓度EC10和EC50,试验结果采用Origin9.0软件作图[22-23]。
采用SPSS 20.0中单因素方差分析(One-way ANOVA)、Dunnett双侧多重比较检验各浓度组与空白组间的显著性差异,P﹤0.05为存在统计学的显著性差异。
2 结果与讨论(Results and discussion)
2.1 芘对泥鳅毒性效应
2.1.1 芘对泥鳅死亡率和平衡受损率的影响
如图1(A)所示,96 h试验完全空白和溶剂空白的死亡率和平衡受损率小于20%。完全空白和试剂空白组之间没有显著性差异(P﹤0.05)。浓度从235.6 mg·kg-1干重开始,与对照组相比,泥鳅死亡率均存在显著性差异,且随着浓度的升高,死亡率也升高。计算得到芘对泥鳅96 h LC50值为548.9 mg·kg-1(95%置信区间为[431.9, 765.8])。同样,如图1(B)所示,21 d毒性试验完全空白和试剂空白的死亡率小于30%,且泥鳅死亡率随浓度的升高而升高。计算得到芘对泥鳅21 d LC50值为4.6 mg·kg-1(95%置信区间为[2.2, 8.7])。空白对照组死亡率偏高,可能跟试验期间食物来源不足有关。
观察发现,泥鳅在中毒死亡之前,会出现明显的由于平衡受损而直立在水位中部,或漂浮在水面上的现象。试验结束后,置于水体中的泥鳅会出现翻身,支撑能力减弱而浮于水位中部情况,平衡受损现象不会恢复(图2)。相比较而言,急性毒性试验的平衡受损现象会更明显一些,如图1所示。当加标浓度达到235.6 mg·kg-1干重时,与对照组相比,出现显著性差异(P﹤0.01)。计算得出,芘对泥鳅96 h EC10值为63.1 mg·kg-1(95%置信区间为[0.6, 138.8]),EC50值为254.8 mg·kg-1(95%置信区间为[81.9, 384.2])。
2.1.2 芘对泥鳅生长的影响
有研究表明[16],有机污染物会影响泥鳅的摄食、吸收活动,从而影响泥鳅的生长。如下图3所示,与对照组相比,泥鳅暴露于芘中,平均干重会出现降低的趋势。把染毒浓度组平均干重的减少所占的百分比记为生长抑制率,发现芘对泥鳅21 d生长产生抑制作用。芘对泥鳅96 h生长抑制不明显。
2.1.3 芘对泥鳅的其他毒性效应
芘会对泥鳅的活动能力造成影响。在96 h毒性试验中,泥鳅对毒物刺激表现出明显反应,活动剧烈,游动迅速,易受惊扰,并伴有跃出水面的现象;随暴露时间延长,其活动能力降低,游动趋缓且身体失衡;重度中毒时,其身体侧倾,游动减少,沉降水底静止不动直至死亡。21 d毒性试验后期,泥鳅表现出呼吸困难,呼吸频率加快,常常游到水面换气,活动能力急剧下降,后期呼吸逐渐减弱,鳃盖静止不动,直至死亡。中毒能引起泥鳅的体液分泌增多。
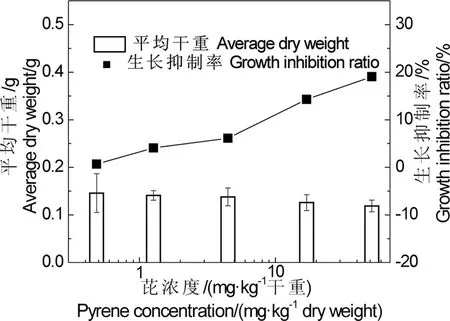
图3 芘对泥鳅21 d生长的影响Fig. 3 The effect of pyrene in sediment on growth of Misgurnus anguillicaudatus in 21 d treatment
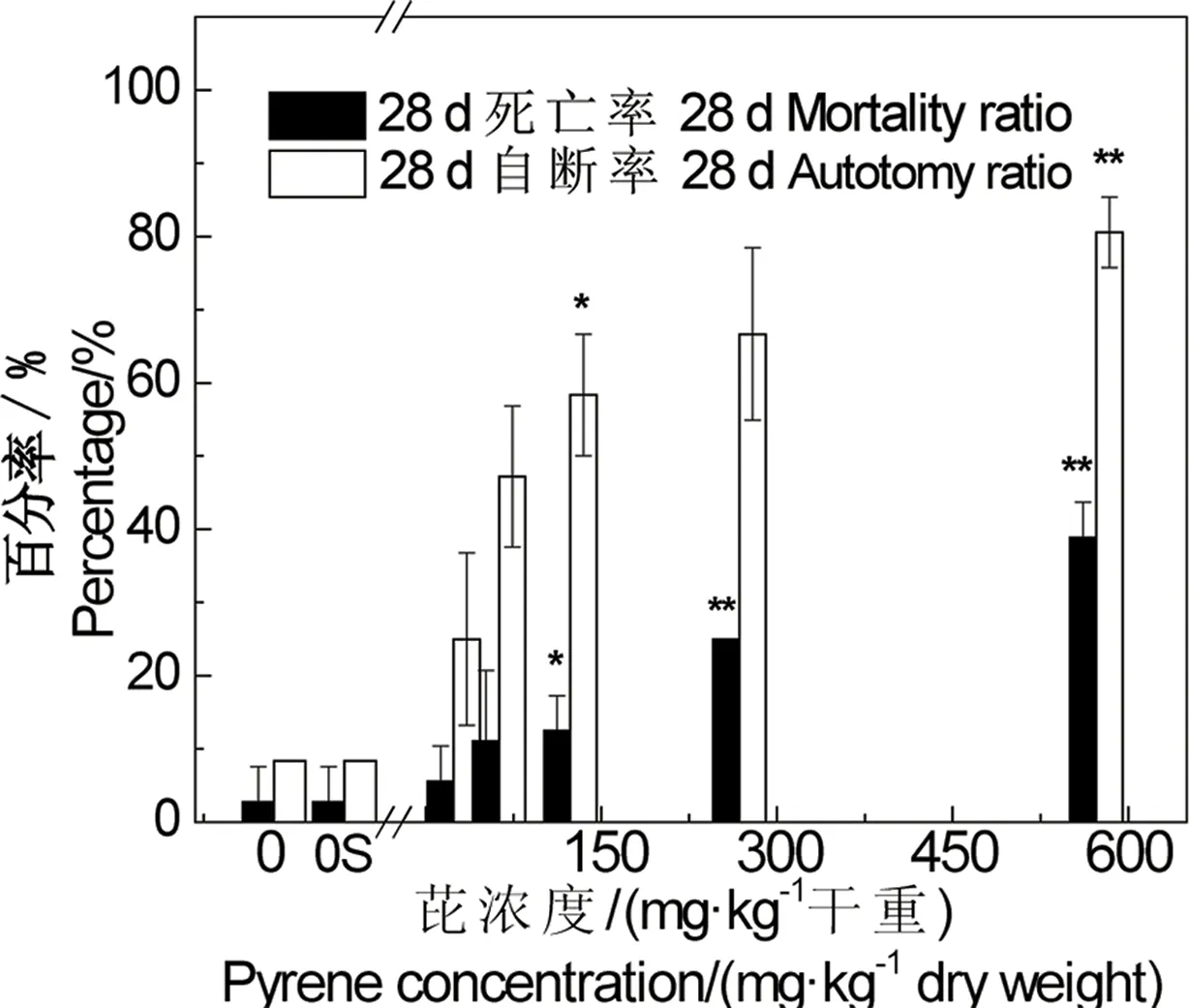
图4 芘对霍甫水丝蚓28 d死亡率和自断率的影响 注:*、**代表与对照相比的显著性差异,P﹤0.05,P﹤0.01。Fig. 4 The effect of pyrene in sediment on mortality and autotomy of Limnodrilus hoffmeisteri during 28 d experiment Note: *,**represents significant difference from control, P﹤0.05, P﹤0.01.
另外,试验过程中泥鳅体色也会发生变化。96 h和21 d毒性试验都发现,泥鳅体色变深,出现色素沉积现象。泥鳅体色变化的程度和速度也随着芘浓度的升高而变快。推测除自然因素之外,污染物也会加深泥鳅的体色并影响体色变化的速度和程度。这与文献报道的污染物会引起鱼类色素积淀的结果相似[18]。
2.2 芘对霍甫水丝蚓毒性效应
研究表明,类似于带丝蚓(Lumbriculus variegatus)[19]和片脚类生物(Diporeia spp.)[25],芘对霍甫水丝蚓的急性毒性很低[14]。96 h试验表明,甚至高达951.5 mg·kg-1的芘都不能引起明显的毒性效应。因此,本文只讨论芘对水丝蚓28 d慢性毒性。
2.2.1 芘对霍甫水丝蚓死亡率和身体自断率的影响
如图4所示为28 d暴露试验后霍甫水丝蚓的死亡率和自断率情况,可以看出,当加标浓度增加到123.5 mg·kg-1干重后,与对照组相比,死亡率会出现显著性的差异(P﹤0.05),且随着加标浓度的增加,死亡率会明显升高。计算得出,芘对霍甫水丝蚓28 d LC50值﹥1 000 mg·kg-1干重。相对于泥鳅、摇蚊等其他底栖生物来说,霍甫水丝蚓对芘的耐受性更强一些。本研究进行的28 d毒性试验的死亡率很低,最高浓度组的死亡率低于40%。Lotufo等[14]对沉积物中芘和菲对霍甫水丝蚓的10 d和28 d毒性试验进行了研究,发现芘对霍甫水丝蚓的毒性很小,当浓度达到841.0 mg·kg-1时,死亡率小于20%,与本研究结果相似。
与死亡相比,霍甫水丝蚓的自断响应更加敏感。霍甫水丝蚓身体任一部分出现断截,导致其身体不完整的现象均统计为自断。颤蚓自断通常发生在尾部,往往体表先出现凹陷,凹陷进一步收缩致使尾部发生自断[21],是颤蚓的一种自我保护机制。如果生活环境得到改善,尾部可以再生。重金属主要蓄积在颤蚓的尾部,有机物在颤蚓全身都有蓄积,但是前部代谢快于后部,代谢物倾向于向尾部迁移,因此颤蚓会主动切断尾部的血液循环与食物运送,使尾部发生自断[26-27]。如图4所示,霍甫水丝蚓自断率随芘浓度的升高而升高。计算得出,芘对霍甫水丝蚓28 d自断EC10值为5.1 mg·kg-1干重(95%置信区间为[0.4, 14.5]),EC50值为85.4 mg·kg-1干重(95%置信区间为[45.2, 134.7])。
2.2.2 芘对霍甫水丝蚓生长的影响
有文献报道,芘会影响内底栖寡毛类生物带丝蚓的生长[19]。本研究发现,当浓度足够高时,霍甫水丝蚓会肌肉收缩,影响其摄食、营养运输和吸收,从而影响其生长。另外,自断也会影响其体重。如图5所示,浓度达到123.5 mg·kg-1干重后,水丝蚓的平均干重较对照组会有所减少。芘会对霍甫水丝蚓生长产生抑制。
2.2.3 芘对霍甫水丝蚓行为活动的影响
较高浓度的芘会引起霍甫水丝蚓蜷缩成团,反应迟钝,运动强度明显减弱,同时使挖掘、筑巢等行为活动发生改变。
挖掘行为是霍甫水丝蚓等颤蚓科生物行为变化的常用指标[21,28-29]。正常情况下,霍甫水丝蚓身体会钻入沉积物中,或将尾部探出沉积物进行呼吸,并在沉积物中留下挖掘痕迹。试验结果表明(如图6所示),随着芘加标浓度的增加,水丝蚓挖掘能力变弱,水丝蚓的挖掘深度变浅,挖掘长度变短,挖掘密度变小。当浓度达到572.5 mg·kg-1干重时,挖掘深度只有0.5~1.0 cm。芘还会影响水丝蚓的筑巢行为(如图6所示),随着浓度的增加,巢穴的密度和直径变小。当加标浓度达到572.5 mg·kg-1干重时,水丝蚓筑巢行为消失。
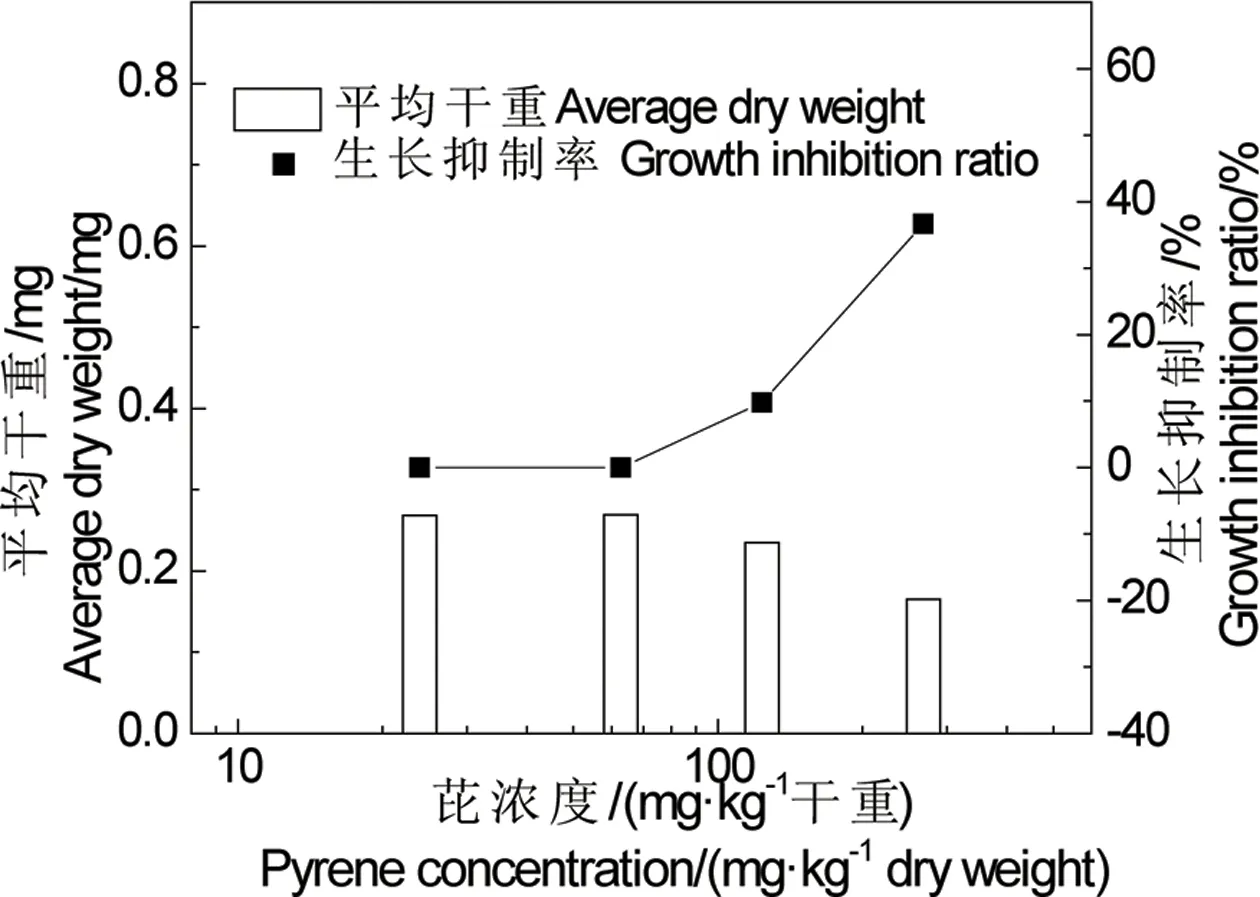
图5 沉积物中芘对霍甫水丝蚓28 d生长的影响Fig. 5 The effect of pyrene in sediment on growth of Limnodrilus hoffmeisteri during 28 d experiment

图6 芘对霍甫水丝蚓挖掘行为和筑巢行为的影响 注:1和4,空白烧杯侧面和正面图;2和5,123.5 mg·kg-1芘时烧杯侧面和正面图;3和6,572.5 mg·kg-1芘时烧杯侧面和正面图。Fig. 6 The effect of pyrene in sediment on galleries and nesting behavior of Limnodrilus hoffmeisteriNote:1 and 4, the control; 2 and 5, the concentration of 123.5 mg·kg-1 pyrene; 3 and 6, the concentration of 572.5 mg·kg-1 pyrene.

表2 沉积物中芘对泥鳅和霍甫水丝蚓的毒性效应终点值
注:“-”代表没有获得对应的数据。
Note:“-” represents that the data were not detected.
本研究发现,随暴露浓度的增高和时间的延长,芘会对泥鳅的活动能力、摄食、平衡能力等行为产生影响,从而导致泥鳅的生长受到抑制甚至死亡。芘不仅能引起霍甫水丝蚓死亡、自断,还会影响霍甫水丝蚓的运动行为(包括挖掘、沉积物回避、筑巢行为)和体重。霍甫水丝蚓的亚致死效应自断比致死效应更为敏感。总体来说,泥鳅对芘的毒性响应比霍甫水丝蚓更加敏感。本文通过对沉积物中芘对泥鳅的急/慢性和霍甫水丝蚓的慢性毒性效应研究,得到了一系列相关的毒性效应终点值(表2),丰富了我国沉积物毒性效应数据,为建立我国芘的沉积物质量基准,提供了必要的数据支持。今后,需大量开展沉积物毒性试验,探究不同门、科、属、种生物的灵敏毒性效应终点,丰富我国本土底栖生物毒性数据库的多样性,为建立我国优控污染物沉积物质量基准,完善水质基准体系提供合理的技术支持。
[1] Ma Y G, Lei Y D, Xiao H, et al. Critical review and recommended values for the physical chemical property data of 15 polycyclic aromatic hydrocarbons at 25C [J]. Journal of Chemical & Engineering Data, 2010, 55(2): 819-825
[2] Tao S, Cui Y H, Xu F L, et al. Polycyclic aromatic hydrocarbons(PAHs) in agricultural soil and vegetables from Tianjin [J]. Science of the Total Environment, 2004, 320(1): 11-24
[3] 蒋丹烈, 胡霞林, 尹大强. 应用物种敏感性分布法对太湖沉积物中多环芳烃的生态风险分析[J]. 生态毒理学报, 2011, 6(1): 60-66
Jiang D L, Hu X L, Yin D Q. Ecological risk assessment on polycyclic aromatic hydrocarbons of sediment in Taihu Lake using species sensitivity distributions [J]. Asian Journal of Ecotoxicology, 2011, 6(1): 60-66 (in Chinese)
[4] 刘良, 颜小品, 王印, 等. 应用物种敏感性分布评估多环芳烃对淡水生物的生态风险[J]. 生态毒理学报, 2009, 4(5): 647-654
Liu L, Yan X P, Wang Y, et al. Assessing ecological risks of polycyclic aromatic hydrocarbons (PAHs) to freshwater organisms by species sensitivity distributions [J]. Asian Journal of Ecotoxicology, 2009, 4(5): 647-654 (in Chinese)
[5] Okay O S, Tüfekci V, Donkin P. Acute and chronic toxicity of pyrene to the unicellular marine alga Phaeodactylum tricornutum [J]. Bulletin of Environmental Contamination and Toxicology, 2002, 68: 600-605
[6] Petersen D G, Reichenberg F, Dahllöf I. Phototoxicity of pyrene affects benthic algae and bacteria from the Arctic [J]. Environmental Science & Technology, 2008, 42: 1371-1376
[7] Hjorth M, Vester J, Henriksen P, et al. Functional and structural responses of marine plankton food web to pyrene contamination [J]. Marine Ecology Progress Series, 2007, 338: 21-31
[8] Okay O S, Tolun L, Tüfekci V. Effects of pyrene on mussels in different experimental conditions [J]. Environment International, 2006, 32: 538-544
[9] Schirmer K, Chan A G J, Greenberg B M, et al. Ability of 16 priority PAHs to be photocytotoxic to a cell line from the rainbow trout gill [J]. Toxicology, 1998, 127: 143-155
[10] Incardona J P, Collier T K, Scholz N L. Defects in cardiac function precede morphological abnormalities in fish embryos exposed to polycyclic aromatic hydrocarbons [J]. Toxicology and Applied Pharmacology, 2004, 196: 191-205
[11] Oliveira M, Gravato C, Guilhermino L. Acute toxic effects of pyrene on Pomatoschistus microps (Teleostei, Gobiidae): Mortality, biomarkers and swimming performance [J]. Ecological Indicators, 2012, 19: 206-214
[12] 王伟莉, 闫振广, 何丽, 等. 五种底栖动物对优控污染物的敏感性评价[J]. 中国环境科学, 2013, 33(10): 1856-1862
Wang W L, Yan Z G, He L, et al. Sensitivity evaluation of five zoobenthos to priority pollutants [J]. China Environmental Science, 2013, 33(10): 1856-1862 (in Chinese)
[13] Organisation for Economic Co-operation and Development (OECD). OECD Guidelines for the Testing of Chemicals No.225. Sediment-water Lumbriculus Toxicity Test Using Spiked Sediment [S]. Paris: OECD, 2007
[14] Lotufo G R, Fleeger J W. Toxicity of sediment-associated pyrene and phenanthrene to Limnodrilus hoffmeisteri (Oligochaeta:Tubificidae) [J]. Environmental Toxicology and Chemistry, 1996, 15(9): 1508-1516
[15] Pasteris A, Vecchi M, Reynoldson T B, et al. Toxicity of copper-spiked sediments toTubifex tubifex (Oligochaeta, Tubificidae): A comparison of the 28-day reproductive bioassay with a 6-month cohort experiment [J]. Aquatic Toxicology, 2003, 65(3): 253-265
[16] 韩雨薇, 钟文珏, 张彦峰, 等. 沉积物中Pb和Cd对泥鳅的毒性效应及其基准阈值的验证[J]. 环境科学研究, 2015, 28(7): 1078-1084
Han Y W, Zhong W J, Zhang Y F, et al. Toxicities of Pb/Cd-spiked freshwater sediments to Misgurnus anguillicaudatus and assessment of Pb/Cd sediment quality guidelines [J]. Research of Environmental Sciences, 2015, 28(7): 1078-1084 (in Chinese)
[17] 闫雅亭, 王宏元, 乔旭峰, 等. 甲氨基阿维菌素苯甲酸盐对泥鳅的急性毒性[J]. 生态毒理学报, 2013, 8(6): 993-997
Yan Y T, Wang H Y, Qiao X F, et al. Acute toxicity of emamectin benzoate to loach [J]. Asian Journal of Ecotoxicology, 2013, 8(6): 993-997 (in Chinese)
[18] Organisation for Economic Co-operation and Development (OECD). OECD Guideline for the Testing of Chemicals No.203. Fish, Acute Toxicity Test [S]. Paris: OECD, 1992b
[19] Kukkonen J, Landrum P F. Toxicokinetics and toxicity of sediment-associated pyrene to Lumbriculus variegatus (Oligochaeta) [J]. Environmental Toxicology and Chemistry, 1994, 13(9): 1457-1468
[20] 张瑜. 沉积物中芘和五氯苯酚对淡水底栖生物的毒性研究[D]. 天津: 南开大学, 2013
Zhang Y. Toxic effect of pentachlorophenol and pyrene in sediments to the benthic organisms in freshwater system [D]. Tianjin: Nankai University, 2015 (in Chinese)
[21] 刘丽, 张红燕, 钟文珏, 等. 沉积物中六氯苯对颤蚓(淡水单孔蚓)的毒性效应研究[J]. 环境科学学报, 2013, 33(9): 2552-2557
Liu L, Zhang H Y, Zhong W J, et al.The toxic effects of hexachlorobenzene (HCB) in sediments to Monoplephorus limosus (Tubificid) [J]. Acta Scientiae Circumstantiae, 2013, 33(9): 2552-2557 (in Chinese)
[22] Organisation for Economic Co-operation and Development (OECD). Current Approaches in the Statistical Analysis of Ecotoxicity Data: A Guidance to Application. OECD Series on Testing and Assessment No.24 [S]. Paris, France: OECD, 2007
[23] 陈平雁, 黄浙明. IBM SPSS 19 统计软件应用教程 第2版[M]. 北京: 人民卫生出版社, 2012: 136-143, 232-237
[24] 王晓南, 刘征涛, 王婉华, 等. 重金属铬(VI)的生态毒性及其土壤环境基准[J]. 环境科学, 2014, 35(8): 3155-3161
Wang X N, Liu Z T, Wang W H, et al. Ecotoxicological effect and soil environmental criteria of the heavy metal chromium (Ⅵ) [J]. Environmental Science, 2014, 35(8): 3155-3162 (in Chinese)
[25] Landrum P F, Dupuis W S, Kukkonen J. Toxicokinetics and toxicity of sediment-associated pyrene and phenanthrene in Diporeia spp.: Examination of equilibrium-partitioning theory and residue-bases effects for assessing hazard [J]. Environmental Toxicology and Chemistry, 1994, 13: 1769-1780
[26] Marie-Laure L B, Sylvie B R, Francois A, et al. An original decontamination process developed by the aquatic oligochaeteTubifex tubifex exposed to copper and lead [J]. Aquatic Toxicology, 1999, 45: 9-17
[27] Séverine P P, Yahia Y M, Mohamad A, et al. Toxic effects and bioaccumulation of the herbicide isoproturon in Tubifex tubifex (Oligocheate,Tubificidae): A study of significance of autotomy and its utility as a biomarker [J]. Aquatic Toxicology, 2010, 98(1): 8-14
[28] Peter F L, Matti L, Sander D, et al. Effect of 3,4,3',4'-tetrachlorobiphenyl on the reworking behavior of Lumbriculus variegatus exposed to contaminated sediment [J]. Environmental Toxicology and Chemistry, 2004, 23(1): 178-186
[29] Sandra L, Terrail R, Jean-Marc B. Ecotoxicity of uranium toTubifex tubifex worms (Annelida, Clitellata, Tubificidae) exposed to contaminated sediment [J]. Ecotoxicology and Environmental Safety, 2009, 72(2): 527-537
◆
The Toxic Effects of Pyrene in Sediments toMisgurnusanguillicaudatusandLimnodrilushoffmeisteri
Shen Zhaoshuang, Zhang Yanfeng*, Zhu Lingyan
Key Laboratory of Pollution Process and Environmental Criteria of Ministry of Education/Tianjin Key Laboratory of Environmental Remediation and Pollution Control, College of Environmental Science and Engineering, Nankai University, Tianjin 300071, China
The xenobiotics accumulating in sediments may pose hazardous effects to benthos. In this study, the acute and chronic toxic effects of pyrene in sediments on Misgurnus anguillicaudatus and Limnodrilus hoffmeisteri were assessed. For Misgurnus anguillicaudatus, the median lethal concentration (LC50), 10% and median effect concentration (EC10, EC50) of unbalance in 96 h experiment were 548.9, 63.1, 254.8 mg·kg-1, respectively. In 21 d experiment, the LC50was 4.6 mg·kg-1. Meanwhile, it showed that pyrene affected the activity, deepened the body color and inhibited the growth of Misgurnus anguillicaudatus. For Limnodrilus hoffmeisteri, in 28 d experiment, the LC50, EC10and EC50of autotomy were >1 000, 5.1, 85.4 mg·kg-1, respectively. Pyrene might also change the behaviors, such as digging, sediment avoidance and nesting, of Limnodrilus hoffmeisteri in different degrees. According to the results, Misgurnus anguillicaudatus is more sensitive than Limnodrilus hoffmeisteri to pyrene in sediments. This paper provides important toxicity data by standard sediment toxicity tests using native benthic organisms in China, which lays the foundation for deriving the sediment quality criteria.
pyrene; sediment; Misgurnus anguillicaudatus; Limnodrilus hoffmeisteri; toxic effects
10.7524/AJE.1673-5897.20150818002
国家水体污染控制与治理科技重大专项子课题(2012ZX07501-003-04)
沈兆爽(1990-),女,硕士,研究方向为环境化学,E-mail: szzs1990@163.com;
*通讯作者(Corresponding author), E-mail: zhangyf@nankai.edu.cn
2015-08-18 录用日期:2015-10-23
1673-5897(2016)2-672-08
X171.5
A
简介:张彦峰(1977-),男,博士,副教授,主要研究方向为环境科学,发表学术论文10余篇。
沈兆爽, 张彦峰, 祝凌燕. 沉积物中芘对泥鳅和霍甫水丝蚓的毒性效应研究[J]. 生态毒理学报,2016, 11(2): 672-679
Shen Z S, Zhang Y F, Zhu L Y. The toxic effects of pyrene in sediments to Misgurnus anguillicaudatus and Limnodrilus hoffmeisteri [J]. Asian Journal of Ecotoxicology, 2016, 11(2): 672-679 (in Chinese)

