水源水雄激素受体干扰效应及在水处理工艺中的变化
姜巍巍,言野,李娜,马梅,*,王子健,刘茵
1. 上海城市水资源开发利用国家工程中心有限公司,上海 200082 2. 中国科学院生态环境研究中心,北京 100085
水源水雄激素受体干扰效应及在水处理工艺中的变化
姜巍巍1,2,言野2,李娜2,马梅2,*,王子健2,刘茵1
1. 上海城市水资源开发利用国家工程中心有限公司,上海 200082 2. 中国科学院生态环境研究中心,北京 100085
我国很多饮用水源水已检测出雌激素受体干扰效应,但是其他效应如雄激素受体干扰效应却罕见报道。为了弥补这方面资料的缺乏,应用雄激素受体双杂交酵母结合S9代谢方法评价了我国6大流域23个水源地水源水以及3个供水厂不同工艺出水样品的雄激素受体干扰效应。结果显示,所有水源水样品浓缩液均没有检测出雄激素受体直接或间接诱导效应,但都观察到了抑制效应,抑制效应以抑制剂氟他胺当量浓度进行表征:直接抑制效应在0.67~3.68 μg·L-1之间,间接抑制效应在0.52~3.02 μg·L-1之间;长江三角洲和淮河流域水源地的水源水雄激素抑制效应明显高于其他流域;经S9代谢后,有16个水源地的氟他胺当量比代谢前降低。3个饮用水厂处理工艺能够使源水的雄激素受体抑制效应降低19.1%~70.5%。研究表明,我国水源水中普遍含有雄激素受体干扰效应物质,目前水厂常规处理工艺对雄激素受体干扰效应有一定的去除效果,但不能完全去除。雄激素受体双杂交酵母测试能够快速、综合地对水体中的雄激素受体干扰效应进行评价,是饮用水安全评价的重要补充手段。
水源水;雄激素受体;酵母测试;生物毒性测试;饮用水
Received 9 June 2015 accepted 14 March 2016
饮用水安全问题关系到人民群众的身体健康和社会稳定,也是我国公共卫生安全体系的重要组成部分。随着我国经济的迅速发展,工农业生产废水和生活污水将大量污染物带入河流和湖泊。饮用水安全形势非常严峻,饮用水水源水(简称水源水)安全问题越来越突出。在这些环境污染物中,环境内分泌干扰物因其能够引起人和野生动物的生殖生理健康,已经得到了广泛的重视[1]。
目前对于环境内分泌干扰物的评价方法主要有化学分析和生物毒性测试两大类。化学分析方法因其检测限低、重复性好、能够对痕量物质进行定量,已经被证明是检测环境内分泌干扰物的有效方法[2]。例如本文作者利用气相色谱-质谱方法发现内源性雌激素雌二醇,外源性雌激素乙炔基雌二醇,以及双酚A等多种内分泌干扰物在我国的水源水体中广泛存在[3]。然而由于内分泌干扰物种类繁多,化学分析不能穷究环境样品中的所有具有内分泌干扰效应的污染物[4],而且仅由环境内分泌干扰物的浓度并不能得知其毒性效应的强弱。再次,化学分析方法对仪器的依赖度较高,耗时耗力。近年来发展出的离体生物毒性测试方法,通过测定样品的整体内分泌干扰效应而无需知道样品的详细化合物组成,且操作简单、快速、经济和高效的优点,已经成为化学分析方法的重要补充[5]。通过离体生物毒性测试方法测试样品的总体内分泌干扰效应,通过化学分析方法分析样品中已知内分泌干扰物的浓度,再结合各内分泌干扰物的效应强度因子,可甄别出主要的内分泌干扰效应物质[3]。
在环境内分泌干扰物中,对雌激素受体干扰物质的研究最多。很多环境污染物被证实具有雌激素受体干扰效应,它们通过作用雌激素受体发挥干扰作用。现有文献已经证明内分泌干扰物亦能够干扰生物体内的雄激素受体,能够引起多种疾病如肌肉萎缩症等[6]。滴滴涕、双酚A、硫丹、灭蚁灵、多环芳烃和多氯联苯类等诸多常见环境污染物都能够通过作用雄激素受体给人和生物体带来健康和生态风险[7-9]。
本研究采用的重组双杂交雄激素受体基因和Lac Z报道基因酵母评价环境内分泌干扰物的方法,检测了全国23个水源地水源水以及不同水处理工艺出水样品的雄激素受体干扰效应的情况,为评价饮用内分泌干扰物对人体健康的影响提供了一定的基础数据,填补了目前我国饮用水水源缺乏雄激素受体干扰效应的空白。
1 材料与方法 (Materials and methods)
1.1 仪器与试剂
仪器:酶标仪(GENios,Tecan),分光光度计(UV-2000,Unico),恒温96孔平板摇床(Incubator 1000,Heidolph),恒温空气浴振荡摇床(HZQ-F160)和百级超净工作台(BCN-1360)均为哈东联公司产品,固相萃取装置(Visiprep DL SPE,Supelco),旋转蒸发仪(Vac V-500/ Rotavapor R-200/Heating Bath B-490/Vacuum Controller V-800,Buchi),水浴氮吹仪(WD-12,Bilon),蠕动泵(Masterflex),不锈钢板式过滤器(150 mm,Millipore)。
试剂:二氯甲烷、甲醇、正己烷(色谱纯级,J.T. Baker),氟他胺(>98%)、二氢睾酮(>98%)、二甲基亚砜(DMSO,99.5%)和邻硝基苯-β-D半乳糖苷(O-NPG,>99%,Sigma),无氨基酵母氮源(BD),实验过程中使用的纯水全部来自Milli-Q纯水净化系统(Millipore)。其他碳酸钠等均为分析纯,购自国药试剂。
1.2 实验材料
固相萃取小柱(HLB,500 mg,6 mL,Waters),玻璃纤维滤膜(APFF,0.45 μm,Millipore)使用前在450 ℃下烘干4 h。酵母菌保存于-80 ℃的营养缺陷型(SD/-Trp/-Leu)培养液中,使用前重新复苏。即将低温冷冻的酵母菌在4 ℃下缓慢解冻,再将50~100 μL新鲜冻融的酵母菌株接种到15 mL SD培养基中,置于转速150 r·min-1,温度30 ℃全温震荡培养箱中培养36 h,测定稀释10倍培养液在600 nm的光密度(以培养基为空白),读数必须处于0.15~0.5之间。
1.3 样品的采集与前处理
于2010年3月至7月,从全国23个水源地的采样,采集范围涵盖了全国六大流域(表1)。每个样点采水样30 L,于棕色玻璃瓶贮存,并当天运回实验室。采样瓶事先用10%硝酸浸泡过夜,再用铬酸浸泡30 min,超纯水洗涤3次后,于450 ℃下烘烤4 h。水样经玻璃纤维滤膜过滤后,固相萃取柱富集。萃取小柱依次分别用正己烷、二氯甲烷和甲醇各5 mL活化后,对水样进行富集,速率约为6 mL·min-1,然后用真空泵抽干(时间约5 min)。用15 mL二氯甲烷分3次对萃取柱洗脱,每次5 mL。用旋蒸浓缩至2 mL,高纯氮气吹干,用0.3 mL DMSO溶解,-20 ℃冰箱保存备用。选用超纯水作为空白对照,其操作步骤同上。操作过程中所使用的容器均为玻璃或聚四氟乙烯。
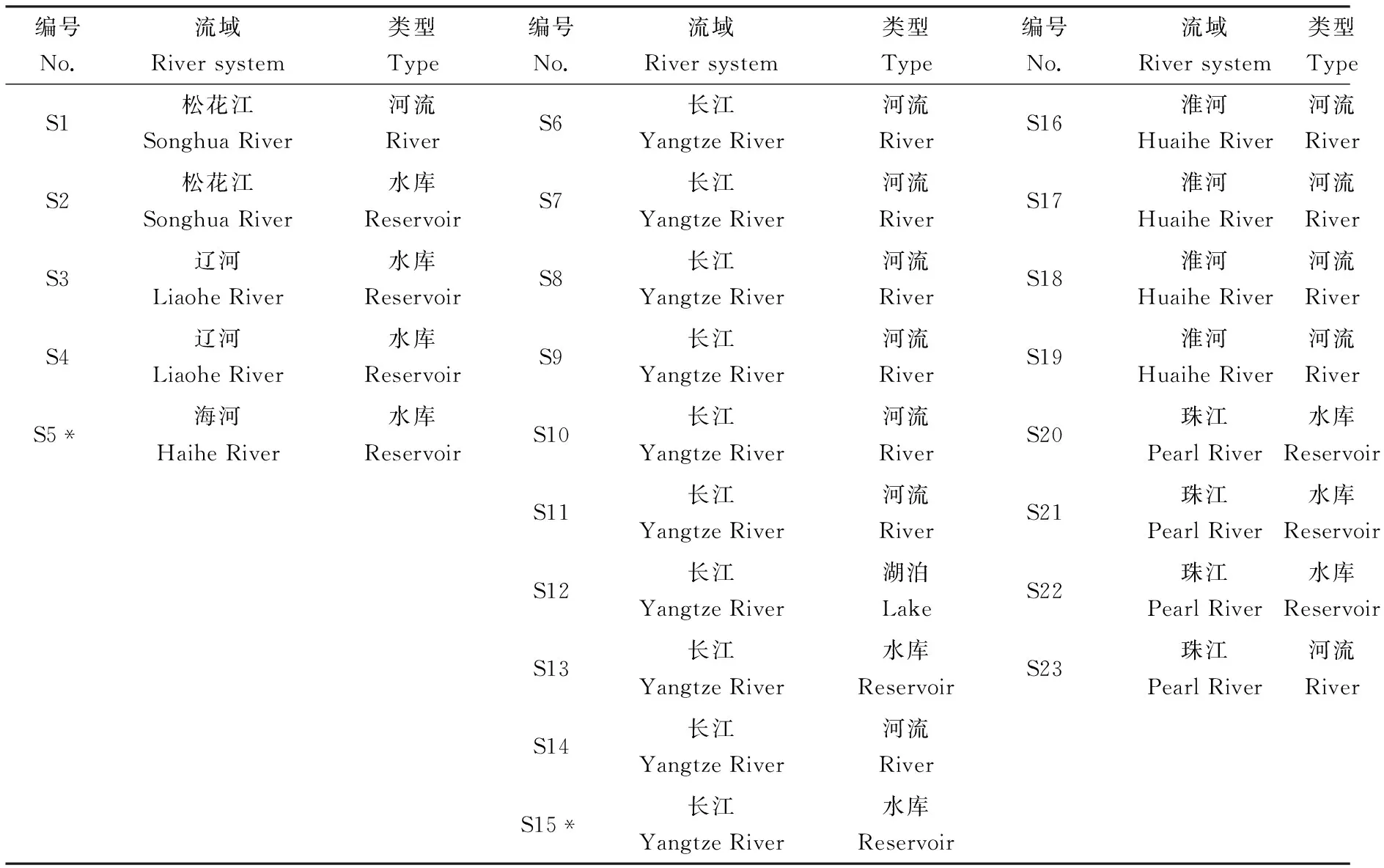
表1 水源地采样点信息

表2 取部分水源水的饮用水水处理工艺流程
注:* 采样点。
Note: * Sample sites.
1.4 酵母测试方法
本实验所用重组人雄激素受体双杂交酵母的基本原理是利用GAL4蛋白的DNA结合域序列(GAL4DNA-BD)和人雄激素受体LBD(hAR-LBD)基因结合,构建出BD- hAR-LBD融合表达载体;同时将GAL4蛋白转录激活结构域(GAL4DNA-AD)和受体共激活因子蛋白GRIP1结合,构建AD-受体共激活因子融合表达载体。将这2个表达载体共转化至酵母Y187内表达。Y187酵母细胞的基因型可表示为Y187(MATα, ura3-52, his3-200, ade2-101, trp1-901, leu2-3112, gal4△, met-, gal80△,URA3:: GAL1UAS-GAL1TATA-lacZ),为色氨酸和亮氨酸缺陷型。当有雄激素存在时,hAR-LBD和受体共激活因子蛋白相互作用,使得GAL4DNA-BD与GAL4DNA-AD在空间上接近,启动报告基因lacZ表达,通过测定报道基因LacZ表达产物β-半乳糖苷酶活性,可以表征化合物的雄激素干扰活性。用氟他胺作为雄激素的标准拮抗剂,将不同浓度的氟他胺与二氢睾酮(5×10-8mol·L-1)共同培养,检测抑制酶活性。结果以对二氢睾酮(5×10-8mol·L-1)诱导酶活性的抑制百分比表示,并绘制剂量效应曲线(标准曲线),求回归方程。
1.4.1 无代谢活化(- S9)的实验步骤
将50~100 μL新鲜冻融的酵母菌株接种到10 mL SD培养液中,按1 μL·mL-1SD培养液比例补加50 μmol·L-1CuSO4,置于转速130 r·min-1, 温度30 ℃全温震荡培养箱中培养20 h;用SD培养液10倍稀释菌液后在600 nm测吸光度(以培养基为空白);进一步稀释菌液使其OD600 nm值为0.2~0.8之间(即在可见波长为600 nm处,吸光度为0.2~0.8,常用0.75);取菌悬液995 μL至对应的Eppendorf管中,分别加入5 μL DMSO(空白),5 μL用DMSO溶解的二氢睾酮(阳性对照)和5 μL用DMSO溶解的样品混匀;将以上溶液各200 μL依次转移到96孔板中。然后于800 r·min-1,30 ℃振荡培养4 h;培养结束后首先测定OD600 nm值;将测完OD600 nm值的溶液吸出150 μL弃去;加入120 μL测试缓冲液(每100 mL基础缓冲液中加入3.33 mL浓度为0.1%的SDS溶液和270 μL β-巯基乙醇)和20 μL氯仿,在30 ℃的恒温摇床上1 100 r·min-1预培养10 min;再加入40 μL O-NPG (13.3 mmol·L-1,溶于基础缓冲液)将酶反应启动;对于E2来说,这样的过程约需要20 min,对于样品来说一般也应在60 min内加入100 μL Na2CO3(1 mol·L-1)溶液终止反应;取上清液200 μL至酶标板中在波长420 nm测OD420 nm值。样品空白的操作与上相同。
1.4.2 代谢(+ S9)实验步骤
将50~100 μL新鲜冻融的酵母菌株接种到10 mL SD培养液中加10 μL CuSO4(按1 μL·mL-1SD培养液比例补加50 μmol·L-1CuSO4),置于130 r·min-1,温度为30 ℃的恒温摇床中培养20 h;用SD培养液10倍稀释菌液后在600 nm测吸光度(以培养基为空白);进一步稀释菌液使其OD600 nm值为 0.2~0.8之间(常用0.75)(即在可见波长为600 nm处,吸光度为0.2~0.8);取S9混合液150 μL至对应的EP管中,分别加入5 μL DMSO(空白),5 μL用DMSO溶解的阳性对照和5 μL用DMSO溶解的样品混匀,混合,180 r·min-1、30 ℃振荡代谢2 h;再向EP管中加入845 μL的酵母菌悬液,混匀。将以上溶液各200 μL依次转移到96孔板中。然后于800 r·min-1,30 ℃振荡培养2 h;培养结束后首先测定OD600 nm值;将测完OD600 nm值的溶液吸出150 μL弃去;加入120 μL基础缓冲液和20 μL氯仿(每孔逐滴加入),在30 ℃的恒温摇床上1 100 r·min-1预培养10 min;再加入40 μL O-NPG(13.3 mmol·L-1,溶于基础缓冲液)将酶反应启动,随着进一步的培养,对于E2来说,这样的过程约需要20 min,对于样品来说一般也应在60 min内加入100 μL Na2CO3(1 mol·L-1)溶液终止反应;取上清液200 μL至酶标板中在波长420 nm测OD420 nm值。样品空白的操作与上相同。
1.5 数据处理
半乳糖苷酶活性U计算如下:
U= (OD420s-OD420b)/(t×V×OD600)
(1)
其中:OD420s,OD420b分别表示样品和空白对照在波长420 nm的吸光度;OD600为样品在波长600 nm的吸光度;t为酶反应时间(120 min);V为测定时溶液体积(0.2 mL)。
用Logistic数学模型对氟他胺拮抗剂与二氢睾酮所产生的剂量-效应关系曲线进行拟合,软件选用OriginPro 8.0,方程为:
(2)
其中,U为半乳糖苷酶活性;A1为方法检测限;A2为曲线最大活性值;c为测试化合物浓度;c0为半数抑制效应浓度;p为曲线中段部分的相对斜率。
抑制活性采用抑制率(%)来表示:
抑制率
IR=(1-Us/Up)×100%
(3)
式中,Us为样品诱导产生的酶活性,Up为阳性对照诱导产生的酶活性。
再根据氟他胺对5×10-8mol·L-1二氢睾酮抑制率的标准曲线(方程同(1)),将样品对5×10-8mol·L-1二氢睾酮的抑制率折算成氟他胺的当量值。
2 结果与讨论(Results and discussion)
2.1 氟他胺对二氢睾酮活性抑制的剂量-效应关系
氟他胺作为非类固醇的雄激素拮抗剂,常用作前列腺癌的抗癌剂使用,在前列腺中能够与睾酮及二氢睾酮等竞争性结合雄激素受体[10]。本实验选取氟他胺作为雄激素的标准拮抗剂,暴露双杂交酵母细胞,考察其对酵母酶活性值的抑制作用。经不同浓度的氟他胺分别与二氢睾酮(5×10-8mol·L-1)共同作用于酵母细胞,结果发现氟他胺对二氢睾酮诱导酶活性具有明显的抑制作用,与抑制百分率呈剂量效应关系,式(2)中A1=1.06、A2=101.80、c0=7.40×10-6、p=0.49(图1)。根据抑制的剂量-效应关系,氟他胺的半数抑制效应浓度值(IC50)为7.4×10-6mol·L-1,与Sohoni等[11]报道氟他胺对二氢睾酮抑制的结果非常接近。
2.2 水源水雄激素受体干扰效应
所有水源水样品浓缩液都没有检测出雄激素受体诱导效应(数据未列出),但是都检测出了雄激素受体抑制效应。未经S9代谢的水样抑制效应值在0.67~3.68 μg·L-1FEQ (氟他胺当量)之间,经代谢后的水样抑制效应值在0.52~3.02 μg·L-1FEQ之间的流域
有一定的关系,全国六大流域的水样都普遍含有雄激素受体抑制效应物质。从流域方面来看,未经S9代谢时,淮河和长江下游流域的水源地水样的雄激素受体抑制效应平均值分别为2.79、2.24 μg·L-1FEQ,明显高于其他流域;其他流域从高到低依次为松花江流域1.64 μg·L-1FEQ、海河流域1.25 μg·L-1FEQ、珠江流域1.23 μg·L-1FEQ、辽河流域0.78 μg·L-1FEQ;经S9代谢后,雄激素受体抑制效应最高的依然是淮河和长江流域,分别为2.72、2.02 μg·L-1FEQ;其他流域从高到低依次为珠江流域1.07 μg·L-1FEQ、松花江流域1.06 μg·L-1FEQ、辽河流域0.95 μg·L-1FEQ、海河流域0.88 μg·L-1FEQ(图3)。
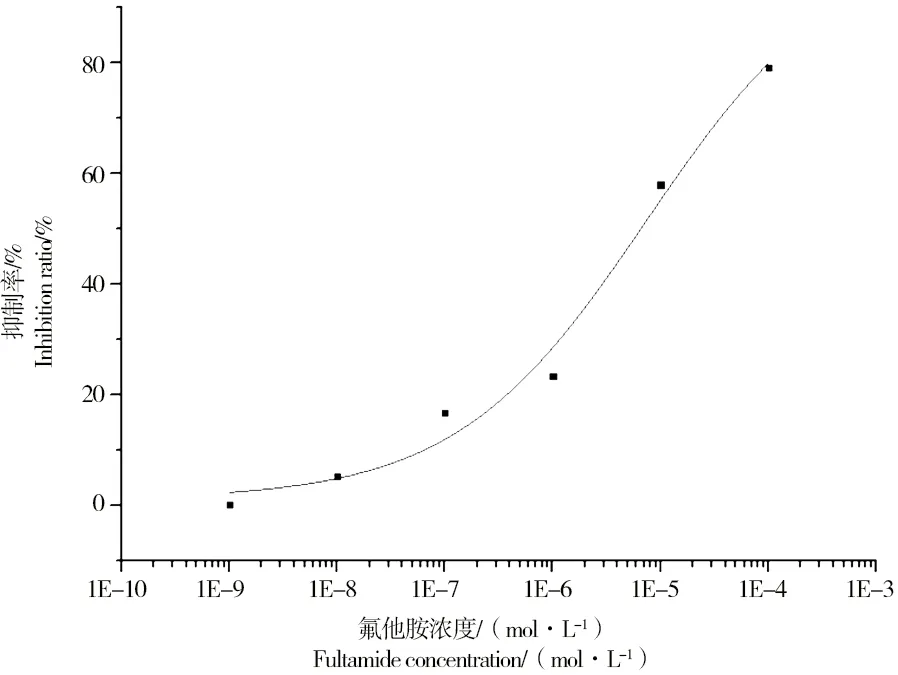
图1 氟他胺对5×10-8 mol·L-1二氢睾酮诱导酶活性抑制的剂量-效应关系(n=3)Fig. 1 Dose-response curve of inhibition activity by flutamide to 5×10-8 mol·L-1 dihydrotestosterone (n=3).
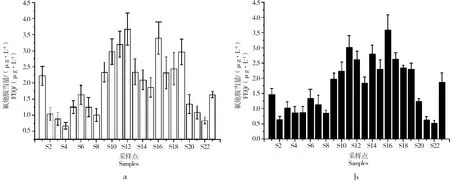
图2 水源水雄激素受体抑制效应(n=3) 注:a,未代谢;b,代谢后。Fig. 2 AR antagonist activities of source waters (n=3) Note: a, without metabolism; b, with metabolism.

图3 流域之间雄激素受体抑制效应的比较Fig. 3 AR antagonist activities of river systems
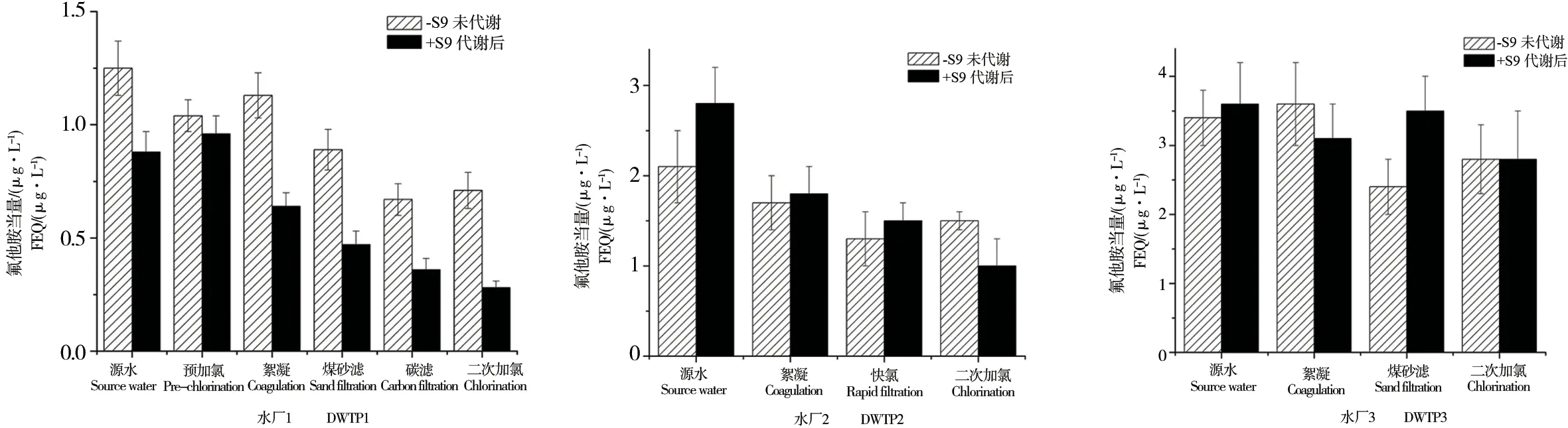
图4 饮用水处理工艺出水雄激素受体抑制效应(n=3)Fig. 4 AR antagonist activities of DWTPs (n=3)
水源水和饮用水中存在各种各样的环境污染物,如抗氧化剂、有机氯、有机磷、抗生素、内分泌干扰物以及很多工业生产的杀虫剂、药品和个人护理品等。Zhang等[12]研究了我国人群和动物排泄的内分泌干扰物浓度水平,并结合58个流域人口和经济发展水平,预测了各流域排放的内分泌干扰物总量。结果表明,东部排放量和密度明显高于西部。其中,淮河流域排放量最大,长江、黄河、松花江流域紧随(图2)。水样的雄激素受体抑制效应与采样点所在其后。淮河、长江流域是我国经济发展较快、人口和大城市较多、工业较为密集的地区,可见流域水源地中雄激素受体干扰物的浓度水平与该地区的发展水平密切相关。此外,Hodges等[13]也发现在中国的东部和南方地区,个人护理品的排放量比其他地区要高,和当地居民的较富裕的生活水平有关系,这些地区的居民有能力使用大量的个人护理品。个人护理品包含大量药品、化妆品等,这些化学物质很多都具有内分泌干扰效应。在中国水体中被广泛检出的很多污染物已经被证实具有雄激素受体干扰效应,包括双酚A、邻苯二甲酸酯类和4-苯基苯酚等[14-18]。可见随着我国经济的发展,工业化程度的提高,越来越多的环境污染物被排放到水体中,这些与水体的内分泌干扰活性有着密切的关系。
很多体内测试结果表明代谢能够升高或降低某些化合物的激素受体干扰效应,但是这些过程很复杂,机理不明确,涉及很多生物化学反应包括水解、甲基化、磺化、葡萄苷酸化和芳基化等[19-21]。本研究的结果表明代谢能够升高或降低某些化合物的雄激素受体干扰效应。
2.3 饮用水处理工艺出水雄激素受体效应
样品的雄激素受体干扰效应检测结果表明,所有检测样品不具有雄激素受体诱导效应;但是,测试样品均检测出雄激素受体抑制效应(图3)。雄激素受体抑制效应范围,DWTP1:代谢前为0.7~1.3 μg·L-1,代谢后为0.3~1.0 μg·L-1;DWTP2:代谢前为1.3~2.1 μg·L-1,代谢后为1.0~2.8 μg·L-1;DWTP3:代谢前为2.4~3.4 μg·L-1,代谢后为2.8~3.6 μg·L-1。3个饮用水厂能够使代谢前原水的雄激素受体抑制效应化合物分别降低42.4%、28.6%和19.1%,代谢后分别降低70.5%、64.3%和23.3%。
常规饮用水处理工艺均不能完全去除原水中雄激素受体抑制效应物质,对代谢后的这类物质的去除效果要优于代谢前,这一点与维甲酸受体抑制效应物质的结果相类似[22]。Ormad等[23]研究表明,过滤工艺能够去除60%的有机氯农药。然而过滤工艺是一个物理过程,并没有分解有机污染物,只是将有机污染物从一种介质转移到另一种介质,对滤料上吸附的有机物仍需后续处理。总之,净水工艺对雄激素受体干扰物的去除过程非常复杂,即使不同水厂的相同工艺,去除效果也不同。
尽管水源水和饮用水中的雄激素受体干扰物的浓度水平很低,但是因为这类内分泌干扰物在很低浓度时就能够影响生物体的生理功能,并且常规的水处理工艺不能够完全去除这类物质,因此出水中含有的这类物质仍然有可能危害水质安全,给人体带来风险[24-25]。
我国水源水和自来水厂出水中普遍具有雄激素受体干扰效应物质。饮用水常规处理工艺不能完全去除这类物质,给人体健康带来隐患。今后需继续对水体中的主要雄激素受体干扰效应物质进行甄别和评价。重组双杂交雄激素受体酵母测试结合S9代谢活化步骤能够快速、准确的对水体中的雄激素受体干扰效应进行评价,是饮用水安全评价的重要补充手段。
[1] 李杰, 司纪亮. 环境内分泌干扰物质简介[J]. 环境与健康杂志, 2002, 19(1): 83-84
Li J, Si J L. Introduction of environmental endocrine disruptors [J]. Journal of Environmental Health, 2002, 19(1): 83-84 (in Chinese)
[2] Vanderford B J, Pearson R A, Rexing D J, et al. Analysis of endocrine disruptors, pharmaceuticals, and personal care products in water using liquid chromatography/tandem mass spectrometry [J]. Analytical Chemistry, 2003, 75(22): 6265-6274
[3] Jiang W, Yan Y, Ma M, et al. Assessment of source water contamination by estrogenic disrupting compounds in China [J]. Journal of Environmental Sciences, 2012, 24(2): 320-328
[4] Tanaka H, Yakou Y, Takahashi A, et al. Comparison between estrogenicities estimated from DNA recombinant yeast assay and from chemical analyses of endocrine disruptors during sewage treatment [J]. Water Science and Technology, 2001, 43(2): 125-132
[5] Campbell C G, Borglin S E, Green F B, et al. Biologically directed environmental monitoring, fate, and transport of estrogenic endocrine disrupting compounds in water: A review [J]. Chemosphere, 2006, 65(8): 1265-1280
[6] Tapier H, Ba G N, Tew K D. Estrogens and environmental estrogens [J]. Biomed Pharmacother, 2002, 56(1): 36-44
[7] Sohoni P, Sumpter J P. Several environmental oestrogens are also anti-androgens [J]. The Journal of Endocrinology, 1998, 158(3): 327-339
[8] Xu L C, Sun H, Chen J F, et al. Evaluation of androgen receptor transcriptional activities of bisphenol A, octylphenol and nonylphenol in vitro [J]. Toxicology, 2005, 216(2-3): 197-203
[9] Li J, Ma M, Giesy J P, et al. In vitro profling of endocrine disrupting potency of organchlorine pesticides [J]. Toxicology Letters, 2008, 183: 65-71
[10] Labrie F. Mechanism of action and pure antiandrogenic properties of flutamide [J]. Cancer, 1993, 72: 3816-3827
[11] 李剑, 饶凯锋, 马梅, 等. 核受体超家族及其酵母双杂交检测技术[J]. 生态毒理学报, 2008, 3(6): 521-532
Li J, Rao K F, Ma M, et al. Nuclear receptor superfamily and yeast two-hybrid system [J]. Asian Journal of Ecotoxicology, 2008, 3(6): 521-532 (in Chinese)
[12] Zhang Q Q, Zhao J L, Ying G G, et al. Emission estimation and multimedia fate modeling of seven steroids at the river basin scale in China [J]. Environmental Science & Technology, 2014, 48(14): 7982-7992
[13] Hodges J E N, Holmes C M, Vamshi R, et al. Estimating chemical emissions from home and personal care products in China [J]. Environmental Pollution, 2012, 165: 199-207
[14] Huang Y Q, Wong C K C, Zheng J S, et al. Bisphenol A (BPA) in China: A review of sources, environmental levels, and potential human health impacts [J]. Environment International, 2012, 42: 91-99
[15] Wang F, Xia X, Sha Y. Distribution of phthalic acid esters in Wuhan section of the Yangtze River, China [J]. Journal of Hazardous Materials, 2008, 154(1-3): 317-324
[16] Fan Z, Wu S, Chang H, et al. Behaviors of glucocorticoids, androgens and progestogens in a municipal sewage treatment plant: Comparison to estrogens [J]. Environmental Science & Technology, 2011, 45(7): 2725-2733
[17] Shi W, Hu X, Zhang F, et al. Occurrence of thyroid hormone activities in drinking water from Eastern China: Contributions of phthalate esters [J]. Environmental Science & Technology, 2012, 46(3): 1811-1818
[18] Zhao J L, Ying G G, Yang B, et al. Screening of multiple hormonal activities in surface water and sediment from the Pearl River system, South China, using effect-directed in vitro bioassays [J]. Environmental Toxicology and Chemistry, 2011, 30(10): 2208-2215
[19] Legler J, Dennekamp M, Vethaak A D, et al. Detection of estrogenic activity in sediment-associated compounds using in vitro reporter gene assays [J]. Science of the Total Environment, 2002, 293(1-3): 69-83
[20] Pottenger L H, Domoradzki J Y, Markham D A, et al. The relative bioavailability and metabolism of bisphenol A in rats is dependent upon the route of administration [J]. Toxicological Sciences, 2000, 54(1): 3-18
[21] Moffat G J, Burns A, Van Miller J, et al. Glucuronidation of nonylphenol and octylphenol eliminates their ability to activate transcription via the estrogen receptor [J]. Regulatory Toxicology and Pharmacology, 2001, 34(2): 182-187
[22] Jiang W, Yan Ye, Li N, et al. Retinoid X receptor activities of source waters in China and their removal efficiencies during drinking water treatment processes [J]. Chinese Science Bulletin, 2012, 57(6): 595-600
[23] Ormad M P, Miguel N, Claver A, et al. Pesticides removal in the process of drinking water production [J]. Chemosphere, 2008, 71(1): 97-106
[24] Benotti M J, Trenholm R A, Vanderford B J, et al. Pharmaceuticals and endocrine disrupting compounds in U.S. drinking water [J]. Environmental Science & Technology, 2008, 43(3): 597-603
[25] Kim S D, Cho J, Kim I S, et al. Occurrence and removal of pharmaceuticals and endocrine disruptors in South Korean surface, drinking, and waste waters [J]. Water Research, 2007, 41(5): 1013-1021
◆
Androgen Receptor Activities of Source Waters and Their Changes during Drinking Water Treatment Processes
Jiang Weiwei1,2, Yan Ye2, Li Na2, Ma Mei2,*, Wang Zijian2, Liu Yin1
1. Shanghai Municipal Water Resource Development and Utilization National Engineering Center Co., Ltd, Shanghai 200082, China 2. State Key Laboratory of Environmental Aquatic Chemistry, Research Center for Eco-Environmental Sciences, Chinese Academy of Sciences, Beijing 100085, China
There is increasing evidence of estrogenic activities of source waters and drinking waters in China based on estrogen receptors (ERs) testing. However, relating such activities to androgen receptors (ARs) in source waters are lacking. To rectify this situation, 23 source water samples from six major river systems in China were assessed using a two-hybrid AR yeast assay without and with metabolism, focusing on agonistic and antagonistic activity. No AR agonistic activity was observed, but significant antagonistic activity was detected in all sample extracts. The AR antagonistic activities of source water sample extracts ranged from 0.67 to 3.68 μg·L-1FEQ (fultamide equivalence) without metabolism, and 0.52 to 3.02 μg·L-1FEQ with metabolism, respectively. Most source waters with high FEQ values were located in the Yangtze River Delta and Huaihe River System. After metabolism, antagonist activities of 16 out of 23 source water sample extracts were decreased. The AR antagonistic activities of finished water samples are 19.1%-70.5% lower than source water. The results showed that AR antagonistic activities were widespread in source waters in China. Two-hybrid AR yeast assay could be an important method in drinking water safety assessment regarding its time-saving and preciseness.
source water; androgen receptor; yeast assay; bioassay; drinking water
10.7524/AJE.1673-5897.20150609001
国家自然科学基金重大项目(51290283);中科院“十三五”规划重点培育方向项目(YSW2013A02);上海市科学技术委员会科研计划项目(14231200303)
姜巍巍(1984-),男,博士,高级工程师,研究方向为水生态毒理学,E-mail: jiang_weiwei@hotmail.com
*通讯作者(Corresponding author), E-mail: mamei@rcees.ac.cn
2015-06-09 录用日期:2016-03-14
1673-5897(2016)2-405-08
X171.5
A
简介:马梅(1967-),女,博士,研究员,研究方向为水生态毒理学。
姜巍巍, 言野, 李娜, 等. 水源水雄激素受体干扰效应及在水处理工艺中的变化[J]. 生态毒理学报,2016, 11(2): 405-412
Jiang W W, Yan Y, Li N, et al. Androgen receptor activities of source waters and their changes during drinking water treatment processes [J]. Asian Journal of Ecotoxicology, 2016, 11(2): 405-412 (in Chinese)

