内质网应激在PFOS致大鼠肝损伤中的作用
肖静,毛伟明,丁慧,丁晴,鹂璐,齐聪,徐仙,刘梦,包怡宁
1. 南通大学公共卫生学院 职业卫生与环境毒理学教研室,南通 226019 2. 新疆医科大学公共卫生学院,乌鲁木齐 830054
内质网应激在PFOS致大鼠肝损伤中的作用
肖静1,*,毛伟明1,丁慧1,丁晴1,鹂璐1,齐聪1,徐仙2,刘梦1,包怡宁1
1. 南通大学公共卫生学院 职业卫生与环境毒理学教研室,南通 226019 2. 新疆医科大学公共卫生学院,乌鲁木齐 830054
通过全氟辛烷磺酸(PFOS) 28 d大鼠经口染毒评价PFOS肝损伤效应,探讨内质网应激在PFOS毒效应中的作用。Wistar大鼠随机分组,分别以0 mg·kg-1、5 mg·kg-1和10 mg·kg-1PFOS 灌胃染毒28 d。HE染色观察大鼠肝脏形态改变。ELISA法测定各组丙氨酸转氨酶(ALT)、天门冬氨酸转氨酶(AST)、碱性磷酸酶(ALP)和淀粉酶(AMY)含量变化。紫外分光光度法测定肝组织匀浆中丙二醛(MDA)、超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)活性变化。RT-PCR检测肝脏内质网应激标志蛋白表达水平。结果表明,PFOS造成大鼠体重降低、肝重增高(P<0.05),组织切片显示肝细胞出现脂质沉积。PFOS不同剂量组大鼠ALT随暴露浓度增加,分别为(50.96±10.02) U·L-1、(71.73±11.55) U·L-1,显著高于对照组(P<0.05),AST、ALP含量与对照组相比显著上升(P<0.05),高剂量组AMY水平为(833.46±63.05) U·L-1,与对照组相比显著降低(P<0.05)。GSH-Px和SOD水平随PFOS浓度增加出现了显著降低(P<0.05),而MDA水平显著升高(P<0.05)。内质网应激标志蛋白表达均较对照组显著上升(P<0.05)。以上结果说明PFOS可导致大鼠肝细胞损伤,其机制可能与内质网应激调控有关。
全氟辛烷磺酸(PFOS);大鼠;肝损伤;内质网应激
Received 9 November 2015 accepted 18 November 2015
全氟辛烷磺酸(perfluorooctane sulfonate, PFOS)是全氟有机化合物(perfluorinated compounds, PFCs)的一种,因其物理化学性质稳定而在纺织、皮革制造、农药及个人消费领域广泛应用,但同时PFOS所具有的疏水疏油特性使其难以降解并易在各环境介质间迁移,目前在大气、水体和土壤中都已检测到PFOS的广泛存在[1-2]。环境中的PFOS可通过呼吸、饮食等方式进入机体,并在生物放大、生物浓缩等作用下在人体内富集产生毒性效应,代谢动力学实验表明肝脏为PFOS主要蓄积和作用器官[3-4]。目前研究发现PFOS可导致实验动物出现肝细胞通讯异常、引发线粒体肿胀、生物膜结构受损,造成肝细胞变性坏死和级联炎性反应,影响肝脏正常功能及基因表达转录[5-6],有研究这认为PFOS的这种损害结局可能与过氧化物酶体增殖激活受体(peroxisome proliferators-activated receptor, PPAR)及其下游基因表达过度上调有关[6],但也有学者指出不同种属动物及人体内PPAR在表达分布及功能调控上均存在一定差异,且不同全氟化合物对啮齿类动物和人类PPAR各亚基激活能力各有不同,相对啮齿类动物,PFOS对人类PPAR的作用较弱[7-9]。Rosen等[10]发现小鼠敲除PPAR基因后,肝脏肿大、脂质堆积及炎性反应并未消失,Jacquet等[11]和Takacs等[12]通过细胞转染实验也认为PFOS存在独立于PPAR之外的损伤途径。但截至目前,对PFOS所致肝脏损伤的具体机制尚未明了。
近年研究表明应激反应是肝损伤过程中的重要环节之一,其中内质网应激(endoplasmic reticulum stress, ERS)ERS作为独立于细胞膜受体或线粒体途径的第3条凋亡途径参与了包括外源化学物、病毒、非酒精性脂肪肝等多种因素引起的肝损伤发生发展[13-14]。ERS作为细胞自我保护机制,正常情况下参与机体应对外在刺激的多重信号传导及基因网络调控,但当ERS过度时,可通过C/EBP同源蛋白(C/EBP homology protein, CHOP)、葡萄糖调节蛋白-78(glucose regulated protein-78, GRP78)、c-Jun氨基末端激酶(c-Jun N-terminal kinase, JNK)及半胱氨酸蛋白水解酶介导的多种方式促进细胞信号错误,导致疾病发生[15]。鉴于以上原因,我们拟通过动物实验考察PFOS对大鼠肝脏损害效应表现及对ERS标志蛋白表达的影响,借此探讨PFOS肝损伤的潜在机制与可能途径,为PFOS生态毒理学研究提供基础数据。
1 材料与方法 (Materials and methods)
1.1 试剂与仪器
试剂:全氟辛烷磺酸(Assay LC-MS 98%,Sigma-Aldrich公司,美国);RT-PCR试剂及引物(TaKaRa大连宝生物公司,中国);丙氨酸转氨酶试剂盒、谷草转氨酶试剂盒、碱性磷酸酶试剂盒(Applied Biosystems公司,美国);单胺氧化酶、超氧化物歧化酶、谷胱甘肽、琥珀酸脱氢酶试剂盒(碧云天生物研究所,中国);其他试剂均为国产分析纯。
仪器:5332型PCR仪(Eppendorf公司,德国)、MODEL550酶标仪(Bio-Rad公司,美国)、RM2126切片机(Leica公司,德国)、CK40显微镜(Olympus公司,日本)、CFI60数码相机(Nikon, 日本);
1.2 试验动物及染毒
考虑到文献报道中PFOS对雄性大鼠具有较为明显的毒性效应[16-17],本次实验选用成年Wistar雄性大鼠48只,体重220~250 g,上海西普尔必凯实验动物有限公司提供(SCXK沪2008-0016),实验室驯养1周后随机分为0 mg·kg-1PFOS(对照组)、5 mg·kg-1PFOS(低剂量组)和10 mg·kg-1PFOS(高剂量组)(n = 16),灌胃染毒28 d。期间每周称重并于实验结束颈椎脱臼处死动物,采集血清及肝脏样本进行相关指标检测。动物饲养室温(18~23) ℃,相对湿度45%~55%。实验期间自由饮水摄食。
1.3 指标检测
1.3.1 脏器系数
大鼠处死前称重,处死后用预冷生理盐水漂洗肝脏,滤纸吸干称取肝重计算脏器系数:脏器系数(%)=脏器重量(g)/大鼠体重(g)×100%。
1.3.2 肝脏病理观察
肝脏组织用10%中性福尔马林溶液固定,常规脱水后石蜡包埋制备4 μm切片,HE染色后显微镜观察其病理学变化。
1.3.3 血清中代谢酶测定
大鼠经下腔静脉取血后室温3 000 r·min-1离心分离血清,ELISA试剂盒检测血清中丙氨酸转氨酶(ALT)、天门冬氨酸转氨酶(AST)、碱性磷酸酶(ALP)和淀粉酶(AMY)水平。
1.3.4 氧化还原酶活力测定
取大鼠肝脏组织1 g,按重量体积比加生理盐水制备10%组织匀浆,2 000 r·min-1离心5 min取上清。硫代巴比妥酸(TBA)法测定丙二醛(MDA)含量,黄嘌呤氧化酶法测定超氧化物歧化酶(SOD)含量,DTNB直接法测定谷胱甘肽过氧化物酶(GSH-Px)含量,具体操作按试剂盒说明书进行。
1.3.5 内质网应激蛋白表达水平检测
大鼠处死后迅速剖腹摘取肝脏,称取100 mg肝组织,Trizol抽提总RNA,紫外分光光度计测定OD260/OD280比值以检验纯度,两步法进行反转录和实时PCR。扩增所用引物如下:GRP78-F:AACCCAGATGAGGCTGTAGCA,GRP78-R:ACATCAAGCAGAACCAGGTCA;CHOP-F:CCAGCAGAGGTCACAAGCAC,CHOP-R:CGCACTGACCACTCTGTTTC;管家基因ß-Actin-F:CAGTGTGGGTGACCCCGT,ß-Actin-R:CCCAGCCATGTACGTTGCTA。反应体系为10 μg·μL-1cDNA模板2 μL、10 μmol·L-1引物各0.4 μL、2×SYBR 10 μL、ddH2O补充总体积为20 μL。反应条件为95 ℃ 5 s,退火温度65 ℃ 30 s,72 ℃ 30 s,反应40个循环计算相对表达量。
1.4 统计学分析

2 结果(Results)
2.1 PFOS暴露对大鼠一般状况的影响
随实验周期进展,PFOS暴露组大鼠出现活动迟缓、被毛暗淡、毛发竖直现象,其中以10 mg·kg-1组大鼠更为明显,偶有大鼠出现轻微腹泻、鼻出血,个别实验动物出现脱毛、蜷卧。随染毒时间延长、剂量增加,暴露组大鼠出现不同程度体型消瘦。
如表1所示,实验第3周时,10 mg·kg-1暴露组大鼠体重(288.4±20.6) g与0 mg·kg-1组(344.4±24.9) g相比出现显著降低(P<0.05),5 mg·kg-1暴露组大鼠虽也出现了体重减少(318.5±19.5) g,但与0 mg·kg-1组相比差异并不显著。第4周时5 mg·kg-1和10 mg·kg-1PFOS暴露组大鼠体重分别为(339.2±14.7) g和(304.4±19.7) g,相比0 mg·kg-1组(387.1±19.3) g均出现显著降低(P<0.05),但不同剂量组间无显著差异。如表2所示,与此同时,PFOS暴露造成大鼠肝重的增加,不同剂量组大鼠肝脏系数与0 mg·kg-1组相比均显著增加(P<0.05)。
2.2 PFOS暴露对大鼠肝脏形态影响
对各组大鼠肝脏形态进行比较,大体观察可见0 mg·kg-1组大鼠肝脏色泽鲜红,质地柔软且表面光滑,边缘锐利,光镜下HE染色显示肝细胞排列整齐,细胞中央有大而圆的核,细胞质均匀。而在PFOS暴露组大体可见明显的肝脏体积增大,肝脏表面出现黄色点状分布的脂肪沉着,肝脏边缘变钝,HE染色镜下观察染毒组肝细胞肿胀,胞质内可见大小不等的脂滴空泡并将细胞核挤向一侧,在10 mg·kg-1组改变更为明显。



GroupDay0Day7Day14Day21Day280mg·kg-1215.5±15.6287.9±14.8319.1±19.9344.4±24.9387.1±19.35mg·kg-1238.6±17.2290.6±19.1311.5±18.1318.5±19.5339.2±14.710mg·kg-1229.4±15.7268.9±20.0284.7±13.8288.4±20.6*304.4±19.7*
注:*表示与0 mg·kg-1组相比P<0.05。
Note:* P<0.05 compared with 0 mg·kg-1group.

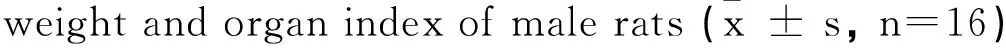
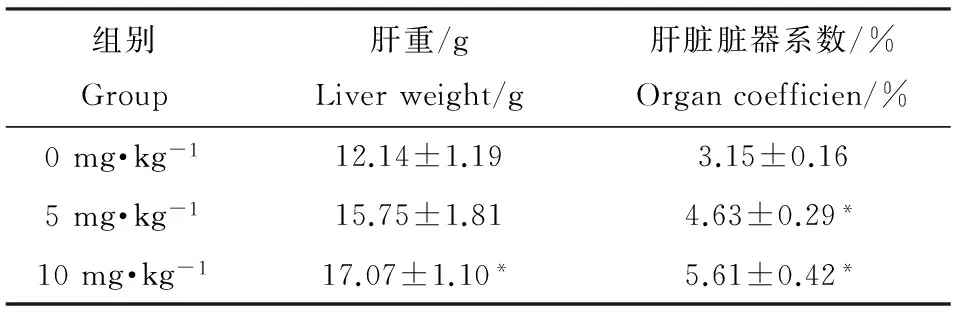
组别Group肝重/gLiverweight/g肝脏脏器系数/%Organcoefficien/%0mg·kg-112.14±1.193.15±0.165mg·kg-115.75±1.814.63±0.29*10mg·kg-117.07±1.10*5.61±0.42*
注:*表示与0 mg·kg-1组相比P<0.05。
Note:* P<0.05 compared with 0 mg·kg-1group.
2.3 PFOS暴露对大鼠血清中肝脏代谢酶水平影响
对PFOS暴露后大鼠血清中肝功能相关酶活性进行了检测,结果如表3所示。PFOS暴露造成ALT、AST、ALP含量显著上升(P<0.05),其中ALT水平随暴露浓度增高显著上升(P<0.05),AST和ALP水平在PFOS各暴露组中均显著高于0 mg·kg-1组(P<0.05),但各暴露组间差异并不显著。AMY在5 mg·kg-1PFOS组改变并不明显,但在10 mg·kg-1组中较对照组出现了显著降低(P<0.05)。
2.4 PFOS暴露对大鼠氧化还原指标的影响
对各组大鼠肝细胞匀浆中氧化还原酶水平的检测发现,5 mg·kg-1PFOS暴露组大鼠肝脏SOD活性相比对照组略有增高,但差异并不显著,而在10 mg·kg-1组SOD水平随PFOS浓度增加出现了显著的降低(P<0.05)。与此同时如表4所示,GSH-Px活性同样受到PFOS暴露的影响,与0 mg·kg-1组相比在各暴露组出现了显著降低(P<0.05),且随PFOS浓度增高受影响程度更为显著(P<0.05),与GSH-Px趋势类似,在暴露组中随PFOS浓度增加MDA水平也随之显著升高(P<0.05)。

图1 PFOS对大鼠肝脏组织病理的影响(HE×100) 注:A,0 mg·kg-1;B,5 mg·kg-1;C,10 mg·kg-1。Fig. 1 Effect of PFOS on liver tissue morphology (HE×100) Note: A, 0 mg·kg-1; B, 5 mg·kg-1; C, 10 mg·kg-1.

表3 PFOS暴露对大鼠血清肝代谢酶的影响
注:*表示与0 mg·kg-1组相比P<0.05,#表示与5 mg·kg-1相比P<0.05。
Note:* P<0.05 compared with 0 mg·kg-1group; # P<0.05 compared with 5 mg·kg-1group.
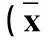
表4 PFOS暴露对大鼠肝组织中氧化还原酶的影响± s,n=16)
注:*表示与0 mg·kg-1组相比P<0.05,#表示与5 mg·kg-1相比P<0.05。
Note:* P<0.05 compared with 0 mg·kg-1group; # P<0.05 compared with 5 mg·kg-1group.
2.5 PFOS暴露对大鼠肝脏内质网应激蛋白表达水平影响
为了解PFOS是否造成内质网应激的出现,对肝脏中ERS标志蛋白GRP78和CHOP表达水平进行了检测。GRP78 mRNA水平在PFOS暴露后,相较对照组均出现了显著上升,分别为对照组的1.87倍和2.75倍,并随着暴露浓度增加表达水平显著升高。实验中同样发现PFOS导致了CHOP mRNA相对表达量的显著增高,分别为对照组1.30和1.53倍,但不同剂量组间CHOP表达差异并不显著。
3 讨论(Discussion)
PFOS作为全氟化合物的典型代表,是目前继多氯联苯、有机氯农药和二噁英之后的一种新型持久性有机污染物,PFOS众多毒效应中以肝脏损害较为明显[18]。本实验中发现PFOS暴露组大鼠血清ALT、AST、ALP和AMY水平随PFOS染毒剂量增加改变显著。ALT、AST为分布于肝细胞胞质及线粒体中的非特异性功能酶,在肝细胞破坏时释放入血。ALP通常由肝脏排泄,肝损伤时可经淋巴道和肝窦反流入血出现增高。AMY是催化淀粉和糖原水解的淀粉酶,有研究发现AMY与肝炎、肝纤维化进程有关[19-20],在轻中度肝损害时可能出现降低[21],与此同时,代谢性疾病患者如胰岛素抵抗人群也常伴随AMY活性减退,证实与肝功能受损直接或间接影响胰腺细胞结构或功能有关[19, 22]。本实验中发现除AMY仅在高剂量组出现降低外,其余指标均表现为随PFOS暴露剂量增加而改变显著,这与动物和人群实验中观察到现象一致[6, 23],表明PFOS可能已造成肝细胞破坏及肝脏代谢紊乱,提示肝脏损害出现。
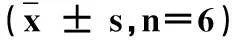
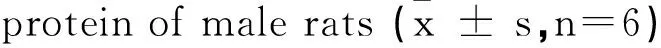

GroupGRP78mRNACHOPmRNA0mg·kg-10.28±0.050.30±0.055mg·kg-10.53±0.10*0.39±0.11*10mg·kg-10.77±0.19*#0.46±0.08*
注:*表示与0 mg·kg-1组相比P<0.05,#表示与5 mg·kg-1相比P<0.05。
Note:* P<0.05 compared with 0 mg·kg-1group; # P<0.05 compared with 5 mg·kg-1group.
ERS是由钙失衡、中毒、氧化应激、代谢障碍等引起错误折叠蛋白质累积而出现的内质网结构和功能破坏,GRP78和CHOP作为ERS关键应激分子在其未折叠蛋白响应调控中发挥重要作用。实验中我们发现PFOS组大鼠肝脏中以上蛋白表达出现显著增高,提示PFOS可能损害内质网功能、诱导ERS出现。Butenhoff等[24-25]在小鼠实验中也观察到PFOS慢性暴露后肝脏内质网形态异常并推测可能导致功能改变,鱼类实验也证实PFOS能造成ERS蛋白二硫键异构酶A3表达增高。近年研究认为ERS在多因素引起的肝损害中均发挥作用,一方面ERS能通过损害线粒体功能间接诱发能量衰竭造成氧化容量受损,抑制AMP依赖蛋白激酶而激活内质网膜连接分子固醇调节元件结合蛋白入核参与转录,引起脂代谢相关基因如脂肪酸合成酶和乙酰辅酶A羧化酶等过度表达,并通过JNK途径激活糖原合成酶激酶3表达干扰胆固醇和甘油三酯摄取,造成脂代谢紊乱、通过中间产物积聚引起肝细胞损伤[26-28]。本次实验中发现暴露组大鼠出现不同程度肝脏重量增加和肝细胞内脂滴出现说明PFOS的损害效应可能与脂肪代谢异常有关,以上ERS调节方式在其中可能发挥作用。这和Curran等[23]报道结果一致,Curran等以50~100 mg·kg-1PFOS对雄性大鼠进行连续28 d染毒,结果发现肝细胞肿大、脂滴增多,肝脏总饱和脂肪酸和硬脂酸水平显著下降,Rosen等[10, 23]也证实PFOS能够诱导SREBP2和PPAR辅助活化因子1表达改变造成肝脏脂肪堆积和炎性浸润。此外,本实验中PFOS组胞内SOD和GSH-px活性显著降低,脂质过氧化产物MDA的水平则随暴露剂量增加出现升高,说明PFOS能引起机体过氧化通路的容量改变,这与他人等研究结果一致[29]。Huang等[25]认为PFOS可显著改变Mn-SOD等氧化还原反应分子水平,并可能通过CCAAT/增强子结合蛋白β或等不同亚基的作用参与ERS调控。这可能因为ERS可上调细胞氧化酶胞浆亚基直接导致活性氧堆积[30-31],也可在CHOP调控下诱导凋亡抑制基因、促凋亡因子及胱天蛋白酶-3表达引起细胞内还原物质如谷胱甘肽耗损触发活性氧级联瀑布反应[32-33],通过启动细胞因子如白介素2、肿瘤坏死因子炎性反应通路造成肝细胞凋亡坏死,同时这种氧化应激级联反应可通过磷酸化真核翻译起始因子2上调酵母菌转录因子的表达持续激活巯基基因表达程序,参与内质网整合应激反应途径从而进一步加重ERS,造成肝脏细胞持续损伤[34-35]。
综上所述,PFOS具有明显的肝毒性作用,可导致肝脏形态异常并影响肝代谢酶水平,同时导致过氧化反应分子的显著改变,这可能与GRP78和CHOP所参与的ERS调控途径有关。
[1] Liu B, Zhang H, Xie L, et al. Spatial distribution and partition of perfluoroalkyl acids (PFAAs) in rivers of the Pearl River Delta, southern China [J]. Science of the Total Environment, 2015, 524(8): 1-7
[2] Miralles-Marco A, Harrad S. Perfluorooctane sulfonate: A review of human exposure, biomonitoring and the environmental forensics utility of its chirality and isomer distribution [J]. Environment International, 2015, 77(4): 148-159
[3] Butenhoff J L, Olsen G W, Pfahles-Hutchens A. The applicability of biomonitoring data for perfluorooctanesulfonate to the environmental public health continuum [J]. Environmental Health Perspectives, 2006, 114(11): 1776-1782
[4] Shan G, Ye M, Zhu B, et al. Enhanced cytotoxicity of pentachlorophenol by perfluorooctane sulfonate or perfluorooctanoic acid in HepG2 cells [J]. Chemosphere, 2013, 93(9): 2101-2107
[5] Wan H T, Zhao Y G, Wei X, et al. PFOS-induced hepatic steatosis, the mechanistic actions on beta-oxidation and lipid transport [J]. Biochimica et Biophysica Acta, 2012, 1820(7): 1092-1101
[6] Elcombe C R, Elcombe B M, Foster J R, et al. Hepatocellular hypertrophy and cell proliferation in Sprague-Dawley rats from dietary exposure to potassium perfluorooctanesulfonate results from increased expression of xenosensor nuclear receptors PPAR alpha and CAR/PXR [J]. Toxicology, 2012, 293(1-3): 16-29
[7] Qazi M R, Xia Z L, Bogdanska J, et al. The atrophy and changes in the cellular compositions of the thymus and spleen observed in mice subjected to short-term exposure to perfluorooctanesulfonate are high-dose phenomena mediated in part by peroxisome proliferator-activated receptor-alpha (PPAR alpha) [J]. Toxicology, 2009, 260(1-3): 68-76
[8] Abbott B D, Wolf C J, Das K P, et al. Developmental toxicity of perfluorooctane sulfonate (PFOS) is not dependent on expression of peroxisome proliferator activated receptor-alpha (PPAR alpha) in the mouse [J]. Reproductive Toxicology, 2009, 27(4): 258-265
[9] Vanden Heuvel J P, Thompson J T, Frame S R, et al. Differential activation of nuclear receptors by perfluorinated fatty acid analogs and natural fatty acids: A comparison of human, mouse, and rat peroxisome proliferator-activated receptor-alpha, -beta, and -gamma, liver X receptor-beta, and retinoid X receptor-alpha [J]. Toxicological Sciences, 2006, 92(2): 476-489
[10] Rosen M B, Schmid J R, Corton J C, et al. Gene expression profiling in wild-type and PPARalpha-null mice exposed to perfluorooctane sulfonate reveals PPARalpha-independent effects [J]. PPAR Research, 2010(2010): 23
[11] Jacquet N, Maire M A, Landkocz Y, et al. Carcinogenic potency of perfluorooctane sulfonate (PFOS) on Syrian hamster embryo (SHE) cells [J]. Archives of Toxicology, 2012, 86(2): 305-314
[12] Takacs M L, Abbott B D. Activation of mouse and human peroxisome proliferator-activated receptors (alpha, beta/delta, gamma) by perfluorooctanoic acid and perfluorooctane sulfonate [J]. Toxicolgy Sciences, 2007, 95(1): 108-117
[13] Afrin R, Arumugam S, Soetikno V, et al. Curcumin ameliorates streptozotocin-induced liver damage through modulation of endoplasmic reticulum stress-mediated apoptosis in diabetic rats [J]. Free Radical Research, 2015, 49(3): 279-289
[14] Zhu X, Zhang X, Yu L, et al. Hepatic overexpression of GRP94 in a rabbit model of parenteral nutrition-associated liver disease [J]. Gastroenterol Research Practice, 2015, 2015(1): 1-8
[15] Xu X, Liu T, Zhang A, et al. Reactive oxygen species-triggered trophoblast apoptosis is initiated by endoplasmic reticulum stress via activation of caspase-12, CHOP, and the JNK pathway in Toxoplasma gondii infection in mice [J]. Infection Immunty, 2012, 80(6): 2121-2132
[16] Butenhoff J L, Ehresman D J, Chang S C, et al. Gestational and lactational exposure to potassium perfluorooctanesulfonate (K+PFOS) in rats: Developmental neurotoxicity [J]. Reproductive Toxicology, 2009, 27(3-4): 319-330
[17] Lv Z, Li G, Li Y, et al. Glucose and lipid homeostasis in adult rat is impaired by early-life exposure to perfluorooctane sulfonate [J]. Environmental Toxicology, 2011, 28(9): 532-542
[18] Fabrega F, Kumar V, Schuhmacher M, et al. PBPK modeling for PFOS and PFOA: Validation with human experimental data [J]. Toxicolgy Letter, 2014, 230(2): 244-251
[19] Tian Y F, He C T, Chen Y T, et al. Lipoic acid suppresses portal endotoxemia-induced steatohepatitis and pancreatic inflammation in rats [J]. World Journal of Gastroenterology, 2013, 19(18): 2761-2771
[20] Yao J, Zhao Y, Zhang J, et al. Serum amylase levels are decreased in Chinese non-alcoholic fatty liver disease patients [J]. Lipids Health Disease, 2014, 13(4): 185-189
[21] 刘慧通, 谢亚男, 杨艳丽, 等. 电流损伤后大鼠血清淀粉酶水平的变化及法医学意义[J]. 西安交通大学学报: 医学版, 2011, 32(2): 264-265
Liu H T, Xie Y N, Yang Y L, et al. The medico-legal significance of serum amylase changes in rats' serum after electrical injury [J]. Journal of Xi'an Jiaotong University: Medical Sciences, 2011, 32(2): 264-265 (in Chinese).
[22] Nakajima K, Oshida H, Muneyuki T, et al. Independent association between low serum amylase and non-alcoholic fatty liver disease in asymptomatic adults: A cross-sectional observational study [J]. BMJ Open, 2013, 3(1): 1-25
[23] Curran I, Hierlihy S L, Liston V, et al. Altered fatty acid homeostasis and related toxicologic sequelae in rats exposed to dietary potassium perfluorooctanesulfonate (PFOS) [J]. Journal of Toxicology and Environmental Health-Part A, 2008, 71(23): 1526-1541
[24] Butenhoff J L, Chang S C, Olsen G W, et al. Chronic dietary toxicity and carcinogenicity study with potassium perfluorooctanesulfonate in Sprague Dawley rats [J]. Toxicology, 2012, 293(1-3): 1-15
[25] Huang T S, Olsvik P A, Krovel A, et al. Stress-induced expression of protein disulfide isomerase associated 3 (PDIA3) in Atlantic salmon (Salmo salar L.) [J]. Comparative Biochemistry and Physiology B-Biochemistry & Molecular Biology, 2009, 154(4): 435-442
[26] Li J, Wang Y, Wang Y, et al. Pharmacological activation of AMPK prevents Drp1-mediated mitochondrial fission and alleviates endoplasmic reticulum stress-associated endothelial dysfunction [J]. Journal of Molecular and Cellular Cardiology, 2015, 86(6): 62-74
[27] Olivares S, Henkel A S. Hepatic Xbp1 deletion promotes endoplasmic reticulum stress-induced liver injury and apoptosis [J]. Journal of Biological Chemistry, 2015, doi: 10.1074/jbc.M115.676239jbc.M115.676239.(2015.10.26)
[28] Zhang N, Lu Y, Shen X, et al. Fenofibrate treatment attenuated chronic endoplasmic reticulum stress in the liver of nonalcoholic fatty liver disease mice [J]. Pharmacology, 2015, 95(4): 173-180
[29] Wielsoe M, Long M, Ghisari M, et al. Perfluoroalkylated substances (PFAS) affect oxidative stress biomarkers in vitro [J]. Chemosphere, 2015, 129(3): 239-245
[30] Treton X, Pedruzzi E, Guichard C, et al. Combined NADPH oxidase 1 and interleukin 10 deficiency induces chronic endoplasmic reticulum stress and causes ulcerative colitis-like disease in mice [J]. PLoS One, 2014, 9(7): 357-364
[31] Li B, Tian J, Sun Y, et al. Activation of NADPH oxidase mediates increased endoplasmic reticulum stress and left ventricular remodeling after myocardial infarction in rabbits [J]. Biochimica et Biophysica Acta, 2015, 1852(5): 805-815
[32] Chen Y J, Su J H, Tsao C Y, et al. Sinulariolide induced hepatocellular carcinoma apoptosis through activation of mitochondrial-related apoptotic and PERK/eIF2alpha/ATF4/CHOP pathway [J]. Molecules, 2013, 18(9): 10146-10161
[33] Thepparit C, Khakpoor A, Khongwichit S, et al. Dengue 2 infection of HepG2 liver cells results in endoplasmic reticulum stress and induction of multiple pathways of cell death [J]. BMC Research Notes, 2013, 6(3): 372-377
[34] Gentz S H, Bertollo C M, Souza-Fagundes E M, et al. Implication of eIF2alpha kinase GCN2 in induction of apoptosis and endoplasmic reticulum stress-responsive genes by sodium salicylate [J]. Journal of Pharmacy and Pharmacology, 2013, 65(3): 430-440
[35] Li J, Wang Y, Wang Y, et al. Pharmacological activation of AMPK prevents Drp1-mediated mitochondrial fission and alleviates endoplasmic reticulum stress-associated endothelial dysfunction [J]. Journal of Molecular and Cellular Cardiology, 2015, 86(12): 62-74
◆
Effects of Endoplasmic Reticulum Stress on Perfluorooctane Sulfonate Induced Liver Damage in Rat
Xiao Jing1,*, Mao Weiming1, Din Hui1, Din Qing1, Li Lu1, Qi Cong1, Xu Xian2, Liu Meng1, Bao Yining1
1. Department of Occupational Medicine and Environmental Toxicology, School of Public Health, Nantong University, Nantong 226019, China 2. School of Public Health, Xinjiang Medical University, Urumqi 830054, China
Effect of endoplasmic reticulum stress on perfluorooctane sulfonate induced liver damage in rat was investigated. Male rats were exposed by gavage with 0 mg·kg-1, 5 mg·kg-1and 10 mg·kg-1PFOS for 28 days. Rats were sacrificed and histological changes of the liver tissue were examined. The contents including ALT, AST, ALP and AMY in serum were determined by ELISA kits. MDA, SOD and GSH-Px were detected by the colorimetric method. Besides, expression of endoplasmic reticulum stress related genes was measured using real-time PCR.The present study showed that PFOS produced significant reductions in body weight gain in male rats. Liver/body weight value was significantly elevated relative to control in male rats. PFOS exposure resulted in a significant hepatic injury with cell edema and hypertrophy in both groups (P<0.05). ALT concentration was highest in 10 mg·kg-1group ((50.96±10.02) U·L-1, (71.73±11.55) U·L-1, respectively) while the content of AMY was lowest in 10 mg·kg-1group ((833.46±63.05) U·L-1). Furthermore, compared with the control, ALP and AST increased significantly (P<0.05). Moreover, PFOS exposure reduced the levels of SOD and GSH-Px while increased the levels of MDA (P<0.05). Furthermore, results from RT-PCR revealed that PFOS up-regulated the expression level of GRP78 and CHOP. In conclusion, exposure to PFOS disturbed the liver homeostasis of male rats, and the mechanism of action is related to endoplasmic reticulum stress.
PFOS; rat; hepatic injury; endoplasmic reticulum stress
10.7524/AJE.1673-5897.20151109004
国家自然科学基金(81202228);江苏省大学生创新创业训练项目(201410304050Z);南通大学教学改革课题(2013S03)
肖静(1980-),女,博士,研究方向为环境毒理学,E-mail: xiaoj_1980@163.com;
2015-11-09 录用日期:2015-11-18
1673-5897(2016)2-380-07
X171.5
A
简介:肖静(1980—),女,环境卫生专业博士,副教授,主要研究方向为环境内分泌干扰物。
肖静, 毛伟明, 丁慧, 等. 内质网应激在PFOS致大鼠肝损伤中的作用[J]. 生态毒理学报,2016, 11(2): 380-386
Xiao J, Mao W M, Ding H, et al. Effects of endoplasmic reticulum stress on perfluorooctane sulfonate induced liver damage in rat [J]. Asian Journal of Ecotoxicology, 2016, 11(2): 380-386 (in Chinese)

