新生鼠PFOS低剂量慢暴露对成年后神经行为的影响
杨生森,郭若冰,杨维才,康红霞,沙永威,田建英,*
1. 宁夏医科大学总医院,银川 750004 2. 宁夏医科大学,银川 750004
新生鼠PFOS低剂量慢暴露对成年后神经行为的影响
杨生森1,2,郭若冰1,杨维才2,康红霞2,沙永威2,田建英2,*
1. 宁夏医科大学总医院,银川 750004 2. 宁夏医科大学,银川 750004
为观察新生鼠全氟辛烷磺酸(PFOS)低剂量慢暴露对其成年后神经行为和海马组织影响,选取出生后5-7 d雄性SD幼鼠80只,按体重随机分为4组,分别为对照组(Con)、低剂量组(P5)、中剂量组(P10)、高剂量组(P20),每组各20只。从PND7开始染毒,共染毒12周,动态记录体重,并进行水迷宫、旷场实验、滚轮实验观察神经行为变化,同时取材进行HE染色,观察海马形态学改变。结果显示与Con组比较,P20组染毒8 d后出现体重增长减缓(P<0.05),4周时P10和P20组死亡率明显升高;并且P10、P20组在4周,P5组在8周时,水迷宫实验逃逸潜伏期延长,目标象限停留时间缩短;P10、P20组大鼠在4周,P5组在8周时,旷场实验中央格停留时间延长,站立次数减少,行走总距离缩短;滚轮试验中,对照组和P5组肢体运动协调能力无显著性差异。P5组在染毒12周时出现海马神经元排列紊乱,胞核固缩及胞体胀大,CA1区细胞和齿状回闩区神经前体细胞数量明显少于Con组(P<0.01)。上述结果表明,大鼠幼年PFOS低剂量慢暴露可损害其成年后空间学习记忆及自主探究能力,这种损害可能与海马神经元发生不足有关
全氟辛烷磺酸;PFOS;新生鼠;神经行为;成年;低剂量;慢暴露
Received 10 December 2015 accepted 1 February 2016
全氟辛烷磺酸(perfluorooetane sulfonate,PFOS)是全氟化合物(prenuoroehemieals,PFCs)的代表性化合物及其终极代谢产物。PFOS具有难降解性,在环境中持续存在,可随着食物链逐级蓄积到较高位营养级动物体内。研究表明,PFOS可引起神经毒性[1],且毒性效应持久,较其他系统危害严重,因此,PFOS的神经毒性倍受关注。学习和记忆作为神经系统的高级认识功能,而新生期为神经系统发育的关键时期,其发育易受到外界环境影响,其功能是否正常取决于神经发育早期。也有研究表明,PFOS可透过胎盘屏障和血脑屏障富集于胚胎和脑组织[2-3],可引起乳鼠认知功能、运动功能及空间记忆功能损伤[4-5]。然而,关于PFOS低剂量慢暴露是否影响新生鼠成年后的神经行为尚不清楚。本研究采用新生鼠PFOS低剂量慢暴露对成年后神经行为和海马组织的影响,为PFOS的远期神经毒性风险评价提供科学依据。
1 材料与方法 (Materials and methods)
1.1 实验材料与分组
PFOS(纯度≥98.0%,美国Sigma公司),使用时用2%吐温-80助溶(纯度99%,上海晶纯实业有限公司)。Morris水迷宫和Water Maze处理软件(北京硕林苑科技公司,中国);矿场实验和滚轮实验(成都泰盟有限公司);组织包埋机(金华科迪仪器设备有限公司);RM2235石蜡切片机(德国Leica)。
领取PND5-7(postnatal day)的SD(Sprague-Dawley)雄性幼鼠80只(宁夏医科大学实验动物中心提供,许可证号(SCXK(宁)2011-0001)),与母鼠分笼喂养,自由取食饮水。实验前,幼鼠在安静环境下适应饲养2 d,饲养温度为(20士2) ℃,相对湿度为50%~60%,噪音小于70 db,自然光照。
80只雄性幼鼠按体重随机分为4组,分别为对照组Con(含2%吐温-80的生理盐水组)、低剂量组P5(5 mg·kg-1PFOS组)、中剂量组P10(10 mg·kg-1PFOS组)、高剂量组P20(20 mg·kg-1PFOS组),每组各20只。染毒容量为5 mL·kg-1,从PND7开始给药,每天腹腔注射1次,连续染毒4周,4周后改为间隔1天给药1次至染毒12周,分别在染毒4周、8周、12周行水迷宫、旷场实验及滚轮实验。
每次行为学测试结束后,4组随机选取3只仔鼠腹腔注射10%水合氯醛麻醉,灌注后取脑组织,用4%的多聚甲醛固定样品,用于组织石蜡切片。
1.2 实验方法
1.2.1 一般情况
观察大鼠的精神、饮食、活动,并分别在染毒4、8、12、21 d及4、8、12周时记录体重。
1.2.2 旷场实验
评价大鼠的行为活跃程度和自主活动变化,以及在一个陌生环境中对外界事物的探索能力。旷场实验箱(100 cm×100 cm×50 cm规格的木质敞箱)试验箱周壁为黑色的旷场,底部划分为25个大小均等的方格,中间的9个方格称为中央格,箱子顶部中央安置有与记录系统相连接的摄像机,通过系统分析大鼠实时图像以获得大鼠在旷场中的行为数据。每次实验将大鼠从木箱底面中心放入。测试时,大鼠可在箱子中自由行走5 min,记录修饰次数、站立次数、粪便次数、中央格停留时间和总距离。每只大鼠测试结束后清洗方箱内壁及底面。
1.2.3 滚轮实验
测试大鼠的运动协调和平衡能力。水平金属杆(直径3 cm)长约为50 cm,用金属板分隔为5段,用挡板隔开大鼠彼此不受影响,转速16 r·min-1。大鼠在转杆上开始爬行后仪器自动记时,从转杆跌落下来时可以被红外装置所监测,自动停止记时并显示大鼠在转杆上运动的时间。如大鼠转杆时间不足5 min,记录实际时间;如超过5 min,记为5 min。初次学习3 d后测试,每天练习3次。测试时进行3次,取平均值。
1.2.4 Morris水迷宫实验
动态跟踪评价空间定位的学习、记忆能力。Morris水迷宫分析系统由水池(直径120 cm,水深22 cm),逃避平台(直径9 cm,高21.5 cm),摄像头和电脑组成。水温保持在(24±2) ℃,平台位于水面下2 cm,与池壁的垂直距离为20 cm。前4天行定位航行实验,考查其学习能力,第5天行空间探索实验,考察其对原平台的记忆能力[6]。评价指标:逃逸潜伏期,穿越目标象限时间,搜索轨迹。
行滚轮实验后进行Morris水迷宫实验。将水池分为4个象限,将大鼠从每个象限中点头朝池壁放入水中,记录大鼠从入水直至找到平台的时间(即逃逸潜伏期)。每天每只大鼠从每个象限入水测试1次,连续训练4天,以此考察空间学习能力。第5天撤去平台,记录大鼠从入水直至找到原平台的时间,以此考察记忆保持能力。如果动物在60 s内未找到平台,时间记录为60 s。
1.2.5 海马组织HE染色
每次行为学检测后,4组随机选取3只大鼠10%水合氯醛麻醉,剪开胸腔,暴露心脏,从左心尖处插入灌流针,剪开右心耳。先用生理盐水进行灌流,待血液冲洗干净后改用4%多聚甲醛继续灌流约15 min,待小鼠四肢僵硬,断头取脑置4%多聚甲醛中4℃过夜。多聚甲醛固定脑组织,石蜡包埋,连续冠状面5 μm厚切片,行HE染色。显微镜观察病理学组织改变,拍照,并随机观察5视野,采用HPIAS-1000高清晰度彩色病理图文分析系统,行细胞计数。
1.3 统计学方法
2 结果(Results)
2.1 新生鼠PFOS慢暴露后的一般情况观察
染毒早期各组动物饮食和运动状况均良好。染毒4周,P10和P20两组幼鼠表现亢奋,并对声音、光线敏感,出现消瘦,肛门周围被毛粪便沾染严重,躁动不安,P20组表现得更加明显。而在幼鼠成年以后,则出现呆滞、懒动。P5组在染毒期间从幼鼠到成年与Con组比较一般状况无明显差异。
2.2 新生鼠PFOS慢暴露对体重的影响
图1显示:从染毒8 d开始,P20组幼鼠体重增长与对照组比较出现减缓(P<0.05);从染毒12 d开始,P20组幼鼠体重低于P5组(P<0.05)(见图A),随着染毒时间延长差异表现得更加明显,这种差异一直持续到成年期(见图B)。且P5组在染毒8周时,体重与Con组比较,也明显减轻(P<0.05)。
2.3 新生鼠PFOS慢暴露对死亡率的影响
表1显示,在染毒期间,P10组和P20组幼鼠都出现中毒并引发死亡。其中,P10组幼鼠死亡6只,P20组幼鼠死亡13只。对其进行解剖观察,发现肝脏肿大,伴有弥漫白色质硬结节,考虑与肝脏毒性有关。而P5组幼鼠未发生死亡。

图1 新生鼠PFOS慢暴露对体重的影响注:图A为4、8、12、21天体重比较;图B为4、8、12周体重比较。与Con组比较,aP<0.05,bP<0.01;与P5组比较,cP<0.05,dP<0.01。P5、P10、P20分别为5 mg·kg-1、10 mg·kg-1、20 mg·kg-1 PFOS组。Fig. 1 The effects of chronic neonatal exposure to PFOS on body weight in ratsNote: A, weight on 4, 8, 12, 21 day; B, weight on 4, 8, 12 week. bP<0.01, aP<0.05 vs Con group; dP<0.01, cP<0.05 vs P5 group. P5, P10, P20 are 5 mg·kg-1, 10 mg·kg-1, 20 mg·kg-1 PFOS treatment groups.
2.4新生鼠PFOS慢暴露神经行为观察
2.4.1 Morris水迷宫实验观察
图2显示,4周时行水迷宫实验学习时各组逃逸潜伏期均随时间增加而呈现逐渐下降趋势,说明各组幼鼠均有一定的学习能力,Con组幼鼠逃逸潜伏期下降最快(见图A)。水迷宫实验学习的第2天,P5、P10和P20组的逃逸潜伏期即长于Con组,并在之后的第4天P10、P20组出现显著性差异(P<0.01,P<0.01),这种差异一直持续到成年后,其游泳轨迹见图B。而P5组在染毒8周时逃逸潜伏期也长于Con组(P<0.05)(见图C),目标象限停留时间也在染毒12周时短于Con组(P<0.05)(见图D)。
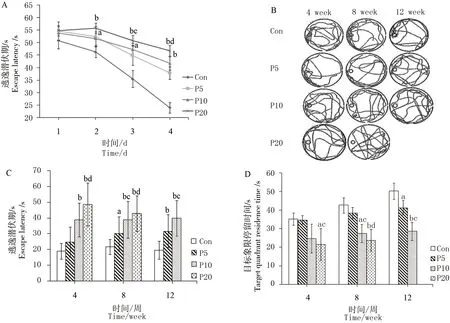
图2 新生鼠PFOS慢暴露对空间学习记忆能力的影响注:图A为4周水迷宫学习时逃逸潜伏期比较;图B为4、8、12周搜索轨迹;图C为4、8、12周逃逸潜伏期比较;图D为4、8、12周目标象限停留时间比较。与Con比较,aP<0.05,bP<0.01;与P5组比较,cP<0.05,dP<0.01。Fig. 2 The effects of chronic neonatal exposure to PFOS on spatial learning and memory in ratsNote: A, Escape latency on 4 week; B, Swimming trajectories on 4, 8, 12 week; C, Escape latency on 4, 8, 12 week; D, Residence time in target quadrant on 4, 8, 12 week; bP<0.01, aP<0.05 vs Con group; dP<0.01, cP<0.05 vs P5 group.

组别Group总数/只Totality/individuals4周/只4weeks/individuals8周/只8weeks/individuals12周/只12weeks/individuals死亡数/只Mortality/individual死亡率/%Mortalityrate%Con2000000P52000000P1020411630P20208411365
2.4.2 旷场实验观察
表2、3、4显示:P10、P20组与Con组比较,染毒4周中央格停留时间长(P<0.01, P<0.01),站立次数少(P<0.01, P<0.01),总距离短(P<0.01, P<0.01),而修饰次数、粪便次数无明显差异(P>0.05, P>0.05),这种影响一直持续到成年。而在染毒12周时,与对照组比较,P5组幼鼠也在中央格停留时间明显延长(P<0.05),站立次数减少(P<0.05),总行走距离缩短(P<0.05),均具有统计学差异。
2.4.3 滚轮实验观察
图3显示,P5组幼鼠在染毒4、8、12周时, 在转杆上持续的时间与Con组比较均无显著性差异(P>0.05)。
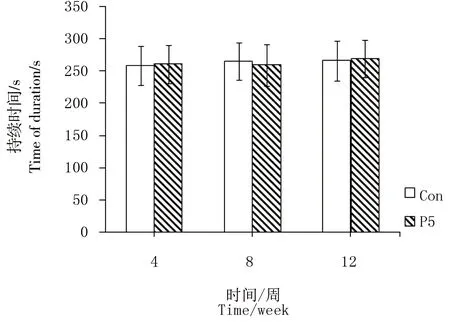
图3 新生鼠PFOS低剂量慢暴露后滚轮实验结果Fig. 3 The rotarod test results of rats after chronic neonatal exposure to low dose PFOS
表2 PFOS染毒4周旷场实验结果
注:与Con比较,bP<0.01;与P5组比较,cP<0.05,dP<0.01。
Note:bP<0.01 vs Con group;dP<0.01,cP<0.05 vs P5 group.
表3 PFOS染毒8周旷场实验结果
注:与Con比较,aP<0.05,bP<0.01;与P5组比较,cP<0.05,dP<0.01。
Note:bP<0.01,aP<0.05 vs Con group;dP<0.01,cP<0.05 vs P5 group.
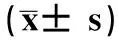
表4 PFOS 染毒12周旷场实验结果
注:与Con比较,aP<0.05,bP<0.01;与P5组比较,cP<0.05。
Note:bP<0.01,aP<0.05 vs Con group;cP<0.05 vs P5 group.
2.5 海马组织HE染色
图4显示,染毒早期P5组与Con组海马区形态学观察比较无明显差异,但在染毒12周时,P5组出现神经元排列紊乱、轮廓模糊、核固缩及胞体胀大、胞浆空泡形成(见图A和图B),并且CA1区和海马齿状回闩区神经前体细胞数量也少于Con组(P<0.01,P<0.01)(见图C和图D)。
3 讨论(Discussion)
PFOS作为一种广泛存在的环境持久有机污染物,在人体的半衰期一般为4~6 y[7],它的神经毒性作用正在引起广泛关注。有学者报道,PFOS神经毒性与细胞内钙离子浓度升高以及钙通道的破坏有关[8-10]。刘冰等[11]以2、8、32和128 mg·kg-1的PFOS染毒Wistar大鼠,结果发现与对照组相比,暴露后大鼠海马细胞内的钙离子浓度显著升高,而且随着染毒剂量的增加而升高。李莹等[12]通过染毒大鼠(PFOS剂量为50、100和200 mg·kg- 1),利用免疫组织化学方法和显微图像分析技术分析大鼠脑组织切片中谷氨酸反应阳性细胞的阳性面积比,平均积分吸光度情况,发现大鼠大脑皮层、海马、小脑中两指标与对照组相比均明显升高,表明PFOS可导致谷氨酸表达水平上调,故认为中枢神经系统中谷氨酸含量的升高可能是PFOS神经毒性机制之一。另外,Austin等[13]发现腹腔注射PFOS(10 mg·kg- 1,共2周)能够增加大鼠脑内的肾上腺素的浓度。
高浓度PFOS暴露的毒理学效应已被广泛研究,而低浓度PFOS的毒性效应常常被忽视,尤其,低浓度慢性PFOS暴露更接近实际的人类环境污染。Johansson等[14]用PFOS(1.4 和 21 μmol·kg- 1)处理PND10新生小鼠,发现21 μmol·kg-1浓度组可以引起小鼠的认知功能损伤,并且导致自发行为(如运动、饮食和总体活动)减少,且这种神经毒性作用持续到成年期(4月龄)。Fuentes等[15]对孕期12~18 d的小鼠进行6 mg·kg-1PFOS灌胃染毒,导致其后代成年后空间记忆功能损伤以及行为缺陷。王玉等[16]使用PFOS的水溶液(5 mg和15 mg)对Wistar仔鼠采用围产期暴露至产后6周,发现高浓度组15 mg导致大鼠学习记忆能力下降,而低浓度组5 mg对大鼠学习记忆能力无明显影响,但成年后的变化未有观察。本研究通过Morris水迷宫空间记忆行为学观察发现,低浓度慢性PFOS暴露,早期对幼鼠逃逸潜伏期和目标象限停留时间影响不大,但成年后其逃逸潜伏期明显延长,目标象限停留时间明显缩短。表明,新生鼠低剂量慢性PFOS暴露早期对幼鼠空间学习记忆能力影响不明显,但会在成年后导致其空间学习记忆能力的下降。
旷场实验又称敞箱实验,是评价实验动物在新环境中自主运动、探究行为与紧张度的一种方法。水平跨越格子数及直立次数是动物在新环境中探索行为及兴奋性的反映,中央格停留时间是动物空间认知能力的反映。正常动物会避开空旷环境,迅速离开中央格,沿周边活动,因而水平跨越格子数及直立次数较多,而中央格停留时间较短。如果动物在新环境中的探究能力和认知能力差,则停留在中央格的时间就会延长,而水平跨越格子数及直立次数减少。本研究结果显示,P10组与P20组在中央格停留时间较长,站立次数及总距离较短,PFOS低浓度慢性暴露P5组大鼠成年后,其自主活动能力和探究能力均明显减低。表明PFOS可以损伤小鼠成年后的自主和探索行为。Butenhoff等[17]研究证明,PFOS能够使大鼠中枢神经系统兴奋氨基酸和谷氨酸合成酶的含量降低,减弱小鼠的感官活动和自主行为能力。但在滚轮实验中PFOS低浓度P5组与对照组比较,发现其转杆持续时间无统计学差异,表明低浓度慢性PFOS暴露对幼鼠成年后的肌肉协调和抓力无明显影响。
以往发现,PFOS暴露能影响大鼠的生长发育[18-20]。本研究发现新生鼠给予中、高剂量的PFOS暴露,在暴露8 d,体重即出现增长减缓,甚至出现死亡,而低剂量暴露大鼠在染毒早期体重增长与对照组无明显差异,而在持续暴露12周后其体重与对照组比较也出现减轻。一些研究认为PFOS可能通过干扰发育有关基因表达,是造成大鼠、小鼠和斑马鱼中发育迟缓和体重降低的原因[21-23]。进入机体内的PFOS,主要分布于肝、血清以及包括大脑皮质,海马,下丘脑等各个脑区。啮齿类动物大约在出生后3周内,脑发育处于快速生长和突触大量发生的时期被称为生长突增(growth spurts)期,运动、认知能力以及情感的成熟与这段时期的突触重塑和联接强化密切相关[24]。海马组织主要负责存储信息,是人类学习和记忆的关键部位。研究表明,海马是PFOS的一个主要的靶器官,也是PFOS的主要富集部位。李莹等[12]发现PFOS高剂量急性染毒中,PFOS可以导致脑组织神经元减少、胞体胀大、胶质细胞增生等现象,提示PFOS可能直接损伤细胞或者间接继发性作用于神经元,引起相应的病理性变化,这与我们的研究相一致。本研究中,随着PFOS暴露时间延长,海马神经元细胞增殖能力减弱,细胞凋亡,从而进一步影响突触可塑性和长时程增强效应,造成学习记忆能力的缺陷。故我们认为早期低剂量慢性暴露PFOS可引起大鼠成年后学习记忆力减退。海马神经发生不足,组织的形态结构发生变化,引起海马环路的损伤是导致神经行为异常的重要原因。
致谢:谨以此文纪念中国科学院资深院士、中国科学院广州地球化学研究所研究员,著名有机地球化学与沉积学家傅家谟教授,以此表达对傅家谟院士的深切怀念和崇高敬意!
[1] Mayilswami S, Krishnan K, Megharaj M, et al. Chronic PFOS exposure alters the expression of neuronal development-related human homologues in Eisenia fetida [J]. Ecotoxicology and Environmental Safety, 2014, 110: 288-297
[2] Loccisano A E, Campbell J L, Butenhoff J L, et al. Evaluation of placental and lactational pharmacokinetics of PFOA and PFOS in the pregnant, lactating, fetal and neonatal rat using a physiologically based pharmacokinetic model [J]. Reproductive Toxicology, 2012, 33(4): 468-490
[3] Lee Y Y, Wong C K C, Oger C, et al. Prenatal exposure to the contaminant perfluorooctane sulfonate elevates lipid peroxidation during mouse fetal development but not in the pregnant dam[J]. Free Radical Research, 2015, 49(8): 1015-1025
[4] Luebker D, York R G, Hansen K J, et al. Neonatal mortality from in utero exposure to perfluorooctanesulfonate (PFOS) in Sprague-Dawley rats: Dose-response, and biochenmical and pharamacokinetic parameters [J].Toxicology, 2005, 215(1-2): 149-169
[5] Viberg H, Fredriksson A. Neonatal exposure to sucralose does not alter biochemical markers of neuronal development or adult behavior [J]. Nutrition, 2011, 27(1): 81-85
[6] Lopez L L, Hauser J, Feldon J, et al. Evaluating spatial memory function in mice: A within-subjects comparison between the water maze test and its adaptation to dry land[J]. Behavioural Brain Research, 2010, 209(1): 85-92
[7] Trudel D, Horowitz L, Wormuth M, et al. Estimating consumer exposure to PFOS and PFOA[J].Risk Analysis,2008, 28(2): 251-269
[8] Lv Q Y, Wan B, Guo L H, et al. In vivo immunotoxicity of perfluorooctane sulfonate in BALB/c mice: Identification of T-cell receptorand calcium-mediated signaling pathway disruption through gene expression profiling of the spleen[J]. Chemicobiological Interctions, 2015, 240: 84-93
[9] Liu X, Liu W, Jin Y, et al. Effects of subchronic perfluorooctane sulfonate exposure of rats on calcium dependent signaling moleculesin the brain tissue [J]. Archives of Toxicology, 2010, 84(6): 471-479
[10] Wang F, Liu W, Jin Y, et al. Transcriptional effects of prenatal and neonatal exposure to PFOS in developing rat brain[J]. Environmental Science & Technology, 2010, 44(5): 1847 -1853
[11] 刘冰. 全氟辛烷磺酸对大鼠海马细胞内钙离子浓度的影响[D]. 沈阳: 中国医科大学, 2007
Liu B. Perfluorooctane sulfonic acid in rat hippocampal cells in the effect of calcium ion concentration [D]. Shenyang: China Medical University, 2007 (in Chinese)
[12] 李莹, 金一和. 全氟辛磺酸对大鼠中枢神经系统谷氨酸含量的影响[J]. 毒理学杂志, 2004, 18(4): 232-234
Li Y, Jin Y H. The influence of glutamate content in the central nervous system of rats by perfluorooctanesulfonic acid [J]. Toxicology Journal, 2004, 18(4): 232-234 (in Chinese)
[13] Austin M E, Kasturi B S, Barber M, et al. Neuroendocrine effects of perfluorooctanesulfonate in rats [J]. Environmental Health Perspectives, 2003, 111: 1485-1489
[14] Johansson N, Fredriksson A, Eriksson P. Neonatal exposure to perfluorooctane sulfonate (PFOS) and perfluorooctanoic acid (PFOA)causes neurobehavioural defects in adult mice [J]. Neurotoxicology, 2008, 29(1): 160-169
[15] Fuentes S, Vicens P, Colomina M T, et al. Behavioral effects in adult mice exposed to perfluorooctanesulfonate (PFOS) [J]. Toxicology, 2007, 242(1-3): 123-129
[16] 王玉, 张倩, 刘薇, 等. 胚胎期和哺乳期全氟辛烷磺酸(PFOS)暴露致大鼠学习记忆能力下降[J]. 生态毒理学报, 2013, 8(5): 671-677
Wang Y, Zhang Q, Liu W, et al. Decline of learning and memory abilities in rats induced by prenatal and lactational exposure to perfluorooctane sulfonate (PFOS) [J]. Asian Journal of Ecotoxicology, 2013, 8(5): 671-677(in Chinese)
[17] Butenhoff J L, Ehresman D J, Chang S C, et al. Gestational and lactational exposure to potassium perfluorooctanesulfonate (K+PFOS) in rats: Developmental neurotoxicity [J]. Reproductive Toxicology, 2009, 27(3-4): 319-330
[18] Han J, Fang Z Q. Estrogenic effects, reproductive impairment and developmental toxicity in ovoviparous swordtail fish (Xiphophorus helleri) exposed to perfluorooctane sulfonate (PFOS) [J]. Aquatic Toxicology, 2010, 99(2): 281-290
[19] 文永霞, 马文智, 刘香, 等. 全氟辛烷磺酸新生发育期胁迫致雌性大鼠成年期生育能力下降和子代不育[J]. 职业与健康, 2015, 24: 3399-3402
Wen Y X, Ma W Z, Liu X, et al. Reduced fertility and offspring infertility of adult female rats induced by perfluorooctane sulfonateexposed in growth and development stages [J]. Occupational and Health, 2015, 24: 3399-3402 (in Chinese)
[20] 马文智, 田建英, 杨生森, 等. S-腺苷L-甲硫氨酸对围产期暴露全氟辛烷磺酸大鼠生殖毒性的拮抗作用[J]. 环境与健康杂志, 2015, 8: 672-676, 753
Ma W Z, Tian J Y, Yang S S, et al. Antagonistic effects of S-adenosyl L-methionine on PFOS induced reproductive and genetic toxicity in rats [J]. Environmental Health, 2015, 8: 672-676, 753 (in Chinese)
[21] Mondal D, Lopez E M, Armstrong B, et al. Relationships of perfluorooctanoate and perfluorooctane sulfonate serum concentrations between child-mother pairs in a population with perfluorooctanoate exposure from drinking water[J]. Environmental Health Perspectives, 2012, 120(5): 752-757
[22] Zhang L, Li Y Y, Zeng H C, et al. MicroRNA expression changes during zebraftsh development induced by perfluorooctane sulfonate[J]. Journal of Applied Toxicology,2011, 3(31): 210-222
[23] Shi X,Yeung W, Lam P K, et al. Protein profiles in zebraftsh (Danio rerio)embryos exposed to perfluorooctane sulfonat [J].Toxicological Sciences, 2009, 31(10): 330-340
[24] Corballis M C. Memory, growth, evolution, and laterality[M]//Lewandowsky S, Hockley W E. Eds. Relating Theory and Data: Essays on Human Memory in Honor of Bennet B. Murdock. Hillsdale, New Jersey: Lawrence Erlbaum Association, Inc, 2013: 23
◆
The Effect of Neonatal Exposure to Low Dose PFOS on Neural Behavior in Puberty
Yang Shengsen1,2, Guo Ruobing1, Yang Weicai2, Kang Hongxia2, Sha Yongwei2, Tian Jianying2,*
1. Affiliated Hospital of Ningxia Medical University, Yinchuan 750004, China 2. Ningxia Medical University, Yinchuan 750004, China
To observe the effect of neonatal exposure of PFOS on the neural behavior and hippocampus in adult -hood, 80 male neonatal SD rats were randomly divided into control group (Con), PFOS groups in low dose (P5), middle dose (P10) and high dose (P20), with 20 rats in each group. The PND7 rats were treated with PFOS by peritoneal injection till PND90. The Con group was treated with 0.2% Tween-80 saline. The neural behaviors were detected by water maze, open-fieldtest and rotarod test. The morphological changes in hippocampus were observed with HE staining. The results demonstrated that the mortality of rats in P10 and P20 group were higher than that in Con group after 4 weeks exposure (P<0.05), and the weight of rats in P20 group were lower than that in Con group after 8 d exposure (P<0.05). The escape latency was longer and the target quadrant residence time was shorter than that of the Con group in P5 group at 8 weeks and in P10 and P20 group at 4 weeks. The time spent at the center of enclosure was longer, the vertical rearing was less, and the ambulatory distance was shorter for P10, P20 rats at 4 weeks, and for P5 rats at 8 weeks than those in Con group. No significant difference was observed in the performance of rats in Con and P5 groups in rotarod test. The morphology of hippocampus of P5 rats at 12 weeks were observed and showed that the neurons were blurring with nuclear pyknosis. The number of nerve cells in CA1 and the neural precursor cells in dentate gyrus were less in P5 rats (P<0.01). These results demonstrated that chronic and low-dose exposure to PFOS in neonatal rats can impair spatial learning and memory ability in adulthood,which is associated with loss of hippocampal neurons.
PFOS; neonatal rat; nerve behavior; adult; low dose; chronic exposures
10.7524/AJE.1673-5897.20151210001
国家自然科学基金(No.8160231,81160338);国家大学生创新项目(No:201410752002);宁夏高校重点项目(NGY2011039)
杨生森(1984-),男,硕士研究生,研究方向为环境因素与神经系统退行性疾病发病机制及防治,E-mail: shengsen2334@163.com
*通讯作者(Corresponding author), E-mail: jianyingt@hotmail.com
2015-12-10 录用日期:2016-02-01
1673-5897(2016)2-307-08
X171.5
A
简介:田建英,女,教授,硕士研究生导师,主要研究方向环境因素与老年性痴呆的发病机制及防治。
杨生森, 郭若冰, 杨维才,等. 新生鼠PFOS低剂量慢暴露对成年后神经行为的影响[J]. 生态毒理学报,2016, 11(2): 307-314
Yang S S, Guo R B, Yang W C, et al. The effect of neonatal exposure to low dose PFOS on neural behavior in puberty [J]. Asian Journal of Ecotoxicology, 2016, 11(2): 307-314 (in Chinese)

