全氟十二烷酸(PFDoA)慢性暴露干扰大鼠肝脏磷酸化蛋白质水平
张红霞,崔瑞娜,戴家银
中国科学院动物研究所 中国科学院动物生态与保护生物学重点实验室,北京 100101
全氟十二烷酸(PFDoA)慢性暴露干扰大鼠肝脏磷酸化蛋白质水平
张红霞,崔瑞娜,戴家银*
中国科学院动物研究所 中国科学院动物生态与保护生物学重点实验室,北京 100101
全氟烷基类化合物(PFASs)是一类新型持久性有机污染物,因其独特的理化性质被广泛应用于工业和商业领域,对生物体具有一定的毒性作用。为探究全氟十二烷酸(PFDoA)致肝脏毒性作用机制,选择雄性大鼠为受试生物,采用2-DE蛋白质组学技术与ProQ Diamond dye磷酸化蛋白染色结合的方法初步研究了不同剂量PFDoA暴露110 d后大鼠肝脏蛋白磷酸化水平的变化。结果表明,30个磷酸化蛋白表达水平在PFDoA处理后发生显著变化,其中,经过MALDI-TOF/TOF质谱分析,成功鉴定18个蛋白点。经过生物信息学分析,发现这些蛋白主要涉及糖脂代谢、氨基酸代谢、应激防御及电子传递等途径。以上结果有助于进一步从翻译后修饰水平了解PFDoA的肝脏毒性作用。
PFDoA;大鼠;肝脏毒性;磷酸化蛋白;Pro-Q Diamond
Received 18 August 2015 accepted 15 October 2015
全氟烷基类化合物(perfluoroalkyl substances, PFASs)是一类具有不同碳链长度的新型持久性有机污染物,包括全氟辛酸(perfluorooctanoic acid, PFOA, C8)、全氟辛磺酸(perfluorooctansulfonate, PFOS, C8)及全氟十二烷酸(perfluorododecanoic acid, PFDoA, C12)等。这类化合物因其独特的疏水疏油、表面活性和热稳定性等理化性质被广泛应用于各种工业生产及商业消费品领域[1]。PFASs不易降解、具有持久性及远距离迁移的特性,因此在世界各地的环境介质和生物组织中都检测到这类物质[2]。研究发现PFASs具有广泛的生物毒性,如导致肝脏肿大和空泡化,增加肝脏脂质水平,降低血清胆固醇,引起免疫器官萎缩和免疫细胞数量减少,具有雌激素活性,降低精子质量,引起新生儿发育迟缓等现象[2-4]。而目前关于PFASs毒性机理的研究主要集中在传统毒理学终点指标、生化指标、基因组学及蛋白水平上[5-8],而从翻译后修饰水平上对其毒性机制研究很少。
蛋白质磷酸化是蛋白质翻译后修饰方式中最普遍的一种。蛋白质磷酸化和去磷酸化几乎调节着生命活动的整个过程,包括细胞的增殖、发育和分化、信号转导、细胞凋亡、神经活动、肌肉收缩、新陈代谢、肿瘤发生等[9-11]。尤其在细胞应答外界刺激的信号传递途径中,蛋白质磷酸化是目前所知道的最主要方式[12-13]。而通常情况下,磷酸化作用调节蛋白质活性时,蛋白质丰度并不发生变化,因此蛋白质磷酸化的定量研究在进一步探讨磷酸化蛋白质的功能时尤为重要。Pro-Q Diamond(Pro-Q DPS)是一种磷酸化蛋白质的荧光染料[14],可以直接对二维双向电泳(2-DE)分离后的磷酸化蛋白质进行选择性染色,对非磷酸化蛋白质的反应性很低,且荧光强度会随着蛋白质磷酸化程度的不同而呈现出一定的量的变化,因此被广泛用于磷酸化蛋白质组学的研究。
肝脏是生物体最重要的代谢和免疫器官。本实验中,我们运用磷酸化蛋白组和质谱技术对PFDoA作用下大鼠肝脏蛋白磷酸化水平进行定量研究,鉴定了差异磷酸化蛋白质性质及可能的修饰位点,并通过生物学分析确定其功能,为阐明PFDoA对大鼠肝脏的毒性作用机理提供进一步的依据。
1 材料与方法 (Materials and methods)
1.1 实验材料
实验用雄性大鼠购自北京维通利华实验动物中心,体重为230~240 g。实验前驯养一周,饲养密度为2只/笼,光照周期为12 h∶12 h,温度为20~26 ℃,相对湿度为50%,并具有通风循环系统。驯养后,随机将大鼠分为3个实验组(包括1个对照组和2个处理组),每组6只,各组平均体重无显著性差异。
1.2 主要仪器与试剂
二维凝胶电泳系统(Ettan IPGphor 3等电聚焦电泳仪、Hoefer SE600垂直电泳仪)(美国GE),Typhoon 9400扫描仪(美国GE),MALDI-TOF/TOF MS(4700,美国Applied Biosystems) 。
PFDoA(纯度﹥99%)、Tween-20、尿素、硫尿、CHAPs等购自美国Sigma公司,2D Quant Kit、2D Clean-Up Kit购自美国GE公司,Pro-Q DPS凝胶染料、磷酸化蛋白分子量标准、SYPRO Ruby凝胶染料购自美国Invitrogen公司,胰蛋白酶(Trypsin)购自美国Promega,乙腈(ACN)、三氟乙酸(TFA)购自德国Merck公司,果糖二磷酸酶1(Fbp1)多克隆抗体、Hprt兔多克隆抗体,热休克蛋白Hsp90ab1和p-Hsp90ab1(S254)兔多克隆抗体均购自美国Santa Cruze公司。所有化学品除了ACN是色谱纯其他均是分析纯,实验所用水都经过Milli-Q system(美国Millipore)处理。
1.3 动物暴露
PFDoA用0.5%的Tween-20制成悬浊液,对大鼠进行灌胃。本实验设一个对照组(灌以0.5% Tween-20)和2个PFDoA处理组(0.2 mg·kg-1·d-1和0.5 mg·kg-1·d-1),灌胃体积均为6 mL·kg-1。连续灌胃110 d后,所有大鼠进行称重,断头处死,迅速剥离肝脏置于液氮中,再转入-80 ℃保存备用。
1.4 蛋白样品制备
每组随机选4个肝脏样品,分别取约100 mg,加入预冷的蛋白裂解液(7 mol·L-1尿素、2 mol·L-1硫脲、4% CHAPS、30 mmol·L-1Tris、1 mmol·L-1PMSF、1%蛋白酶抑制剂cocktail),冰浴匀浆后超声破碎2 min:15%功率,工作1 s,间隔5 s。以4 ℃、12 000 g离心20 min,收集上清液。提取后的蛋白用2D Quant Kit测定蛋白浓度。每组中4个样品等蛋白量混合成1个样品,混合样品用2D Clean-Up Kit除盐后重新测定浓度以备后续2-DE分析。
1.5 二维凝胶电泳(2-DE)
每组混合样品各取100 μg加入200 μL水化液中(7 mol·L-1尿素、2 mol·L-1硫脲、2% CHAPS、20 mmol·L-1DTT、0.5% IPG buffer),充分混匀。20 000 g离心30 min后,加入到11 cm胶条槽中。将室温平衡后的IPG胶条(11 cm,pH 4~7)放入胶条槽,加覆盖油,在IPGphor仪器上进行第一向等电聚焦至43 kVh。等电聚焦后,进行IPG胶条平衡,之后置于Hoefer SE600电泳槽内进行垂直电泳,并加入0.5 μg磷酸化蛋白Marker。电泳条件:15 ℃循环水浴、10 mA电泳1 h,之后30 mA横流电泳至溴酚蓝指示剂到达底部边缘。每次3个样品,每组1个,至少4个实验重复。
1.6 Pro-Q DPS染色和SYPRO Ruby染色
Pro-QDPS是一种磷酸化蛋白特异性染料。将SDS-PAGE分离后凝胶置于固定液(40%甲醇、10%乙酸)中过夜。超纯水漂洗3次,加入Pro-Q DPS染液染色90 min。加入脱色液(50 mmol·L-1NaOAC、20%乙腈,pH 4.0)脱色3次,每次30 min。超纯水漂洗2次后用Typhoon 9400扫描仪对凝胶进行扫描。激发光/发射光:532 nm/580 nm,用ImageQuant TL 7.0软件对图像进行分析,避免蛋白点过饱和。
SYPRO Ruby是一种全蛋白荧光染料。Pro-Q DPS染色后凝胶放入超纯水中漂洗2次后加入含SYPRO Ruby染液中染色过夜。加入SYPRO Ruby脱色液(7%乙酸、10%甲醇)脱色30 min。超纯水漂洗2次后用Typhoon 9400扫描仪对凝胶进行扫描。激发光/发射光:532 nm/610 nm,用ImageQuant TL 7.0软件对图像进行分析,避免蛋白点过饱和。
全程避光操作,扫描后将SYPRO Ruby染色后的凝胶进行银染。
1.7 图像分析
运用ImageMaster 2D Platinum 6.0(美国GE)软件对Pro-Q DPS染色胶图进行分析。背景校正、定义地标后检测蛋白点,对照组作为Master gel,与各实验组胶进行匹配。将匹配上蛋白点的体积百分比(Vol%)输出后进行分析,用t-test检验方法进行统计。P <0.05的蛋白认为是差异表达蛋白。将SYPRO Ruby胶图与Pro-Q DPS染色图进行匹配,找出差异点后与银染图进行匹配。
1.8 质谱鉴定及数据库搜索
在银染胶上切取差异蛋白点,置于96孔板中,每孔加入150~200 μL脱色液(铁氰化钾 25 mmol·L-1,硫代硫酸钠50 mmol·L-1)脱色40 min。超纯水洗2次,加入ACN脱水,烘干。每孔加入2.5~3 μL Trypsin酶液于37 ℃消化12 h,直到胶粒由白变透明。每孔加入肽段提取液(50% ACN、0.1% TFA)60~70 μL,提取30 min,重复1次。冻干后加入10 μL肽段提取液,用于质谱分析。
取0.5 μL样品与等体积的质谱上样液(0.1% TFA、50% ACN)混合后点靶,用4700 Proteomics Analyzer (TOF/TOF TM)串联飞行时间质谱仪进行质谱分析,激光源为355 nm波长,加速电压为20 kV,采用正离子模式和自动获取数据的模式采集数据。所得结果用MASCOT进行数据库检索。搜索参数设置:数据库为NCBInr;检索种属为大鼠;最大允许漏切位点为1;酶为胰蛋白酶。质量误差范围设置:PMF 0.3 Da,MS/MS 0.4 Da。
将protein score>56的检索结果认定为可信匹配蛋白,置信区间(C.I.)>95%的肽段序列认定为可信序列。然后将可信匹配蛋白依据GO terms和KEGG进行功能分类和生物学过程分析。多数蛋白具有多种功能,则根据其主要的功能进行分类。
1.9 Western blot 验证
将等量蛋白样品通过SDS-PAGE分析,转膜。PBST洗膜后奶粉封闭,加入一抗(1:1 000),过夜孵育。PBST洗膜后,加入辣根过氧化物酶(HRP)标记的羊抗兔IgG(1:5000),孵育1 h,后洗膜曝光。蛋白条带使用化学发光(ECL)检测试剂显示,X胶片曝光。扫描后,用Quantity One软件进行灰度分析,目标蛋白灰度使用内参(Hprt)进行校正。
1.10 统计分析
2 结果(Results)
2.1 Pro-Q DPS磷酸化蛋白染色方法的建立
本实验参考Agrawal等(2005)优化的Pro-Q DPS染色方法结合二维电泳对雄性大鼠肝脏的磷酸化蛋白进行分析,磷酸化蛋白染色后用SYPRO Ruby荧光染料对全蛋白进行后染色。图1显示了同一张2D凝胶多重染色的图谱,其中蛋白marker中45 kd、23.6 kd为磷酸化蛋白。图中可以看出雄性大鼠肝脏蛋白在11 cm、pH 4~7二维凝胶上分离效果较好,大多数蛋白点清晰可见;从蛋白marker中磷酸化蛋白在两胶图上的信号强度可以看出本实验中Pro-Q DPS在二维凝胶上的磷酸化蛋白染色特异性比较好,可以进行差异磷酸化蛋白质组学分析。
2.2 PFDoA对大鼠肝脏磷酸化蛋白表达水平的影响
不同剂量PFDoA(0、0.2、0.5 mg·kg-1·d-1)暴露110 d大鼠肝脏蛋白2-DE分离后用Pro-Q DPS染料进行磷酸化蛋白染色,并用ImageMaster 6.0软件选取有明显荧光信号的122个磷酸化蛋白点进行定量差异分析,并与SYPRO Ruby染色胶图进行匹配。

图1 用两种荧光染料对雄性大鼠肝脏进行染色的2-DE凝胶胶图 注:A,Pro-Q DPS 磷酸化蛋白染色;B,SYPRO Ruby全蛋白染色。Fig. 1 2-DE images of hepatic proteins from male rats stained sequentially with two dyesNote:A, Pro-Q DPS stained phosphoproteins; B, SYPRO Ruby stained general proteins.
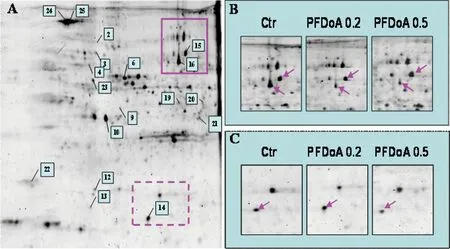
图2 差异磷酸化蛋白在Pro-Q DPS染色2-DE胶图上的分布 注:A,18个成功鉴定的磷酸化蛋白点在对照组Pro-Q DPS染色胶图的位置,注释为Spot No;B,蛋白点15、16在不同处理组的磷酸化水平;C,蛋白点14在不同处理组的磷酸化水平;Ctr,对照组,PFDoA 0.2,0.2 mg·kg-1·d-1 PFDoA处理组,PFDoA 0.5,0.5 mg·kg-1·d-1 PFDoA处理组。Fig. 2 Representative 2-DE image for differentially expressed phosphoproteins from rat liver (Pro-Q DPS stained-gel) Note:A, 18 spots of identified phosphoprotein from rat liver in control group. B, Phosphorylation levels of spots 15 and 16 in different groups; C, Phosphorylation levels of spots 14 in different groups; Ctr, Control; PFDoA 0.2, 0.2 mg·kg-1·d-1 PFDoA group; PFDoA 0.5, 0.5 mg·kg-1·d-1 PFDoA group.

表1 PFDoA暴露110 d后大鼠肝脏磷酸化差异蛋白鉴定列表
注:aSpot No. 参考图1;b是否已确认为大鼠磷酸化蛋白(Uniprot数据库搜索磷酸化位点),Y已确定(具有磷酸化位点信息),N未确定(无磷酸化位点信息);c生物学功能分类。
Note:aSpots No. referring to Fig.1;bKnown (Y) or unknown (N) rat phosphoproteins (searched the phosphorylated sites in Uniprot Database);cIdentified proteins were grouped according to their functions.
经分析,30个磷酸化蛋白表达水平在PFDoA处理后发生显著变化(P<0.05)。其中25个差异磷酸化蛋白点在银染胶上进行匹配,挖点后通过MALDI TOF/TOF质谱对蛋白性质进行鉴定。18个蛋白点被成功鉴定,图2显示了它们在2-DE凝胶图上的分布情况,蛋白性质及磷酸化水平差异如表1所示。其中,磷酸化水平上调的有15个,而下调仅为3个。热休克蛋白Hspd1、Hspab1在0.5 mg·kg-1·d-1PFDoA处理下磷酸化水平显著升高(P < 0.05),而Hspa8的磷酸化水平在低浓度组显著降低,但变化倍数不大。酰基CoA硫解酶(Cte1)在PFDoA作用下分别上调1.75倍和2.21倍,但低浓度组差异不显著(P>0.05);另外,琥珀酰CoA连接酶(Suclg2)磷酸化水平在低浓度组(0.2 mg·kg-1·d-1)上调1.14倍(P < 0.05)。
2.3 生物信息学分析及蛋白含量分析
对18个MAIDI TOF/TOF鉴定的差异蛋白进行UniProt数据库搜索(http://www.uniprot.org/),发现10个蛋白在大鼠中的磷酸化位点已知(表1),而其他8个蛋白是否是磷酸化蛋白及其在哺乳动物中的磷酸化位点还需进一步研究。
另外,我们对18个成功鉴定的蛋白进行GO生物学功能和KEGG生物学通路分析,发现这些差异蛋白主要参与应激防御、脂类代谢、糖代谢、氨基酸代谢和电子传递等功能(表1)。其中,4个磷酸化蛋白参与糖代谢过程,包括Suclg2、Fbp1、葡萄糖磷酸变位酶(Pgm1)和丙酮酸激酶(L-PK)。另一大类是应激和免疫防御功能的蛋白,其中4个蛋白点属于热休克蛋白(Hspa8、Hspd1和Hsp90ab1)。
另外,进一步用Western blot方法分析大鼠肝脏Fbp1的蛋白水平及Hsp90ab1的蛋白水平和磷酸化水平变化,如图3所示。结果发现PFDoA暴露110 d后,大鼠肝脏Fbp1蛋白水平变化不显著(P>0.05),而Hsp90ab1的总蛋白水平在0.5 mg·kg-1·d-1PFDoA处理组显著升高,同时磷酸化水平在2个处理组均显著升高(P<0.05),可见Pro-Q DPS染色方法有一定的准确性。
3 讨论(Discussion)
PFDoA是含12个碳原子的PFAS,目前在水、土壤、野生动物及人体血清中均检测到[15-16]。已被证实其毒性大于短链PFASs[17],并可以引起肝脏肿大、血脂紊乱、性激素失调及睾丸损伤等[18-19]。其中,用不同浓度PFDoA(0、0.02、0.05、0.2和0.5 mg·kg-1·d-1)暴露雄性大鼠110 d后,各处理组肝脏相对重量和绝对重量显著增加,其中0.2和0.5 mg·kg-1·d-1处理组血清葡萄糖、碱性磷酸酶(ALP)活性和总胆汁酸(TBA)水平显著增加,肝脏出现脂肪空泡化及坏死现象,且最高浓度组肝脏出现明显的脂质过氧化[8,[20]。为了从翻译后修饰水平进一步研究PFDoA致肝脏毒性作用机制,我们选择0、0.2和0.5 mg·kg-1·d-1PFDoA处理组大鼠肝脏,采用与2-DE蛋白质组学技术与ProQ DPS磷酸化蛋白染色结合的方法对不同剂量PFDoA暴露110 d大鼠肝脏磷酸化蛋白进行了初步分析。
糖代谢包括糖异生和糖酵解过程。本实验中,糖异生过程的关键酶Fbp1磷酸化水平在0.2 mg·kg-1·d-1PFDoA处理组显著上调,而总蛋白表达量未发生明显变化,说明其磷酸化水平的变化不依赖于总蛋白量的升高,但PFDoA对其具体的作用途径还不清楚。目前,Fbp1活性被认为是通过变构效应进行调节,ADP、AMP、2,6-二磷酸果糖(FBP2)是其主要的变构激活剂;而在正常哺乳动物肝细胞中其磷酸化水平的变化与催化活性的影响还不清楚[21],因此,我们还尚不能由此推断PFDoA对大鼠肝脏糖异生途径的影响。Pgm1是半乳糖进入糖酵解途径的催化酶。Gururai等[22]研究发现信号传递蛋白p21-活化蛋白激酶1(Pak1)通过介导Pgm1磷酸化而增强Pgm1的活性。由此可见本实验中Pgm1磷酸化水平升高可以促进其催化活性的增加,使半乳糖生成的1-磷酸葡萄糖转化成6-磷酸葡萄糖的速度增加,从而加速肝脏对半乳糖的分解利用,并对糖酵解途径产生促进作用。丙酮酸激酶(Pk)是糖酵解途径的重要调节酶,其L型同功酶(L-Pk)可与磷酸烯醇式丙酮酸结合催化其形成丙酮酸,它的催化反应速度被磷酸化和去磷酸化所调节。血糖水平低时,高血糖素的级联放大系统可以使丙酮酸激酶磷酸化,成为活性低的形式,而去磷酸化的酶活性较高。本实验中,不同剂量PFDoA暴露后大鼠肝脏L-Pk磷酸化水平显著下调,分别为对照组的-2.61和-6.40倍,说明在蛋白表达量不变的情况下L-Pk催化活性增加,从而加速酵解过程,这可能由于PFDoA暴露后大鼠血糖和肝脏葡萄糖的积累[8]对L-Pk的磷酸化状态起到一定调节作用。而芯片结果显示0.2 mg·kg-1·d-1处理组L-Pk mRNA表达水平显著降低[8],因此需要进一步对其蛋白表达量及酶活性进行验证,以确定PFDoA对L-Pk的具体作用方式及意义。
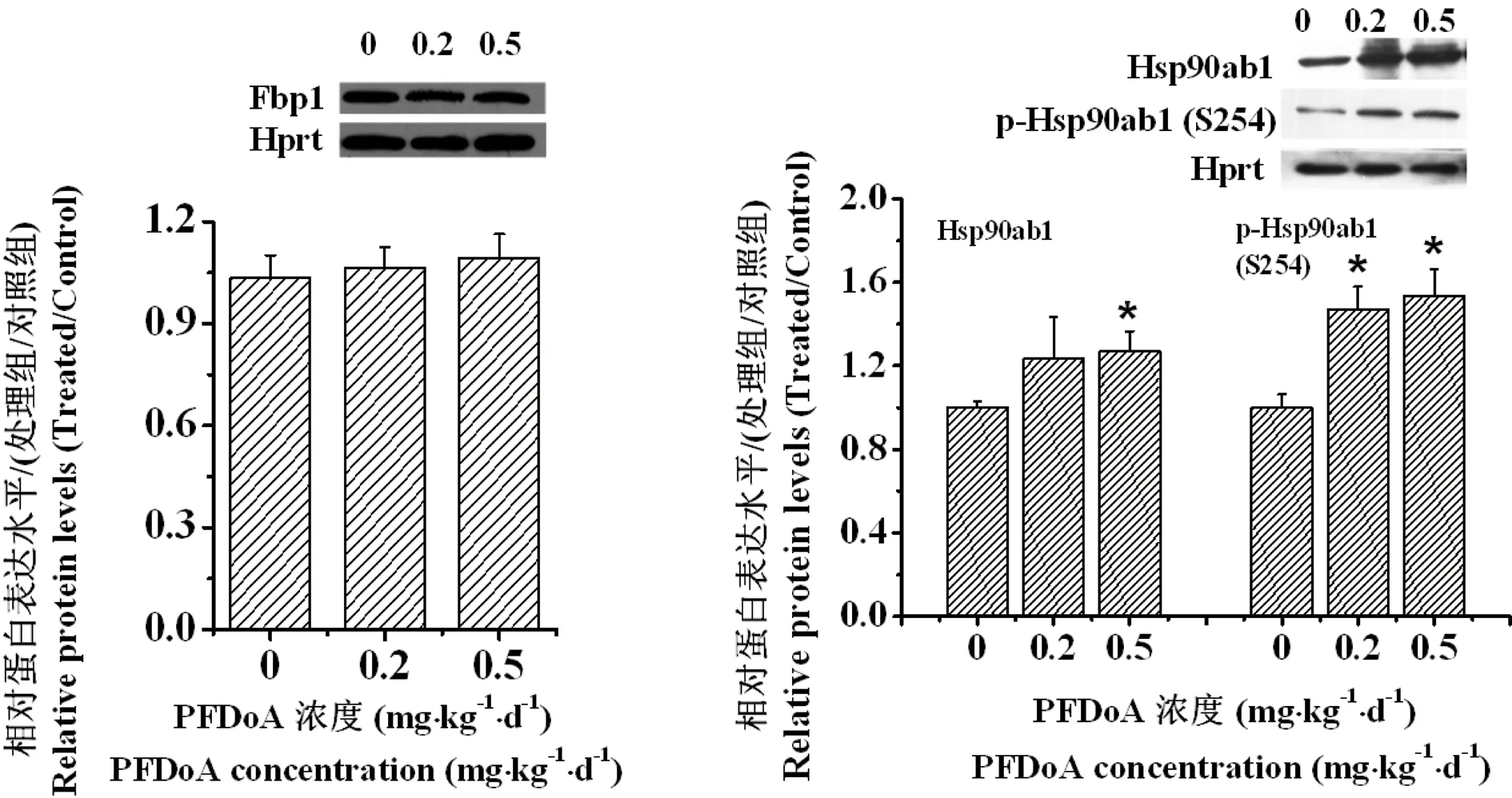
图3 Western blot分析PFDoA暴露110 d后大鼠肝脏Fbp1蛋白水平变化、Hsp90ab1蛋白水平及磷酸化水平的变化Fig. 3 Protein levels of Fbp1, Hsp90ab1 and phosphorylation levels of Hsp90ab1 in rat liver exposed to PFDoA for 110 days by Western blot analysis
糖酵解过程产生的丙酮酸氧化脱羧形成乙酰CoA,并经三羧酸循环最终生成CO2和H2O。Suclg2在三羧酸循环过程中将琥珀酰CoA转化成琥珀酸,目前还没有有关确认Suclg2是磷酸化蛋白的报道,UniProt数据库中也没有其磷酸化位点的信息。而本实验中Suclg2可以被Pro-Q Diamond磷酸化染料染色,且表达量在0.2 mg·kg-1·d-1PFDoA处理组显著升高,与我们之前DIGE结果中总蛋白水平变化趋势一致[20]。Roux等[23]对不同发育阶段海胆卵的磷酸化蛋白进行研究,发现Suclg2可被Pro-Q Diamond染色并在不同发育阶段表达量不同。因此,Suclg2可能是非特异性染色蛋白,我们观察到的是总蛋白的变化,但也可能是一种磷酸化蛋白,PFDoA作用下其磷酸化水平的升高与总蛋白水平的变化有关,但可以肯定的是PFDoA对Suclg2的诱导首先体现在转录水平上,促进蛋白表达量的增加,继而加速TCA循环。
与Suclg2类似,脂肪酸代谢过程中的Cte1磷酸化情况也未见报道,并且本实验中Cte1 蛋白点的Pro-Q Diamond磷酸化染色较浅(图2A,蛋白点20),说明其磷酸化水平很低或属于非特异性染色。已有研究显示PFDoA作用下Cte1 mRNA和蛋白水平均显著升高[20],因此0.5 mg·kg-1·d-1处理组表达量的升高可能反映了总蛋白量的变化。甘油激酶(GK)是甘油代谢的限速酶,甘油被运输到肝脏,被GK磷酸化形成3-磷酸甘油,进入糖酵解途径分解或用于糖异生。有研究表明硬壁菌铅黄肠球菌(Enterococcus casseliflavus)和嗜热菌(Thermus flavus )GK可以受磷酸烯醇式丙酮酸(PEP)介导使组氨酸残基发生磷酸化从而增强其活性,且活性变化程度具有种属差异[24],而大鼠等哺乳动物中GK的磷酸化修饰情况还未见报道。本实验中大鼠肝脏GK的Pro-Q DPS染色颜色较深(蛋白点6),说明其磷酸化程度较高,而高浓度组GK的磷酸化水平显著降低,是否因此改变酶活性从而影响甘油代谢途径还需进一步研究。
另一类差异磷酸化蛋白是与氧化应激和免疫防御相关的热休克蛋白,包括Hsp90家族的Hsp90ab1、Hsp70家族的Hspa8及Hsp60家族的Hspd1,高温或生理上的刺激都可以激发它们的合成。它们以磷酸化蛋白的形式在体内存在,对维持细胞稳态发挥重要的作用。已有研究表明高温刺激、肾上腺切除或剧烈运动可使大鼠肝脏Hsp70s的磷酸化状态发生改变[25],TCDD可显著增加人肝细胞Hspa5的磷酸化水平[26],但磷酸化对Hsp70s功能的影响还不清楚;Kulathingal等[27]发现α突触核蛋白的积累能显著降低3D5细胞Hsp90α/β的磷酸化水平;另外Barati等[28]研究发现肾细胞中丝氨酸-苏氨酸激酶(Akt)能使热休克蛋白Hsp70、Hsp90α/β等磷酸化,并认为肾细胞受到物理或病理刺激后Akt介导的热休克蛋白磷酸化对调节分子伴侣的功能有重要作用。本实验中,Hspd1和Hspab1在高浓度处理组磷酸化水平显著升高,而Hspa8的磷酸化水平在低浓度组显著降低,考虑到热休克蛋白维持细胞稳态功能的重要性,有必要进一步研究PFDoA引起的Hsps磷酸化水平的变化对Hsps功能的影响。
本文通过2-DE和Pro-Q DPS磷酸化蛋白染色法对PFDoA引起的大鼠肝脏磷酸化蛋白组的变化进行了初步分析。发现PFDoA处理组中一些磷酸化蛋白水平发生变化,这些蛋白涉及多个生物学过程,如脂类代谢、糖代谢、氨基酸代谢、应激防御及呼吸链氧化磷酸化等途径,这为我们从翻译后修饰水平进一步了解PFDoA的毒性作用提供了依据。但其中多数蛋白磷酸化位点的功能及磷酸化修饰水平对相关蛋白功能的影响还不清楚。因此,需要进一步研究并完善蛋白修饰位点及其功能,为揭示环境污染物的毒性提供基础。
[1] Giesy J P, Kannan K. Perfluorochemical surfactants in the environment [J]. Environmental Science & Technology, 2002, 36(7): 146A-152A
[2] Lau C, Anitole K, Hodes C, et al. Perfluoroalkyl acids: A review of monitoring and toxicological findings [J]. Toxicological Sciences, 2007, 99(2): 366-394
[3] Lau C, Butenhoff J L, Rogers J M. The developmental toxicity of perfluoroalkyl acids and their derivatives [J]. Toxicology and Applied Pharmacology, 2004, 198(2): 231-241
[4] Kennedy G L Jr, Butenhoff J L, Olsen G W, et al. The toxicology of perfluorooctanoate [J]. Critical Reviews in Toxicology, 2004, 34(4): 351-384
[5] Guruge K S, Yeung L W, Yamanaka N, et al. Gene expression profiles in rat liver treated with perfluorooctanoic acid (PFOA) [J]. Toxicological Sciences, 2006, 89(1): 93-107
[6] Rosen M B, Abbott B D, Wolf D C, et al. Gene profiling in the livers of wild-type and PPARalpha-null mice exposed to perfluorooctanoic acid [J]. Toxicologic Pathology, 2008, 36(4): 592-607
[7] Rosen M B, Schmid J R, Corton J C, et al. Gene expression profiling in wild-type and PPARalpha-null mice exposed to perfluorooctane sulfonate reveals PPARalpha-Independent effects [J]. PPAR Research, 2010, DOI: 10.1155/2010/794739
[8] Ding L, Hao F, Shi Z, et al. Systems biological responses to chronic perfluorododecanoic acid exposure by integrated metabonomic and transcriptomic studies [J]. Journal of Proteome Research, 2009, 8(6): 2882-2891
[9] Gatzka M, Walsh C M. Apoptotic signal transduction and T cell tolerance [J]. Autoimmunity, 2007, 40(6): 442-452
[10] Hanahan D, Weinberg R A. The hallmarks of cancer [J]. Cell, 2000, 100(1): 57-70
[11] Taniguchi C M, Emanuelli B, Kahn C R. Critical nodes in signalling pathways: Insights into insulin action [J]. Nature Reviews Molecular Cell Biology, 2006, 7(2): 85-96
[12] Charbonneau H, Tonks N K. 1002 protein phosphatases? [J]. Annual Review of Cell and Developmental Biology, 1992, 8: 463-493
[13] 晏光荣, 曹亚. 蛋白质组学在信号转导研究中的应用 [J]. 生命的化学, 2004, 24(1): 10-12
[14] Steinberg T H, Agnew B J, Gee K R, et al. Global quantitative phosphoprotein analysis using Multiplexed Proteomics technology [J]. Proteomics, 2003, 3(7): 1128-1144
[15] Guruge K S, Taniyasu S, Yamashita N, et al. Perfluorinated organic compounds in human blood serum and seminal plasma: A study of urban and rural tea worker populations in Sri Lanka [J]. Journal of Environmental Monitoring, 2005, 7(4): 371-377
[16] Olsen G W, Ellefson M E, Mair D C, et al. Analysis of a homologous series of perfluorocarboxylates from American Red Cross adult blood donors, 2000-2001 and 2006 [J]. Environmental Science & Technology, 2011, 45(19): 8022-8029
[17] Kudo N, Suzuki-Nakajima E, Mitsumoto A, et al. Responses of the liver to perfluorinated fatty acids with different carbon chain length in male and female mice: In relation to induction of hepatomegaly, peroxisomal beta-oxidation and microsomal 1-acylglycerophosphocholine acyltransferase [J]. Biological & Pharmaceutical Bulletin, 2006, 29(9): 1952-1957
[18] Zhang H, Shi Z, Liu Y, et al. Lipid homeostasis and oxidative stress in the liver of male rats exposed to perfluorododecanoic acid [J]. Toxicology and Applied Pharmacology, 2008, 227(1): 16-25
[19] Shi Z, Zhang H, Ding L, et al. The effect of perfluorododecanonic acid on endocrine status, sex hormones and expression of steroidogenic genes in pubertal female rats [J]. Reproductive Toxicology, 2009, 27(3-4): 352-359
[20] Liu H, Zhang H, Cui R, et al. Activation of peroxisome proliferator-activated receptor alpha ameliorates perfluorododecanoic acid-induced production of reactive oxygen species in rat liver [J]. Archives of Toxicology, 2016, 90(6): 1383-1397
[21] Rakus D, Zarzycki M, Dzugaj A. Rabbit muscle fructose-1,6-bisphosphatase is phosphorylated in vivo [J]. Acta Biochimica Polonica, 2003, 50(1): 115-121
[22] Gururaj A, Barnes C J, Vadlamudi R K, et al. Regulation of phosphoglucomutase 1 phosphorylation and activity by a signaling kinase [J]. Oncogene, 2004, 23(49): 8118-8127
[23] Roux M M, Radeke M J, Goel M, et al. 2DE identification of proteins exhibiting turnover and phosphorylation dynamics during sea urchin egg activation [J]. Developmental Biology, 2008, 313(2): 630-647
[24] Yeh J I, Kettering R, Saxl R, et al. Structural characterizations of glycerol kinase: Unraveling phosphorylation-induced long-range activation [J]. Biochemistry, 2009, 48(2): 346-356
[25] Gonzalez B, Manso R. Induction, modification and accumulation of HSP70s in the rat liver after acute exercise: Early and late responses [J]. The Journal of Physiology, 2004, 556(Pt 2): 369-385
[26] Kim J H, In Y J, Kim W K, et al. Differential signatures of protein glycosylation and phosphorylation in human Chang liver cells induced by TCDD treatment [J]. Toxicology Letters, 2008, 178(1): 20-28
[27] Kulathingal J, Ko L W, Cusack B, et al. Proteomic profiling of phosphoproteins and glycoproteins responsive to wild-type alpha-synuclein accumulation and aggregation [J]. Biochimica et Biophysica Acta, 2009, 1794(2): 211-224
[28] Barati M T, Rane M J, Klein J B, et al. A proteomic screen identified stress-induced chaperone proteins as targets of Akt phosphorylation in mesangial cells [J]. Journal of Proteome Research, 2006, 5(7): 1636-1646
◆
Chronic Exposure of PFDoA Affect the Phosphorylation Levels of Proteins in Rat Liver
Zhang Hongxia, Cui Ruina, Dai Jiayin*
Key Laboratory of Animal Ecology and Conservation Biology, Institute of Zoology, Chinese Academy of Sciences, Beijing 100101, China
Perfluoroalkyl and polyfluoroalkyl substances (PFASs), an emerging kind of persistent organic pollutant, have been widely used in commercial and industrial products due to their unique physicochemical properties. PFASs have various toxicities to the living system. Perfluorododecanoic acid (PFDoA) with twelve carbon atoms, has broad industrial applications and is widely distributed in both wildlife and the environment. However, unlike other PFASs with short carbon chains, up to date limited studies have been performed on the toxic effects of PFDoA on animals. To reveal the mechanism of PFDoA hepatotoxicity, male rats were exposed to PFDoA for 110 days and the phosphoprotein profiles in the rat liver were analyzed by 2-DE methods coupled with Pro-Q Dimond phosphoprotein stain (Pro-Q DPS). The results showed significant change in the phosphorylation levels of 30 proteins after PFDoA exposure. Among them, 18 proteins were identified successfully by MALDI-TOF/TOF MS analysis. After bioinformatics analysis, these identified phosphoproteins were found to be involved in lipid metabolism, glucose metabolism, stress and immune response, electron transport, and so on. The results presented in this study will provide basic data for further study of the mechanism of PFDoA hepatotoxicity at the post-translational modification level.
PFDoA; rat; hepatotoxicity; phosphoprotein; Pro-Q Diamond
10.7524/AJE.1673-5897.20150818003
国家自然科学基金(31320103915; 21377128)
张红霞(1981-),女,助理研究员,研究方向为生态毒理学,E-mail: zhanghx@ioz.ac.cn;
*通讯作者(Corresponding author), E-mail: daijy@ioz.ac.cn
2015-08-18 录用日期:2015-10-15
1673-5897(2016)2-266-09
X171.5
A
简介:戴家银(1965—),男,博士,中国科学院动物研究所研究员,主要从事持久性污染物的生态毒理学研究工作,发表学术论文80余篇。
张红霞,崔瑞娜,戴家银. 全氟十二烷酸(PFDoA)慢性暴露干扰大鼠肝脏磷酸化蛋白质水平[J]. 生态毒理学报,2016, 11(2): 266-274
Zhang H X, Cui R N, Dai J Y. Chronic exposure of PFDoA affect the phosphorylation levels of proteins in rat liver [J]. Asian Journal of Ecotoxicology, 2016, 11(2): 266-274 (in Chinese)

