对特辛基苯酚干扰雌激素受体作用的分子基础及其对ERβ亚型选择性结合的理论研究
朱婧涵,薛峤,张爱茜
中国科学院生态环境研究中心 环境化学与生态毒理学国家重点实验室,北京 100085
对特辛基苯酚干扰雌激素受体作用的分子基础及其对ERβ亚型选择性结合的理论研究
朱婧涵,薛峤,张爱茜*
中国科学院生态环境研究中心 环境化学与生态毒理学国家重点实验室,北京 100085
对特辛基苯酚(4-tert-octylphenol, PTOP)是一种环境内分泌干扰物。已有研究发现虽然其能够直接与雌激素受体(estrogen receptor, ER)的两种亚型(ERα, ERβ)结合并产生干扰效应,但其结合能力却各不相同,PTOP对ERβ表现出更强的结合活性。为了探究PTOP与ER结合的分子机制及其对ER两种亚型的选择性机制,本文采用分子动力学模拟对PTOP-ER复合物进行了研究,并利用MM-GBSA方法计算了结合自由能。结果表明,范德华作用是维持PTOP与ER结合的主要驱动力;而极性相互作用的差异是导致PTOP对ERα和ERβ产生选择性结合的重要因素,PTOP与ERα之间的极性溶剂化作用阻碍了两者的结合。将PTOP与ER的天然底物雌二醇进行比较,发现PTOP与ER口袋之间缺乏氢键稳定二者结合,因此PTOP的结合活性较低。计算模拟亦指出了PTOP结合过程中发挥重要作用的关键氨基酸。以上计算结果将有助于我们进一步理解PTOP影响ER介导生理过程的干扰机制。
雌激素受体α;雌激素受体β;对特辛基苯酚(PTOP);分子动力学;MM-GBSA
Received 30 November 2015 accepted 26 January 2016
雌激素受体(estrogen receptor, ER)包含两种亚型,分别为ERα和ERβ,它们的三维结构较为相似,主要由DNA结合区(DNA binding domain, DBD),铰链区以及配体结合区(ligand binding domain, LBD)等几部分构成。其中DBD主要与DNA结合并通过AF-1(Activation Function 1)区域进行DNA的调控表达。而LBD则主要与雌激素进行结合,同时,这一区域也是各种环境污染物的主要靶点。ERα与ERβ的DBD高度保守,氨基酸序列的同源性达到95%,而它们LBD区域的氨基酸序列的同源性也达到了59%[1-5]。不仅如此,两者LBD部分的三维结构也基本相同,均包含了12个α螺旋(helix 1-12,简称H1-H12)及2个β片层(β1、β2),其中H3、H6、H8、H11、H12及β1、β2组成了配体结合口袋[6],如图1所示。ERα和ERβ结合口袋区域非常保守,主要由疏水性残基组成,但存在微小差异,即ERα中Leu384和Met421在ERβ中分别对应Met336和Ile373[7]。
对特辛基苯酚(4-tert-octylphenol, PTOP)又名辛基酚,是一种较为常见的环境内分泌干扰物,在工业生产中被广泛用于制取油溶性酚醛树脂、表面活性剂、染料、杀虫剂等。PTOP因其疏水特性被大量吸附于土壤、悬浮固体和沉积底泥中[8]。在2001年,全世界每年PTOP的产量大约为50 000 t,其在底泥和水生环境中含量分别高达670 μg·kg-1和200 μg·L-1[8-9],目前PTOP每年的产量在不断上升;2013年欧盟PTOP每年的产量已高达23 000 t[10]。
PTOP结构与雌激素具有相似性,其结构如图2所示;当其进入人体内,会表现出拟雌激素作用[11],通过与ER结合,诱导ER介导信号的异常激活和雌激素应答基因的转录,干扰正常的雌激素代谢并能进一步影响雌激素受体所介导的生理过程,对胚胎发育、性行为和性差异产生不利的影响。目前已有研究表明PTOP会改变生物体性激素水平,抑制下丘脑-垂体发育,改变发情和繁殖周期,并影响新生儿的性发育,甚至增加致癌基因的表达[12-16]。
PTOP在烷基酚家族中具有代表性,其与ERα和ERβ的结合均表现出拟雌激素效应[17],是烷基酚类化合物中雌激素效应最强的一类化合物。已有的研究证实PTOP可以直接与ERα和ERβ进行结合并产生干扰效应,其结合活性的强度比天然雌激素雌二醇(estrodiol, E2)低,大约是E2的1/1000[18];另有研究结果表明ERβ对PTOP表现出较高的亲和性[17,19]。PTOP的干扰机制及其对ERα和ERβ的选择机制目前还不清楚,为了更深入地理解其结合基础,并从原子层面解析PTOP选择性结合的分子机制,本研究采用分子动力学(molecular dynamics, MD)模拟的方法,分别对ERα-PTOP、ERβ-PTOP、ERα-E2和ERβ-E2四个复合物进行了20 ns时长的模拟研究,并计算了各体系的结合自由能,通过与E2对比,探究了PTOP与ER两种亚型结合的分子机制,并阐述了PTOP对ERβ选择性结合的原因。
1 模拟方法(Methods)
1.1 理论模型的建立
本文研究中所构建的初始模型中,ERα、ERβ与E2的复合物结构来源于Protein Data Bank(PDB ID:1ERE,3OLS),并利用Sybyl 1.2软件对缺失残基进行了修补。同时以2个晶体结构为基础,采用Sybyl 1.2软件中的surflex模块对PTOP进行了分子对接,以打分最高的对接构象为基础,经过分子力学的优化,构建了ERα、ERβ与PTOP复合物结构。对晶体结构与对接结果均进行了pKa计算来确定氨基酸的质子态,同时保留了结晶水。
1.2 分子动力学模拟
整个分子动力学模拟过程都是在AMBER12软件下进行,在模拟过程中使用了最新的ff12SB分子力场。配体的静电势分布使用了AM1-BCC方法进行拟合。在模拟过程中采用了周期性边界条件,溶剂模型为TIP3P水模型,从水盒子表面到蛋白质复合物的任意原子之间的距离至少保证在9.0 Å。并向ERα-E2、ERα-PTOP模型添加了相应的Na+离子保持整个体系的电中性。
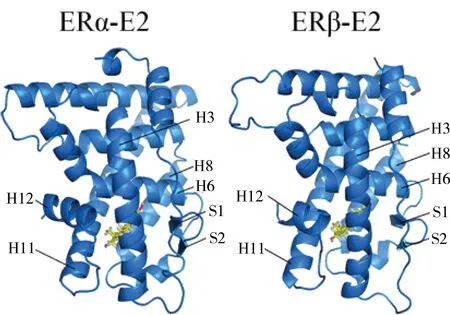
图1 ERα-E2 LBD (PDB ID:1ERE)与ERβ-E2 LBD (PDB ID:3OLS)晶体结构图,蓝色表示蛋白,结合口袋处黄色部分表示配体雌二醇(E2)Fig. 1 The crystal structure of ERα-E2 (PDB ID: 1ERE) LBD and ERβ-E2 (PDB ID: 3OLS) LBD (blue) with E2 (yellow) in the binding pocket
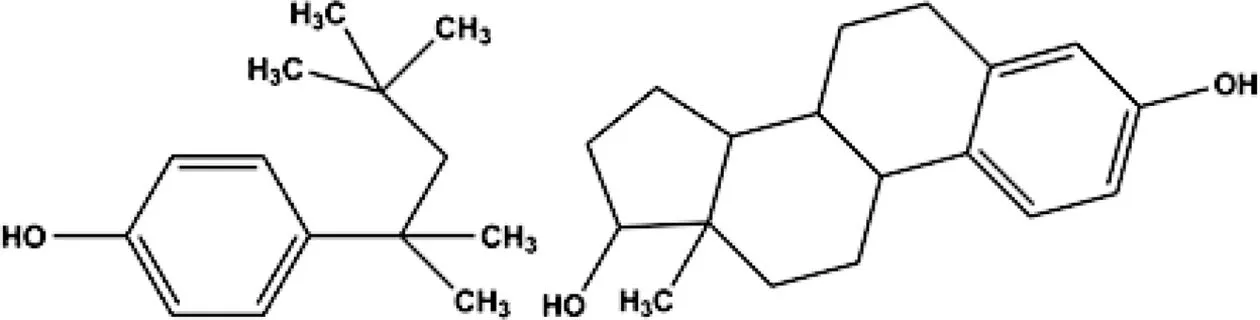
图2 对特辛基苯酚(左)和雌二醇(右)的化学结构Fig. 2 The structure of 4-tert-octylphenol (PTOP) (left) and estradiol (E2) (right)
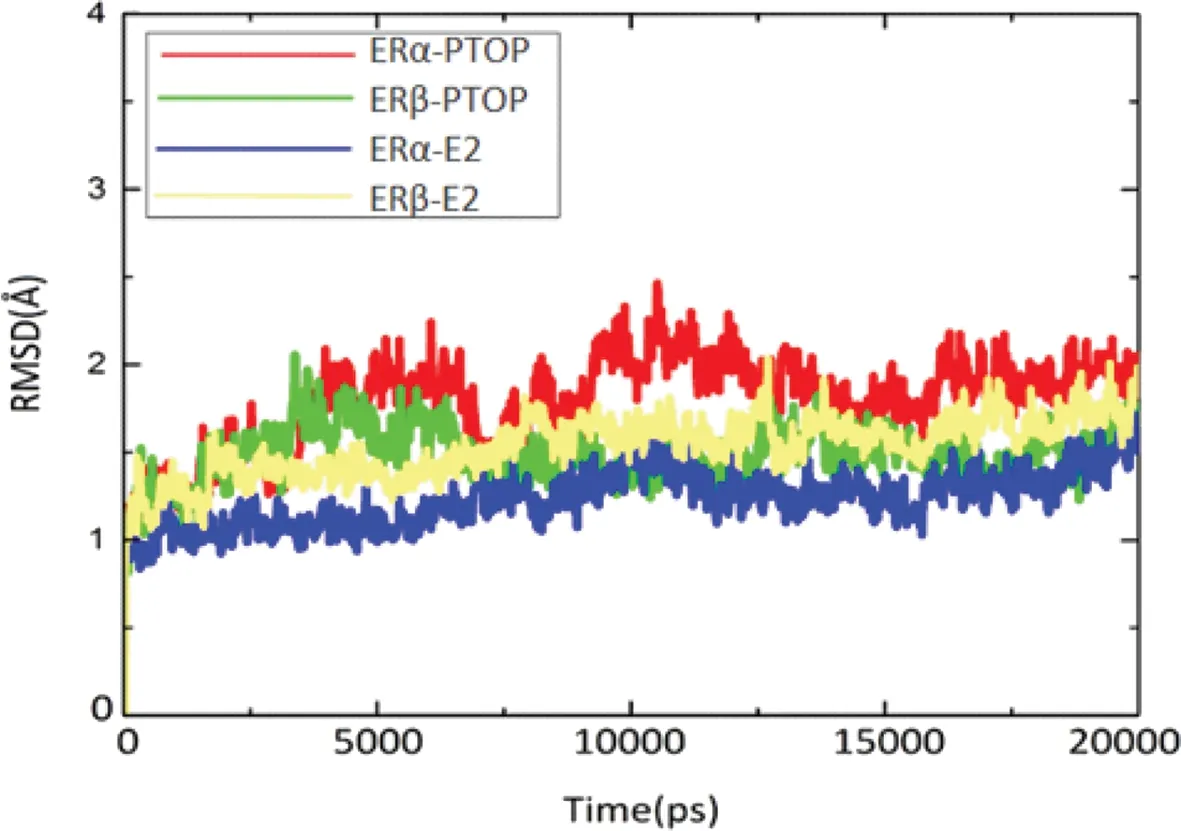
图3 ERα-E2、ERα-PTOP、ERβ-E2、ERβ-PTOP复合物体系的主链原子随时间变化的RMSD曲线Fig. 3 The backbone RMSD curves of ERα-E2, ERα-PTOP, ERβ-E2, and ERβ-PTOP
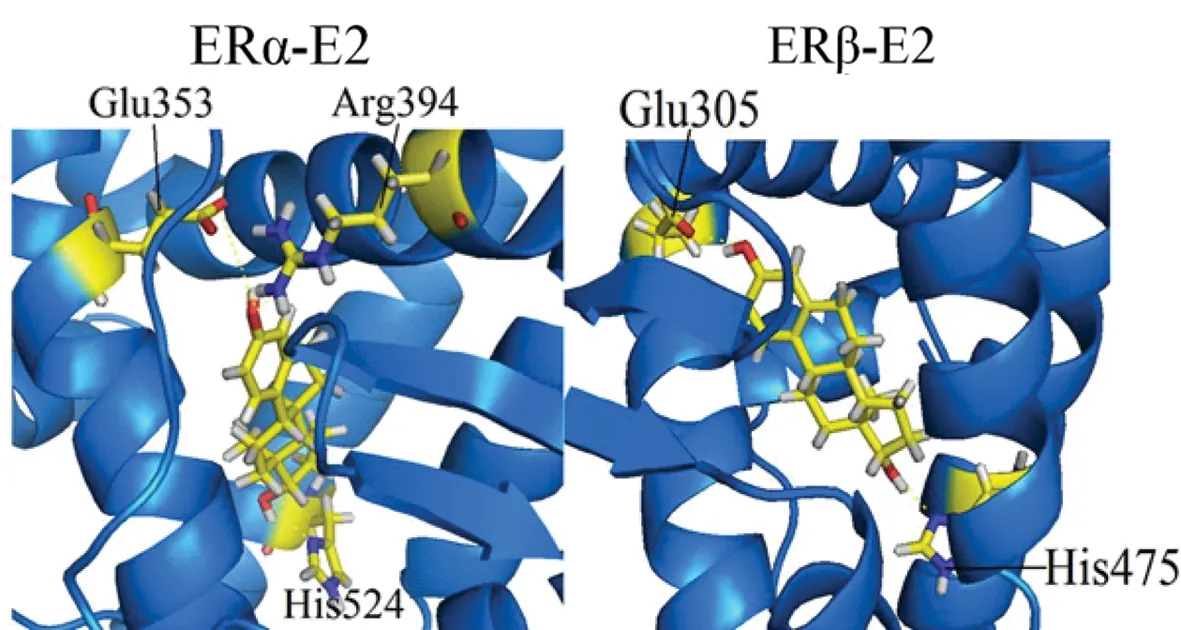
图6 E2与ERα和ERβ之间形成的氢键,氢键以黄色虚线表示Fig. 6 Hydrogen bonds between E2-ERα and E2-ERβ, colored by yellow line

图4 ERα-PTOP和ERβ-PTOP轨迹的聚类分析(粉红色表示占有率最高的构象,黄色代表初始构象)Fig. 4 Cluster analysis of ERα-PTOP and ERβ-PTOP (Pink: the structure of the largest cluster, yellow: initial structure)
在模拟过程中,首先对整个体系进行了1000步的最陡下降法优化,之后进行了2000步的共轭梯度法来优化。优化之后的复合物结构采用Langevin动力学方法使体系在300 ps内由0 K升温至310 K,碰撞频率为1 ps-1。之后在正则系综(NVT)条件下进行了500 ps时长的MD模拟对体系进行平衡。最后在等温等压(NPT)条件下,分别对4个复合物体系进行了20 ns的长程动力学模拟。在模拟中,所有H原子均使用SHAKE算法进行约束,步长设置为2 fs。采用PME方法计算长程静电相互作用,整个体系的截断半径设为12 Å。氢键的判据设定为氢键供体与受体的距离小于3.5 Å,角度小于60°。
1.3 MM-GBSA计算
MM-GBSA(molecular mechanics-generalized Born surface area)利用分子力学结合连续溶剂模型分析结合自由能的方法。结合自由能的正负决定了蛋白质与配体是否能结合,其数值的大小决定了结合的稳定程度。实验采用AMBER12软件中的MM-PBSA.py模块,使用MM-GBSA方法分别对4种复合物体系进行结合自由能△G的计算。实验原理如下:
△G= EMM+ GSol-TS
EMM=Eint+Eele+Evdw
GSol=GGB+GSA
其中,EMM、GSol、TS分别代表了气相的分子力学成分,溶剂化稳定能以及构象熵。EMM是内能(Eint)、静电能(Eele)以及范德华相互作用(Evdw)的加和。溶剂化能GSol则可以被分解为静电溶剂化自由能(GGB)和非极性溶剂化自由能(GSA);GGB可以由GB方法计算得到[20]。GSA则与结合过程中的溶剂可及表面相关[21]。MM-GBSA还计算了每个残基对于结合的贡献,即分解能。
2 结果与讨论(Results and discussion)
2.1 4种复合物的稳定性
本文分别对ERα-E2、ERβ-E2、ERα-PTOP、ERβ-PTOP复合物体系进行了时长为20 ns的MD模拟,并对结果进行了均方根偏差分析(root-mean-square deviation, RMSD)来表征整体蛋白结构的稳定性。如图3所示,4个复合物体系均在5 ns之后基本达到平衡,同时其RMSD波动基本处于2.5 Å以下,这表明蛋白质在结合了E2或者PTOP之后,并没有发生剧烈的构象变化。但需要指出的是,每个复合物的RMSD均有差异,其中,ERα-PTOP的RMSD波动较高,说明ERα在结合了PTOP之后,其结构稳定性最差;ERβ-PTOP复合物的RMSD比ERα-PTOP低,表明ERβ在结合PTOP后结构比ERα稳定。ERα和ERβ与E2结合后,RMSD均相对平稳。通过对比ERα-PTOP及ERα-E2,E2显然比PTOP更能稳定蛋白的结构,这也从侧面反映了E2的结合更好。
为了更明确地表征PTOP结合后蛋白整体结构的变化,我们对ERα-PTOP和ERβ-PTOP的复合物结构进行了聚类分析,如图4所示。我们选取了轨迹中占有率最高的构象作为代表性构象,将其与初始构象进行对比,可以看到,不论ERα或是ERβ均没有发生较大变化,二级结构与三级结构也基本保持稳定。但值得注意的是,在ERα-PTOP复合物中,PTOP的位置有一定偏移,而ERβ-PTOP中,PTOP基本保持在原位。这也反映出PTOP在ERα中的结合不如ERβ稳定。
2.2 结合自由能分析
为了减小误差,在4个复合物轨迹中,均选取了最后15~20 ns的最稳定轨迹来进行MM-GBSA分析,每个轨迹均选取了250帧构象。由于使用Nmode模块计算熵(△S)极为耗时[22],因此我们在最后5 ns轨迹中平均的抽提出25帧构象进行熵的计算。除了熵之外,整体的结合自由能还被进一步分为4项:范德华能、静电力能、极性溶剂化自由能与非极性溶剂化自由能。
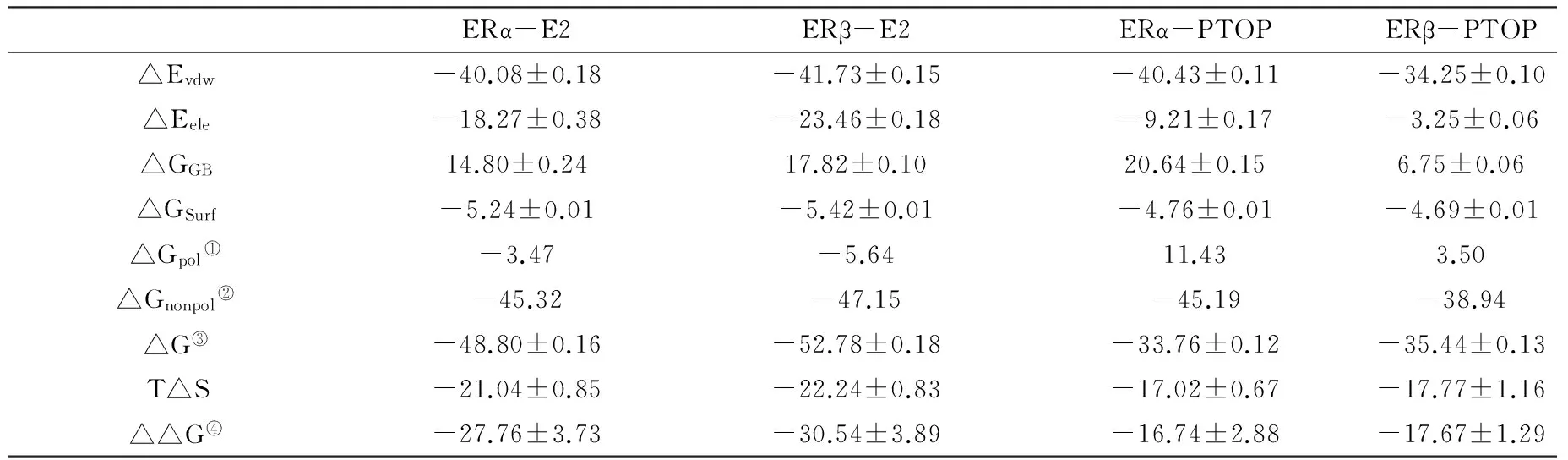
表1 复合物ERα-E2、ERα-PTOP、ERβ-E2、ERβ-PTOP之间的结合自由能(单位:kcal·mol-1)
Note: ①△Gpol=△Eele+△GGB; ②△Gnonpol=△Evdw+△GSurf; ③△G=△Evdw+△Eele+ △GGB+ △GSurf; ④△△G=△G - T△S
表1列出了ERα-E2、ERβ-E2、ERα-PTOP、ERβ-PTOP的结合自由能,分别为-27.72 kcal·mol-1、-30.54 kcal·mol-1、-16.74 kcal·mol-1、-17.67 kcal·mol-1。可以看到,E2与ER的结合自由能显著强于PTOP,这与实验结果是相一致的。对于4个复合物体系,非极性相互作用(ΔGnonpol=ΔEvdw+ΔGSA)是结合自由能的最大来源,是维持结合稳定性的主要驱动力。而极性相互作用(ΔGpol=ΔEele+ΔGGB)对于结合的贡献较小。通过对比可以看到,4个复合物的非极性相互作用差别不大;在极性相互作用中,ERα-E2、ERβ-E2两个复合物的极性相互作用是有利于结合的(其能量分别为-3.47 kcal·mol-1、-5.64 kcal·mol-1),而ERα-PTOP、ERβ-PTOP两个体系的极性相互作用却是非常不利于结合的(其能量分别为11.43 kcal·mol-1、3.50 kcal·mol-1),这也是造成PTOP比E2结合活性低的主要原因。
相对于ERα,我们还发现PTOP与ERβ具有更高的结合活性,这也符合实验上PTOP对ERβ结合具有选择性的结论。通过将其结合自由能进一步分解,我们可以到看2个复合物的极性相互作用与非极性相互作用均有差异。PTOP与ERα的非极性相互作用更强,进一步的分析表明PTOP与ERα的范德华作用更强,这表明ERα的疏水环境更好。但极性相互作用则完全相反,PTOP与ERβ的极性相互作用较弱(3.50 kcal·mol-1);而PTOP与ERα的极性相互作用则高达11.43 kcal·mol-1,对结合极为不利。进一步的分解表明这种不利的极性相互作用主要来源于极性溶剂化自由能。通过分析,我们发现极性相互作用的差异使得PTOP与ERβ的结合活性更高,这种差异是导致PTOP在ERα与ERβ之间对ERβ进行选择性结合的主要原因。
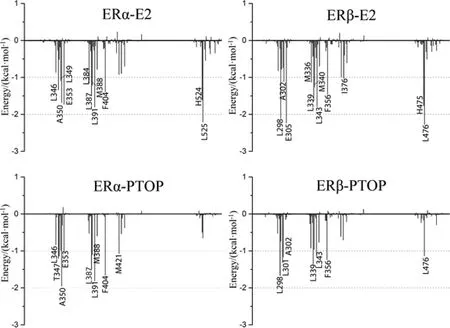
图5 单个氨基酸残基的结合自由能Fig. 5 Binding free energy of individual amino acid residue

表2 主要残基的氢键情况(占有率20%以上)
2.3 关键氨基酸残基
我们将结合自由能分解到每个氨基酸残基之上,以此来确定在结合过程中的关键残基。图5分别列出了ERα-E2、ERα-PTOP、ERβ-E2、ERβ-PTOP的重要氨基酸残基(对结合自由能的贡献均大于-1.00 kcal·mol-1)。其中,ERα的Leu346(ERβ中的相应残基编号为Leu298)、Ala350 (302)、Leu387 (339)、Leu391 (343)、Phe404 (356)在4个复合物的结合过程中都具有显著贡献,说明这5个氨基酸对于结合活性较弱的化合物的识别与结合具有关键作用。
除此之外,还应该注意到ERα-E2、ERβ-E2、ERα-PTOP、ERβ-PTOP的重要氨基酸数目分别为11、10、8、7个,E2显然与ER中更多的氨基酸有显著相互作用,这表明E2与ER的结合口袋更兼容,结合的更加紧密。通过对实验数据进行分析,在ERα-E2的11个重要残基中,9个残基的主要贡献来源于非极性相互作用,2个残基的主要贡献来源于极性相互作用,即Glu353(-6.22 kcal·mol-1)与His524(-2.96 kcal·mol-1);对于ERβ-E2复合物,9个残基的贡献来源于非极性相互作用,仅Glu305(-9.09 kcal·mol-1)的自由能贡献主要来源于极性相互作用。而对于ERα-PTOP及ERβ-PTOP复合物,所有重要残基的自由能贡献均主要来源于非极性相互作用。通过以上结果,首先可以确定PTOP及E2的结合能均主要来源于疏水性残基的非极性相互作用;其次,相对于E2,PTOP缺乏与极性氨基酸的分子间相互作用。
2.4 分子间相互作用
我们进一步分析了E2和PTOP分别与ERα和ERβ之间的氢键。在图6中,ERα与E2结合后,E2的3-OH基团与ERα中Glu353、Arg394生成2个氢键,而E2的17-OH基团与位于H11的His524形成了一个氢键,但此氢键角度较大,结合较为不稳定;ERβ-E2中,E2的3-OH基团与Glu305形成了稳定的氢键,而其17-OH端则与His475形成氢键,但该氢键同样角度偏大,并不稳定。这些结果与之前研究所表明的ERα-E2和ERβ-E2分子间相互作用的结果相一致[6,23]。通过分解能的计算,可知Glu353 (ERα)与Glu305 (ERβ)的静电能非常显著,分别为-6.22 kcal·mol-1及-9.09 kcal·mol-1;表2表示ERα-E2和ERβ-E2两体系中主要残基的氢键生成情况,其中ERα的His524以及ERβ中的His475所形成的氢键占有率很低,在模拟过程中不稳定容易断裂,因此在表2中没有统计,而Glu353与Arg394则与E2形成了较为稳定的氢键;ERβ的Glu305的OE1原子与E2形成了稳定的氢键,占有率达到74.9%;这反映出氢键对于稳定化合物与ER的结合是极为重要的。从表2中可以看出,而对于ERα-PTOP和ERβ-PTOP两个复合物,PTOP并没有与ER形成稳定的氢键,这导致了PTOP分子在ER的结合口袋中缺乏直接的稳定因素,也是造成PTOP与ER结合活性较低的主要原因。
综上可知,通过对ERα-E2、ERβ-E2、ERα-PTOP、ERβ-PTOP四个复合物的MD模拟并结合MM-GBSA计算,我们研究了PTOP与ER结合的分子机制及其对ERβ具有选择性的原因。计算结果表明,非极性相互作用是维持PTOP与ER结合的主要驱动力,而PTOP与ER之间缺乏氢键,这导致极性相互作用是不利于结合的,也是PTOP结合活性远低于E2的主要原因。而PTOP与ERα及ERβ极性相互作用尤其是极性溶剂化自由能的差异,是导致该分子对ERβ选择性结合的主要原因。分解能的结果还进一步锚定了结合过程中的重要氨基酸残基。以上结果将有助于我们进一步理解PTOP对ER介导生理过程的干扰机制。
[1] Kuiper G G, Enmark E, Pelto-Huikko M, et al. Cloning of a novel receptor expressed in rat prostate and ovary [J]. Proceedings of the National Academy of Sciences of the United States of America, 1996, 93(12): 5925-5930
[2] Mosselman S, Polman J, Dijkema R. ERβ:Identification and characterization of a novel human estrogen receptor [J]. FEBS Letters, 1996, 392(1): 49-53
[3] Bhat R A, Harnish D C, Stevis P E, et al. A novel human estrogen receptor beta:Identification and functional analysis of additional N-terminal amino acids [J]. Journal of Steroid Biochemistry & Molecular Biology, 1998, 67(3): 233-240
[4] Berry M, Metzer D, Chamboon P. Role of the 2 activating domains of the estrogen receptor in the cell-type and promoter-context dependent agonistic activity of the antiestrogen 4-hydroxytamoxifene [J].The EMBO Journal, 1990, 9(9): 28112-28118
[5] Tzukerman M T, Esty A, Santiso-Mere D, et al. Human estrogen receptor transactivational capacity is determined by both cellular and promoter context and mediated by two functionally distinct intramolecular regions [J]. Molecular Endocrinology, 1994, 8(1): 21-30
[6] Brzozowski A M, Pike A C, Dauter Z, et al. Molecular basis of agonism and antagonism in the oestrogen receptor [J]. Nature, 1997, 389(389): 753-758
[7] Bhat R A, Stauffer B, Unwalla R J. Molecular determinants of ERα and ERβ involved in selectivity of 16α-iodo-17β estradiol [J]. Journal of Steroid Biochemistry & Molecular Biology, 2004, 88(1): 17-26
[8] Othman A I, El-Missiry M A, Koriem K M, et al. Alfa-Lipoic acid protects testosterone secretion pathway and sperm quality against 4-tert-octylphenol induced reproductive toxicity [J]. Ecotoxicology & Environmental Safety, 2012, 81(81): 76-83
[9] Isobe T, Nishiyama H, Nakashima A, et al. Distribution and behavior of nonylphenol, octylphenol, and nonylphenol monoethoxylate in Tokyo metropolitan area: Their association with aquatic particles and sedimentary distributions [J]. Environmental Science & Technology, 2001, 35(6): 1041-1049
[10] Kotula-Balak M, Chojnacka K, Hejmej A, et al. Does 4-tert-octylphenol affect estrogen signaling pathways in bank vole Leydig cells and tumor mouse Leydig cells in vitro? [J]. Reproductive Toxicology, 2013, 39(4): 6-16
[11] Jung Y W, Hong E J, Choi K C, et al. Novel progestogenic activity of environmental endocrine disruptors in the upregulation of calbindin-D9k in an immature mouse model [J]. Toxicological Sciences, 2005, 83: 78-88
[12] Pisapia L, Pozzo G D, Barba P, et al. Effects of some endocrine disruptors on cell cycle progression and murine dendritic cell differentiation [J]. General & Comparative Endocrinology, 2012, 178(1): 54-63
[13] Blake C A, Boockfor F R. Chronic administration of the environmental pollutant 4-tert-octylphenol to adult male rats interferes with the secretion of luteinizing hormone, follicle-stimulating hormone, prolactin, and testosterone [J]. Biology of Reproduction, 1997, 57(2): 255-266
[14] Laws S C, Carey S A, Ferrell J M, et al. Estrogenic activity of octylphenol, nonylphenol, bisphenol A and methoxychlor in rats [J]. Toxicological Sciences An Official Journal of the Society of Toxicology, 2000, 54(1): 154-167
[15] Myllymaki S A, Karjalainen M, Haavisto T E, et al. Infantile 4-tert-octylphenol exposure transiently inhibits rat ovarian steroidogenesis and steroidogenic acute regulatory protein (StAR) expression [J]. Toxicology & Applied Pharmacology, 2005, 207(1): 59-68
[16] Bian Q, Qian J, Xu L, et al. The toxic effects of 4-tert-octylphenol on the reproductive system of male rats [J]. Food & Chemical Toxicology, 2006, 44(8): 1355-1361
[17] Paris F, Balaguer P, Térouanne B, et al. Phenylphenols, biphenols, bisphenol-A and 4-tert-octylphenol exhibit alpha and beta estrogen activities and antiandrogen activity in reporter cell lines [J]. Molecular & Cellular Endocrinology, 2002, 193(1-2): 43-49
[18] White R, Jobling S, Hoare S A, et al. Environmentally persistent alkylphenolic compounds are estrogenic [J]. Endocrinology, 1994, 135(1): 175-182
[19] Kuiper G G, Lemmen J G, Carlsson B, et al. Interaction of estrogenic chemicals and phytoestrogens with estrogen receptor beta [J]. Endocrinology, 1998, 139(10): 4252-4263
[20] Hawkins G D, Cramer C J, Truhlar D G. Parametrized models of aqueous free energies of solvation based on pairwise descreening of solute atomic charges from a dielectric medium [J]. The Journal of Physical Chemistry, 1996, 100(51): 19824-19839
[21] Cordin O, Banroques J, Tanner N K, et al. The DEAD-box protein family of RNA helicases [J]. Gene, 2006, 367(1): 17-37
[22] Kottalam J, Case D A. Langevin modes of macromolecules:Applications to crambin and DNA hexamers [J]. Biopolymers, 1990, 29(10-11): l409-1421
[23] Wang P, Mcinnes C, Zhu B T. Structural characterization of the binding interactions of various endogenous estrogen metabolites with human estrogen receptor α and β subtypes: A molecular modeling study [J]. Plos One, 2013, 8(9): e74615-e74615
◆
Structural Basis and Molecular Mechanism for Selective Binding of 4-Tert-octylphenol to Estrogen Receptor
Zhu Jinghan, Xue Qiao, Zhang Aiqian*
State Key Laboratory of Environmental Chemistry and Ecotoxicology, Research Center for Eco-Environmental Sciences, Chinese Academy of Sciences, Beijing 100085, China
4-tert-octylphenol (PTOP) is a typical endocrine disrupting chemical, which can interfere with the transcriptional regulation of estrogen receptor (ER) via direct binding to its both subtypes. The structural basis for the fact that binding affinity of ERβ with PTOP is higher than that of ERα is still unclear. To investigate the ER binding mechanism and the subtype selectivity of PTOP, molecular dynamics combined with MM-GBSA was used to perform computational simulations for the PTOP-ER complex. The results indicated that the van der Waals interaction is the major driving force for the ER binding of PTOP, while the polar interaction, especially polar solvation, dominates the PTOP subtype selectivity. The more intensive the polar interaction becomes, the less stable the PTOP-ER complexes are. In addition, low ER affinity of PTOP, in comparison with estradiol, may be attributed to less hydrogen bonds formed in the PTOP-ER complex. Moreover, the key residues which play important roles in the binding process were revealed. This work provides further understanding of how PTOP induce the ER-mediated endocrine disrupting effect in a ligand-depent manner.
estrogen receptor α; estrogen receptor β; 4-tert-octylphenol (PTOP); molecular dynamics simulation; MM-GBSA
10.7524/AJE.1673-5897.20151130020
国家自然科学基金(21507152, 21277164);中国科学院战略性先导科技专项课题(XDB14030500);国家高技术研究发展计划(863计划)(2013AA065201)
朱婧涵(1992-),女,研究生,研究方向为理论环境化学,E-mail: nanaqq7@hotmail.com
*通讯作者(Corresponding author), E-mail: aqzhang@rcees.ac.cn
2015-11-30 录用日期:2016-01-26
1673-5897(2016)2-194-07
X171.5
A
简介:张爱茜(1972-),女,博士,研究员,主要研究方向理论环境化学。
朱婧涵, 薛峤, 张爱茜. 对特辛基苯酚干扰雌激素受体作用的分子基础及其对ERβ亚型选择性结合的理论研究[J]. 生态毒理学报,2016, 11(2): 194-200
Zhu J H, Xue Q, Zhang A Q. Structural basis and molecular mechanism for selective binding of 4-tert-octylphenol to estrogen receptor [J]. Asian Journal of Ecotoxicology, 2016, 11(2): 194-200 (in Chinese)

