富硒藻类研究进展
孙显,杨宇峰,
1. 暨南大学 水生生物研究所,广州 510632 2. 水体富营养化与赤潮防治广东省教育厅重点实验室,广州 510632
富硒藻类研究进展
孙显1,2,杨宇峰1,2,
1. 暨南大学 水生生物研究所,广州 510632 2. 水体富营养化与赤潮防治广东省教育厅重点实验室,广州 510632
微量元素硒不仅是人和动物必需的营养元素,也是植物生长发育不可缺少的元素。硒酸盐在水体中溶解度高于其他环境介质,导致水生生物对无机硒(硒酸盐)有更高的利用率。藻类能吸收无机硒,可将无机硒有效地转化为有机形态。藻体内的硒主要以硒蛋白、硒核酸、硒多糖等生物大分子以及硒代半胱氨酸和硒代蛋氨酸等生物小分子有机化合物存在。在水生生态系统中,藻类是硒的主要吸收者。富硒藻类通过食物链将硒传递至浮游动物、贝和鱼等动物体内,能提高其抗氧化能力,从而导致其对重金属耐受性增强。本文综述了藻类在自然界硒生物有机化中的地位和作用,藻类对硒的富集方式及代谢途径,硒在藻类中的生物学效应,富硒藻类的开发利用现状及今后的发展方向,较全面地综述了富硒藻类研究进展。
硒;藻类;富硒
1 硒的生理功能及其开发(Physiological function of selenium and its development)
1.1 硒的发现
1817年瑞士化学家Jons Jacob Berzelius在分析制造硫酸的铅盒壁上的红色沉淀物时首次发现硒元素。发现初期,人们认为硒是有毒元素。直到1957年美国科学家Schwarz和Foltz研究发现硒能防治大鼠肝坏死,硒元素才被认为是动物生命的必需元素[1]。真正发挥生物活性作用的为有机硒。有机硒有2种存在形式,其一为可解离的因子,细菌中常见;另一种已氨基酸共价键存在,成为含硒蛋白。人体中的硒蛋白来源主要来自膳食。1973年世界卫生组织专家委员会正式宣布,硒是人体生理必需的14种微量元素之一[2]。1988年中国营养学会将硒元素列为人体必需的l5种每日膳食营养元素之一。
1.2 硒资源的分布
全球范围内硒的分布极不均匀。据美国矿产局估算,全世界硒的基础储量为1.34×105t,已探明的储量为7.1×104t,以南美洲最多(占全球总量的52.7%),亚洲和北美洲其次(各占15.4%),欧洲占12.2%,大洋洲占4.4%[3]。在已探明的硒储量中,智利、美国、加拿大、中国、赞比亚、扎伊尔、秘鲁、菲律宾、澳大利亚和巴布亚新几内亚等国家的硒储量占世界硒资源的76.9%[3]。在中国,黑龙江、吉林、青海、陕西、四川和西藏等省(区)严重缺硒,黑龙江省缺硒最严重,四川省次之,因此人工补硒具有重要的现实意义[4]。
1.3 硒与水环境
硒缺乏与硒富集取决于环境的特异性以及对硒的利用性[5]。硒元素对生物界的营养性和毒性,在环境中的迁移和变化规律不仅取决于硒的总量,同时也取决于它的形态。自然界中硒的存在价态形式有如下几种,-2、0、+4和+6。0价态是单质硒,难以被生物吸收利用,生物学作用极低(表1)[6]。无机硒中的硒的价态是+4,+6,常见的这类物质如Na2SeO3和Na2SeO4。有机硒中硒的价态通常是-2价,存在于生物体内重要的低分子量有机硒化合物(表2)[7]。
水环境中的硒主要来源于自然以及人类活动,如农业灌溉和矿物开采与燃烧。淡水中硒浓度范围一般为0.13~2.50 nmol·L-1(0.01~0.5 μg Se·L-1)。在硒污染区域,硒浓度能达到5 μmol·L-1(400 μg Se·L-1)[8]。水体中无机硒主要存在2种价态,Se4+(亚硒酸盐)和Se6+(硒酸盐)。亚硒酸盐与硒酸盐的比例取决于水体中pH值、可络合物质含量和生态系统结构[9]。通常亚硒酸盐在还原环境中占主导地位,而硒酸盐主要在氧化碱性水体中存在。有机硒也同样存在于天然水体,如硒氨基酸、硒蛋白和甲基硒化物,但与无机硒化合物相比,浓度较低[10]。

表1 硒的形态及其自然转化
1.4 硒的生理功能
硒元素是参与构建谷胱甘肽过氧化物酶(guaiacol peroxidase,GPX)不可缺少的元素,GPX能参与人体抗氧化过程,阻止不饱和酸的氧化,避免机体产生有毒代谢物,从而减少诱发癌症的物质,维护人体正常代谢。硒对导致心脏病的镉、砷以及汞等有毒物质也有抵抗作用,是有效的解毒剂。硒还可减弱黄曲霉毒素,抑制肝癌和乳腺癌的发生[11]。此外,硒还参与免疫反应,提高人体B细胞的增殖与活性,提高T细胞功能,通过避免细胞氧化损伤而保护机体的免疫系统。此外,硒还参与眼睛光感受器中光子转换成电信号能量的过程[12]。人体如果缺硒,将会导致多种疾病的发生。
2 硒的生物有机化 (Bio-organic of selenium)
2.1 硒的生物有机化意义
硒主要通过生物地球化学食物链(biogeochemical food chain,土壤和水-植物-动物-人)进入人体。硒摄入不足严重威胁人类健康。在低硒或缺硒地区,需要应用增硒技术。一个通行的方法是应用Na2SeO3及其制成品对动植物进行补硒,也可以利用富硒地区的矿物进行富硒生产[13]。就全球范围来说,每年因硒缺乏给畜牧业生产带来巨大的损失。美国自1967年以来在缺硒地区生产的饲料中给猪鸡补硒,避免了几十亿美元的经济损失,补硒能显著提高了畜牧生产的经济效益[14]。因此,通过饲料补硒是研究硒的一个热点[15]。
现代医学表明硒具有重要的药物价值,可抗癌、抗衰老以及防治心血管病、克山病、关节炎等疾病。然而,硒摄入过量也会导致中毒,有研究表明过量的硒可能致癌,并且会导致人类牙齿脱落(表3)[16]。1980年美国国家科学院食物营养委员会建议成人每日安全和适宜的硒摄入量为50~200 μg。1987年中国根据膳食调查报告确定了成人最低的硒日需量,即成年男女每日分别达到19 μg和14 μg以预防克山病。1988年中国营养学会推荐每日膳食硒的供给量为50 μg。2000年中国营养学会制定了中国居民膳食硒的参考摄入量,提出成人膳食硒平均需要量(EAR)为41 μg·d-1,推荐摄入量(RNI)为50 μg·d-1,可耐受的最高摄入量(UL)为400 μg·d-1,并制定了不同年龄组、孕妇和乳母的膳食硒参考摄入量[17]。

表2 生物中有机小分子硒化合物

表3 人类和动物体内硒的界限值(单位:μg·d-1)
食物是人体硒摄入的主要来源,而天然食物中的硒含量普遍较低,果蔬的含硒量一般小于0.01 mg·kg-1,猪肾的含硒量最高,也仅有1.89 mg·kg-1,仅靠天然食物中的硒含量一般不能满足人体的正常需要[12]。毒理分析表明,有机硒毒性远低于无机硒,且生物利用率更高。所以,只有将无机硒转化为有机硒,才具有普遍的食用和保健价值。植物有机硒是安全有效的补硒形式。但由于天然生长的植物中硒的含量一般较低,加之硒化合物的不稳定性,已发现的天然含硒化合物类型仍较少,所以硒的生物有机化研究还有待深入[18]。对于低硒地区,通过植物载体的生物有机化作用,对人们进行科学补硒,不但是一条安全、有效的补硒渠道, 而且还带来其他方面的经济效益[19]。目前很多富硒生物制品已进入市场,如大蒜、酵母、茶和各种乳酸菌等。因为硒酸盐在水体中溶解度高于其他环境,导致水生生物对无机硒(硒酸盐)有更高的利用率,水生生物的硒富集也越来越受到关注[20]。
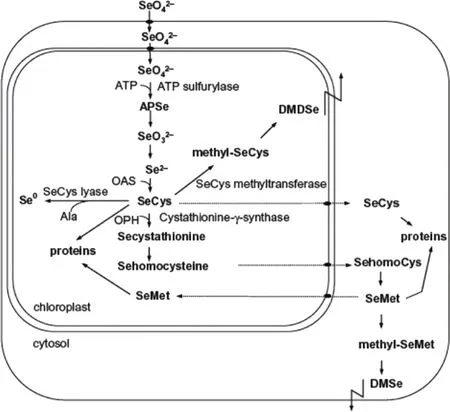
图1 植物内硒代谢途径[22] 注:APSe,腺苷二氧磷基硒酸;OAS,乙酰丝氨酸;OPH,O-磷酸高丝氨酸;SeCys,硒代半胱氨酸;SeMet,硒代甲硫氨酸;DMSe,二甲基硒化物;DMDSe,二甲基二硒化物。Fig. 1 Schematic overview of Se metabolism in plants[22] Note: APSe, adenosine phosphoselenate; OAS, O-acetylserine; OPH, O-phosphohomoserine; SeCys, selenocysteine; SeMet,selenomethionine; DMSe, dimethylselenide; DMDSe, dimethyldiselenide.
2.2 藻类对硒的有机化途径
藻类能较为稳定的吸收无机硒,并将无机硒有效的转化为有机形态,经驯化可获得对硒的耐受性和富集能力更强的藻种[21]。藻类对无机硒有机化过程是通过硫消化酶(sulfate assimilation enzymes)快速从其所处环境中吸收硒酸盐或亚硒酸盐,并将无机硒转化为硒有机复合物(图1)[22]。过量的与硒相关的非特应性氨基酸、硒代半胱氨酸(SeCys)和硒代甲硫氨酸(SeMet)会参与机体蛋白表达,影响蛋白功能与活性,表现出毒性[23]。植物可将SeCys降解为无毒性的零价硒元素(Se0),或将SeCys甲基化为相对无毒性的甲基硒代半胱氨酸(methyl-SeCys)。Methyl-SeCys可以在植物细胞中积累或再次被甲基化为不稳定二甲基二硒醚(DMDSe)。SeMet同样可被甲基化为不稳定二甲基硒(DMSe)[24]。当硒在细胞能刚出现积聚现象时,对于SeCys的甲基化随之出现,此机制被认为是植物对于硒耐性基础[25]。
2.3 微型藻类对硒的富集
在水生生态系统中,微型藻类是硒的主要吸收者。它们积累无机硒,然后转化成有机硒,再通过食物链将硒转移到高等生物体内(如轮虫、桡足类、枝角类以及鱼等)[10]。富硒螺旋藻中硒的存在形式主要为有机硒,有机硒占总硒含量的75%以上[26]。硒代蛋氨酸能参与修复鱼类和水禽类的生殖损伤,但其在藻体中合成量较低,通过食物链,这些硒氨基酸在高等生物体能被合成为硒蛋白,发挥生物学功能[27]。Abdel-Tawwab等[28]发现喂食非洲鲶鱼有机硒能使鱼在行为学和生理学角度表现出对高铜环境的的抗性和适应能力上升。近期学者研究发现将摄食有机硒的轮虫投喂鳕鱼仔鱼,仔鱼存活率相比增加了32%。同时仔鱼中谷胱甘肽过氧化物酶活性提高,从而提高了仔鱼对于污染水体中重金属的耐受性[29]。目前,微藻的硒积累,硒的有机化过程以及转移到高等生物的方式成为目前重要研究方向[30]。
硒是一些海洋单细胞藻类(如莱茵衣藻Chlamydomonas reinhardtii)的必需营养元素[31]。一种海洋单细胞藻(Emiliania huxleyi)的生长需要毫微摩尔级的硒[32]。Doušková等[33]报道了一种对亚硒酸盐有高耐性的栅藻(Scenedesmus quadricauda)可在光反应发生器中经培养而产生高富硒产品。随后Umysová等[34]通过设计亚硒酸钠组(Na2SeO3)、硒酸钠组(Na2SeO4)以及两者混合组3组实验,对S. quadricauda耐硒能力进行筛选。实验结果表明,硒对于该绿藻的影响不仅仅取决于剂量,同时也取决于硒的存在形态。
目前研究的富硒微藻主要有:螺旋藻[35]、紫球藻[36]、小球藻[37]、球石藻[38]等。因为硒对微藻具有生长促进与毒性抑制二重性,因此,微藻的富硒量不与培养液中添加的硒质量浓度成正相关。添加的硒质量浓度较低时,微藻的富集硒的能力随硒质量浓度增高而增大;在添加的硒质量浓度较高的条件下,微藻富集硒的能力随硒质量浓度增高而降低[38]。因此适宜微藻生长以及藻类富硒能力最强时的硒质量浓度随藻种、生长环境因素、生长时期等条件的不同而各有不同(表4)。低硒浓度可有效促进微藻生长,高硒浓度对微藻产生致死效应,致死浓度为促生长浓度的10倍左右。
一般当外加硒质量浓度小于50 mg·L-1时,可以促进藻类的生长。与其他藻种相比,螺旋藻和小球藻对硒的耐受性较高[37,41]。研究发现,小球藻能在数分钟内迅速的吸收硒,且这种吸收不可逆。24 ~ 48 h后,被吸收总硒的40%在细胞内转化为有机态[43]。在小球藻中,超过70%的硒蛋白是以硒代蛋氨酸(selenomethionine,SeMet)的形式存在[44]。通过细胞水平的观察发现,小球藻细胞对亚硒酸钠的耐受浓度可达到100 mg·L-1。细胞内总硒以及SeMet的含量随培养基中硒浓度的增加而增加,最终总硒量能达到生物量的30%~40%[45]。螺旋藻的富硒研究主要在亚硒酸钠的补给型培养基中进行。亚硒酸盐的浓度低于200 mg·L-1时,不会抑制藻类的生长[46];然而,当高于500 mg·L-1的浓度时,亚硒酸钠对螺旋藻出现毒性抑制效应[47]。郑文杰等[48]将钝顶螺旋藻经硒驯化筛选得到有机硒含量高达850~2 100 μg·g-1的藻株。
微藻在低质量浓度硒条件下的生长促进作用与细胞内活性氧自由基形成能力有关。硒化合物具有清除自由基和产生自由基的能力[49]。硒元素本身在生物体的抗氧化反应中起至关重要的作用。在低硒浓度时硒元素起到抗氧化剂的作用,如在谷胱甘肽过氧化物酶中,硒作为一种组成成分被广泛认为具有直接或间接去除活性氧的作用,从而增加细胞的活力,促进藻类的生长[50]。
而高质量浓度下硒对藻类的抑制和毒性作用机理尚存在争议,目前主要有4种观点[41,51]。
观点1:在高浓度硒环境中,微藻细胞主要产生自由基,而非清除自由基。微藻细胞吸收的硒达到饱和以后,细胞将会产生氧化应激反应,导致自由基(ROS)的大量积累,从而使藻类的生长受到抑制,甚至产生毒性作用[41]。
观点2:硒对于藻类的抑制和毒性作用与硒和硫2种元素之间的竞争作用有关。硒元素与硫元素在元素周期表中同属于第六主族(氧族),化学性质相近。机体中用以催化含硫化合物反应的酶同样能够成功地催化含硒化合物反应。研究表明,当有机体生长在一定浓度的硒环境中,通过硫酶的参与,硒可通过硫的代谢途径进入生物体,并取代有机体细胞中某些大分子结构中的部分硫。因此,若硒元素过多地取代机体蛋白质中半胱氨酸、胱氨酸或蛋氨酸的硫元素,则可能引起蛋白质空间结构改变,影响蛋白质功能(如酶的变性失活等),扰乱藻类正常生命活动,从而抑制藻类的生长[51]。
观点3:添加的高浓度硒可诱导机体在生长代谢过程中产生大量硒化氢,从而强烈抑制细胞色素氧化酶,影响一些酶的活性,从而抑制藻的生长[51]。
观点4:硒能与藻类细胞叶绿体中的叶绿素结合,干扰光合作用中电子传递的过程,影响能量转化过程,从而造成细胞的营养和能量供应不足。研究显示,硒可能会损伤藻类细胞中的捕光色素蛋白复合体,从而降低其捕获光能的能力,导致机体光合作用效率下降,从而抑制紫球藻的生长[39]。

表4 硒浓度对不同微藻种生长与富硒量的影响
2.4 大型海藻对硒的富集
大型海藻体积较大且分布广泛,且其对于重金属具有吸附容量大、选择性强、效率高、消耗少,因而具有巨大的潜力作为硒的富集者。大型海藻作为提供天然抗氧化剂的丰富资源,一些海藻种,如海带(Lamilaria japonica)[52]和石莼[53]已经作为动物饲料添加成分和人类饮食走向市场。
海带可以通过硒代谢途径将无机硒有机化[54]。研究报道,石莼能大量积累硒,且硒富集量与亚硒酸钠剂量呈线性关系[53]。富硒培养可以显著提高裂片石莼的抗氧化活性。且富硒培养裂片石莼水提物具有优良的抗氧化活性,对水溶性自由基(ABTS)的抑制率明显高于脂溶性自由基(DPPH),有广阔的开发前景[55]。
龙须菜(Gracilaria lemaneiformis)是一种适应性强、生长速度快的可食用红藻。龙须菜具有很强的防治富营养化的能力[56]。此外,龙须菜也是琼脂和其他天然产物的重要来源,如多糖,蛋白质和膳食纤维等[57]。本课题组通过初期研究发现,龙须菜对硒的耐受浓度是普通微藻的10倍以上;低浓度亚硒酸钠对大型海藻龙须菜与细基江禽的相对生长率、色素含量、藻胆蛋白含量、光系统H最大光量子效率(Fv/Fm)皆有促进作用,可有效提高2种大型海藻的产量以及营养含量。
可食用大型海藻具有转化无机硒的巨大潜力。富硒产品开发与大型海藻规模养殖相结合,具有巨大的生态以及经济效益。
2.5 影响藻类富硒的因素
影响藻类富硒的因素主要有温度、光强、pH以及其他元素浓度(如磷、硫和锌等)。
研究显示,当培养液中硒浓度为0.4 mg·L-1时,螺旋藻在温度35 ℃生长率最高;培养温度低于25 ℃时,螺旋藻富硒量最大[41]。一种原因为:在较低的温度条件下,藻类生长缓慢,有助于藻类对硒进行适应并富集[41]。另一种原因为:螺旋藻中与富硒活动有关的酶在高温条件下失活所造成富硒能力下降[48]。
周志刚等[41]的研究表明,在8 000 lx的光强不仅可刺激螺旋藻细胞生长,且利于藻细胞对硒的富集。
藻类对不同价态的无机硒(硒酸盐和亚硒酸盐)吸收能力强弱随pH值改变而改变[58]。一般藻类在pH为5~9范围内能有效吸收无机硒[59]。黄键等[60]研究表明,pH 8.0的培养条件利于钝顶螺旋藻富集Se(IV)。莱茵衣藻(Chlamydomonas reinhardtii)在pH 8.0的水环境中,吸收硒酸盐能力最强,随着pH值下降吸收亚硒酸盐的能力则显著增加。pH影响衣藻富硒的原因主要有2点:一是pH改变溶液中离子的质子化程度,进而改变离子的化学形态,生物活性较高的硒化学形态利于衣藻富硒,而生物活性较低的硒化学形态则抑制藻类富硒;二是pH可改变衣藻细胞吸收转移蛋白质的活性能力[58]。
藻类对硒的生物富集也会受到环境中大量微量营养元素(如磷,硫)浓度的影响[61]。众所周知,硫酸盐与硒酸盐在生物体内能产生拮抗[28,62-63]。环境中的硫元素能和硒元素在细胞内蛋白表达过程中竞争。因此高硫环境能降低C. reinhardtii细胞内硒积累产生的毒性[59]。实验证明,在培养基中增加硫的浓度,会抑制C. reinhardtii和Selenastrum capricornutum这2种藻对硒酸盐与亚硒酸盐的吸收能力[28,58,64]。在硫缺乏的环境中,栅藻(Scenedesmus quadricauda)对硒酸盐和亚硒酸表现出更为敏感的特性[65]。藻类中存在某些透性酶,既能与硫结合,也能与硒结合,也许还能结合更多的金属离子,这有待进一步的研究[28]。Yu等[66]认为这可能是硒和磷之间相似的阴离子转运方式产生的竞争所致。另外,黄键等[60]的研究发现ZnSO4可促进钝顶螺旋藻的生长,而Zn(Ac)2能提高藻类的富硒能力。
藻类的富硒培养,pH值与培养基中的硫含量是应该重点关注的环境因素[61]。不同价态的硒酸盐投放,调节水体适宜pH值,促使藻体吸收硒达到最大化,并将硒有效有机化。同时监控培养水体中的硫浓度,保持藻体对硒的持续性吸收。
3 藻类中硒形态的测定 (Determination of selenium speciation in algae)
对藻类中硒成分检测的相关报道远少于其他富硒物种(酵母、植物等)。2001年Larsen等[67]首次检测出富硒小球藻中的几种主要硒成分,分别为二甲基硒丙酸、硒代半胱氨酸和硒代蛋氨酸。随后研究人员进一步将硒的不同类型进行综合性离子交换分离。Mosulishvili等[68]和Li等[69]利用富硒螺旋藻作为实验材料,将藻体内的硒成分分离并进行定量分析。数年后,科学家通过高效液相色谱法-电感耦合等离子体-质谱(high performance liquid chromatography-Inductively coupled plasma-Mass spectrometry, HPLC-ICP-MS)联用技术,检测出富硒绿藻(Chlorella和Scenedesmus)中存在的主要硒氨基酸(硒代蛋氨酸和硒代半胱氨酸)含量[70]。虽然HPLC-ICP-MS技术具有足够的灵敏性与专一性,但却不能提供检测成份的结构,也无法检测出未知或未预见的成分[71]。电喷射光谱分析技术(Electrospray-MS)能弥补HPLC-ICP-MS的不足,提供检测成分的分子信息,并能识别出未知的成分[72]。
富硒藻类中硒成分的分离方法一直以来,缺少足够的信息。研究人员目前认为,富硒藻类中的硒蛋白结构应与富硒酵母中的硒蛋白结构相类似,但始终不能得以证明[73]。2005年,有学者将富硒绿藻干燥,通过异丙醇—三氯甲烷—双蒸水—缓冲剂—硫酸钠溶液的循序提取法,将干藻粉中的不同硒化学形态进行分离。随后使用ICP-MS技术将水提物进行分析测定,可确定富硒绿藻中的未经新陈代谢的亚硒酸盐含量[74-75]。
硒的生物转化具有广阔的前景。然而,由于生物体的复杂性,人们对动植物中的硒的存在形式尚未完全明了,富硒藻类在提供丰富的硒形式的同时,其中部分形态的毒性和化学稳定性相差很大,这是开发富硒资源中值得注意的问题。因此,需要不断运用先进的技术检测确定富硒藻类中的硒成分,保证人类健康有效的从中摄取硒。
4 展望 (Perspective)
硒元素是生命活动的必需元素,对维持人体正常的新陈代谢具有重要意义。关于富硒藻类的研究从硒对藻类生长和富集硒的影响,到富硒藻体中硒形态、生物活性,正逐步走向深入。在环境方面,可利用藻类的富硒治理水体硒污染以及硒工业中硒排放所造成的污染。在营养保健方面, 将富硒藻开发为保健品及生物饵料,可利用富硒藻类对生物进行有机硒补充。关于富硒藻类的培养,培养条件的进一步优化以期获得硒含量更高的藻类产品以及深入探索富硒藻类的生物活性和医疗保健功能仍然是研究的重点;而关于硒在生物体中的分子形态将是研究的一个重要方向,将为揭示藻类富集转化硒的机理提供直接的证据。
[1] 王桂琴. 微量元素硒的研究进展[J]. 甘肃畜牧兽医, 2001, 15(6): 30-33
Wang G Q.Research progress of trace element selenium [J]. Gansu Animal and Veterinary Sciences, 2001, 15(6): 30-33 (in Chinese)
[2] 史丽英, 罗世炜. 微量元素硒的研究进展[J]. 襄樊职业技术学院学报, 2005, 4(1): 108-110
Shi L Y, Luo S W.The advanced research of trace selenium [J]. Journal of Xiangfan Vocational and Technical College, 2005, 4(1): 108-110 (in Chinese)
[3] 刘家军, 郑明华. 硒矿资源研究及其开发利用. 资源、环境与可持续发展战略[M]. 北京:中国环境科学出版社, 1995: 114-116
Liu J J, Zheng M H. Research on Selenium Mineral Resources and Its Development and Utilization [M]. Beijing: China Environmental Science Press, 1995: 114-116 (in Chinese)
[4] 刘金旭, 陆肇海, 苏琪. 家畜家禽的硒营养缺乏的调查研究—I. 我国饲料牧草含硒量的分布(初报)[J]. 中国农业科学, 1985(4): 76-81
Liu J X, Lu Z H, Su Q. Regional selenium deficiency of feed stuffs in China- I [J]. Scientia Agriculture Sinica, 1985(4): 76-81 (in Chinese)
[5] Zhang L, Ackley A R, Pilon-Smits E A H. Variation in selenium tolerance and accumulation among 19 Arabidopsis thaliana accessions [J]. Journal of Plant Physiology, 2007, 164(3): 327-336
[6] 邢翔, 郭建秋. 硒的分布及综合利用研究[J]. 长江大学学报, 2008, 5(2): 41-44
Xing X, Guo J Q. Selenium distribution and comprehensive utilization [J]. Journal of Yangtze University, 2008, 5(2): 41-44 (in Chinese)
[7] 李家奎, 王小龙. 硒的生物转化研究进展[J]. 中国兽医杂志, 2008, 38(3): 3-5
Li J Q, Wang X L.Research progress in the biological transformation of selenium [J]. Chinese Journal of Veterinary Medicine, 2008, 38(3): 3-5 (in Chinese)
[8] Conde J E, Sanz A M. Selenium concentrations in natural and environmental waters [J]. Chemical Reviews, 1997, 97: 1979-2003
[9] Pyrzynska K. Speciation of selenium compounds [J]. Analytical Sciences, 1998, 14(3): 479-483
[10] Fan T W M, The S J, Hinton D E, et al. Selenium biotransformations into protein aceous forms by food web organisms of selenium-laden drainage waters in California [J]. Aquatic Toxicology, 2002, 57: 65-84
[11] 王秀红. 微量元素硒与人体健康[J]. 微量元素与健康研究, 2006, 23(1): 66-67
Wang X H. Selenium and health [J]. Studies of Trace Elements and Health, 2006, 23(1): 66-67 (in Chinese)
[12] 王俊, 黄明, 徐幸莲, 等. 硒及富硒功能食品研究进展[J]. 江苏农业科学, 2003(2): 53-56
Wang J, Huang M, Xu X L, et al. Research progress of selenium and selenium-enriched functional food [J]. Jiangsu Agricultural Sciences, 2003(2): 53-56 (in Chinese)
[13] 邢丹英. 作物富硒技术研究与应用[D]. 武汉: 华中农业大学, 2004
Xing D Y. Research and application of crop selenium-enriched crop technology [D]. Wuhan: Huazhong Agricultural University, 2004 (in Chinese)
[14] Ullrey D E. Regulation of essentral nutrient additions to animal diets (selenium - A model case.) [J]. Journal of Animal Science, 1980, 51: 645
[15] Mortimer D T. Vit E-selenium deficiency syndrome in pigs [J]. Veterinary Record, 1983, 112: 278
[16] Raptis S E, Kaiser G, Tolg G. A survey of selenium in the environment and a critical review of its determination at trace levels [J]. Fresenius Journal of Analytical Chemistry, 1983, 316(2): 105-123
[17] 张联合, 郁飞燕, 苗艳芳. 硒在人和动物健康上的研究[J]. 安徽农业科学, 2007, 35(21): 688-690
Zhang L H, Yu F Y, Miao Y F. Study on the selenium in human and animal heaith [J]. Journal of Anhui Agricultural Science, 2007, 35(21): 688-690 (in Chinese)
[18] 郑文杰, 欧阳政. 植物有机硒的化学及其医学应用[M]. 广州: 暨南大学出版社, 2000: 7
Zheng W J, Ouyang Z. Chemical and Medical Application of Organic Selenium in Plants [M]. Guangzhou: Jinan University Press, 2000: 7 (in Chinese)
[19] 叶兴枝, 邢丹英, 金明珠. 不同硒源对大麦农艺性状的影响及富硒效应研究[J]. 麦类作物学报, 2007, 27(3): 539-542
Ye X Z, Xing D Y, Jin M Z. Effect of different selenium sour on agronomic character and selenium-enriched in barley [J]. Journal of Triticeae Crops, 2007, 27(3): 539-542 (in Chinese)
[20] Chapman P M, Adams W J, Brooks M L, et al. Ecological Assessment of Selenium in the Aquatic Environment [M]. Boca Raton: CRC Press, 2010
[21] Wang C, Lovell R T. Organic selenium sources, selenomethionine and selenoyeast, have higher bioavailability than an inorganic selenium source, sodium selenite, in diets for channel catfish (Ictalurus punctatus) [J]. Aquaculture, 1997, 152: 223-234
[22] Terry N, Zayed A M, de Souza M P, et al. Selenium in higher plants [J]. Annual Review of Plant Physiology and Plant Molecular Biology, 2000, 51: 401-432
[23] Sors T G, Ellis D R, Salt D E. Selenium uptake, translocation, assimilation and metabolic fate in plants [J]. Photosynthesis Research, 2005, 86: 373-389
[24] Pilon-Smits E A H, Quinn C F. Selenium Metabolism in Plants [M]// Hell R, Mendel R. (Eds.). Cell Biology of Metals and Nutrients. Berlin Heidelberg: Springer Press, 2010: 225-241
[25] Neuhierl B, Thanbichler M, Lottspeich F, et al. A family of S-methylmethionine dependent thiol/ selenol methyl transferases. Role in selenium tolerance and evolutionary relation [J]. Journal of Biological Chemistry, 1999, 274: 5407-5414
[26] 黄峙, 郑文杰, 向军俭, 等. 硒硫比值对钝顶螺旋藻有机化硒的影响及藻体中硒的形态, 价态构成[J]. 海洋科学, 2002, 26(5): 60-62
Huang Z, Zheng W J, Xiang J J, et al. Efffects of various Se:S ratios on Se-organizing and chemical states and valences of Se in Spriulina platensis [J]. Marine Sciences, 2002, 26(5): 60-62 (in Chinese)
[27] Williams M J, Ogle R S, Knight A W, et al. Effects of sulfate on selenate uptake and toxicity in the green alga Selenastrum capricornutum [J]. Archives of Environmental Contamination and Toxicology, 1994, 27(4): 449-453
[28] Abdel-Tawwab M, Mousa M A A, Fayza E A. Growth performance and physiological response of African catfish, Clarias gariepinus (B.) fed organic selenium prior to the exposure to environmental copper toxicity [J]. Aquaculture, 2007, 272: 335-345
[29] Penglase S, Nordgreen A. Increasing the level of selenium in rotifers (Brachionus plicatilis ‘Cayman’) enhances the mRNA expression and activity of glutathione peroxidase in cod (Gadus morhua L.) larvae [J]. Aquaculture, 2010, 306: 259-269
[30] Sun X, Zhong Y, Huang Z, et al. Selenium accumulation in unicellular green alga Chlorella vulgaris and its effects on antioxidant enzymes and content of photosynthetic pigments [J]. PLoS ONE, 2014, 9(11): e112270
[31] Novoselov S, Rao M, Onoshko N, et al. Selenoproteins and selenocysteine insertion system in the model plant cell system, Chlamydomonas reinhardtii [J]. Embo Journal, 2002, 21: 3681-3693
[32] Danbara A, Shiraiwa Y. The requirement of selenium for the growth of marine coccolithophorids, Emiliania huxleyi, Gephyrocapsa oceanica and Helladosphaera sp (Prymnesiophyceae) [J]. Plant and Cell Physiology, 1999, 40: 762-766
[33] Doušková I, Machát J, Umysová D, et al. Scenedesmus quadricauda - A Promising Microorganism for Selenium-Enriched Algal Biomass Production. SEFS-5 Symposium for European Freshwate Sciences [M]. Palermo, Italy, 2007: 197
[34] Umisova D, Vitova M, Douskova I, et al. Bioaccumulation and toxicity of selenium compounds in the green alga Scenedesmus quadricauda [J]. BMC Plant Biology, 2009, 9: 58-74
[35] 黄峙, 杨芳, 郑文杰. 富硒螺旋藻中硒别藻蓝蛋白的纯化及其特性[J]. 微生物学报, 2006, 6(3): 401-405
Huang Z, Yang Y, Zheng W J. Purification and properties of Se-containing allophycocyanins from selenium-enriched Spirulina platensis [J]. Acta Microbiologyica Sinica, 2006, 6(3): 401-405 (in Chinese)
[36] 刘艳, 桑敏, 李爱芬, 等. 硒在紫球藻蛋白质, 多糖和脂类物质中的累积与分布[J]. 中国海洋药物, 2010, 29(3): 22-27
Liu Y, San M, Li A F, et al. Accumulation and distribution of selenium in protein, polysaccharide and lipid of Porphyridium sp. [J]. Chinese Journal of Marine Drugs, 2010, 29(3): 22-27 (in Chinese)
[37] 吕蓉, 张波. 硒质量浓度对小球藻生长, 生物富集的影响[J]. 盐业与化工, 2008, 37(4): 35-37
Lv R, Zhang B. Effects of selenium concentration on the growth and bioaccumulation of Chlorella pyrenoidosa [J]. Journal of Salt and Chemical Industry, 2008, 37(4): 35-37 (in Chinese)
[38] 刘静雯, 张稚兰, 杜翠红, 等. 富硒海洋球石藻(Emiliania huxleyi)的培养及其硒蛋白的初步分离纯化[J]. 海洋与湖沼, 2010, 41(6): 879-884
Liu J W, Zhang Z L, Du C H, et al. Culturing of selenium-enriched Emiliania huxleyi and its selenoproteins purification [J]. Oceanologia Et Limnologia Sinica, 2010, 41(6): 879-884 (in Chinese)
[39] 刘太胜, 李爱芬, 顾继光, 等. 硒对紫球藻生长及光谱特性的影响[J]. 生态环境, 2006,15(2): 224-228
Liu T S, Li A F, Gu J G, et al. Effects of selenium on the growth and spectroscopic properties of Porphyridium UTEX637 [J]. Ecology and Environment, 2006,15(2): 224-228 (in Chinese)
[40] 王大志, 高亚辉, 程兆第. 硒对两种盐藻生长的影响及其在细胞中的累积和分布[J]. 海洋学报, 1997, 19(5): 110-115
Wang D Z, Gao Y H, Chen Y D. Effects of selenium on the growth of two algae species and its accumulation and distribution in cells [J]. Acta Oceanologica Sinica, 1997, 19(5): 110-115 (in Chinese)
[41] 周志刚, 钟罡, 刘志礼. 硒对极大螺旋藻生长及含硒量的影响[J]. 海洋科学, 1997, 5: 42-45
Zhou Z G, Zhong G, Liu Z L. Effects of selenium on the growth and selenium contents of Spirulina maxima [J]. Marine Sciences, 1997, 5: 42-45 (in Chinese)
[42] 陈必链, 庄惠如, 余望, 等. 钝顶螺旋藻对锌和硒生物富集作用的研究[J]. 食品与发酵工业, 1998, 24(6): 27- 29
Chen B L, Zhuang H R, Yu W, et al. Study on selenium and zinc bio-enrichment in Spirulina platensis [J]. Food and Fermentation, 1998, 24(6): 27- 29 (in Chinese)
[43] De Alcantara S, Lopes C C, Wagener K. Controlled introduction of selenium into Chlorella cells [J]. Indian Journal of Experimental Biology, 1998, 36: 1286-1288
[44] Fan T W M, Lane A N, Martens D, et al. Synthesis and structure characterization of selenium metabolites [J]. Analyst, 1998, 123: 875-884
[45] Pelah D, Cohen E. Cellular response of Chlorella zofingiensis to exogenous selenium [J]. Plant Growth Regulation, 2005, 45: 225-232
[46] Pronina N A, Kovshova Y I, Popova V V, et al. The effect of selenite ions on growth and selenium accumulation in Spirulina platensis [J]. 2002, 49: 235-241
[47] Li Z Y, Guo S Y, Li L. Bioeffects of selenite on the growth of Spirulina platensis and its biotransformation [J]. Bioresource Technology, 2003, 89: 171-176
[48] 郑文杰, 贺鸿志, 黄峙, 等. 螺旋藻富集和转化硒研究进展[J]. 中国生物工程杂志, 2003, 23(1): 57-60
Zheng W J, He H Z, Huang Z, et al. The progress in Spirulina accumulating and inorganic selenium transforming [J]. Progress in Biotechnology, 2003, 23(1): 57-60 (in Chinese)
[49] Muto S, Niimura K, Oohara M, et al. Polysaccharides and antiviral drugs containing the same as active ingredient: United States, US5089481 A [P]. (1992-02-18).
[50] Matthias J A, Anza D, Ancuela A, et al. Salt stress-induced cell death in the unicellular green alga Micrasterias denticulate [J]. Journal of Experimental Botany, 2009, 60(3): 939-954
[51] 徐辉碧, 范华汉. 生命科学中的微量元素(第2版)[M]. 北京: 中国计量出版社, 1996: 620-668
Xu B H, Fan H H. Trace elements in life sciences (the second edition) [M]. Beijing: China Metrology Press, 1996: 620-668 (in Chinese)
[52] Cho S H, Cho Y J, Choi C Y. Effect of feeding regime on compensatory growth of juvenile abalone, Haliotis discus hannai, fed on the dry sea tangle, Laminaria japonica [J]. Journal of the World Aquaculture Society, 2011, 42(1): 122-126
[53] Schiavon M, Moro I, Pilon-Smits E A H, et al. Accumulation of selenium in Ulva sp and effects on morphology, ultrastructure and antioxidant enzymes and metabolites [J]. Aquatic Toxicology, 2012, 122: 222-231
[54] Yan X, Zheng L, Chen H, et al. Enriched accumulation and biotransformation of selenium in the edible seaweed Laminaria japonica [J]. Journal of Agricultural and Food Chemistry, 2004, 52: 6460-6464
[55] 钟钰, 陈填烽, 郑文杰, 等. 裂片石莼水提物清除ABTS和DPPH自由基的光谱学研究[J]. 生态科学, 2013, 32(4): 447-452
Zhong Y, Chen T F, Zheng W J, et al. Spectrometric investigation of DPPH and ABTS free radical-scavenging of Ulva lacyuca L. aqueous extracts [J]. Ecological Science, 2013, 32(4): 447-452 (in Chinese)
[56] Yang Y F, Fei X G, Song J M, et al. Growth of Gracilaria lemaneiformis under different cultivation conditions and its effects on nutrient removal in Chinese coastal waters [J]. Aquaculture, 2006, 254(1-4): 248-255
[57] Ye C P, Zhang M C, Yang Y F, et al. Photosynthetic inhibition on the microalga Dunaliella sallina (Chlorophyta) by the dried macroalga Gracilaria lemaneiformis (Rhodophyta) [J]. Biomedical Engineering and Biotechnology (iCBEB), 2012: 400-404
[58] Riedel G F, Sanders G J. The influence of pH and media composition on the uptake of inorganic selenium by Chlamydomonas reinhardtii [J]. Environmental Toxicology and Chemistry, 1996, 15: 1577-1583
[59] Tuzen M, Sari A. Biosorption of selenium from aqueous solution by green algae (Cladophora hutchinsiae) biomass: Equilibrium, thermodynamic and kinetic studies [J]. Chemical Engineering Journal, 2010, 158: 200-206
[60] 黄键, 陈必链, 吴松刚. 环境因素对螺旋藻富集硒和锌及生长的影响[J]. 食品与发酵工业, 1999, 25(4): 23-25
Huang J, Chen B L, Wu S G. Effects of environmental factors on the growth and bioaccumulation of Zn and Se in Spirulina platensis [J]. Food and Fermentation Industries, 1999, 25(4): 23-25 (in Chinese)
[61] Lee W Y, Wang W X. Metal accumulation in the green macroalga Ulva fasciata: Effects of nitrate, ammonium and phosphate [J]. Science of the Total Environment, 2001, 278(1-3): 11-22
[62] Fournier E, Adam-Guillermin C, Potin-Gautier M, et al. Selenate bioaccumulation and toxicity in Chlamydomonas reinhardtii: Influence of ambient sulphate ion concentration [J]. Aquatic Toxicology, 2010, 97: 51-57
[63] Simmons D B D, Emery R J N. Phytochelatin induction by selenate in Chlorella vulgaris and regulation of effect by sulfate levels [J]. Environmental Toxicology and Chemistry, 2011, 30(2): 469-476
[64] Morlon H, Fortin C, Adam C, et al. Selenite transport and its inhibition in the unicellular green alga Chlamydomonas reinhardtii [J]. Environmental Toxicology and Chemistry, 2006, 25: 1408-1417
[65] Umysová D, Vítová M, Doušková I, et al. Bioaccumulation and toxicity of selenium compounds in the green alga Scenedesmus quadricauda [J]. BMC Plant Biology, 2009, 9(1): 1
[66] Yu R Q, Wang W X. Biological uptake of Cd, Se (IV), and Zn by Chlamydomonas reinhardtii in response to different phosphate and nitrate additions [J]. Aquatic Microbial Ecology, 2004, 35: 163-173
[67] Larsen E H, Hansen M, Fan T, et al. Speciation of selenoamino acids, selenonium ions and inorganic selenium by ion exchange HPLC with mass spectrometric detection and its application to yeast and algae [J]. Journal of Analytical Atomic Spectrometry, 2001, 16: 1403-1408
[68] Mosulishvili L M, Kirkesali Y I, Belokobylsky A I, et al. Epithermal neutron activation analysis of blue-green algae Spirulina platensis as a matrix for selenium-containing pharmaceuticals [J]. Journal of Radioanalytical and Nuclear Chemistry, 2002, 252: 15-20
[69] Li X, Xu H, Wu Q. Large-scale biodiesel production from microalga Chlorella protothecoides through heterotrophic cultivation in bioreactors [J]. Biotechnology and Bioengineering, 2007, 98: 764-771
[71] Lobinski R, Edmonds J S, Suzuki K T, et al. Species selective determination of selenium compounds in biological materials (Technical report) [J]. Pure and Applied Chemistry, 2000, 72: 447-461
[72] McSheehy S, Pohl P, Szpunar J, et al. Analysis for selenium speciation in selenized yeast extracts by two-dimensional liquid chromatography with ICP-MS and electrospray MS-MS detection [J]. Journal of Analytical Atomic Spectrometry, 2002, 16: 68-73


◆
Research Progress on Selenium Enriched Algae
Sun Xian1,2, Yang Yufeng1,2,*
1. Institute of Hydrobiology, Jinan University, Guangzhou 510632, China 2. Key Laboratory of Aquatic Eutrophication and Control of Harmful Algal Blooms, Guangdong Higher Education Institute, Guangzhou 510632, China
Received 27 November 2015 accepted 29 March 2016
Selenium (Se) is a natural trace element that acts as an essential micronutrient for human and animals as well as plants. Selenite is more soluble in water than in other environments, resulting in higher utilization rates by aquatic organisms to uptake inorganic Se (selenate). Algae can absorb inorganic Se and effectively convert it into organic form. Se components in algae mainly exist as biologic macromolecules (e.g., selenoprotein, Se nucleic acid, and Se polysaccharide) and biologic small molecules (e.g., selenocysteine and selenomethionine). In aquatic ecosystems, Se is mainly absorbed by algae. Se-enriched algae will pass Se to plankton, shellfish, fish and other animals through the food chain; Se helps improve the antioxidant activity of these animals and therefore enhance their tolerance of heavy metals. This paper comprehensively reviews research progress of Se-enriched algae, including significance and role of algae in the natural conversion of inorganic Se to organic Se, enrichment means and metabolic pathways in algae, biologic effects of Se in algae, and status quo of development and utilization as well as developing trend of Se-enriched algae.
selenium; algae; Se enrichment
10.7524/AJE.1673-5897.20151127006
农业部公益科研专项(201403008);国家自然科学基金委-广东省联合基金(U1301235)
孙显(1986-),男,博士,研究方向为淡水与海洋生态毒理学,E-mail: imytian@163.com
*通讯作者(Corresponding author), E-mail: tyyf@jnu.edu.cn
2015-11-27 录用日期:2016-03-29
1673-5897(2016)2-101-10
X171.5
A
简介:杨宇峰(1963-),男,教授,博士,博士生导师。从事渔业水域环境生态学与生物修复技术、养殖生态学、近海环境大型海藻生物修复与浮游生物的研究。
孙显, 杨宇峰. 富硒藻类研究进展[J]. 生态毒理学报,2016, 11(2): 101-110
Sun X, Yang Y F. Research progress on selenium enriched algae [J]. Asian Journal of Ecotoxicology, 2016, 11(2): 101-110 (in Chinese)

