TiO2光催化臭氧氧化降解全氟辛酸的研究
李来胜, 黄继业
(华南师范大学化学与环境学院, 广州 510006)
TiO2光催化臭氧氧化降解全氟辛酸的研究
李来胜*, 黄继业
(华南师范大学化学与环境学院, 广州 510006)

光催化臭氧氧化; 全氟辛酸; 光生空穴; 羟基自由基; 协同作用
近年来,人工合成的全氟化合物(PFCs)由于强表面活性、耐火性、化学稳定性和热稳定性等特点被广泛运用于工业生产和生活领域,如防雾剂,脱模剂和工业表面活性剂等. 由于其具有环境持久性、毒性和生物蓄积性,已经引起了社会的广泛关注[1-5]. 其中全氟辛酸(Perfluorooctanoic Acid, PFOA)和全氟辛烷磺酸(Perfluorooctane Sulfonic Acid, PFOS)是最典型的代表. 据报道PFOA具有致畸性和潜在的致癌性,已被纳入美国环境保护署污染物名单[6-8].
众所周知,高级氧化技术(AOPs)被广泛运用于降解有机污染物. 羟基自由基(·OH)是主要的氧化剂并且它的氧化还原电位高达2.8 V. 然而,有研究[9-10]表明·OH对PFOA的降解效果是十分微弱的. 因为PFOA中C—F键键能高达530 kJ/mol,远高于C—C键键能(410 kJ/mol). ·OH与PFOA的反应速率≤10-5L/(mol·s)[11]. 因此,传统的高级氧化技术(如O3、紫外光UV、O3/H2O2和H2O2/Fe2+等)不能有效降解PFOA[12]. TiO2光催化氧化技术对PFOA降解具有一定的效果,但降解速率慢、脱氟率低[13]. 针对这一问题,本文将TiO2光催化氧化和臭氧氧化技术耦合,用于降解PFOA.
1 实验方法
1.1 材料与试剂
全氟辛酸(PFOA,96%)、氟离子标准溶液均购于阿拉丁公司;高效液相色谱级甲醇购于Oceanpak公司;TiO2(P25,比表面积50 m2/g)购于德国德固赛公司(Degussa).
1.2 实验步骤
光催化臭氧氧化实验在定制的1.3 L玻璃柱状反应器中进行(图1). 低压汞灯(Heraeus,主波长为254 nm,28 W)置于反应柱中央,并由石英套管与反应隔开. 反应器外有循环冷却水套,以保持反应溶液温度. O3由高纯O2通入臭氧发生器(ANSEROS, COM-AD-01-OEM)产生,并通过位于反应器底部的砂芯布气板通入反应溶液中. O2的流速为1 L/min,O3的产量为25 mg/h. Na2S2O3溶液作为尾气中剩余O3的吸收液. PFOA溶液(1 L, 10 mg/L)中加入0.2 g TiO2作为催化剂,通入O2曝气30 min. 待PFOA达到吸附平衡后接通紫外灯电源. 溶液从取样口取出经0.45 μm有机滤膜过滤后,留待检测.

图1 光催化臭氧氧化反应装置
Figure 1 Schematic diagram of experimental apparatus for photocatalytic ozonation
1.3 分析方法
高效液相色谱-质谱联用仪(Agilent 1200HPLC,Agilent 6410A ESI/MS检测器)对PFOA降解产物进行检测. 色谱柱为Diamonsil C18柱(250 mm×4.6 mm, 5 μm);柱温:50 ℃;进样量∶10 μL;流动相A:2 mmol/L醋酸铵,流动相B:甲醇;流速:1 mL/min;采用梯度洗脱模式,流动相B的变化为:0~0.1 min,72%;0.1~6.0 min,72%~95%;6.0~9.5 min,95%;9.5~9.6 min,95%~72%;9.6~15.0 min,72%;质谱采用电喷雾离子源,负离子模式;离子喷雾电压:-4.5 kV;温度:500 ℃;碰撞气体:0.021 MPa;碰撞能量:-15.5 eV.
氟离子浓度由离子色谱仪(ICS900, DIONEX)测定. 离子色谱由分离柱(IonPac AS19, 4 mm×250 mm)、保护柱(IonPac AG19, 4 mm×50 mm)、抑制型电导检测器组成. 流动相为KOH(10 mm/L),流速为1.0 mL/min. 脱氟率的计算公式如下:脱氟率(%)=414.07m(F-)/[15×18.998m0]×100%=
1.453m(F-)/m0×100%,
(1)
其中,m(F-)为氟离子质量浓度(mg/L);m0为PFOA初始质量浓度(mg/L).
2 结果与讨论
2.1 TiO2光催化臭氧氧化降解PFOA
单独臭氧条件下,反应4 h后PFOA基本没有脱氟(图2). 这是由于PFOA的C—F键键能高达530 kJ/mol,·OH对其降解效果微乎其微. 此外,PFOA在254 nm紫外灯照射下,反应4 h后脱氟率仅有8.3%,因为PFOA在波长大于200 nm的紫外区吸收很微弱[14],在254 nm紫外光下的半衰期(t1/2)长达4 333 min[15].

图2 PFOA在不同体系下的脱氟效果
TiO2光催化体系(UV/TiO2/O2)降解PFOA 4 h后,PFOA脱氟率仅有14.7%. 目前普遍认为光生空穴在PFOA的降解过程中起主要作用,但由于TiO2表面光生空穴和光生电子(e-)极易复合,限制了PFOA进一步降解[16]. 本研究在TiO2光催化降解PFOA过程中加入O3,PFOA脱氟率显著提高,达到44.3%. 这是由于光催化和臭氧氧化过程存在明显协同作用,O3的加入加快了光生电子转移,减少了与光生空穴复合几率,提高光催化反应的量子效率.
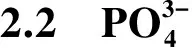


图浓度对光催化臭氧氧化降解PFOA的影响

2.3 PFDA初始质量浓度的影响
当PFOA质量浓度为5 mg/L时,反应4 h后脱氟率为25.3%(图4). 随着PFOA初始质量浓度增大,脱氟率呈现先增大后减小的趋势. 在10、25和50 mg/L下,脱氟率分别为44.3%、49.5%和43.7%. 这是因为在低质量浓度条件下,随着PFOA初始质量浓度的增加,更多PFOA参与了反应,从而提高了催化反应速率. 当PFOA达到一定质量浓度后,继续增大PFOA初始质量浓度会产生更多的中间产物并吸附在催化剂表面,从而阻碍PFOA吸附,使反应速率下降[18].

图4 PFOA初始质量浓度对其光催化臭氧氧化降解的影响
Figure 4 Influence of initial concentrations of PFOA on the photocataly-tic ozonation of PFOA
2.4 反应温度的影响
在TiO2光催化臭氧氧化降解PFOA过程中,反应温度也起着一定作用. 由图5可见,起始阶段,反应温度越高,PFOA脱氟效果越好. 但随着反应进行到2 h后,初始温度越低,PFOA脱氟率反而更高. 这是因为在反应过程的前半段温度占主导因素,温度升高可以降低反应活化能,增加分子间碰撞几率进而提高反应速率[19]. 而在反应过程的后半段吸附作用影响更大,催化剂的吸附容量随温度升高而降低. 因此,随反应温度升高,PFOA在 TiO2表面的吸附量逐渐降低,其脱氟率下降.

图5 反应温度对光催化臭氧氧化降解PFOA的影响
Figure 5 Influence of reaction temperature on the photocatalytic ozonation of PFOA
2.5 TiO2光催化臭氧氧化降解PFOA机理
DILLERT等[20]研究了TiO2光催化降解PFOA过程,并提出了类似于Photo-Kolbe反应的降解机理. 而对于TiO2光催化臭氧氧化耦合体系降解PFOA,产生的中间产物(表1)分别为全氟庚酸(PFHpA)、全氟己酸(PFHxA)、全氟丁酸(PFBA)、全氟丙酸(PFPrA)、全氟戊酸(PFPeA).

表1 TiO2光催化臭氧氧化降解PFOA的主要产物
由于存在光催化和臭氧氧化的协同效应,可能的降解机理如下:
首先,O3具有强氧化性(2.07 V),可以与催化剂表面生成的光生电子反应,进而产生·OH[21]:

(2)

(3)
HO3·→O2+·OH.
(4)
光生电子的消耗减少了电子-空穴对复合几率,从而产生更多光生空穴参与PFOA的氧化,生成全氟自由基[16]:
C7F15OO-+h+→C7F15OO·,
(5)
该自由基脱去羧基生成全氟辛烷自由基C7F15·:
C7F15OO·→C7F15·+CO2,
(6)
全氟辛烷自由基与式(3)产生的·OH结合生成C7F15OH[22]:
C7F15·+·OH→C7F15OH.
(7)
由于C7F15OH不稳定,会迅速脱去HF生成C6F13COF:
C7F15OH→C6F13COF+H++F-.
(8)
接着C6F13COF经水解转化为C6F13COO-:
C6F13COF+H2O→C6F13COO-+2H++F-.
(9)
C6F13COO-重复上述过程逐步脱去CF2,最终形成5种短链全氟羧酸化合物.
在TiO2光催化臭氧氧化降解PFOA过程中,·OH对PFOA中间产物起到氧化作用,从而加快降解反应的进行. 因此,对于TiO2光催化臭氧氧化耦合体系,协同效应促使更多光生空穴和·OH产生,二者共同作用实现对PFOA的有效降解.
3 结论
TiO2光催化臭氧氧化耦合体系显著提高PFOA降解效率,反应4 h后脱氟率达到44.3%. 降解反应发生在催化剂表面,PFOA和O3在TiO2表面的吸附是降解反应进行的必要条件. 反应过程的前半段温度占主导因素,脱氟率随温度的升高而升高. 反应过程的后半段吸附起主要作用,脱氟率随温度升高而下降.
在TiO2光催化臭氧氧化降解PFOA过程中,光生空穴和·OH都充当了氧化剂的作用. 其中光生空穴起主要作用,·OH加快降解反应的进行. TiO2光催化臭氧氧化降解PFOA的主要中间产物是5种短链全氟羧酸化合物(PFHpA、PFHeA、PFPeA、PFBA 和 PFPrA).
[1] LUDWICKI J K, GORALCZYK K, STRUCINSKI P, et al. Hazard quotient profiles used as a risk assessment tool for PFOS and PFOA serum levels in three distinctive European populations[J]. Environment International, 2015, 74: 112-118.
[2] MARTIN J W, HOUDE M, LETCHER R J, et al. Biological monitoring of polyfluoroalkyl substances[J]. Environmental Science & Technology, 2006, 40: 3463-3473.
[3] KEY B D, HOWELL R D, CRIDDLE C S. Fluorinated organics in the biosphere[J]. Environmental Science & Technology, 1997, 31: 2445-2454.
[4] WU X M, BENNETT D H, CALAFAT A M, et al. Serum concentrations of perfluorinated compounds (PFC) among selected populations of children and adults in California [J]. Environmental Research, 2015, 136: 264-273.
[5] WANG Y, NIU J, ZHANG L, et al. Toxicity assessment of perfluorinated carboxylic acids (PFCAs) towards the rotifer Brachionus calyciflorus[J]. Science of the Total Environment, 2014, 491/492: 266-270.
[6] LÜ Z, LI G, LI Y, et al. Glucose and lipid homeostasis in adult rat is impaired by early-life exposure to perfluorooctane sulfonate [J]. Environmental Toxicology, 2013, 28: 532-542.
[7] HOGUE C. PFOA called likely human carcinogen[J]. Chemical Engineering News, 2006, 83(27):5.
[8] US Environmental Protection Agency. Contaminant candidate list-3[N]. (2003-07-18)[2016-03-02]. http:∥www.epa.gov/safewater/ccl/ccl3.html#ccl3.
[9] WARDMAN P. Reduction potentials of one-electron couples involving free-radicals in aqueous-solution[J]. Journal of Physical and Chemical Reference Data, 1989, 18: 1637-1755.
[10]DENG S, NIE Y, DU Z, et al. Enhanced adsorption of perfluorooctane sulfonate and perfluorooctanoate by bamboo-derived granular activated carbon[J]. Journal of Hazardous Materials, 2015, 282:150-157.
[11]GREENSTOCK C L, BUXTON G V, HELMAN W P, et al. Criticalreview of rate constants for reactions of hydrated electrons, hydrogen-atoms and hydroxyl radicals (·OH/·O-) in aqueous solution[J]. Journal of Physical and Chemical Reference Data, 1988, 17: 513-886.
[12]SCHRÖDER H F, MEESTERS R J W. Stability of fluo-rinated surfactants in advanced oxidation processes-a follow up of degradation products using flow injection-mass spectrometry, liquid chromatography-mass spectrometry and liquid Chromatography-multiple stage mass spectro-metry[J]. Journal of Chromatography A, 2005, 1082: 110-119.
[13] 李明洁, 喻泽斌, 陈颖, 等. TiO2光催化降解PFOA的反应动力学及机制研究[J]. 环境科学, 2014, 35 (7): 2612-2619.
LI M J, YU Z B, CHEN Y, et al. Photocatalytic degradation kinetics of perfluorooctanoic acid (PFOA) in TiO2dispersion and its mechanism[J]. Chinese Journal of Environmental Science, 2014, 35 (7): 2612-2619.
[14] 陈静, 张彭义, 刘剑. 全氟羧酸在185 nm真空紫外光下的降解研究[J]. 环境科学, 2007, 28(4): 772-776.
CHEN J, ZHANG P Y, LIU J. Photodegradation of perfluorinated carboxylic acids by 185 nm UV light[J]. Chinese Journal of Environmental Science, 2007, 28(4): 772-776.
[15]WANG Y, ZHANG P Y, PAN G, et al. Ferric ion mediated photochemical decomposition of perfluorooctanoic acid (PFOA) by 254 nm UV light[J]. Journal of Hazar-dous Materials, 2008, 60: 181-186. [16]PANCHANGAM S C, LIN A Y, TSAI J H, et al. Sonication-assisted photocatalytic decomposition of perfluorooctanoic acid[J]. Chemosphere, 2009, 75: 654-660.
[17]GEELHOED J S, HIEMSTRA T, VAN R W H. Phosphate and sulfate adsorption on goethite: single anion and competitive adsorption[J]. Geochimica et Cosmochimica Acta, 1997, 61 (12): 2389-2396.
[18]SLEIMAN M, CONCHON P, FERRONATO C, et al. Photocatalytic oxidation of toluene at indoor air levels (PPBV): towards a better assessment of conversion, reaction intermediates and mineralization[J]. Applied Catalysis B: Environmental, 2009, 86(3): 159-165.
[20]DILLERT R, BAHNEMANN D, HIDAKA H. Light-induced degradation of perfluorocarboxylic acids in the presence of titanium dioxide[J]. Chemosphere, 2007, 67: 785-792.
[22]ZHUO Q, DENG S, YANG B, et al. Efficient electrochemical oxidation of perfluorooctanoate using a Ti/SnO2-Sb-Bi anode[J]. Environmental Science & Technology, 2011, 45: 2973-2979.
【中文责编:成文 英文责编:李海航】
Efficient Degradation of Perfluoroocatanoic Acid by TiO2-Mediated Photocatalytic Ozonation
LI Laisheng*, HUANG Jiye
(School of Chemistry and Environment, South China Normal University, Guangzhou 510006, China)

photocatalytic ozonation; perfluorooctanoic acid; photo-generated hole; hydroxyl radical; synergistic effect
2016-03-02 《华南师范大学学报(自然科学版)》网址:http://journal.scnu.edu.cn/n
国家高技术研究与发展计划(863)项目(2013AA06A305)
X703.1
A
1000-5463(2016)06-0106-05
*通讯作者:李来胜,教授,Email: llsh@scnu.edu.cn.

