构造原理与电子排布式的课堂教学设计
许自慧
(新疆兵团建工师四中)
构造原理与电子排布式的课堂教学设计
许自慧
(新疆兵团建工师四中)
为了让学生更容易地学懂、掌握构造原理与电子排布式的书写,对本节重点内容做了以下课堂教学设计。通过学习原子结构中的构造原理等知识,使学生感受到由现象到本质,由宏观到微观的奇妙之处,既培养了学生的基本知识技能,又培养了学生的情感、态度、价值观。
能层;能级;构造原理;电子排布式
高中化学选修三《物质结构与性质》中第一章原子结构与性质是在学生已具备初中原子的结构及高中化学必修知识以后,进一步选修的内容。本章第一节原子结构内容涉及了新的概念,如能层、能级、构造原理、电子排布式、基态、激发态等多个知识点,概念比较抽象不好学,而这部分知识点又是高考选修三的重要考点之一。因此经过研究与实践,为了让学生更容易地学懂、掌握构造原理与电子排布式的书写,我对本节重点内容做了以下课堂教学设计。
首先对教材的地位和作用进行分析:本节内容首先是让学生了解原子结构模型的发展历程,及相关科学家的重要贡献,体会人类对原子结构的认识是一个逐步深入的过程,科学理论的发展是一个逐步完善的过程。在活动中使学生感悟科学家献身科学的精神和进行科学探索所具有的科学态度。其次,通过学习原子结构中的构造原理等知识,使学生感受到由现象到本质,由宏观到微观奇妙之处,既培养了学生的基本知识技能,又培养了学生的情感、态度、价值观。
对学生情况进行分析:
学生已有知识和能力:通过初中化学的学习,学生已经会写1-20号原子结构示意图,知道原子核外电子是分层排布的,知道原子的最外层电子数决定了元素的化学性质。通过高中必修二的学习,学生进一步了解了原子结构的相似性和递变性决定了元素性质的相似性和递变性,即:元素周期律。学生已基本具备分析、对比、总结归纳的能力,同时也具备自主、合作、实验探究能力。
学生可能遇到的困难:不理解能层与能级的区别;不理解构造原理在电子排布式的书写中的重要作用;混淆构造原理与电子排布式中能级的书写顺序。因此,在教学中要注意分析对比、举例说明并加强课堂练习。
设计教学目标:
知识与技能:
1.了解原子结构的构造原理,知道原子核外电子的能级分布。
2.能用电子排布式表示常见元素(1-36号)原子核外电子的排布。
过程与方法:通过查阅资料,讨论交流,学会自主学习、交流合作的学习方式。通过学习过程,学会比较、分析、归纳、应用的能力。
情感、态度、价值观:了解科学理论的发展是一个逐步完善的过程。感悟科学家献身科学的精神和进行科学探索所具有的科学态度。培养“从现象到本质、从微观到宏观、结构决定性质”的化学思想。
设计教学重点和难点:构造原理和电子排布式。
设计教学方法:问题式教学、探究式教学。
设计教学过程:重、难点的突破——构造原理:
复习提问:核外电子排布的能层符号依次为什么?(答:K L M N O P Q)。
教师引入:同一能层的电子,能量也可能不同,还可以把它们分成能级,就好比能层是楼层,能级是楼梯的阶级。各个能层的能级符号分别是什么?答:K层1s;L层2s 2p;M层3s 3p 3d;N层4s 4p 4d 4f等,同一能层中,不同能级的能量也是不相同的。请大家根据课本第5页能层与能级的图表讨论以下几个问题:
学生合作探究:
1.原子核外电子的每一个能层最多可容纳的电子数与能层的序数(n)间存在什么关系?
(答:2n2)
2.不同r的能层分别有多少个能级,与能层的序数(n)间存在什么关系?(答:能级数=能层数n)
3.英文字母相同的不同能级中所能容纳的最多电子数是否相同?(答:s能级上最多容纳2个电子,p能级上最多容纳6个电子,d能级上最多10个,f能级上最多14个电子)
提问:多电子原子的核外电子排布遵循什么规律呢?为什么钾原子的电子排布不是2 8 9 ,而是2 8 8 1 呢?
教师引入:科学家归纳大量的光谱事实得出如下结论:设想从氢原子开始,随着原子核外核电荷数的递增,原子核外每增加一个质子,原子核外便增加一个电子,这个电子大多是按课本第6页图1-2所示的能级顺序填充的,填满一个能级再填一个新能级。这种规律称为“构造原理”。
板书:构造原理中能级顺序为:(能量由低到高)
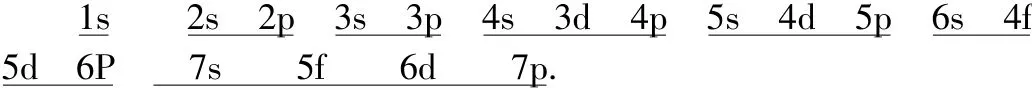
简化:数字记忆:
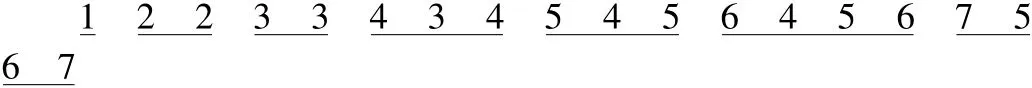
在相同的数字中,从前往后,依次表示同一能层的 spdf能级。如,中的4从前往后表示的分别是:能级。依次类推。
教师讲解:核外电子就是按照上述构造原理(能级顺序)填充电子。但书写电子排布式时书写顺序仍按照每个能层的能级构成顺序书写。
板书:电子排布式的书写顺序(即:能级构成顺序)为:
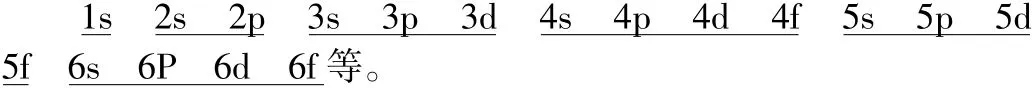
举例:写出下列原子核外电子排布式:氧原子、氯原子、钾原子
氧原子:1s22s22p4,氯原子:1s22s22p63s23p5,钾原子:1s22s22p63s23p64s1
强调:在填写电子时一定要遵循构造原理:先填充1s能级,最多2个电子,再填2s能级,最多2个电子,再填充2p能级,最多6个电子,如果有更多的电子,再继续填3s 3 p能级。
如:钾原子,当填满足1s22s22p63s23p6几个能级后,还有一个电子,这时不能先填3d能级,而应该根据构造原理的填充顺序,先填4s能级,后填3d能级。所以钾原子的电子排布式为:1s22s22p63s23p64s1(由于3d及后面其他能级未填充电子,所以书写时可以省略不写)。所以,我们明白了钾原子核外电子排布为2 8 8 1的原因。
练习:学生书写1-36号元素原子的核外电子排布式。(注意:半充满或全充满的特殊原子24号铬Cr和29号Cu的书写)
师生总结:能级构成与构造原理的区别。
·编辑 谢尾合

