I型大麻素受体介导大麻素 HU210对星型胶质细胞 CXCR4水平下调
朱舟,韩静,张遐,徐逸
(1华中科技大学同济医学院附属同济医院神经科,武汉 430030;2陕西师范大学现代教学技术教育部重点实验室,西安 710061;3加拿大渥太华大学 IMHR,渥太华 K1Z7H3;4华中科技大学同济医学院附属同济医院整形外科,武汉 430030)
I型大麻素受体介导大麻素HU210对星型胶质细胞CXCR4水平下调
朱舟1,韩静2,张遐3,徐逸4*
(1华中科技大学同济医学院附属同济医院神经科,武汉 430030;2陕西师范大学现代教学技术教育部重点实验室,西安 710061;3加拿大渥太华大学 IMHR,渥太华 K1Z7H3;4华中科技大学同济医学院附属同济医院整形外科,武汉 430030)
目的 探寻大麻素抑制中枢神经系统免疫反应的机制,为大麻素临床药物的合理应用提供实验依据。方法用不同浓度的HU210刺激培养的星形胶质细胞,利用Western blot检测并比较刺激组和未刺激组细胞CXCR4蛋白水平的差异,进而用I型大麻素受体(type-1 cannabinoid receptor,CB1R)拮抗剂AM281刺激细胞后,观察HU210对CXCR4表达的影响。结果 Western blot检测结果显示,高浓度HU210能下调星形胶质细胞CXCR4表达,AM28能阻断HU210所致的CXCR4下调。结论 HU210经由CB1R下调CXCR4,这可能是大麻发挥免疫抑制作用的机理之一。
大麻素;1型大麻素受体;CXCR4;星形胶质细胞
基质细胞衍生因子1(stromal cell-derived factor 1,SDF-1)是趋化因子 CXC亚家族的一员,其受体为CXCR4。在中枢神经系统 SDF-1/CXCR4对神经元及神经胶质细胞的迁移/分化和生存起重要的作用[1,2]。胶质细胞的 CXCR4与中枢神经系统的炎性反应和神经毒性反应密切相关。在多发性硬化、Alzheimer病及脑肿瘤的病理过程中,星形胶质细胞、白细胞和血管内皮细胞的CXCR4表达明显增高[3,4]。另外,作为HIV病毒的中枢神经系统受体之一[5,6],CXCR4参与HIV导致的神经元死亡和痴呆[7,8]。因此,阻断CXCR4受体,可能是潜在的神经保护途径。
越来越多研究已经证实大麻素能抑制中枢神经系统炎性反应,缓解多发性硬化、脑卒中等疾病的进展[9-12],但其机制尚不明确。为了揭示大麻素抑制免疫功能的机制,为大麻素临床药物的合理应用提供实验依据,我们利用人工合成大麻素HU210和I型大麻素受体(type-1 cannabinoid receptor,CB1R)拮抗剂AM281,观察HU210对星形胶质细胞(astrocyte,AS)内CXCR4水平的影响及其机制。
材料与方法
1 动物
实验动物为出生0~2天的Sprague-Dawley(SD)大鼠,由Charles River Laboratories(美国实验动物公司加拿大渥太华分部)提供。动物饲养条件和实验程序严格按加拿大国家实验动物委员会动物使用和管理条例执行。
2 主要试剂
HU210购于Tocris,AM281购于Sigma,小鼠抗GFAP单克隆抗体、多克隆兔抗CB1R购于Chemicon,多克隆兔抗CXCR4购于Abcam,多克隆兔抗βactin购于Santa Cruz,辣根过氧化物酶标记的抗兔IgG购于Sigma,Alexa Fluor 488羊抗小鼠IgG和Alexa Fluor 568羊抗兔IgG购于Molecular Probes,ECL显色试剂盒及蛋白测试BCA试剂盒购于Pierce。
3 星形胶质细胞培养和鉴定
取0~2d的SD大鼠幼崽大脑皮层,吹打分散成106/ml细胞悬液,接种于涂有多聚赖氨酸的培养瓶中,置于37°C、5%CO2培养箱,第2d更换培养基,以后每3d换1次培养基,培养第6d将培养瓶置于37°C恒温摇床150r/min振摇2h,弃培养基后用0.125%的胰酶消化贴壁细胞,吹打成细胞悬液后以种植密度106个/cm2接种于涂有多聚赖氨酸的盖玻片的6孔板。对AS进行AS特异性蛋白GFAP荧光标记和DAPI染核,计算AS的培养纯度。AS培养纯度达99.05%±2.20%。
4 实验分组
将生长融合的星形胶质细胞培养基中加入不同浓度HU210,HU210由DMSO溶解,分为对照组(仅加入DMSO)、3μmol/L组、6μmol/L组和12μmol/L组。
5 免疫荧光染色
取出培养皿中盖玻片,0.01mol/L PBS冲洗3次后,用100%甲醇固定30min,10%牛血清白蛋白封闭30min后,在不同的玻片上分别加入一抗小鼠抗GFAP单克隆抗体(1∶500)/兔抗CB1R抗体(1∶300)和一抗小鼠抗GFAP单克隆抗体(1∶500)/兔抗CXCR4(1∶300),4℃孵育过夜后,PBS充分洗去一抗,加入Alexa Fluor 488羊抗小鼠(1∶500)和Alexa Fluor 568羊抗兔(1∶500),PBS充分漂洗后在荧光显微镜(Zeiss LSM510 META)下观察、拍照;阴性对照用PBS替代一抗。
6 Western blot检测
分别用不同浓度HU210和50μmol/L AM281刺激生长融合的星形胶质细胞5h后,去除细胞培养基,用D-Hanks清洗两遍,按说明书用M-PER Mammalian Protein Extraction Reagent试剂盒对细胞进行裂解,5min后收集细胞裂解液,离心14,000g(4°C)20min,收集上清,BCA试剂盒检测蛋白浓度;加40μg蛋白样到12%SDS-PAGE中进行垂直电泳分离,然后全湿式电转法转至 PVDF膜上;用含5%脱脂奶粉的TBS-T室温封闭2h,兔抗CXCR4(1∶500)、兔抗CB1R(1∶500)及兔抗β-actin(1∶500)。4°C慢摇过夜,次日充分漂洗后加入辣根过氧化物酶标记的抗兔IgG(1∶2,500),在室温下摇动孵育2h,ECL试剂盒显色,用数字照相成像系统(Alpha Innotech)拍照并进行条带分析(AlphaEase FC software),以测定目的蛋白水平。
7 统计学分析
结 果
1 高浓度HU210下调星形胶质细胞内CXCR4
为了明确培养的AS是否表达CXCR4及CB1R,对分离培养的AS进行GFAP/CXCR4和GFAP/CB1R免疫荧光双标检测。结果显示,AS特异性标记蛋白GFAP在胞质表达,CXCR4和CB1在胞质和细胞膜均有表达(图1)。
用不同浓度HU210刺激AS 5h后收集细胞,提取蛋白,进行 Western blot检测,结果显示,与用溶媒(vehicle)DMSO刺激的对照组细胞相比,3μmol/L HU210刺激AS对CXCR4水平无明显明显影响,6μmol/LHU210刺激后CXCR4的水平显著降低,12μmol/L HU210刺激后CXCR4水平 6μmol/LHU210刺激后相似,即高浓度HU210下调AS内CXCR4水平的影响并非剂量依赖性(图2)。

图1 培养星形胶质细胞中GFAP、CXCR4和CB1R表达的免疫荧光染色。比例尺,50 μmFig.1 Immunofluorescent staining for detection of the expression of GFAP,CXCR4 and CB1R in the cultured astrocytes.Scale bar,50μm
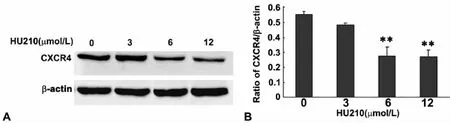
图2 HU210对培养星形胶质细胞内CXCR4水平的影响。A,HU210刺激 AS后,CXCR4水平的 western blot检测;B,HU210刺激 AS后,CXCR4水平变化的统计学分析;**,与溶媒刺激细胞相比,P<0.01;n=4Fig.2 The effect of HU210 on CXCR4 level in the cultured astrocytes.A,Western blot detection of CXCR4 level in the cultured astrocytes after HU210 treatment;B,statistical analysis of the change in CXCR4 level in the cultured astrocytes after HU210 treatment;**,P<0.01 versus astrocytes treated with the vehicle;n=4
2 CB1R拮抗剂阻断HU210对星形胶质细胞内CXCR4的下调作用
为了明确CB1R是否参与HU210对CXCR水平的下调作用,继而检测了CB1R的选择性拮抗剂AM281对HU210下调星形胶质细胞内 CXCR4水平作用的影响。将AS分为对照组、HU210组及HU210+AM281组,各自分别以DMSO、6μmol/L HU210以及6μmol/L HU210联合50 μmol AM281,对AS进行孵育5h后进行Western blot检测。结果表明,AM281能阻断HU210导致的CXCR4蛋白水平下降,提示HU210作用于CB1R而降低CXCR4的蛋白水平(图3)。
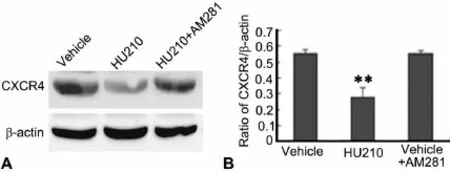
图3 AM281阻断 HU210对培养星形胶质细胞内CXCR4水平的下调作用。A,HU210和 AM281对培养星形胶质细胞内 CXCR4水平影响的Western blot检测;B,HU210和AM281对培养星形胶质细胞内CXCR4水平影响的统计学分析;**,与溶媒刺激细胞相比,P<0.01;n=4Fig.3 AM281 blocked the down-regulation of CXCR4 by HU210 in the cultured astrocytes.A,Western blot detection of the effect of HU210 and AM281 on CXCR4 level in the cultured astrocytes;B,statistical analysis of the effect of HU210 and AM281 on CXCR4 level in the cultured astrocytes;**,P<0.01 versus astrocytes treated with the vehicle;n=4
讨 论
在正常中枢神经系统中,神经元、神经胶质细胞和血管内皮细胞可持续低水平表达SDF-1和其受体CXCR4。SDF-1/CXCR4对细胞定向趋化发挥重要作用,研究表明多种中枢神经系统疾病,如实验性自身免疫性脑脊髓炎动物模型及多种脑部原发肿瘤均存在病变部位CXCR4的表达上调[12]。研究认为CXCR4的上调与神经系统损伤及神经元死亡相关,在新生小鼠脑组织缺血缺氧模型中,利用地塞米松干预能下调CXCR4的表达,影响炎症级联反应,从而发挥神经保护作用[13]。星形胶质细胞参与CXCR4相关的神经元死亡,中枢神经系统损伤局部SDF-1分泌增多,星形胶质细胞被升高的SDF-1趋化到损伤部位,聚集的星形胶质细胞产生大量炎性因子和神经毒性物质,比如TNF-α和谷氨酸,导致神经元损伤死亡[14]。因此阻断星形胶质细胞CXCR4可能起到神经保护作用。
桑科植物大麻是最早被人类认识的成瘾性植物之一,因其具有特殊的药理学作用,日益受到研究者的广泛重视。目前,大麻素免疫抑制及抗炎功效已被认为对多种神经系统疾病,如缺血性脑卒中、多发性硬化、帕金森病、阿尔茨海默病等有治疗效果[9-12]。大麻的抗炎效应及免疫抑制机制尚不明确,可能与大麻素抑制突触前谷氨酸释放减轻神经毒性反应,并能抑制TNF-α、NO和IL-1等细胞因子的生成。
对体外培养AS的研究表明,低浓度(3μmol/L)HU210对CXCR4水平无显著影响,但高浓度(6μmol/L和12μmol/L)HU210干预5h后可以显著降低CXCR4水平。人工合成大麻素 HU210的化学名为1,l-乙基庚基-1l-羟基四氢大麻酚,是大麻素的活性成分四氢大麻酚(△9tetrahydrocannabinol,△9THC)的结构类似物,通过作用于CB1R发挥作用,和△9THC比,与受体的亲和力更强,作用持续时间更久。
目前,国内外关于大麻素与SDF-1/CXCR4相关性研究较少,为数不多的研究发现高浓度的大麻素WIN 55,212-2显著抑制SDF-1导致的淋巴细胞趋化[15];大麻素THC能抑制HIV感染所致的免疫反应,而CXCR4作为HIV进入宿主细胞的辅助受体之一,提示THC和CXCR4间可能存在相互作用[16]。我们的研究检测了大麻素对CXCR4水平的影响,证实大麻素的确能通过CB1R下调星形胶质细胞CXCR4,可能是大麻发挥免疫抑制作用的机理之一。如前所述,中枢神经系统疾病存在广泛CXCR4表达上调,CXCR4的上调与炎性反应及神经损伤密切相关,大麻素对CXCR4的下调作用则为大麻素在中枢神经系统疾病的临床应用提供了理论基础。
[1]Tham TN,Lazarini F,Franceschini IA,et al.Developmental pattern of expression of the alpha chemokine stromal cellderived factor 1 in the rat central nervous system.Eur J Neurosci,2001,13(5):845-856.
[2]庞月珊,罗勇,谢宸宸,等.AMD3100对局灶脑缺血/再灌注大鼠脑皮质血管再生的影响.中国组织化学与细胞化学杂志,2014,23(1):20-24.
[3]Lu M,Grove EA,Miller RJ.Abnormal development of the hippocampal dentate gyrus in mice lacking the CXCR4 chemokine receptor.PNAS,2002,99(10):7090-7095.
[4]Rempel SA,Dudas S,Ge S,et al.Identification and localization of the cytokine SDF1 and its receptor,CXC chemokine receptor 4,to regions of necrosis and angiogenesis in human glioblastoma.Clin Cancer Res,2000,6(1):102-111.
[5]McManus CM,Weidenheim K,Woodman SE,et al.Chemokine and chemokine-receptor expression in human glial elements:induction by the HIV Protein,Tat,and chemokine autoregulation.Am J Pathol,2000,156(4):1441-1453.
[6]Feng,Y,Broder,C.C,Kennedy,P.E.et al.A.HIV-1 entry cofactor:functional cDNA cloning of a seven-transmembrane,G protein-coupled receptor.Science,1996, 272(5263):872-877.
[7]Mocchetti I,Campbell LA,Harry GJ,et al.When human immunodeficiency virus meets chemokines and microglia: neuroprotection or neurodegeneration?J Neuroimmune Pharmacol,2013,8(1):118-131.
[8]Mocchetti I,Bachis A,Masliah E.Chemokine receptors and neurotrophic factors:potential therapy against aidsdementia?J Neurosci Res,2008,86(2):243-255.
[9]Pryce G,Baker D.Endocannabinoids in Multiple Sclerosis and Amyotrophic Lateral Sclerosis.Handb Exp Pharmacol, 2015,231:213-231.
[10]Detyniecki K,Hirsch L.Marijuana Use in Epilepsy:The Myth and the Reality.Curr Neurol Neurosci Rep,2015,15 (10):65.
[11]More SV,Choi DK.Promising cannabinoid-based therapies for Parkinson's disease:motor symptoms to neuroprotection. Mol Neurodegener,2015,10:17.
[12]Arevalo-Martin A,Vela,JM,Molina-Holgado E, et al.Therapeutic action of cannabinoids in a murine model of multiple sclerosis.J Neurosci,2003, 23(7):2511-2516.
[13]Felszeghy K,Banisadr G,Rostene W,et al.Dexamethasone down regulates chemokine receptor CXCR4 and exerts neuroprotection against hypoxia/ischemia induced brain injury in neonatal rats.Neuroimmunomodulation,2004,11(6):404-413.
[14]Bezzi P,Domercq M,Brambilla L,et al.CXCR4-activated astrocyte glutamate release via TNFalpha: amplification by microglia triggers neurotoxicity. Nat Neurosci,2001,4(7):702-710.
[15]Tanikawa T,Kurohane K,Imai Y.Regulatory effect of cannabinoid receptor agonist on chemokine-induced lymphocyte chemotaxis.Biol Pharm Bull,2011,34(7):1090-1093.
[16]Xu C,Hermes DJ,Mackie K,et al.Cannabinoids OccludetheHIV-1Tat-InducedDecreasein GABAergic Neurotransmission in Prefrontal Cortex Slices.J Neuroimmune Pharmacol,2016,11(2): 316-331.
Type-I cannabinoid receptor mediates down-regulation of CXCR4 in astrocytes by cannabinoid HU210
Zhu Zhou1,Han Jing2,Zhang Xia3,Xu Yi4*
(1Department of Neurology,Tongji Hospital,Tongji Medical College,Huazhong University of Science and Technology,Wuhan 430030,China;2The Modern Teaching Technology Key Laboratory of the Ministry of Education,Shaanxi Normal University,Xi'an 710061,China;3IMHR,University of Ottawa,Ottawa K1Z 7H3,Canada;4Plastic Surgery Department,Tongji Hospital,Tongji Medical College,Huazhong University of Science and Technology,Wuhan 430030,China)
Objective This research aimed to explore the mechanism of cannabinoids in restraining immunoreaction in the central nervous system to seek the theoretical basis for clinical application.Methods The cultured astrocytes were stimulated with various concentrations of HU210;the expression levels of CXCR4 protein were detected by western blot,and compared between groups with and without cannabinoid treatment.The cells were then treated with AM 281,an antagonist of type-1 cannabinoid receptor(CB1R), and the change of CXCR4 expression was measured.Results Western blot results showed that high concentration HU210 could downregulate CXCR4 expression in astrocytes;however,CB1R antagonist AM281 was able to block this effect.Conclusion HU210 downregulates CXCR4 expression through CB1R,which might be one of the mechanisms for the immunosuppression effect of cannabinoids.
Cannabinoids;type-1 cannabinoid receptor;CXCR4;astrocyte
R931.71
A
10.16705/j.cnki.1004-1850.2016.05.002
2016-08-01
2016-10-08
华中科技大学自主创新研究基金(2015ZHYX011);湖北省科技支撑计划(2015BKA220)
朱舟,女(1978年),汉族,副教授
(To whom correspondence should be addressed):stmartin2005@foxmail.com

