RhD和HBsAg双表达载体的构建与表达研究
许纪玲,蔡 杰,陆玉婷,蔡旭兵,杨永林
(南京红十字血液中心,江苏 南京210003)
RhD和HBsAg双表达载体的构建与表达研究
许纪玲,蔡 杰,陆玉婷,蔡旭兵,杨永林*
(南京红十字血液中心,江苏 南京210003)
人类Rh血型系统是临床上最重要的血型系统之一,是人类红细胞血型系统最具有多态性的血型系统。到目前为止已发现了至少49种不同抗原,其中与临床相关的主要抗原为D、C、E、c和e等5种。Rh血型抗原定位于人类1号染色体短臂1p34.3-lp36.1,分别编码2个非糖基化的疏水性跨膜蛋白质RhD和RhCE[1]。RhD和RhCE基因同源性高达96%-97%。其中D抗原具有很强的免疫原性,抗原抗体的不相容能引起溶血性输血反应、新生儿溶血病和自身免疫性溶血性贫血[2,3],因此RhD基因的研究有着重要的指导意义,将HBsAg和RhD构建在同一载体中,可以通过对HBsAg作为表达检测指标,简易快捷的了解RhD的表达情况。
1 材料与方法
1.1 材料
1.1.1 菌株、质粒和细胞株 大肠杆菌DH5a本实验保留菌种,真核表达载体pIRES购自clontech公司,K562细胞株购自昆明细胞库。血液样本经检测RhD为阳性的献血者。
1.1.2 试剂 DNA限制性内切酶EcoRI、MluI、XbaI、SalI、聚合酶Pfu均购置于Fermentas公司,DNA Ligation Kit (Takara,D6020A)、Takara Agarose Gel DNA Purification Kit(Takara,DV805A),pMD18-T VectorT (Takara,D101A)均购自大连宝生物有限公司,TIANpure Midi Plasmid Kit(DP107)购自天根生化科技(北京)有限公司,Lipofectamine 2000转染试剂盒(,CAT NO.11668-027)购自美国invitrogen公司,QIAamp DNA Mini Kit(CAT NO.51106)购自德国QIAGEN公司,人抗RhD多克隆抗体及HRP标记羊抗人球蛋白抗体购自武汉博士德有限公司,HBsAg检测试剂合购自英科新创生物有限公司。
1.1.3 引物及测序 根据RhD的基因组DNA选取特异性序列区域,使用online设计软件设计扩增引物,用于扩增RhD的9个外显子,具体序列见表1,并设计用于拼接RhD的外显子的引物,具体序列见表2。根据克隆位点序列,设计克隆用引物,将拼接得到的完整RhD基因序列克隆入pIRES载体中,并在下游克隆位点处克隆入HBsAg序列,具体序列见表3。所有引物及测序均上海生工有限工公合成。

表1 RhD的9个外显子的扩增引物序列

表2 RhD的9个外显子进行两两拼接的特异性拼接引物序列

表3 RhD和HBsAg克隆入pIRES载体中的克隆引物序列
1.2 方法
1.2.1 扩增RhD外显子 取200 ml RhD阳性的全血使用QIAamp DNA Mini kit提取基因组DNA,方法参见试剂使用说明。采用Pfu聚合酶及相应九对特异性扩增引物分别扩增出对应的RhD基因的9个外显子[4]。经电泳鉴定后切胶回收分别克隆入PMD18T中,挑选插入目的片段的菌落送交测序,经NCBI网站比对进一步挑选出外显子序列完全正确的克隆。
1.2.2 拼接全长RhD基因 在9个外显子两端设计重叠互补引物,使得相邻两个外显子带有相互末端的重叠序列。采用重叠延伸拼接法进行两两拼接,最后拼接成为完整的RhD序列。将拼接完成的外显子序列克隆入PMD18T中,挑选插入目的基因的菌落送交测序,挑选出与NCBI基因序列上完全一致的阳性克隆。
1.2.3 pIRES双克隆载体的构建 用pIRES的克隆引物扩增RhD全基因,将扩增得到的目的片段和pIRES载体用EcoRI,MluI限制性DNA内切酶进行双酶切,将双酶切后的目的基因和pIRES载体进行切胶回收后,进行连接,转化,挑选阳性克隆。得到pIRES-RhD的重组质粒,RhD在上游克隆位点上。再用pIRES的克隆引物扩增HBsAg基因,将扩增得到的目的片段和pIRES-RhD载体用XbaI,SalI限制性DNA内切酶进行双酶切,将双酶切后的目的基因和pIRES-RhD载体进行切胶回收后,进行连接,转化,挑选阳性克隆。克隆HBsAg基因到pIRES-RhD的下游克隆位点上,最终得到pIRES-RhD-HBsAg的双表达载体,具体流程图见图1。
1.2.4 pIRES-RhD-HBsAg质粒转染 将K562细胞接种于6孔板中,每孔3 ml的RPMI1640完全培养基,待生长到1×106/ml时即可用于转染[5],转染前更换新鲜培养基。取14 μg待转质粒溶于150 μl Opti-MEM;取12 μl Lipofectamine 2000稀释于150 μl Opti-MEM。将稀释的质粒和转染试剂1∶1混合后室温放置5 min。6孔板中每孔放入250 μl质粒转染试剂混合物。放置于二氧化碳培养箱中培养2天,收集细胞及培养上清,分别检测HBsAg和RhD抗原的表达。
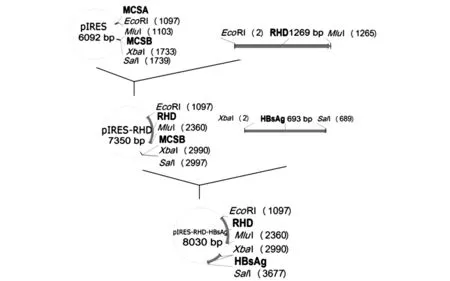
图1 pIRES-RhD-HBsAg载体构建示意图
1.2.5 RhD抗原及HBsAg的检测 取转染后40小时的细胞,约5×106,离心去上清,PBS洗3次,加入细胞裂解液200 μl,混均,并煮沸5 min,12000 g离心5 min,保留上清用WB检测。转膜后常规BSA封闭1 h,加入抗RhD多克隆抗体(1∶200),常温孵育1 h,洗膜后加入HRP标记羊抗人球蛋白抗体(1∶10 000),常温孵育1 h,最后采用化学发光方法曝光。取转染后细胞培养上清检测HBsAg,详细方法参见试剂盒说明书。
2 结果
2.1 RhD9个外显子的扩增片段,电泳结果见图2A,条带大小均正确。RhD片段两两拼接产物电泳见图2B。
2.2 克隆得到的pIRES-RhD-HBsAg双表达载体的双酶切鉴定
限制性内切酶EcoRI、MluI37℃对pIRES-RhD-HBsAg进行双酶切,完全消化后进行电泳,结果见图3A,结果表明插入片段大小正确。同样以限制性内切酶XbaI、SalI37℃对pIRES-RhD-HBsAg进行双酶切,完全消化后进行电泳,结果见图3B,结果表明插入片段大小正确。

A:RhD的9个外显子扩增片段。1-9为RhD的9个外显子扩增片段,M:DL2000;B:RhD的两个相邻的外显子片段拼接为一个长片段。1、2:相邻的两个外显子片段,3:两个外显子片段拼接而成的长片段,M:DL2000。
图2 RhD外显子的扩增与拼接

图A:EcoRI,MluI双酶切电泳图。1、2:两pIRES-RhD-HBsAg克隆,M:DL2000;图B:XbaI、SalI双酶切电泳图。1、2:两pIRES-RhD-HBsAg克隆,M:DL2000
图3 质粒的酶切与鉴定
2.3 RhD及HBsAg检测结果
细胞用于RhD检测,WB结果见图4,条带大小约32 Kd,和RhD分子量大小一致。pIRES-RhD-HBsAg转染后的上清用于HBsAg的ELISA检测,结果表明转染后细胞有效表达并分泌HBsAg,结果见表4。

1、2:均为pIRES-RhD-HBsAg转染细胞,Lane3:pIRES转染细胞
图4 RhDWB检测结果
3 讨论
Rh血型系统的相关基因序列有着高度的同源性。Rh血型抗原活性是由红细胞表面的Rh蛋白和Rh相关糖蛋白组装而成的复合物所决定,它们分别受控于1号染色体上2个紧密连锁的RhD和RhCE基因,以及6号染色体上的RhAG基因,到2007年5月为止,使用基因分型技术检测出的等位基因已超过200个,其中RhCE座位上47个,RhD座位上145个,RhAG座位上13个[5]。
RhD变异体包含3类:弱D,部分D,DEL[6]。虽然这3类变异体的分子机理尚未完全明了,但是主要是由于RhD上的碱基位点发生突变,缺失,外显子的拼接发生错误,以及由于RhD和RhCE基因发生重组产生的,因此能够完整的高保真的扩增得到RhD的基因对于进一步研究RhD的抗原反应有着重要的意义。目前国内相关研究多是克隆RhD的部分功能区域,或者采用反转录的方法从RNA中获取RhD的基因,但是由于Rh系统相关基因的高度同源性并不能扩得完全一致的RhD基因,一般经序列比对只能达到97%-98%的匹配度。以这样的序列进行进一步的研究不能够得到非常可靠可信的结果。
传统方法从富含网织红的骨髓中提取RNA模板,进行扩增。本实验直接从普通红细胞中提取基因组DNA,采用外显子直接扩增后拼接的方法得到完整的RhD序列。实验原料更加容易获得,更适合普通实验室进行操作。
本实验采用pIRES双表达载体构建双基因克隆载体。pIRES能在细胞基因组外扩增并表达目的基因,具有多拷贝、强启动、操作方便等优点,它在体外转染细胞效率较高。具有巨细胞病毒启动子、脑心肌炎病毒的内部核糖体进入位点(internal ribosome entrysite,IRES),IRES连接两个开放阅读框,其转录产物在翻译时,核糖体能同时进入并开始翻译IRES上游及下游的两个转录子。两种基因可同时表达,表达的蛋白无需经过加工和修饰,具有天然的生物学活性。pIRES-RhD-HBsAg载体可以同时表达两种蛋白,通过检测上清液HBsAg的基因表达请况就可以了解膜蛋白RhD的基因转录情况。在本实验中我们进行了初步的转染实验,用构建的双表达载体转染K562细胞[7],经转染后通过商品化HBsAg的ELISA检测试剂盒检测上清可以很明确的检测到HBsAg的表达,且检测到RhD抗原的表达。
本研究对RhD全序列进行了克隆表达,尚没有包括RhD基因的其他突变体和剪接体[8],但是为将来进一步进行RhD不同基因型的研究起到铺垫作用。本实验能够证明RhD的转录表达是成功。但是RhD的抗原活性还和其他一些Rh相关蛋白有着协同作用[9-11],这些作用尚不明确。这些都将是我们进一步研究和所要解决的问题。
[1]Vent ND,Reid Me.THe Rh blood group system:a review[J].Blood,2000,95:375.
[2]李翠莹,穆士杰,郑 岩.血型不规则抗体筛选在临床输血中的意义[J].第四军医大学学报,2002,23(24):2327.
[3]Daniels GL,Anstee DJ,Cartron JP,et al.ISBTworking party on terminology for red cell surface antigens [J ] .Vox Sang,2001,80:193.
[4]兰炯采,陈 强,孙 倩,等.RhD 基因外显子多态性观察[J].中国免疫学杂志,2000,16(5):284.
[5]Blumenfeld OO.Patnaik SK,Allelic genes of blood group antigens:a source of human mutations and cSNPs documented in the Blood Group Antigen Gene Mutation Database[J].Human Mutation,2004,23(1):8.
[6]李翠莹,穆士杰,郑 岩.血型不规则抗体筛选在临床输血中的意义[J].第四军医大学学报,2002,23(24):2327.
[7]严力行,许先国,朱发明,等.RhD 基因的克隆及其在K562 细胞中的表达[J].中国实验血液学杂志,2005,13(3):492.
[8]许先国,吴俊杰,洪小珍,等.鉴定9个新的RhD基因mRNA可变剪接体[J].遗传,2006,28(10): 1213.
[9]Mouro-Chanteloup I,D’Ambrosio AM,Gane P,et al.Cell-surface expression of RhD blood group polypeptide is posttranscriptionally regulated by the RhAG glycoproteinl[J].Blood,2002,100:1038.
[10]Beckmann R,Smythe JS,Anstee DJ,et al Coexpression of band 3 mutants and Rh polypeptide:differential effects of band 3 on the expression of the Rh complex containingD polypeptide and the Rh cornplex containing CcEe polypeptide[J].Blood,2001,97:2496.
[11]Mouro-Chanteloup I,Delaunay J,Gane P,et al Evidence that the red ceU skeleton protein 4.2 interacts with tlle Rh membrane complex member CD47[J].Blood,2003,101:338.
1007-4287(2016)11-1836-05
2016-02-19)
*通讯作者

