HIF-1α因子标记在卵巢恶性生殖细胞肿瘤组织中的表达及意义*
姚美珍 谭布珍
HIF-1α因子标记在卵巢恶性生殖细胞肿瘤组织中的表达及意义*
姚美珍①谭布珍①
目的:探讨缺氧诱导因子1α(HIF-1α)在卵巢恶性生殖细胞肿瘤中的表达及与临床病理特征的关系。方法:采用免疫组织化学技术检测56例卵巢恶性生殖细胞肿瘤组织和38例正常卵巢组织中HIF-1α的表达因子。结果:HIF-1α在卵巢恶性生殖细胞肿瘤组织中表达率为64.3%,明显高于正常卵巢组织的23.7%,比较差异有统计学意义( χ2=4.224,P<0.01)。结论:HIF-1α在缺氧环境下可促使肿瘤发生与发展,维持肿瘤生长,可作为临床监控卵巢恶性生殖细胞肿瘤发生、发展的一个生物学标志和基因治疗靶点。
卵巢恶性生殖细胞肿瘤; HIF-1α; 病理
First-author’s address:The Second Affiliated Hospital of Nanchang University,Nanchang 330006,China
卵巢恶性生殖细胞肿瘤是一种复杂而高度恶性的肿瘤,发展快,易复发,预后差,死亡率高。缺氧诱导因子-1(HIF-1)是在缺氧条件下广泛存在于哺乳动物和人体内的一种转录因子,由α和β两个亚基组成,对维持肿瘤细胞能量代谢、细胞增殖和血管生成具有很重要的作用,其中HIF-1α是决定HIF-1活性的缺氧调控亚基,可特异性的作用于氧反应通路,活性受氧浓度调节[1-2]。本研究采用免疫组化SP法,测定卵巢恶性生殖细胞肿瘤组织和正常卵巢组织中HIF-1α的表达,旨在探讨卵巢恶性生殖细胞肿瘤的HIF-1α表达及其与临床病理分型及分期之间的关系。
1 资料与方法
1.1一般资料 选择本院2012年1月-2015年7月手术治疗并经病理证实的卵巢恶性生殖细胞肿瘤患者组织标本56例和正常受试者卵巢组织标本38例,卵巢恶性生殖细胞肿瘤中包括卵巢内胚窦瘤16例,无性细胞瘤20例,未成熟畸胎瘤17例,胚胎癌3例;患者年龄12~36岁,平均23岁;按照2000年FIGO临床病理分期标准,Ⅰ期20例,Ⅱ期20例,Ⅲ期14例,Ⅳ期2例,Ⅰ、Ⅱ为早期,Ⅲ、Ⅳ期为晚期。正常卵巢组织受试者年龄15~35岁,平均24岁,均来自不孕症腹腔镜探查行卵巢活检手术,病理证实卵巢组织无异常者。两组年龄比较差异无统计学意义(P>0.05),具有可比性。
1.2方法 免疫组化SP法:石蜡切片脱蜡至水,3%的过氧化氢室温孵育10 min,微波修复,正常山羊血清封闭,滴加一抗(兔抗人缺氧诱导因子-1α单克隆抗体浓缩液),4 ℃过夜,依次滴加生物素标记二抗,辣根酶标记链霉卵白素工作液,DAB显色,复染,酒精脱水,二甲苯透明,封固。用已知阳性片作阳性对照,用PBS代替一抗作阴性对照。
1.3免疫组化结果判定标准 采用Fromovitz阳性细胞半定量分级法。HIF-1α阳性判定标准为肿瘤细胞的胞质或胞核内出现棕黄色颗粒。先根据阳性细胞占肿瘤细胞的百分数计分,≤5%为0分,6%~25%为1分,26%~50%为2分,51%~75%为3分,≥76%为4分;同时根据阳性细胞染色深浅计分:不着色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分。上述两项评分相加,0~1分为阴性(-);2~3分为弱阳性(+);4~5分为中度阳性(++);6~7分为强阳性(+++)[3-4]。
1.4统计学处理 采用SPSS 10.0软件对所得数据进行统计分析,计量资料用均数±标准差(±s)表示,比较采用t检验;计数资料以率(%)表示,比较采用 χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1卵巢恶性生殖细胞肿瘤组织与正常卵巢组织HIF-1α表达比较 HIF-1α在卵巢恶性生殖细胞肿瘤组织中表达率为64.3%,明显高于正常卵巢组织的23.7%,比较差异有统计学意义( χ2=4.224,P<0.01),见表1。
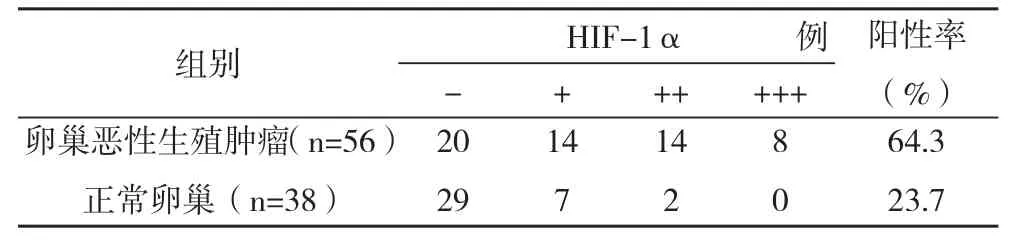
表1 卵巢恶性生殖细胞肿瘤组织与正常卵巢组织HIF-1α表达比较
2.2HIF-1α在不同病理类型的卵巢恶性生殖细胞肿瘤中的表达 不同病理类型的卵巢恶性生殖细胞肿瘤中恶性程度高、预后差的卵黄囊瘤、未成熟畸胎瘤及胚胎癌HIF-1α表达高于恶性程度低、预后较好的无性细胞瘤,比较差异有统计学意义(H=27.081,P=0.000),见表2。
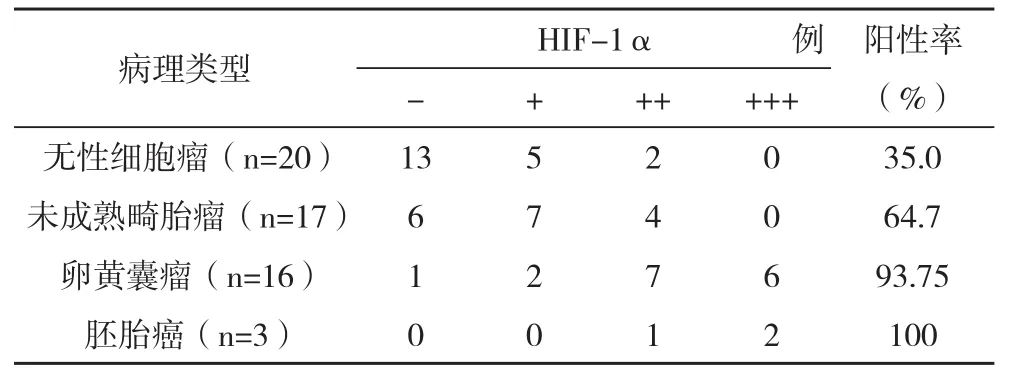
表2 HIF-1α在不同病理类型的卵巢恶性生殖细胞肿瘤中的表达
2.3HIF-1α在不同临床分期的卵巢恶性生殖细胞肿瘤中的表达 HIF-1α在晚期(Ⅲ~Ⅳ期)卵巢恶性生殖细胞肿瘤中阳性率为100%,明显高于早期(Ⅰ~Ⅱ期)的50%,比较差异有统计学意义( χ2=3.176,P=0.001),见表3。
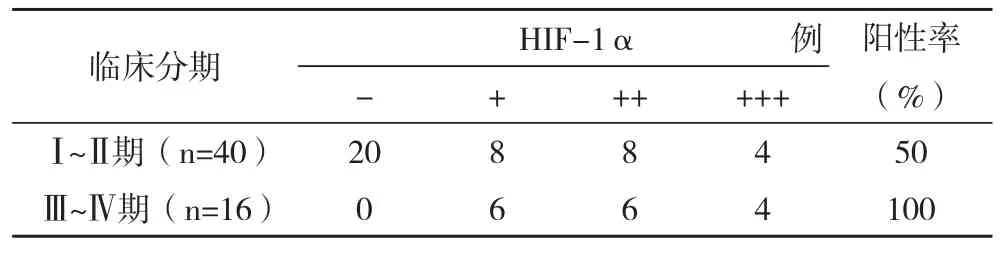
表3 HIF-1α在不同临床分期的卵巢恶性生殖细胞肿瘤中的表达
3 讨论
对人类肿瘤标本的免疫组化分析显示,在大多数肿瘤中HIF-1α呈过度表达,Zhong等[5]利用HIF-1α单克隆抗体检测了HIF-1α在多种肿瘤中的表达,发现90%的结肠癌、肺癌及前列腺癌等癌组织中表达升高,而在肿瘤附近正常组织中没有或仅有弱阳性表达;Birner等[6]宫颈癌的研究中也得到类似的结果。本研究显示卵巢恶性生殖细胞肿瘤组织中HIF-1α的阳性表达率明显高于正常卵巢组织(P<0.05),说明HIF-1α可促进肿瘤的发生;樊利芳等[7]用免疫组织化学方法研究HIF-1α在肺癌中的表达,发现其与临床分期,有无转移呈正相关;文献[8]显示对206例淋巴结转移阳性的乳腺癌标本的HIF-1α表达进行分析,免疫组化显示HIF-1α阳性表达率为76.2%(157/206)。本研究显示在卵巢恶性生殖细胞肿瘤中的表达明显高于正常卵巢组织,恶性程度高、预后差的卵黄囊瘤、未成熟畸胎瘤、胚胎癌中的HIF-1α阳性表达率明显高于恶性度低的、预后较好的无性细胞瘤;Ⅲ~Ⅳ期卵巢恶性生殖细胞肿瘤组织的HIF-1α的阳性表达率明显高于Ⅰ~Ⅱ期(P<0.05),表明HIF-1α可提示肿瘤的高度侵袭性。
综上所述,笔者认为HIF-1α在缺氧环境可促进肿瘤发生与发展,维持肿瘤生长,故可作为临床监控卵巢恶性生殖细胞肿瘤发生、发展的一个生物学标志,作为基因治疗的靶点。抑制HIF-1α蛋白的表达及转录活性,有望成为一种新的治疗恶性肿瘤的途径[9-15]。
[1]连利娟.林巧稚妇科肿瘤学[M].3版.北京:人民卫生出版社,1999:508-516.
[2]宗建春,吴诚义.HIF-1的生物学机制及在肿瘤研究中的进展[J].重庆医学,2004,33(5):780.
[3] Fromowitz F B,Voila M V,Chao S,et al.Res P21 the expression in the progression of breast cancer[J].Human Pathol,1987,18(12):1268.
[4] Weidner,N,Folkman J,Pozza R,et al.Tumor angiogenesis a new significant and independent prognostic factor in earlystage breast carcinoma[J].Journal of the National Cancer Institute,1992,84(24):1875-1887.
[5] Zhong H,De-Marzo A M,Laughner E,et al.Over expression of hypoxia inducible factor-1 alpha in common human cancers and their metastases[J].Cancer Res,1999,59(22):5830-5835.
[6] Birner P,Schindl M,Obermair A,et al.Overexpression of hypoxia-inducible factor 1α is a marker for an unfavorable prognosis in early-stage invasive cervical cancer[J].Cancer Res,2000,60(16):4693-4696.
[7]樊利芳,刁路明,陈德基,等.肺癌组织中缺氧诱导因子-1α的表达及其与凋亡和增殖的关系[J].癌症,2002,21(3):254-258.
[8] Folkman J.Tumor angiogenesis:therapeutic implications[J].N Engl J Med,1971,285(21):1182-1186.
[9] Schindl M,Schoppmann S F,Samonigg H,et al.Over expression of hypoxia-inducible factor 1α is associated with an unfavorable prognosis in lymph node-positive reast cancer[J].Clin Cancer Inst,2002,8(6):1831-1837.
[10] Quackenbush E J,Letarte M.Identification of several cell surface proteins of non-T,non-B acute lymphoblastic leukemia by using monoclonal antibodyies[J].Journal of Immunology,1985,134(2):1276-1285
[11] Fonsatti E,Del Vecchio L,Altomonte M,et al.Encloglin:an accessory unotherapeutic potential in human malignancies[J].J Cell Physiol,2001,15(26):1420-1425.
[12] Sumi T,Ishiko O,Yoshida H,et al.Expression of cyclooxygenase-2 in ovarian mature cystic teratomas with malignant transformation[J].Int J Mol Med,2001,8(5):495-498.
[13] Gaffney D K,Haslam D,Tsodikov A,et al.Epidermal growth factor receptor(EGFR)and vascular endothelial growth factor(VEGF) negatively affect overall survival in carcinoma of the cervix treated with radiotherapy[J].Int J Radiat Oncol Biol Phys,2003,56(4):922-928.
[14] Li C.CD105 is a Biomarker for Colorectal Cancer Prognosis[J]. Cancer Weekly,2003,15(7):42-44.
[15] Totzke G,Schulze-Osthoff K,Janicke R U.Cyclooxygenase-2 inhibitors sensitize tumor specifically to death receptor-induced apoptosis independently of COX-2 cells inhibition[J].Oncogene,2003,22(39):8021-8030.
The Expression and Significance of HIF-1α Marker in Malignant Ovarian Germ Cell Tumor Tissues/
YAO Mei-zhen,TAN Bu-zhen.//
Medical Innovation of China,2016,13(30):111-113
Objective:To investigate the expression of hypoxia inducible factor 1α(HIF-1) in ovarian malignant germ cell tumors and its relationship with clinicopathological features.Method:Immunohistochemical technique was used to detect the expression of HIF-1α in 56 cases of ovarian malignant germ cell tumor and 38 cases of normal ovarian tissue.Result:The expression rate of HIF-1α in ovarian malignant germ cell tumor was 64.3%,which was significantly higher than 23.7% of normal ovarian tissue,the difference was statistically significant( χ2=4.224,P<0.01).Conclusion:HIF-1α promote tumor occurrence and development,maintain tumor growth,can be used as a clinical monitoring of malignant ovarian germ cell tumor biological sign of development and a target for gene therapy.
Malignant ovarian germ cell tumor; Hypoxia inducible factor 1α; Pathology
10.3969/j.issn.1674-4985.2016.30.031
江西省卫生厅课题(20073085)
①南昌大学第二附属医院 江西 南昌 330006
姚美珍
(2016-08-08) (本文编辑:李颖)

