UPLC-Q-TOF/MS技术结合诊断离子方法快速分析连钱草中黄酮类化合物
李 伟,冯育林,黎田儿,吴 欢,李 艳,钟国跃,吴 蓓,何明珍
(1.江西中医药大学中药固体制剂制造技术国家工程研究中心,江西 南昌 330006;2.江西省南昌市食品药品检验所,江西 南昌 330029)
UPLC-Q-TOF/MS技术结合诊断离子方法快速分析连钱草中黄酮类化合物
李 伟1,冯育林1,黎田儿1,吴 欢1,李 艳1,钟国跃1,吴 蓓2,何明珍1
(1.江西中医药大学中药固体制剂制造技术国家工程研究中心,江西 南昌 330006;2.江西省南昌市食品药品检验所,江西 南昌 330029)
建立了超高效液相色谱-串联四极杆飞行时间质谱(UPLC-Q-TOF/MS)技术结合诊断离子法快速分析连钱草中黄酮类化合物。采用信息依赖型的扫描(IDA)模式,在电喷雾负离子模式下分析黄酮标准化合物的裂解规律及特征碎片离子信息,并以标准物质的特征碎片离子作为诊断离子,全面鉴别连钱草中的黄酮类成分。在连钱草中共鉴别出35个黄酮类化合物,其中有25个化合物为在该植物中首次发现;除白杨素、芹菜素、毛蕊异黄酮、木犀草素、山奈酚、槲皮素外,其他化合物均以黄酮苷的形式存在。该方法可为连钱草的质量控制及药效学研究提供技术支持。
超高效液相色谱-串联四极杆飞行时间质谱(UPLC-Q-TOF/MS);诊断离子;连钱草;黄酮
连钱草又名活血丹、透骨消,为唇形科多年生草本植物活血丹(Glechomalongituba(Nakai)Kupr.)的干燥地上部分[1],是贵州、云南等地苗族习用药材[2],除西北地区外,在全国各地均有分布[3]。现代药理学研究表明,连钱草对金黄色葡萄球菌极度敏感,对痢疾杆菌、绿脓杆菌和伤寒杆菌中度敏感,具有抗炎、抑菌、降血糖、降胆固醇等药理活性[4-6]。连钱草中含有挥发油[7]、有机酸类[8]、萜类[9-10]和黄酮类[11-12]化学成分,目前已报道了大波斯菊苷、芦丁、槲皮素、芹菜素、木犀草素、木犀草苷等黄酮类化合物,但仍有许多未知的黄酮类成分未见报道。为了明确连钱草的药效活性物质基础和作用机制,有必要全面分析连钱草的化学成分。
确定中药材中未知化学成分常用的方法是对药材进行提取分离纯化,得到化合物单体成分后,进行核磁共振波谱解析,进而得到化合物准确的结构信息。虽然该方法的准确性高,但试剂消耗量大、过程繁琐、耗时较长,且不能满足痕量分析的要求。近年来,超高效液相色谱-串联四极杆飞行时间质谱(UPLC-Q-TOF/MS)技术结合了超高效液相色谱的分离能力和高分辨质谱的高灵敏度和高精确度,能够实现复杂体系中化学成分的高通量分析[13-17],在中药复杂成分定性分析方面得到广泛应用[18-19]。UPLC-Q-TOF/MS技术结合数据依赖性型扫描模式(IDA)能够得到化合物高质量精度的一级质谱和二级质谱信息。根据化合物的一级质谱信息确定化合物的分子式,从Chemspider等数据库中筛选出候选化合物[20];根据化合物的二级质谱信息进一步确定化合物的母核结构、特征官能团等,从而快速筛选或推测目标化合物。由于具有相同结构的化合物在质谱中有相似的裂解规律和特征碎片,因此总结黄酮标准物质的裂解规律,并以其特征碎片离子作为诊断离子,有利于黄酮类未知化合物的质谱解析。
本实验将采用UPLC-Q-TOF/MS技术,以具有代表性的黄酮标准化合物裂解规律和特征碎片离子为诊断信息,结合SciFinder、Chemspider、Massbank数据库的在线检索功能,全面解析连钱草中的黄酮类化合物,希望为连钱草的质量控制提供技术支持,同时为其药效学研究奠定物质基础。
1 实验部分
1.1 仪器
TripleTOF®5600高分辨质谱仪:美国AB Sciex公司产品,配有Analyst TF1.6和Peakview1.2数据处理系统;LC-30AD超高效液相色谱仪:日本岛津公司产品;KQ250DB型数控超声波清洗器:巩义市予华仪器有限责任公司产品。
1.2 材料及试剂
连钱草药材:购于贵州,经江西省南昌市食品药品检验所主管药师吴蓓鉴定为唇形科活血丹(Glechomalongituba(Nakai)Kupr.)干燥地上部分;木犀草素(批号:111520-200504)、木犀草苷(批号:111720-201408)、山萘酚(批号:110861-200808)、紫云英苷(批号:110080-201307)、槲皮素(批号:111538-201105)、芦丁(批号:100080-201409)对照品:购自中国食品药品检验所;甲醇、乙腈(色谱纯):美国Fisher公司产品;甲酸(色谱纯):美国Sigma-Aldrich公司产品;蒸馏水:屈臣氏集团产品;其余试剂均为分析纯。
1.3 供试品溶液的制备
取1 g连钱草药材粉末(过3号药筛),加入50 mL 60%甲醇,超声30 min,用0.45 μm滤膜过滤,滤液稀释100倍,过0.22 μm微孔滤膜,待测;用甲醇稀释对照品溶液,配制成浓度为100 μg/L的标准溶液。
1.4 实验方法
1.4.1 色谱条件 Acquity UPLC BEH C18柱(100 mm×2.1mm×1.7 μm);柱温30 ℃,体积流量0.4 mL/min;进样量2 μL;流动相:1‰甲酸水溶液(A相)-乙腈(B相);B相比例随时间变化为0~30 min、10%~20%B,30~70 min、20%~50%B,70~90 min、保持50%B相不变。
1.4.2 质谱条件 电喷雾离子源(ESI),负离子扫描模式,喷雾电压-4 500 V,温度600 ℃,气帘气压力1.72×105Pa,雾化气(GS1)和辅助气(GS2)压力均为3.45×105Pa,质量扫描范围m/z50~1 200,数据采集时间90 min,母离子触发的子离子扫描方式(TOF/MS-IDA-MS2),去簇电压-100 V,碰撞能量-40 eV,碰撞能量叠加10 eV。
2 结果与讨论
2.1 黄酮类标准物质的质谱裂解规律研究
按1.4.2节条件分别将6个黄酮类对照品溶液经进样针注入质谱仪中,采集数据并得到二级碎片离子后,总结黄酮类标准物质的裂解规律和特征碎片离子信息。6个黄酮类标准物质的结构式示于图1,二级质谱图示于图2。
2.1.1 黄酮苷元裂解规律及特征碎片离子
木犀草素,分子式为C15H10O6,母离子为[M—H]-m/z285.041 2。在二级质谱中,可以生成一系列的碎片离子,其中m/z241.049 9(C14H9O4-)比母离子少44 u,为木犀草素母核C环失去羰基后再失去氧原子的碎片离子;木犀草素母核发生RDA裂解,分别生成m/z151.003 8(C7H3O4-)和m/z133.029 5(C8H5O2-)碎片离子,其中m/z133.029 5由B环和C环上的残基组成,其丰度远大于m/z151.003 8。

图1 6个黄酮类化合物的结构式
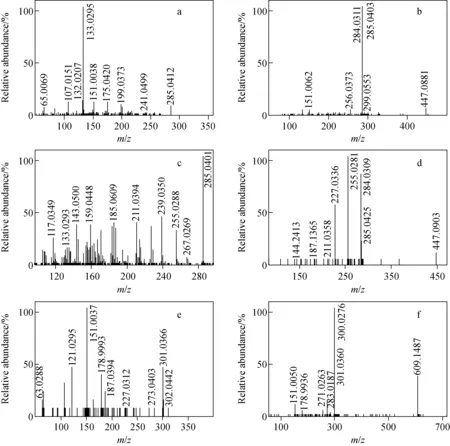
注:a.木犀草素;b.木犀草苷;c.山奈酚;d.紫云英苷;e.槲皮素;f.芦丁

槲皮素,分子式为C15H10O7,母离子[M—H]-m/z301.036 6。二级碎片离子m/z273.040 3(C14H9O6-)为C环上脱CO生成;m/z178.999 3(C8H3O5-)为槲皮素失去B环后再失去CH的碎片离子;m/z151.003 7为槲皮素RDA裂解形成的碎片离子。
综上所述,黄酮类化合物在质谱中容易失去C环中的羰基(-28 u)和氧原子(-16 u),且易发生RDA裂解生成m/z151.003 8碎片离子。其中,在具有黄酮醇结构的化合物中,m/z301.036 6、178.999 3可视为槲皮素母核的诊断离子,m/z285.040 1、255.028 8可视为山奈酚母核的诊断离子。
2.1.2 黄酮苷裂解规律及特征碎片离子
木犀草苷,分子式为C21H20O11,母离子[M—H]-m/z447.088 1,葡萄糖基在A环的7位羟基上,二级碎片离子中,出现了明显的苷元母核离子m/z285.040 3(C15H9O6-)和m/z284.031 1(C15H8O6·-)。根据有机化合物质谱裂解规律和氮规则可知,当化合物不含或含偶数个氮原子时,化合物的相对分子质量为偶数,其[M—H]-峰的质荷比一般为奇数,但在质谱中均裂形成的奇电子离子质荷比却为偶数。m/z284.031 1(C15H8O6·-)为葡萄糖均裂方式形成的碎片离子,其丰度小于异裂方式脱去葡萄糖后的碎片离子m/z285.040 3;m/z284.031 1(C15H8O6·-)可继续脱去C环羰基生成m/z256.037 3(C14H8O5·-);此外,还发现了黄酮母核RDA裂解碎片m/z151.006 2。
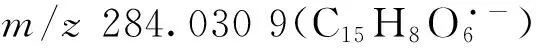

综上所述,在与黄酮苷元相同的碰撞能量下,黄酮苷中的基峰常为脱掉糖基后的苷元碎片。在黄酮醇类化合物的糖基中,中性碎片的丢失方式与苷键的位置有关[21-22]:若与苷键连接的糖为单糖,苷键位于A环酚羟基时,脱糖基常以异裂方式为主,生成质荷比为奇数的奇电子离子峰;当苷键位于C环醇羟基时,脱糖基常以均裂方式为主,生成质荷比为偶数的偶电子离子峰。苷元碎片离子的丰度大小可以作为判断苷元结构及糖基位置的重要诊断依据[23],但当与苷键连接的糖为双糖或多糖时,情况比较复杂[24]。常见的黄酮类化合物的诊断离子信息情况列于表1。
2.2 连钱草中黄酮类化合物的确认
按1.4节条件进样,采集连钱草样品数据,使用Peakview1.2软件分析,共鉴别出35个黄酮类化合物,其中有25个化合物为在该植物中首次发现,连钱草样品的总离子流图示于图3,鉴别结果列于表2。由于黄酮类化合物具有相同的母核,在质谱中具有相似的裂解规律,本实验选取具有代表性的化合物2、6、18、28、29、33、34,阐述其详细的解析过程。
化合物2:保留时间43.59 min,根据母离子[M—H]-m/z269.046 1,可得到化合物的分子式为C15H10O5。该化合物的母离子质荷比比木犀草素小16 u,且丰度最强的碎片离子m/z117.035 2(C8H5O-)也比木犀草素基峰碎片离子m/z133.029 5(C8H5O2-)小16 u,由此推测该化合物比木犀草素少1个羟基;在其二级碎片离子中,发现了黄酮RDA裂解碎片m/z151.003 0(C7H3O4-),经数据库检索,推测该化合物为芹菜素,其二级质谱图及裂解途径示于图4。
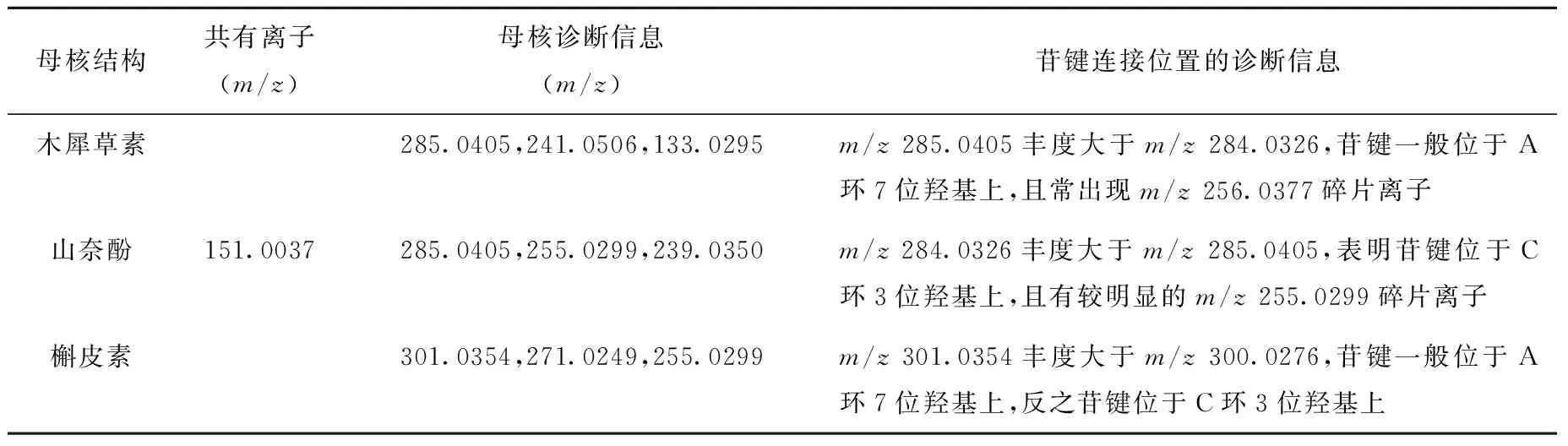
表1 常见黄酮类化合物的诊断离子
图3 UPLC/Q-TOF-MS分析连钱草的总离子流图
表2 连钱草中黄酮类化合物的鉴别结果
Table 2 Identification results of flavonoids compounds fromGlechomalongituba(Nakai) kupr

序号tR/min分子式母离子(m/z)误差/×10-6二级碎片离子(m/z)推断结果117.82C21H20O10431.09840.8268.0381,240.0474,211.0433,151.0049大波斯菊苷243.53C15H10O5269.0453-0.9227.0346,183.0445,149.0245,117.0356,107.0144芹菜素325.02C21H20O11447.0932-0.2285.0403,256.0373,151.0062木犀草素-7-O-葡萄糖苷418.55C27H30O16609.14864.1301.0365,300.0280,271.0253,255.0305芦丁537.67C15H10O7301.03571.3151.0027,121.0299,107.0126槲皮素6*40.25C27H30O15593.15414.9533.1225,503.1189,473.1070,383.0800,353.1070夏佛托苷7*12.84C26H28O14563.14422.6473.1089,443.1047,383.0806,353.0662异夏佛托苷825.02C21H20O11447.0932-0.2285.0403,227.0390,151.0062木犀草苷9*44.57C15H10O6285.04060.5255.0288,239.0350,227.0339,211.0344,185.0609,171.0446山柰酚10*1.14C15H10O4253.0500-2.5209.0666,143.0502,119.0480白杨素1119.42C27H26O17621.11142.7351.0581,269.0455,193.0361海常素12*30.16C21H18O11445.07790.6269.0455,225.0552黄芩苷13*10.29C27H26O18637.10884.5351.0586,285.0417,193.0365,175.0252,113.0241木犀草素-3',7-二-O-葡糖醛酸14*10.29C27H26O18637.10883.7461.0764,285.0415,257.0439木犀草素-3',7-二-O-葡糖苷酸15*32.45C24H22O14533.09594.2489.1066,447.0965,327.0512,285.0410木犀草素-7-O-6″-丙二酰基葡萄糖苷1627.92C21H18O12461.07254285.0418,284.0328,255.0288,239.0350,227.0339山柰酚-3-葡萄糖醛酸甙

续表2

续表2
注:*表示连钱草中首次检出的化合物
化合物6:保留时间40.25 min,根据母离子[M—H]-m/z593.151 2,可得到化合物的分子式为C27H30O15。在该化合物的二级质谱图中,可以发现比母离子小60 u(m/z533.122 5、C25H25O13-)、90 u(m/z503.118 9,C24H23O12-)、120 u(m/z473.128 9,C23H21O11-)等一系列的特征碎片离子。m/z473.107 0继续失去90 u、120 u,分别得到m/z383.080 0(C20H15O8-)和m/z353.107 0(C19H13O7-)碎片离子,这与碳苷的裂解规律非常相似[25],故推测该化合物可能为碳苷,且有两分子的葡萄糖(中性丢失162.052 8 u)与苷元相连。该化合物苷元的相对分子质量为269.048 5(C15H19O5-),推测其可能为芹菜素的双糖碳苷。根据这些信息,经检索数据库,推断该化合物为夏佛托苷,其二级质谱图及裂解途径示于图5。
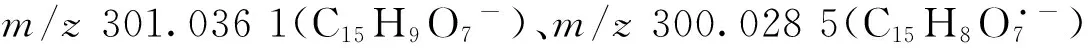
化合物28:保留时间22.02 min,根据母离子[M—H]-m/z577.164 2,可得到化合物的分子式为C27H30O14。该化合物的特征碎片离子m/z431.100 0(C21H19O10-)和m/z285.041 0(C15H9O6-)分别为母离子依次脱去鼠李糖(中性丢失146.057 9 u)生成的碎片;m/z431.100 0丰度小于m/z430.092 5(C21H18O10·-),表现出明显的黄酮醇苷结构特征,由此推测其有一分子的鼠李糖连接在C环羟基上;m/z285.041 0和m/z255.031 0(C14H7O5-)也显示苷元母核为黄酮醇结构,推测其苷元为山奈酚。根据以上信息,经数据库检索,推测该化合物为山奈苷,其二级质谱图及裂解途径示于图7。

图4 芹菜素的二级质谱图(a)及其裂解途径(b)

图5 夏佛托苷的二级质谱图(a)及其裂解途径(b)
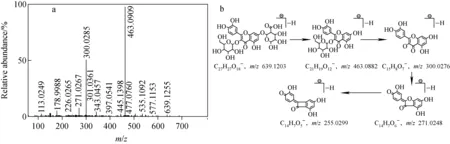
图6 槲皮素3-O-β-葡萄糖苷-7-O-β-葡萄糖苷酸的二级质谱图(a)及其裂解途径(b)
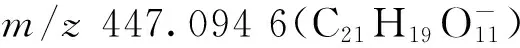
化合物33:保留时间18.55 min,根据母离子[M—H]-m/z609.152 2,可得到化合物的分子式为C27H30O16。在特征碎片离子中,m/z463.092 1(C21H19O12-)为母离子脱去一分子鼠李糖后的碎片,继续脱去鼠李糖得到m/z317.031 7(C15H9O8-)碎片离子;由于该化合物的2个糖基相同,无法确定糖的连接方式,但因m/z463.092 1的丰度较强,可推测2个鼠李糖连接在苷元的不同位置;m/z316.023 7(C15H8O8·-)的丰度较m/z317.031 7强,且出现了m/z271.025 2(C14H7O6·-)和m/z178.999 4碎片离子,表明该化合物具有槲皮素母核结构;m/z317.031 7较槲皮素母离子[M—H]-m/z301.036 6(C15H9O7-)多16 u,说明该化合物的苷元结构比槲皮素多1个羟基;根据A环与B环残基形成的一系列碎片离子m/z178.999 4(C8H3O5-)、m/z163.005 3(C8H3O4-)和m/z151.002 7(C7H33-),推测该羟基可能位于B环上。经数据库检索,推测该化合物为杨梅素-3,7-O-二鼠李糖苷,其二级质谱图及裂解途径示于图9。
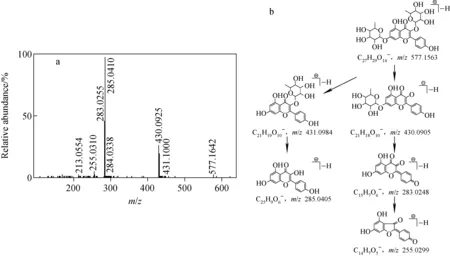
图7 山奈苷的二级质谱图(a)及其裂解途径(b)

图8 银锻苷的二级质谱图(a)及其裂解途径(b)
化合物34:保留时间12.37 min,根据母离子[M—H]-m/z625.153 2,可得到化合物的分子式为C27H30O17。在特征碎片离子中,m/z479.083 5(C21H19O13-)为母离子脱去一分子鼠李糖后的碎片,m/z463.092 1(C21H19O12-)为母离子脱去一分子葡萄糖后的碎片,由此可见,葡萄糖和鼠李糖在苷元上的位置不同;由苷元的碎片离子m/z317.030 1(C15H9O8-)、m/z316.024 0(C15H8O8·-)和m/z271.019 8(C14H7O6·-),推测该化合物的母核与化合物33相同,不同之处在于A环7位羟基上为葡萄糖。经数据库检索,推测该化合物为杨梅素-3-O-鼠李糖苷-7-O-葡萄糖苷,其二级质谱图及裂解途径示于图10。
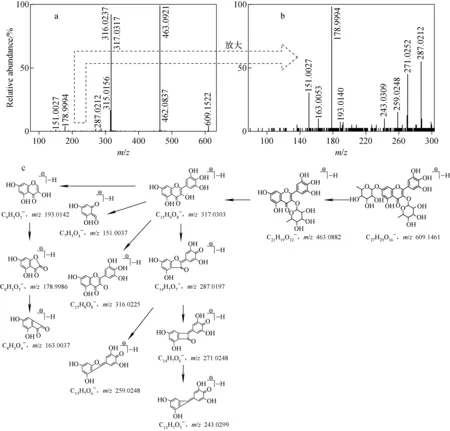
图9 杨梅素-3,7-O-二鼠李糖苷的二级质谱图(a)、局部放大图(b)及其裂解途径(c)
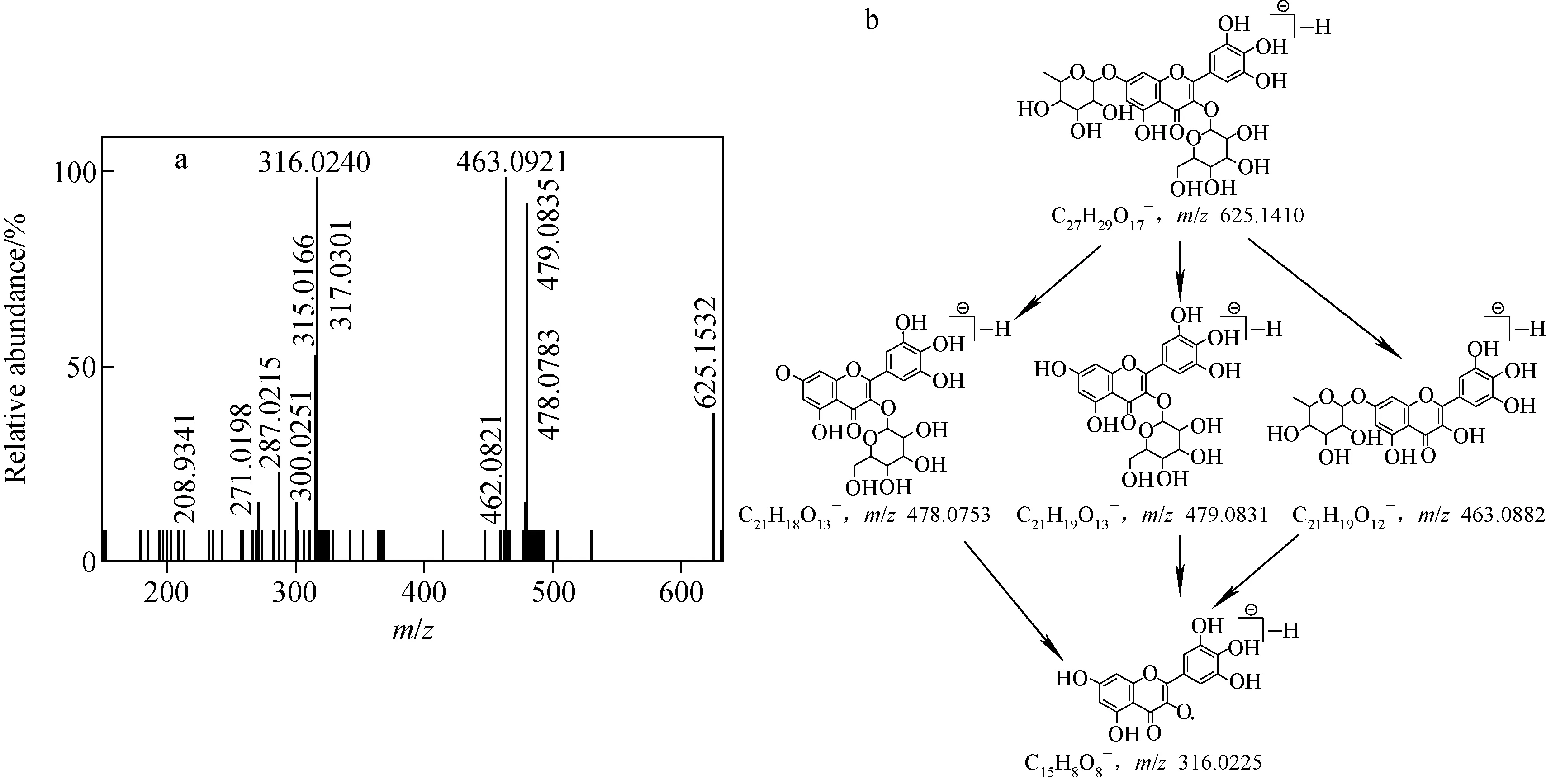
图10 杨梅素-3-O-鼠李糖苷-7-O-葡萄糖苷的二级质谱图(a)及其裂解途径(b)
3 讨论
本研究采用UPLC-Q-TOF/MS技术分析连钱草中黄酮类化合物。由于具有相同结构的黄酮类化合物在质谱中表现出相同的裂解途径及特征碎片离子,故在采集连钱草样品前,分析了典型的黄酮标准物质的碎片裂解途径,以标准物质的特征碎片离子作为诊断信息,有利于同源未知化合物的解析。本实验共鉴别了连钱草中35个黄酮类化合物,其中有25个化合物为在该植物中首次发现。除白杨素、芹菜素、毛蕊异黄酮、木犀草素、山奈酚、槲皮素外,其他化合物均以黄酮苷的形式存在。该结果可为连钱草质量控制及药效研究奠定物质基础。
[1] 国家药典委员会. 中华人民共和国药典(一部)[M]. 北京:中国医药科技出版社,2015:275.
[2] 张前军,杨小生,朱海燕,等. 连钱草中三萜类化学成分[J]. 中草药,2006,37(12):1 780-1 781.
ZHANG Qianjun, YANG Xiaosheng, ZHU Haiyan, et al. Triterpenoid ofGlechomalongituba[J]. Chin Tradit Herbal Drugs, 2006, 37(12): 1 780-1 781(in Chinese).
[3] Editorial Board of Chinese Heral. State administration of traditional Chinese medicine,China. China Herbal[M] . Shanghai: Shanghai Scientific and Technical Publishers, 1999.
[4] 陶勇,石米扬. 连钱草的抑菌活性研究[J]. 中国医院药学杂志,2011,31(10):284-285.
TAO Yong, SHI Miyang. Antimicrobial activity of theGlechomalongituba[J]. Chin Hosp Pharm, 2011, 31(10): 284-285(in Chinese).
[5] 袁春玲,王佩琪,郭伟英. 连钱草的降血糖作用及其机制研究[J]. 中药药理与临床,2008,24(3):57-58.
YUAN Chunlin, WANG Peiqi, GUO Weiying. Study on effect and mechanism ofGlechomalongitubaon hypoglycemic action[J]. Chin Med Pharmaco Clinic, 2008, 24(3): 57-58(in Chinese).
[6] 葛少祥,彭代银,刘金旗,等. 连钱草治疗胆固醇结石的实验研究[J]. 中药材,2007,30(7):842-845.
GE Shaoxiang, PENG Daiyin, LIU Jinqi, et al. Study on treatment of cholesterol gallstones byGlechomalongituba[J]. Chin Med Mat, 2007, 30(7): 842-845(in Chinese).
[7] 樊钰虎,周刚,张璐,等. 连钱草挥发油化学成分的气相色谱-质谱分析[J]. 中国实验方剂学杂志,2010,16(13):41-44.
FAN Yuhu, ZHOU Gang, ZHANG Lu, et al. Analysis on chemical components of volatile oils fromGlechomalongitubaby gas chromatography-mass spectrometry[J]. Chin Exp Tradit Med Form, 2010, 16(13): 41-44(in Chinese).
[8] 张前军,杨小生,朱海燕,等. 连钱草中有机酸成分研究[J]. 天然产物研究与开发,2006,18(增刊):55-56.
ZHANG Qianjun, YANG Xiaosheng, ZHU Haiyan, et al. Organic acids ofGlechomalongituba[J]. Nat Prod Res Dev, 2006, 18(Suppl): 55-56(in Chinese).
[9] ZHANG Q J, YANG X S, ZHU H Y, et al. A novel sesquiterpenoid fromGlechomalongituba[J]. Chin Chem Lett, 2006, 17(3): 355-357.
[10]ZHU Y D, ZOU J, ZHAO W M. Two new monoterpenoid glycosides fromGlechomalongituba[J]. J Asian Nat Prod Res, 2008, 10(2): 199-204.
[11]杨念云,段金廒,李萍,等. 连钱草中的黄酮类化学成分[J]. 中国药科大学学报,2005,36(3):210-212.
YANG Nianyun, DUAN Jin’ao, LI Ping ,et al. Flavonoids fromGlechomalongituba(Nakai) Kupr[J]. J China Pharm U, 2005, 36(3): 210-212(in Chinese).
[12]杨念云,段金廒. 连钱草的化学成分研究[J]. 药学学报,2006,41(5):431-434.
YANG Nianyun, DUAN Jin’ao. Chemical constituents ofGlechomalongituba[J]. Acta Pharmaceutica Sinica, 2006, 41(5): 431-434(in Chinese).
[13]钟艳梅,冯毅凡,郭姣. 基于UPLC/Q-TOFMS技术的白术药材化学成分快速识别研究[J]. 质谱学报,2015,36(1):72-77.
ZHONG Yanmei, FENG Yifan, GUO Jiao. Rapid identification of components fromAtractylodismacrocephalaeRhizomaBaed on UPLC/Q-TOF MS[J]. Journal of Chinese Mass Spectrometry Society, 2015, 36(1): 72-77(in Chinese).
[14]AZNAR M, RODRIGUEZ-LAFUENTE A, ALFARO P, et al. UPLC-Q-TOF-MS analysis of non-volatile migrants from new active packaging materials[J]. Anal Bioanal Chem, 2012, 404(6/7): 1 945-1 957.
[15]WONG M C Y, LEE W T K, WONG J S Y, et al. An approach towards method development for untargeted urinary metabolite profiling in metabonomic research using UPLC/Q TOF MS[J]. J Chromatogr B, 2008, 871(2): 341-348.
[16]SHI F, GUO C, GONG L, et al. Application of a high resolution benchtop quadrupole-Orbitrap mass spectrometry for the rapid screening, confirmation and quantification of illegal adulterated phosphodiesterase-5 inhibitors in herbal medicines and dietary supplements[J]. J Chromatogr A, 2014, 1 344(6): 91-98.
[17]LI W, XING W, WANG S, et al. An online coupled peritoneal macrophage/cell membrane chromatography and high-performance liquid chromatography/mass spectrometry method to screen for anti-inflammatory components from the Chinese traditional medicineChloranthusmultistachysPei[J]. Biomed Chromatogr, 2013, 27(11): 1 580-1 586.
[18]LI L, LUO G A, LIANG Q L, et al. Rapid qualitative and quantitative analyses of Asian ginseng in adulterated American ginseng preparations by UPLC/Q-TOF-MS[J]. J Pharm Biomed Anal, 2010, 52(1): 66-72.
[19]MA Z C, ZHOU S S, LIANG Q D, et al. UPLC-TOF/MS based chemical profiling approach to evaluate toxicity-attenuated chemical composition in combination of ginseng and Radix Aconiti Praeparata[J]. Acta Pharm Sin, 2011, 46(12): 1 488-1 492.
[20]WU H X, YANG C Y, WANG Z H, et al. Metabolism profile of quinocetone in swine by ultra-performance liquid chromatography quadrupole time-of-flight mass spectrometry[J]. Eur J Drug Metab Pharmacokinet, 2012, 37(2): 141-154.
[21]ABLAJAN K, ABLIZ Z, SHANG X Y, et al. Structural characterization of flavonol 3,7-di-O-glycosides and determination of the glycosylation position by using negative ion electrospray ionization tandem mass spectrometry[J]. J Mass Spectrom, 2006, 41(3): 352-360.
[22]MARCH R E, LEWARS E G, STADEY C J, et al. A comparison of flavonoid glycosides by electrospray tandem mass spectrometry[J]. Int J Mass Spectrum, 2006, 248(1/2): 61-85.
[23]CUYCKENS F, CLAEYS M. Mass spectrometry in the structural analysis of flavonoids[J]. J Mass Spectrom, 2004, 39(1): 1-15.
[24]HVATTUM E, EKEBERG D. Study of the collision-induced radical cleavage of flavonoid glycosides using negative electrospray ionization tandem quadrupole mass spectrometry[J]. J Mass Spectrom, 2003, 38(1): 43-49.
[25]刘建群,舒积成,张锐,等. 新西兰牡荆苷等4 种碳苷黄酮的电喷雾质谱裂解规律研究[J]. 中国实验方剂学杂志,2013,19(8):72-76.
LIU Jianqun, SHU Jicheng, ZHANG Rui, et al. Study on the four flavone-C-glycosides by electrospray ionization tandem mass spectrometry[J]. Chin Exp Tradit Med Form, 2013, 19(8): 72-76(in Chinese).
Rapid Analysis on Flavonoids inGlechomalongituba(Nakai) Kupr by UPLC-Q-TOF/MS Couple with Diagnostic Ions
LI Wei1, FENG Yu-lin1, LI Tian-er1, WU Huan1, LI Yan1,ZHONG Guo-yue1, WU Bei2, HE Ming-zhen1
(1.NationalPharmaceuticalEngineeringCenterforSolidPreparationinChineseHerbalMedicine,JiangxiUniversityofTraditionalChineseMedicine,Nanchang330006,China;2.NanchangFoodandDrugInspectionInstitute,Nanchang330029,China)
With the modernization of Chinese medicine, the development of effective quality control method for Chinese herbs is one of the key scientific problems in the future. A method of high performance liquid chromatography-time-of-fight mass spectrometry (UPLC-Q-TOF/MS) couple with diagnostic ions under negative mode of ESI was developed for analyzing flavonoids inGlechomalongituba(Nakai) Kupr. An information dependent acquisition (IDA) mode was used to acquire high-precision mass spectrometric data for comprehensive profiling of constituents fromGlechomalongituba(Nakai) Kupr. Both precursor ions and corresponding fragment ions (mass deviation are less than 5×10-6) were simultaneously generated in negative mode. The precursor ions showing chemical formula could provide candidate compounds by querying the relevant database. Some database, such as Massbank, SciFinder, Chemspider, were used to quickly screen the possible compounds inGlechomalongituba(Nakai) Kupr. The characteristic groups and structure information were obtained by analyzing fragment ions, and that was very important to select out target ingredients form candidate compounds. The results show that a total of 35 flavonoids are identified, and 25 of which flavonoids are identified for the first time fromGlechomalongituba(Nakai) Kupr. In addition to chrysin, apigenin, isoflavone, luteolin, kaempferol and quercetin, all the other compounds are flavonoid glycosides. The method can provide the technical support and material basis for pharmacodynamics research and quality control ofGlechomalongituba(Nakai) Kupr.
high performance liquid chromatography-time-of-fight mass spectrometry (UPLC-Q-TOF/MS); diagnostic ions;Glechomalongituba(Nakai) Kupr; flavonoids
2015-12-22;
2016-03-18
江西民族传统药现代科技与产业发展协同创新中心开放基金项目资助
李 伟(1989—),男(汉族),江西上饶人,硕士研究生,药物化学专业。E-mail: liwei6308402@163.com
何明珍(1977—),女(瑶族),广西恭城人,讲师,从事天然药物活性成分及体内代谢研究。E-mail: hmz07@163.com
吴 蓓(1976—),女(汉族),江西南昌人,副主任药师,从事药学研究。E-mail: wubei8@163.com
时间:2016-07-05;
http:∥www.cnki.net/kcms/detail/11.2979.TH.20160705.1349.020.html
O657.63
A
1004-2997(2016)06-0504-13
10.7538/zpxb.youxian.2016.0028

