UPLC-HRMSn结合高能诱导裂解快速鉴定麦冬中高异黄酮类成分
王子健,刘 颖,刘思燚,李 宁,卢建秋,张加余
(1.北京中医药大学北京中医药研究院,北京 100029;2.香港科技大学深圳研究院,广东 深圳 518057;3.北京中医药大学图书馆,北京 100029)
UPLC-HRMSn结合高能诱导裂解快速鉴定麦冬中高异黄酮类成分
王子健1,刘 颖1,刘思燚1,李 宁2,卢建秋3,张加余1
(1.北京中医药大学北京中医药研究院,北京 100029;2.香港科技大学深圳研究院,广东 深圳 518057;3.北京中医药大学图书馆,北京 100029)
应用UPLC-LTQ-Orbitrap法快速鉴定麦冬药材中高异黄酮类化合物,考察不同高能诱导裂解(HCD)能量下高异黄酮的裂解情况,优选特征碎片离子对进行鉴定,并探索麦冬中高异黄酮类成分的裂解规律。应用该方法在麦冬提取物中鉴定出68个高异黄酮类成分,其中包括26个高异黄酮成分,31个高异黄烷酮成分,11个高异黄酮糖苷类成分。结果表明,HCD模式能够提供丰富稳定的裂解碎片离子信息,结合UPLC-LTQ-Orbitrap技术能够快速准确地鉴定复杂组分中高异黄酮类成分,可为中药系列成分研究提供有价值的方法参考。
麦冬;高异黄酮;高能诱导裂解(HCD);UPLC-LTQ-Orbitrap;质谱裂解
麦冬(Radix Ophiopogonis)是百合科沿阶草属植物麦冬(Ophiopogonjaponicus(L.f) KerGawl)的块根,是常用中药。高异黄酮类化合物是麦冬中特有的一类成分,已被证明具有广泛的生物学活性,如雌激素样作用、抗炎、抑制磷酸化等[1]。
目前,对麦冬中高异黄酮类成分的分析主要采用柱色谱法分离得到单一产物,然后经核磁共振(NMR)鉴定以及HPLC-MS/MS分析。但提取分离过程耗时费力,且不能整体表征麦冬中高异黄酮类成分。同时,由于麦冬药材中含有的高异黄酮类成分数量众多、结构类似、同分异构体难以区分且含量相差悬殊,目前采用的液质联用方法对其物质基础研究尚不深入[2-5],无论是色谱分离度还是质谱碎片信息准确度都有待进一步提升[4-5]。
超高效液相色谱-质谱法(UPLC-MS)结合了超高效液相色谱的快速分离能力和质谱的高灵敏度、高专属性的检测能力,现已成为中药复杂体系成分结构鉴定的常用方法[6-9]。线性离子阱-串联静电轨道阱(LTQ-Orbitrap)的高分辨质谱仪可提供高分辨(分辨率最高达100 000)的相对分子质量和丰富的碎片信息。同时,高能诱导裂解(higher energy collision induced dissociation, HCD)相对于常规的碰撞诱导裂解(collision induced dissociation, CID)可提供更稳定的高能裂解方式,不会发生CID裂解中的低质量碎片丢失(cut-off)效应,一次高能碎裂反应即可获得化合物全面的碎片信息,可明显提高化合物的鉴定效率[10]。
本工作通过对比不同水平裂解能量下的高分辨质谱信息,优化分析条件,并结合该类化合物的HCD质谱裂解规律,对麦冬药材中高异黄酮类成分进行筛选和表征,希望为麦冬药效成分的快速发现提供依据。
1 实验部分
1.1 仪器与装置
Accele 600 Pump高效液相色谱仪和LTQ-Orbitrap XL线性离子阱-串联静电轨道场质谱仪:美国Thermo Fisher公司产品,配有电喷雾离子源(ESI)和Xcalibur 2.1工作站;KQ-250DE 型数控超声波清洗器:昆山市超声仪器有限公司产品;Millipore Synergy UV 型超纯水机:美国Millipore公司产品;R200D型电子分析天平(十万分之一):德国 Sartorius公司产品。
1.2 药材与试剂
麦冬药材:购自北京同仁堂药店,经北京中医药大学谭鹏副教授鉴定为百合科植物麦冬Ophiopogonjaponicus(Thunb.) Ker Gaw l. 的干燥块根;高异黄酮对照品(5,7,4′-三羟基-6-甲基二氢高异黄酮、麦冬二氢高异黄酮A、甲基麦冬二氢高异黄酮B、甲基麦冬二氢高异黄酮A、5,7,2′-三羟基-4′-甲氧基-6,8-二甲基二氢高异黄酮和麦冬二氢高异黄酮E):均为本实验室从麦冬药材中分离而得,纯度大于95%;甲醇、乙腈和甲酸:均为色谱纯,美国Thermo Fisher公司产品;实验用水:Millipore超纯水。
1.3 麦冬提取物的制备
称取500 g麦冬药材,粉碎成粗粉,加75%乙醇回流提取2次,合并得到的乙醇提取液,减压浓缩至无醇味后,放置至室温;将其注入NKA大孔吸附树脂柱,水洗至无糖反应,用80%乙醇洗脱,收集洗脱液,减压回收乙醇,经真空干燥后,即得麦冬提取物。
1.4 溶液的配制
1.4.1 标准品的制备 分别称取适量的上述标准品,精密称定,加入80%甲醇超声溶解,配制成1 mg/L混合溶液。
1.4.2 供试品溶液的制备 精密称取0.2 g麦冬提取物,加入25 mL 80%甲醇,超声提取30 min,静置冷却后,取上清液,过0.22 μm微孔滤膜,即得供试品溶液。
1.5 实验条件
1.5.1 色谱条件 色谱柱:Waters Acquity UPLC BEH C18柱(2.1 mm×50 mm×1.7 μm);流动相:A为0.05%甲酸-水溶液,B为乙腈;梯度洗脱程序:0~7 min、25%~35%B,7~9 min、35%~37%B,9~12 min、37%B,12~30 min、37%~57%B,30~34.5 min、57%~65%B,34.5~36 min、65%~90%B;流速:0.3 mL/min;柱温:25 ℃;进样量:2 μL。
1.5.2 质谱条件 电喷雾离子源,负离子检测模式;鞘气和辅助气均为氮气,纯度>99%;鞘气流速40个单位,辅助气流速20个单位;碰撞气为氦气,纯度>99.99%;电离源电压:-4 kV;离子源温度:350 ℃;毛细管电压:-35 V;管透镜电压:-110 V;样品采用傅里叶变换高分辨全扫描(FT),质量扫描范围m/z150~1 500;检测分辨率:30 000;二级质谱采用数据依赖型扫描,选取一级丰度最高的3个色谱峰进行HCD碎裂;HCD参数为:分辨率15 000,归一化碰撞能量120、150单位。
2 结果与讨论
2.1 高异黄酮类成分检测条件的优化
2.1.1 液相色谱条件的优化 为了同时获得良好的高异黄酮色谱峰形和质谱信号响应,采用0.05%甲酸作为流动相改性剂。实验对比了甲醇-0.05%甲酸溶液、乙腈-0.1%甲酸溶液、乙腈-0.05%甲酸溶液和乙腈-甲醇-0.1%甲酸溶液等不同流动相体系对高异黄酮色谱分离效果的影响,从而优化色谱分离条件,得到的麦冬中高异黄酮的总离子流图示于图1。
2.1.2 HCD裂解条件的优化 碰撞能量对于产生碎片离子的种类和强度具有至关重要的作用。为了获得丰富全面的高异黄酮碎片信息,提高鉴定精确度,实验以标准品作为研究对象,考察了不同碰撞能量(30、50、70、90、120、150、200单位)下母离子的碎裂状态。结果表明:在较低碰撞能量(低于70单位)下,母离子几乎未发生碎裂;当碰撞能量处于70~150单位时,碎片离子的种类比较丰富,特征离子的相对丰度较高,可提供详细的结构信息;当碰撞能量进一步提高时,多数特征离子被过度碎裂,相对丰度降低,不利于结构解析。因不同高异黄酮化合物的最优碰撞能量并不相同,经对比优化,最终采用120、150单位碰撞能量下的碎片信息进行结构鉴定。
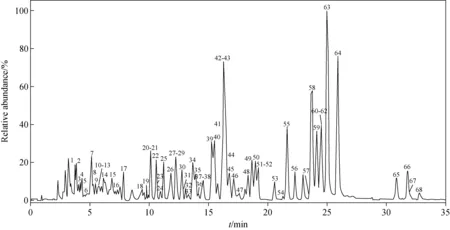
图1 麦冬中高异黄酮类成分的总离子流图
2.2 高异黄酮HCD裂解规律的分析
高异黄酮是比异黄酮多1个亚甲基的特殊黄酮,结构类型示于图2。亚甲基的存在导致此处容易发生质谱裂解反应,从而产生失去B环的碎片离子,即高异黄酮最主要的特征离子[11],据此可对A环及B环上的取代基类型及数量进行快速推断。在HCD模式下,高异黄酮不仅能产生上述诊断离子,而且母核上的取代基(如甲氧基),以及A环本身也会发生裂解反应。以标准品麦冬黄烷酮A为例,其分子式为C18H16O6,准分子离子峰[M-H]-的精确质量数为m/z327.086 5,推断其分子式为C18H15O6,误差为-2.81×10-6。该离子经HCD裂解产生碎片离子m/z193.049 6[C10H9O4]-、m/z192.042 3[C10H8O4]-、m/z164.047 6[C9H8O3]-、m/z136.016 8[C7H4O3]-。根据特征离子m/z193.049 6,可推断B环上有1个亚甲二氧基,而A环上有2个羟基和1个甲基;m/z164.047 6是中性丢失C4位羰基的碎片离子,m/z136.016 8是m/z164.047 6的C环继续裂解的产物,其裂解途径示于图3。高异黄酮会产生相差13 u的特征碎片离子[M-H-B-ring]-和[M-H-B-ring+CH]-,这可作为判断高异黄酮取代基种类和数量的依据。当含有甲氧基取代时,会产生中性丢失1个CH3(-15 u)的碎片离子,依据产生该碎片离子的数量可判断化合物中甲氧基的数量;当含有醛基取代时,则会在准分子离子基础上产生中性丢失1个CO(-28 u)的碎片离子,依此可判断醛基的有无[12]。上述特征裂解碎片及裂解方式可为高异黄酮类成分的结构鉴定提供依据。
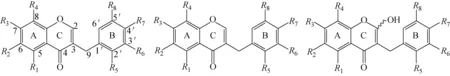
图2 高异黄酮类成分的结构类型
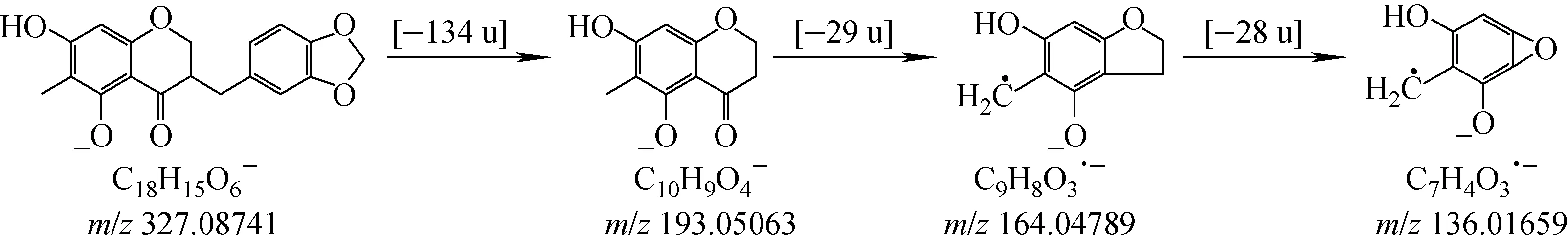
图3 麦冬黄烷酮A的 HCD裂解途径推断
2.3 高异黄酮类成分结构的快速鉴定
参照文献报道[1-5,11],设定麦冬高异黄酮的高分辨质谱数据处理参数:最大分子质量误差为3×10-6,C、H、O原子数目的范围分别为16~29、12~36、3~14。结合得到的高分辨质谱数据和多级质谱碎片信息,共从麦冬提取物中快速鉴定出68个高异黄酮类成分。各化合物的保留时间,高分辨质谱质量数的理论值和实测值,误差,以及在120、150单位下的HCD多级裂解碎片等详细信息列于表1。
2.3.1 高异黄酮结构鉴定 结合质谱数据处理参数和特征离子碎片信息,共鉴定出26个高异黄酮化合物。经文献[4-5,11]比对可以确定取代基位置的化合物有15个,未能确定取代基位置的化合物的取代基信息已于表1中列出。下面举例说明高异黄酮的鉴定过程。
在负离子模式下,化合物22和25均产生m/z297.076 9[M-H]-的准分子离子峰,根据精确的相对分子质量可推断其分子式为C17H13O5,误差为0.27×10-6。在HCD裂解过程中,m/z297.076 9均可产生m/z204.042 2[M-H-B-ring+CH]-、m/z191.034 5[M-H-B-ring]-的碎片离子,由此可推断B环上有1个羟基取代,而A环上有2个羟基和1个甲基取代。根据色谱保留行为分析以及文献报道[5],将它们分别鉴定为5,7,4′-三羟基-8-甲基高异黄酮和5,7,4′-三羟基-6-甲基高异黄酮。
化合物53可产生m/z341.102 7[M-H]-的准分子离子峰,推断其分子式为C19H17O6,误差为-1.43×10-6。该化合物的HCD碎片离子m/z205.050 0[M-H-B-ring]-、m/z218.057 3[M-H-B-ring+CH]-分别为B环丢失后得到的,且进一步产生了m/z326.077 9[M-H-CH3]-和m/z311.054 9[M-H-2CH3]-等碎片离子,说明其分子结构中可能含有2个甲氧基。结合保留时间及相关文献[5],将其鉴定为5,3′-二羟基-7,4′-二甲氧基-6-甲基高异黄酮。
另外,在分析过程中还发现了一类含有醛基的高异黄酮,如化合物66产生m/z339.087 0[M-H]-的准分子离子峰,可推断分子式为C19H15O6,误差为-1.09×10-6。二级碎片离子m/z311.090 9[M-H-CO]-的产生表明其含有醛基,而m/z324.062 3[M-H-CH3]-表明其含有1个甲氧基,因此将其鉴定为6-醛基异麦冬黄酮B[5]。
2.3.2 高异黄烷酮结构鉴定 结合质谱数据处理参数和特征离子碎片信息,共鉴定出31个高异黄烷酮化合物。经文献[4-5,11]比对可以确定取代基位置的化合物有22个,未能确定取代基位置的化合物的取代基信息列于表2。
在负离子模式下,化合物48产生m/z355.118 6[M-H]-的准分子离子峰,经精确分子质量比对,推断其分子式为C20H19O6,误差为-0.25×10-6。根据HCD裂解产生的m/z205.049 9[M-H-B-ring]-碎片离子,推断B环上有1个亚甲二氧基取代,而依据m/z190.026 5[M-H-B-ring-CH3]-的碎片离子,可推断A环有甲氧基取代。经色谱保留行为及文献比对[5-6],将其鉴定为5-羟基-7-甲氧基-3′,4′-亚甲二氧基-6,8-二甲基高异黄烷酮。
化合物37产生m/z327.123 0[M-H]-的准分子离子峰,推断其分子式为C19H19O5,误差为-2.38×10-6。在HCD碎裂下产生m/z191.034 8碎片离子,据此推断B环取代的可能性有甲氧基或羟基加甲基,而依据产生的m/z312.099 4[M-H-CH3]-、m/z297.076 5[M-H-2CH3]-碎片离子,进一步推断其含有2个甲氧基取代,故确定B环取代为甲氧基,结合文献[5]将其鉴定为5-羟基-7,4′-二甲氧基-8-甲基高异黄烷酮。
2.3.3 高异黄酮类葡萄糖苷结构鉴定 当HCD碰撞能量为120单位,高异黄酮葡萄糖苷产生的碎片离子信息较少,主要为丢失一分子葡萄糖残基产生[M-H-Glu]-;当碰撞能量提高至150单位时,苷元进一步裂解产生特征碎片离子,据此可以通过推断它们的取代基分布情况鉴定这些糖苷类成分的结构。本实验共鉴定出11个糖苷化合物,根据文献及保留时间可以推断苷元取代基位置的有6个,未能确定取代基位置化合物的苷元信息列于表2。
表1 麦冬提取物中高异黄酮类成分的HCD裂解信息及鉴定
Table 1 Characterizations of homoisoflavone in extract ofOphiopogonjaponicasby UPLC-LTQ-Orbitrap-HCD-MSn
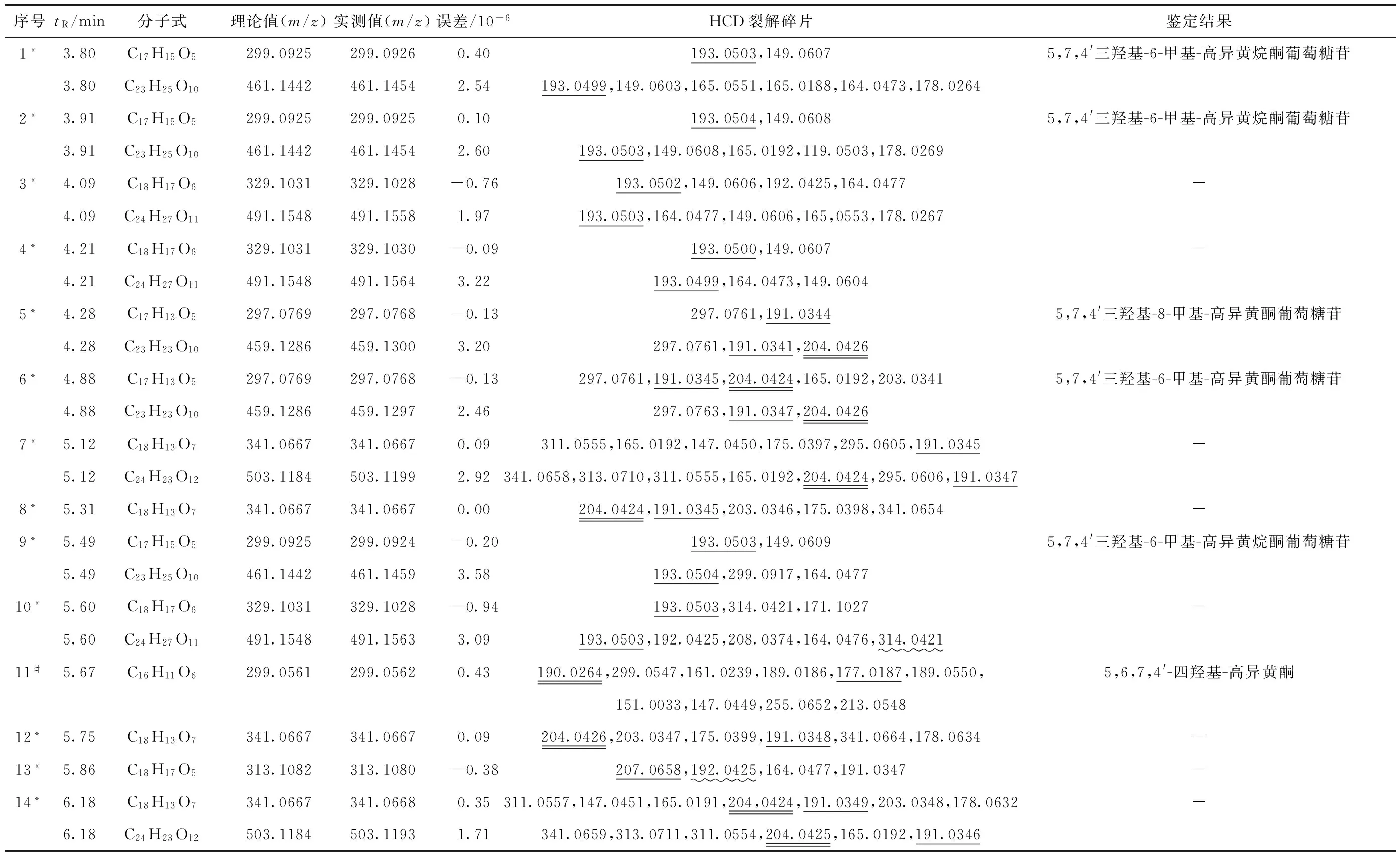
序号tR/min分子式理论值(m/z)实测值(m/z)误差/10-6HCD裂解碎片鉴定结果1*3.80C17H15O5299.0925299.09260.40193.0503,149.06075,7,4'三羟基-6-甲基-高异黄烷酮葡萄糖苷3.80C23H25O10461.1442461.14542.54193.0499,149.0603,165.0551,165.0188,164.0473,178.02642*3.91C17H15O5299.0925299.09250.10193.0504,149.06085,7,4'三羟基-6-甲基-高异黄烷酮葡萄糖苷3.91C23H25O10461.1442461.14542.60193.0503,149.0608,165.0192,119.0503,178.02693*4.09C18H17O6329.1031329.1028-0.76193.0502,149.0606,192.0425,164.0477-4.09C24H27O11491.1548491.15581.97193.0503,164.0477,149.0606,165,0553,178.02674*4.21C18H17O6329.1031329.1030-0.09193.0500,149.0607-4.21C24H27O11491.1548491.15643.22193.0499,164.0473,149.06045*4.28C17H13O5297.0769297.0768-0.13297.0761,191.03445,7,4'三羟基-8-甲基-高异黄酮葡萄糖苷4.28C23H23O10459.1286459.13003.20297.0761,191.0341,204.04266*4.88C17H13O5297.0769297.0768-0.13297.0761,191.0345,204.0424,165.0192,203.03415,7,4'三羟基-6-甲基-高异黄酮葡萄糖苷4.88C23H23O10459.1286459.12972.46297.0763,191.0347,204.04267*5.12C18H13O7341.0667341.06670.09311.0555,165.0192,147.0450,175.0397,295.0605,191.0345-5.12C24H23O12503.1184503.11992.92341.0658,313.0710,311.0555,165.0192,204.0424,295.0606,191.03478*5.31C18H13O7341.0667341.06670.00204.0424,191.0345,203.0346,175.0398,341.0654-9*5.49C17H15O5299.0925299.0924-0.20193.0503,149.06095,7,4'三羟基-6-甲基-高异黄烷酮葡萄糖苷5.49C23H25O10461.1442461.14593.58193.0504,299.0917,164.047710*5.60C18H17O6329.1031329.1028-0.94193.0503,314.0421,171.1027-5.60C24H27O11491.1548491.15633.09193.0503,192.0425,208.0374,164.0476,314.042111#5.67C16H11O6299.0561299.05620.43190.0264,299.0547,161.0239,189.0186,177.0187,189.0550,5,6,7,4'-四羟基-高异黄酮151.0033,147.0449,255.0652,213.054812*5.75C18H13O7341.0667341.06670.09204.0426,203.0347,175.0399,191.0348,341.0664,178.0634-13*5.86C18H17O5313.1082313.1080-0.38207.0658,192.0425,164.0477,191.0347-14*6.18C18H13O7341.0667341.06680.35311.0557,147.0451,165.0191,204,0424,191.0349,203.0348,178.0632-6.18C24H23O12503.1184503.11931.71341.0659,313.0711,311.0554,204.0425,165.0192,191.0346

续表1

续表1

续表1
注1.△表示经标准品比对;#表示经特征离子比对和查阅文献;*表示经特征离子推断取代基种类及数量
2.m/z193.0503表示裂解位置在C3-C9之间掉落B环的特征离子[M-H-B-ring]-;m/z218.0571表示裂解位置在C9-C1′之间掉落B环的特征离子[M-H-B-ring+CH]-;m/z324.0623表示含有1个或多个甲氧基取代有-15 u或-30 u特征掉落的特征离子[M-H-CH3]-和[M-H-2CH3]-;m/z313.1066表示含有醛基有-28 u特征掉落的特征离子[M-H-CO]-

表2 未确定取代基位置的高异黄酮类化合物的鉴定
化合物1、2、9均产生m/z461.145 9[M-H]-的准分子离子峰,且在相同保留时间的位置产生m/z299.092 4[M-H-Glu]-的苷元碎片,由精确分子质量推断其分子式分别为C23H25O10和C17H15O5,误差分别为2.54×10-6和0.40×10-6。糖苷和苷元经HCD裂解均产生m/z193.050 3[M-H-Glu-B-ring]-的碎片离子,据此可推断其苷元B环为羟基取代。由于3个化合物苷元的裂解碎片种类和相对丰度与标准品5,7,4′-三羟基-6-甲基高异黄烷酮基本相同,结合三者的色谱保留行为将其鉴定为5,7,4′-三羟基-6-甲基高异黄烷酮葡萄糖苷或其同分异构体。
化合物5、6在相同的保留时间均产生了m/z459.129 7[M-H]-准分子离子峰,同时产生m/z297.076 8[M-H-Glu]-苷元碎片分子,经精确分子质量推断,其分子式分别为C23H23O10和C17H13O5,误差分别为2.46×10-6和-0.13×10-6。根据多级质谱数据可知,这两个化合物均产生了m/z191.034 3[M-H-Glu-B-ring]-和m/z204.042 6[M-H-Glu-B-ring+CH]-的碎片离子峰,由此可以推断它们的B环上有1个羟基取代,而A环上有2个羟基和1个甲基取代。结合化合物22和25的碎片离子分析,可推断化合物5、6为化合物22和25的葡萄糖苷。因此,将化合物5鉴定为5,7,4′-三羟基-8-甲基-高异黄酮葡萄糖苷,化合物6鉴定为5,7,4′-三羟基-6-甲基-高异黄酮葡萄糖苷。
3 结论
本工作应用UPLC-LTQ-Orbitrap技术结合高能诱导裂解模式对麦冬提取物中高异黄酮类成分进行了快速鉴定。通过考察不同裂解能量对高异黄酮类成分的影响,优化了最佳裂解条件,最终选择120和150单位作为碰撞能量;归纳总结了高异黄酮类成分在上述碎裂能量下的HCD裂解规律和特征碎片离子,并据此对高异黄酮类成分的结构及A、B环的取代模式进行推断。应用该方法从麦冬提取物中鉴定出68个高异黄酮类成分的结构,包括11个高异黄酮葡萄糖苷、26个高异黄酮、31个高异黄烷酮。结果表明,该方法能够对中药中系列成分的结构进行快速筛查和鉴定,可为中药药效物质基础研究提供方法参考。
[1] 江洪波,黄静,郭明娟,等. 天然高异黄酮的研究进展[J]. 药学学报,2007,42(2):118-126.
JIANG Hongbo, HUANG Jing, GUO Ming-juan, et al. Recent advances in the study of natural homoisoflavonoids[J]. Acta Pharmaceutica Sinica, 2007, 42(2): 118-126(in Chinese).
[2] 蒋慧莲. 麦冬特征性成分及其质量标准研究[D]. 杭州:浙江中医药大学,2013.
[3] 白晶. 麦冬甾体皂苷和高异黄酮类成分的研究进展[J]. 北京联合大学学报,2014,28(2):9-12.
BAI Jing. Progress in studies on steroidal saponins and homoisoflavonoids inOphiopogonjaponicus[J]. Journal of Beijing Union University, 2014, 28(2): 9-12(in Chinese).
[4] 郭哲,陈丽,梁琼麟,等. 基于准确相对分子质量和多级质谱技术的LC-MS方法鉴定麦冬醇提液中高异黄酮类成分[J]. 中草药,2011,42(5):844-847.
GUO Zhe, CHEN Li, LIANG Qionglin, et al. Identification of homoisoflavonoids inOphiopogonjaponicusalcohol extract by LC-MS based on precise mass and tandem mass spectrometer[J]. Chinese Traditional and Herbal Drugs, 2011, 42(5): 844-847(in Chinese).
[5] XIE T, LIANG Y, HAO H P. Rapid identification of ophiopogonins and ophiopogonones inOphiopogonjaponicasextract with a practical technique of mass defect filtering based on high resolution mass spectrometry[J]. Journal of Chromatography A, 2012, 1 227(5): 234-244.
[6] ZHANG J Y, WANG Z J, ZHANG Q, et al. Rapid screening and identification of target constituents using full scan-parent ions list-dynamic exclusion acquisition coupledto diagnostic product ions analysis on a hybrid LTQ-Orbitrap mass spectrometer[J]. Talanta, 2014, 124: 111-122.
[7] ZHANG J Y, WANG Z J, LI Y, et al. A strategy for comprehensive identification of sequential constituents using ultra-high-performance liquid chromatography coupled with linear ion trap-orbitrap mass spectrometer, application study on chlorogenic acids inFlosLoniceraeJaponicae[J]. Talanta, 2016, 147(62): 16-27.
[8] 张加余,蔡伟,李云,等. HPLC/LTQ-Orbitrap MSn结合MDF数据挖掘技术快速鉴定藏白蒿绿原酸类似物[J]. 质谱学报,2015,36(4):321-327.
ZHANG Jiayu, CAI Wei, LI Yun, et al. Rapid characterization of chlorogenic acids analogues inArtemisiayounghusbandiiusing HPLC/LTQ-Orbitrap MSncoupled with MDF data mining technology[J]. Journal of Chinese Mass Spectrometry Society, 2015, 36(4): 321-327(in Chinese).
[9] ZHANG J Y, CAI W, ZHOU Y, et al. Profiling and identification of the metabolites of baicalin and study ontheir tissue distribution in rats by ultra-high-performance liquidchromatography with linear ion trap-orbitrap mass spectrometer[J]. Journal of Chromatography B, 2015, 985: 91-102.
[10]王敏,张海燕,杨金良,等. 硫磺类药物电喷雾质谱高能裂解规律[J]. 温州医学院学报,2013,43(10):642-646.
WANG Min, ZHANG Haiyan, YANG Jinliang, et al. Research on fragmentation pathways of sulfonamide by ESI high energy collision induced dissociation technique[J]. Journal of Wenzhou Medical College, 2013, 43(10): 642-646(in Chinese)
[11]LI N, ZHANG J Y, ZENG K W, et al. Anti-inflammatory homoisoflavonoids from the tuberous roots ofOphiopogonjaponicus[J]. Fitoterapia, 2012, 83(6): 1 042-1 045.
[12]ZHANG J Y, LI N, CHE Y Y, et al. Characterization of seventy polymethoxylated flavonoids (PMFs) in the leaves ofMurrayapaniculataby on-line high-performance liquid chromatography coupled to photodiode array detection and electrospray tandem mass spectrometry[J]. Journal of Pharmaceuticaland Biomedical Analysis, 2011, 56(5): 950-961.
Rapid Identification of Homoisoflavonoids inOphiopogonjaponicasBased on UPLC-HRMSnCombined HCD Method
WANG Zi-jian1, LIU Ying1, LIU Si-yi1, LI Ning2, LU Jian-qiu3, ZHANG Jia-yu1
(1.BeijingInstitutionofChineseMedicine,BeijingUniversityofChineseMedicine,Beijing100029,China;2.HKUSTShenzhenResearchInstitute,Shenzhen518057,China3.LibraryofBeijingUniversityofChineseMedicine,Beijing100029,China)
Radix Ophiopogon, a kind of traditional Chinese medicine, is the root of LiliaceaeOphiopogonjaponicus(Thunb.) Ker Gaw l. Modern research demonstrates thatOphiopogonjaponicascan be used as a folk food medicine in free radical scavenging, reducing blood sugar, sedative hypnotic and anti-myocardial ischemia and arrhythmia, and so on. The major chemical compounds of this plant are mainly homoisoflavonoids, steroidal saponins and polysaccharides. According to the relevant reports, the homoisoflavonoids is a kind of specific compounds inOphiopogonjaponicus. However, due to the large number of different types of homoisoflavonoids in the herbal medicine, the structures are too similar to be distinguished from each other. Meanwhile, the differences of their relative contents inOphiopogonjaponicasare great. In this paper, the rapid separation ability of UPLC-LTQ-Orbitrap and the higher energy collision induced dissociation mode (HCD mode) were used to acquire high resolution fragment ion information and studied on the fragmentation patterns of homoisoflavonoids. The chromatographic separation ofOphiopogonjaponicusextract was used Waters Acuqity UPLCTMBEH C18 column, mobile phase was 0.05% formic acid in water and acetonitrile system, and the chromatographic conditions for the rapid separation were optimized. To avoid interference with other components and obtain the tandem mass spectrometry high content and low content data, a method based on parent ions detection list in the negative ion mode detection was established. Furthermore, the established method was helpful in investigating the dissociation pathways of homoisoflavonoids in different HCD cleavage energy and confirming the characteristic fragment ions for the identification. Meanwhile, 68 constituents attributed to homoisoflavonoids inOphiopogonjaponicasare finally identified, including 26 homoisoflavonoids, 31 homoisoflavanones, and 11 homoisoflavonoids glycosides. The results indicate that the HCD model can provide abundant and stable information of fragment ions, which can be adopted to quickly and accurately clarify the homoisoflavonoids in complex system. This study can provide an effective analytical method to explore the material basis of sequential constituents in traditional Chinese medicines.
Ophiopogonjaponicus; homoisoflavonoids;higher energy collision induced dissociation(HCD);UPLC-LTQ-Orbitrap;mass fragmentation
2016-02-05;
2016-05-06
国家自然青年科学基金(81303206,81303189);北京中医药大学校级课题(2015-JYB-JSMS043)资助
王子健(1988—),男(汉族),北京人,助理实验师,从事仪器分析方法开发研究。E-mail: helloffiresilver@gmail.com
张加余(1981—),男(汉族),山东人,副研究员,从事药物分析研究。E-mail: zhangjiayu0615@163.com
卢建秋(1964—),男(汉族),黑龙江人,研究员,从事药物分析研究。E-mail: lujq@vip.sina.com
时间:2016-09-01;
http:∥www.cnki.net/kcms/detail/11.2979.TH.20160901.1531.012.html
O657.63
A
1004-2997(2016)06-0481-11
10.7538/zpxb.youxian.2016.0043

