超声造影评价肝动脉化疗栓塞联合微波消融治疗中晚期肝癌疗效
陈 刚,唐晓军,魏 强,马芝倩
·临床经验·
超声造影评价肝动脉化疗栓塞联合微波消融治疗中晚期肝癌疗效
陈 刚,唐晓军,魏 强,马芝倩
目的 探讨应用超声造影(contrast enhanced ultrasound,CEUS)方法评价肝动脉化疗栓塞(transcatheter hepatic arterial chemo-embolization, TACE)联合经皮微波凝固疗法(percutaneous microwave coagutation therapy,PMCT)治疗中晚期肝癌的近期疗效。 方法 50例中晚期肝癌患者共53个病灶,先行TACE治疗,1周后再行PMCT治疗。全部病例于治疗后2周行CEUS检查,观察患者治疗区域肿瘤灭活、残存或复发状况。结果 联合介入治疗后CEUS检查显示,46个病灶内部各期均无增强,始终呈低回声,提示肿瘤完全灭活。7个病灶动脉期治疗区局部呈新月形或结节状增强,门脉期及延迟期减退,诊断肿瘤残存或复发。与CT、AFP及病理联合诊断比较,CEUS诊断准确性为90.6%,敏感性为85.7%,特异性为91.3%。结论 连续动态观察治疗区域的微循环状况及残存病灶的血流特征是CEUS的优势,可以较准确地判断治疗区域内病灶的存活情况,并进一步指导再次介入所选择的方式和方法,是评价介入治疗中晚期肝癌疗效的有效方法。
超声造影; 肝动脉化疗栓塞; 经皮微波凝固疗法; 肝癌
我国乙型肝炎高发,部分患者经过肝炎、肝硬化发展为肝癌。确诊患者多数已到中晚期,仅有10%~15%的肝癌患者能够施行手术治疗[1]。由于单一方案治疗肝癌疗效欠佳,现多采用多种方式联合治疗肝癌[2-3]。肝动脉化疗栓塞(TACE)联合经皮微波凝固疗法(PMCT)创伤较小,治疗过程相对安全且疗效肯定,已成为多数中晚期肝癌患者的首选治疗方法。但仍有少数患者治疗后治疗区域肿瘤未能完全杀灭而出现复发。研究发现,超声造影(CEUS)用于评价治疗区域肝肿瘤是否完全灭活,以及发现治疗区域肝肿瘤残留或复发,与增强CT的诊断价值相似或更高,且可以根据治疗区域内血流信号的特征,选择再次治疗的方式和方法,已成为评价肝肿瘤治疗疗效的又一有效方法[4-5]。本研究旨在探讨超声造影评价肝动脉化疗栓塞联合经皮微波凝固治疗中晚期肝癌的近期疗效和用途
1 对象与方法
1.1 研究对象 为我院自2011年8月-2015年8月间收治的50例中晚期肝癌患者,其中女6例,男44例,年龄34~78岁,平均年龄56岁。共53个病灶,直径3~11 cm,其中位于肝左叶11个,肝右叶38个,左右叶交界部4个。50例中20例穿刺活检病理确诊,其余30例CT、AFP以及相关病史临床确诊。所有患者明确诊断后,先采用TACE治疗,1周后行PMCT治疗,治疗结束后2周行CEUS检查,观察治疗局部的肿瘤灭活、残留及复发状况。所有患者均为首次发现病例且无外科手术指征的中晚期肝癌患者,血液检查及生化指标均在允许范围内,Child-Pugh分级A~B。
1.2 治疗方法
1.2.1 TACE治疗 所有患者均先行TACE治疗。Seldinger穿刺股动脉,使用RH导管或Yashiro导管置入肝总动脉造影,置入微导管超选择至肿瘤供血动脉内,造影明确栓塞范围后注入碘化油10~20 mL与奈达铂20~40 mg混合乳化液行化疗栓塞,并根据肿瘤体积大小注入适量颗粒性栓塞剂(海藻酸钠或明胶海绵)双重栓塞(肿瘤完全栓塞,保留供血动脉)。
1.2.2 PMCT治疗 TACE后常规支持治疗7 d,于超声引导下行PMCT治疗。术前常规检测出、凝血时间和血小板计数,不正常者纠正后再行PMCT治疗。2%利多卡因穿刺点麻醉后,根据治疗肿块的具体部位,选择最佳穿刺点及穿刺路径进针,按肿瘤大小及部位不同,设置微波功率50~65 W,治疗时间150~350 s,治疗过程中超声监测肝内治疗区变化,结束后超声扫描确定有无肝包膜下出血,穿刺点无菌敷贴覆盖,严格卧床休息,观察24 h血压、脉搏。
1.2.3 超声造影 使用GE Logiq 9和百胜EsaoteMyLab twice彩色多普勒超声诊断仪,3.5 C探头频率2.5~4.0 MHz,CA541探头频率2.5~7.0 MHz。超声造影剂使用声诺维(意大利博莱科公司,为磷脂包裹的六氟化硫气体微泡),生理盐水溶解后均匀振荡,经肘部浅静脉于2~4 s内团注法快速注入。
造影方法:二维超声全面扫查肝脏,确定靶病灶后观测其位置、大小、数量及边界轮廓,多普勒超声观察内部血供特点,确定最佳扫查病灶位置后切换至造影模式,更改为低机械指数,声诺维快速团注同时启动超声仪内计时器,实时观察靶病灶区动脉期、门脉期及延迟期的回声强度变化,录像反复回放观察至明确诊断。
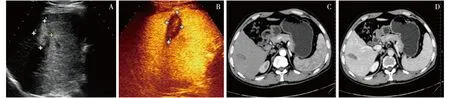
A: 二维超声显示肝内见不均强回声病灶;B: CEUS显示病灶始终无增强(灭活完全);C: 增强CT动脉期扫描未见强化;D: 增强CT门静脉期扫描未见强化图1 原发性肝癌TACE+PMCT治疗后
造影评价:以注入造影剂的10~30 s划为肝动脉期,31~120 s为门脉期,121~360 s为延迟期,观察各时期病灶内回声强度及同周围肝组织回声强度对比。推注造影剂后靶病灶内边缘清晰,无时相动态变化且各时期均为无回声区,可确定肿瘤完全灭活。推注造影剂后病灶动脉期局部有形态不规则增强区域,门脉期及延迟期消退,则提示有肿瘤残留或复发,需再次TACE或PMCT治疗。
TACE联合PMCT治疗后肝癌残留或复发的最终诊断依据为两种以上影像学检查并结合甲胎蛋白水平、穿刺活检或连续6个月以上随访进行综合判断。CEUS、CT或MRI在术后2周进行,其中行CEUS和CT检查36例,CEUS和MRI检查10例,穿刺活检4例,无病理诊断者以临床随访的最终诊断为标准。两种影像检查阴性且甲胎蛋白(AFP)降至正常,经6个月随访病灶无明显变化可判断为肿瘤灭活;而两种影像检查显示病灶动脉期治疗区有残存增强病灶,门脉期及延迟期病灶造影消退,AFP升高,穿刺活检阳性,提示有残存肿瘤。
2 结 果
联合治疗前常规超声检查显示:33个肿瘤病灶为低回声团块影,53个肿瘤病灶内彩色多普勒超声可见周边及内部点状、条索状血流信号。CEUS检查显示,上述病灶动脉期回声均匀或不均匀迅速增强,门脉期迅速消退呈低增强或等增强,延迟相呈低增强。
联合治疗后CEUS结果显示:53个病灶中,46个病灶治疗区动脉相、门脉相及延迟相病灶回声始终无增强(图1),提示肿瘤灭活,最终证实42个诊断正确。7个病灶造影显像表现为病灶增强范围较治疗前不同程度缩小,但仍有部分增强区,其中5个为不规则结节形增强,余2个为边缘新月形增强(图2)。彩色多普勒超声显示增强区域内点状及条索状血流信号影,提示肿瘤未完全灭活,肿瘤残留或有复发,最终诊断证实6个诊断正确,CEUS检测肝细胞癌凝固区残余瘤的准确性为90.6%,敏感性为85.7%,特异性为91.3%。
3 讨 论
肝癌属于难治性肿瘤,治疗方法多样, 2种介入治疗方法TACE和PMCT在很大程度上有互补性,TACE治疗的原理是靶血管内高浓度化疗药物灌注,杀灭肿瘤组织及栓塞肝癌的供血动脉,造成肝癌组织缺血坏死,同时栓塞剂还可到达肿瘤周边的门静脉,使得瘤体血供显著减少,由于流经瘤体的血流减少,在进行PMCT治疗时随血流流失的热量也相应减少,使得局部升温更快更恒定,从而提高了PMCT的治疗效果。TACE还能引起肿瘤组织缺血和炎症反应,增加了热疗的敏感性。而PMCT的热效应同样增加肝肿瘤组织对化疗药物的敏感性,促进肿瘤组织对化疗药物的摄取,对TACE有增效作用,从而形成良性促进的环样效应。研究证实TACE联合PMCT治疗中晚期肝癌的疗效明显优于单纯TACE或单纯PMCT治疗的疗效[6-7]。
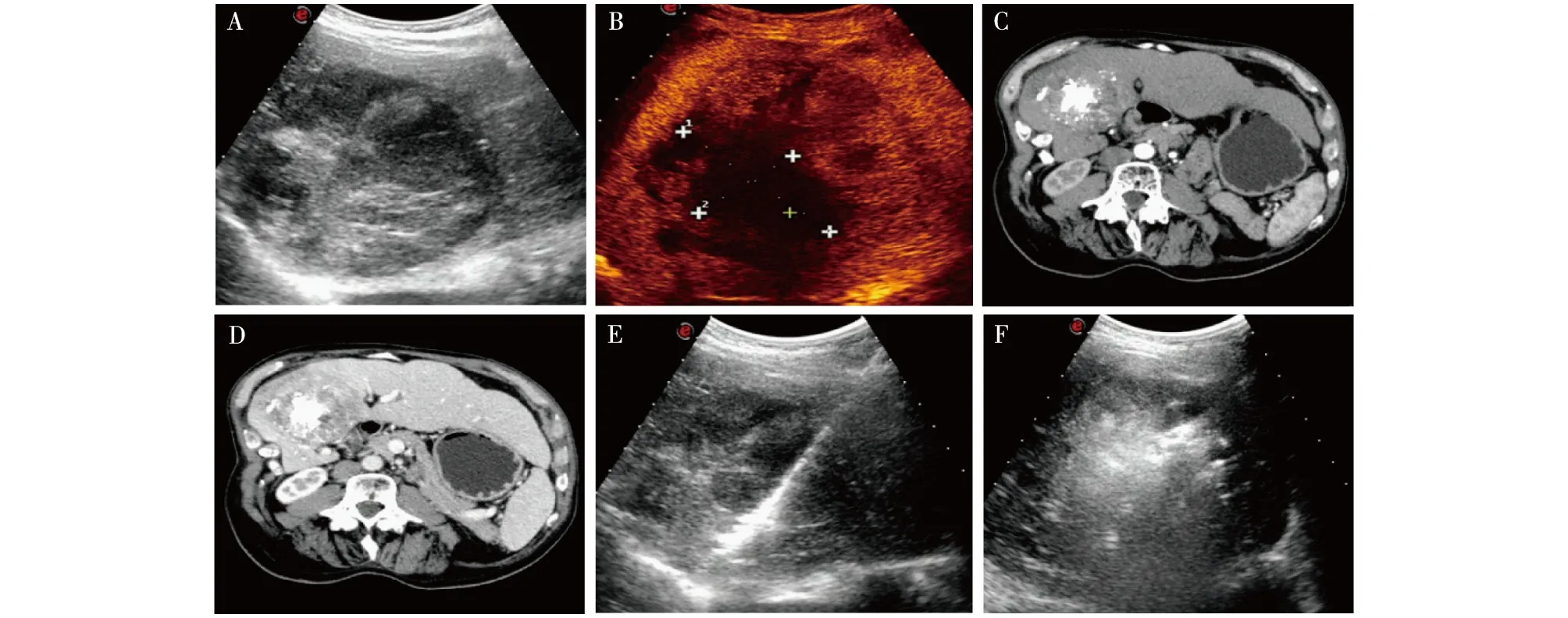
A: 二维超声显示肝内见不均强回声病灶;B: CEUS时病灶中央区域始终无增强,外缘区域局部呈不规则结节形增强(残留活性组织);C: 增强CT动脉期扫描见残留肿瘤病灶轻度强化;D: 增强CT门静脉期显示残留病灶与周围肝组织界限清晰;E: 再次PMCT,可见瘤体内电极针影;F: PMCT治疗过程中瘤体内气体逐渐弥散,覆盖整个肿瘤区域图2 原发性肝癌TACE+PMCT治疗后
介入治疗后病灶的灭活程度是影像学检查的重点,主要依靠CT、MRI、常规超声、DSA及CEUS等。通常临床多采用增强CT扫描观察病灶的灭活程度,但CT扫描射线剂量大,多数患者在介入前已常规CT检查,紧接着接受DSA的射线照射,治疗后再次CT检查,短时间内大剂量的X射线照射对患者的身体健康是严重的损害。且CT增强扫描常受到患者心搏出量、呼吸位移及肝脏血管异位开口的影响,不能很好的提示治疗区域内病灶灭活的程度。MRI常有呼吸伪影干扰。常规超声检查价格低廉,操作简单无辐射,但易受到呼吸、手法的影响,对内部血流产生错误判断。CEUS可针对性的观察感兴趣区域由动脉期向门脉期、延时期的连续性变化,准确显示治疗后病灶形态大小、病灶内部及周边血供状况,从而判断肿瘤治疗后是否完全灭活,与增强CT诊断价值相似甚至更高。CEUS与增强CT不同,造影剂始终位于血管内,可以更准确的显示残存或新生肿瘤部分的血管,且不受碘油的干扰,能更客观地提示残存或新生肿瘤,是评价疗效敏感而有效的方法。研究显示CEUS敏感度高,增强CT特异性高,CEUS和增强CT联合评价治疗疗效可提高诊断效率[8]。CEUS评价介入治疗疗效的优势是操作简单易行,费用低廉,无辐射。从二维超声全面扫查,到感兴趣区域多普勒扫查,最后怀疑区域造影扫查,形成逐级递增的阶梯形检查模式,可以更好的规避漏、误诊。CEUS还可术中即时评价肝癌治疗效果,必要时在PMCT治疗过程中可实时引导穿刺活检,可准确判断治疗后病灶内有无残存肿瘤组织或新生肿瘤组织[9-10]。但是CEUS也有其局限性,包括以下方面:① 一次造影不能获得全肝各个时相图像,对于多发病灶的患者只能采取多次注射造影剂的方法来获得图像,相应的增加了患者的经济负担;② 肿瘤位置较深超声衰减过大,图像质量下降;③ 因胸腔气体干扰影响的临近肺底的肿瘤造影效果不理想;④ 合并有脂肪肝的患者增强效果亦欠佳;⑤ 对过大的病灶观察不能全面;⑥ 乏血供的肝脏肿瘤病灶消融后癌残留评估存在一定的困难。遇到此类病灶,应选择CT或MRI检查,以弥补CEUS不足。
综上所述,CEUS在显示瘤内血流灌注方面敏感,介入治疗前行CEUS有助于选择合适的介入及消融方案,联合治疗后行CEUS能敏感的检出小残留灶和复发灶,指导下一步治疗方案并可帮助定位引导穿刺治疗,有较高的临床价值和良好的应用前景,但因CEUS仅能对局部病灶较好成像,对位置较深的病灶或多个病灶易产生误诊和漏诊,仍需要与其他影像学方法互相补充,相互完善。随着新的超声技术的不断发展和新型超声造影剂的研制,肝脏CEUS将为肝脏占位性病变的诊断和治疗提供更加可靠的信息。
[1] 杨广顺,吴盂超,吴志全.原发性肝癌的规范化综合治疗[J].中华外科杂志,2001, 2001, 39(10):742-744.
[2] 张薇,张龙江,罗 松,等.动态对比增强磁共振成像对原发性肝癌的评估应用[J].医学研究生学报,2014,27(7):702-705.
[3] 黄声稀,司 芩,钱晓莉,等.超声造影评估射频消融联合无水乙醇治疗肝癌的局部疗效评价[J].医学研究生学报,2011,24(4):368-370.
[4] Liu JB, Goldberg BB, Merton DA, et al.The role of contrast-enhanced sonography for radiofrequency ablation of liver tumors[J]. J Ultrasound Med, 2001, 20(5):517-523.
[5] 李 凯,苏中振,郑荣琴,等.虚拟导航三维超声造影评估肝癌消融安全边界的初步研究[J].中华超声影像学杂志,2011,20(8):672-675.
[6] 李 梅, 姚 乐, 程 媛, 等. 肝动脉化疗栓塞联合微波消融治疗中晚期肝癌的疗效观察[J]. 现代肿瘤医学, 2015, 23(16): 2351-2355.
[7] 陈 刚, 唐晓军, 李宏波, 等. 肝动脉化疗栓塞联合经皮微波消融治疗中晚期肝癌的疗效评价[J]. 临床放射学杂志, 2012, 31(5): 710-713.
[8] 张秀梅,严 昆,陈敏华,等.原发性肝癌及肝转移癌局部治疗后超声造影表现类型及其诊断价值[J]. 中华医学超声杂志(电子版), 2009,6(1):31-41.
[9] Zheng SG, Xu HX, Liu LN. Management of hepatocellular carcinoma: the role of contrast-enhanced ultrasound[J]. World J Radiol, 2014, 6(1): 7-14.
[10]Wu J, Yang W, Yin S, et al. Role of contrast-enhanced ultrasonography in percutaneous radiofrequency ablation of liver metastases and efficacy evaluation[J]. Chin J Cancer Res, 2013, 25(2): 143-154.
(本文编辑:齐 名)
210003江苏南京,东南大学附属第二医院介入放射科
陈 刚,唐晓军,魏 强,等.超声造影评价肝动脉化疗栓塞联合微波消融治疗中晚期肝癌疗效[J].东南国防医药,2016,18(5):531-533,539.
R445.1
B
10.3969/j.issn.1672-271X.2016.05.024
2016-03-22;
2016-04-29)

