人血浆蛋白多烯紫杉醇纳米粒子的自组装及对肿瘤的靶向性
龚光明,陈美惠,王曙东
·论 著·
人血浆蛋白多烯紫杉醇纳米粒子的自组装及对肿瘤的靶向性
龚光明,陈美惠,王曙东
目的 提高多烯紫杉醇的溶解度,提高其靶向性能。方法 用二硫键断裂法制备人血清白蛋白多烯紫杉醇纳米粒子,并用电镜进行观察。对粒子载药量、稳定性及粒子对肿瘤部位趋向性进行表征。结果 二硫键断裂法成功组装了白蛋白-多烯紫杉醇纳米粒子。电镜观察该纳米粒子外貌为80~100 nm左右的球形粒子,高效液相和蛋白质定量检测多烯紫杉醇载药量可达21.5%。结果 白蛋白多烯紫杉醇纳米制剂可显著提高多烯紫杉醇的溶解度,提高对肿瘤靶向性。结论 白蛋白-多烯紫杉醇纳米粒子对肿瘤细胞具有良好的靶向作用,具有临床运用的潜在价值。
血浆蛋白;多烯紫杉醇;纳米粒子;自组装;肿瘤靶向
肿瘤新生血管不遵循正常的血管结构而具有毛细血管的特征[1],其高通透性使得一些特殊大小的药物载体容易通过肿瘤血管但不能通过正常血管,药物体系在其中聚集且潴留时间延长,这就是渗透和滞留效应(enhanced permeability and retention, EPR)[2-4],是肿瘤被动靶向[5]。除分子靶向肿瘤药物外[6-7],血清白蛋白可在快速生长的肿瘤中积蓄,具有主动靶向性[8-9],负载的药物能被选择性输送到肿瘤组织,药物毒副作用被降低[10]。多烯紫杉醇是一类合成的微管为靶点的抗肿瘤药物,使用时需要吐温80和乙醇增溶,具有显著毒性。前期我们用巯基乙醇为变性剂制备了白蛋白纳米粒子[11]。本研究中我们用工艺更简便的三(2-羧乙基)膦(trichloroethyl phosphate, TCEP)为变性剂制备了白蛋白多烯紫杉醇纳米粒子,并进行了相关表征。
1 材料与方法
1.1 材料
人血清白蛋白(human serum albumin, HSA),近红外-797(NIR-797),购自Sigma(美国)。TCEP购自Pierce(美国)。三羟甲基氨基甲烷(Tris)购自国药集团,多烯紫杉醇(Docetaxel)购自南京泽朗医药,等其余试剂均为国产试剂,现购现用。S180(小鼠肛门纤维肉瘤细胞,购自上海博谷生物公司),ICR小鼠雄性,20~22 g,10只,购自上海西普尔-必凯实验动物有限公司〔合格证号:2008001640769,许可证号码:SCXK(沪)2013-0016〕。JEM-2100电子显微镜(JEOL,日本)。
1.2 方法
1.2.1 白蛋白多烯紫杉醇粒子 (HSA docetaxel nanoparticles, NPs-Docetaxel)的制备、形态观察 将HSA溶解于,5 mM Tris(pH 7.8),浓度为2 mg/mL,搅拌作用下,向HSA溶液中加入TCEP,10 min后加入Docetaxel(10 mg/mL)。Tris缓冲液对纳米粒子溶液进行透析,时间为24 h。粒子溶液滴在200目镀碳膜铜网上,用1%磷钨酸染色。干燥后,用JEOL电子显微镜观察粒子。
1.2.2 纳米粒子中Docetaxel含量分析 HPLC色谱条件:色谱柱:Kromasil C18柱,5 μm, 250 mm×4.6 mm;流速:1.0 mL/min;流动相:乙腈∶水(76∶24,v/v);检测波长:230 nm。
载药量根据公式:载药量=Docetaxel重量/(蛋白质重量+Docetaxel重量)×100%
取100 μL NPs-Docetaxel加入800 μL乙腈,震荡,混匀后,10 000 rpm,离心10 min,取上清。Docetaxel标准品为对照,HPLC测定样品中Docetaxel质量,考马斯亮蓝试剂盒测定样品中白蛋白质量,计算纳米粒子溶液中Docetaxel载药量。
1.2.3 纳米粒子在25 ℃ 5%葡萄糖水溶液中的稳定性 取NPs-Docetaxel冻干样品,5%葡萄糖+蒸馏水溶解后,用激光粒度测定仪检测粒径起始粒子大小,将溶液静置在25 ℃,分别在0、2、6、18、24、36、48 h检测其粒子大小。
1.2.4 NPs-Docetaxel的大鼠血液毒性 不同组分别连续3次给予生理盐水、Docetaxel (10 mg/kg)和NPs-Docetaxel (10、20 mg/kg)后,抗凝管采血,全血自动分析仪 (XS-800i, SYSMEX, Japan)分析白细胞和红细胞的数量。
1.2.5 NIR-797-NPs-Docetaxel在小鼠体内的分布 用5 mg NIR-797(二甲亚砜溶解)与 50 mg HSA(5 mM Tris,pH 7.8, 10 mL)混合反应2 h制备NPs-Docetaxel,5 mM Tris缓冲液透析24 h,加入1%甘露醇后冻干,临用前用水稀释。
1.2.5.1 S180小鼠肿瘤模型 参照Wu等[12]方法,将所购S180细胞接种至ICR小鼠左腋皮下,构建荷瘤小鼠。1周后选肿瘤长径、短径在0.5~1 cm之间的成瘤小鼠6只,分成两组,3只/组,分别用于NIR-797和NIR-797-NPs-Docetaxel成像,以脱毛膏脱去肿瘤部位毛发用于活体成像。
1.2.5.2 NIR-797-NPs-Docetaxel示踪 NIR-797-NPs-Docetaxel溶液甘露醇冻干粉用水溶解后,取200 μL 尾静脉注射肿瘤小鼠,间隔3、8、30、72、108 h在近红外检测仪下观察荧光标记纳米粒子在小鼠体内成像情况。
1.2.5.3 实时荷瘤小鼠NIR体内示踪过程 小鼠麻醉后,放入红外成像仪暗室,将暗室通麻醉气体使小鼠处于麻醉状态,明场调节视野,使小鼠全身在视野范围之内,荧光激发波长调节至704 nm,发射波长700~950 nm,成像后保存图象待处理。小鼠活体成像结束后,将小鼠取心、肝、脾、肺、肾、肿瘤、大脑、小肠、胃等脏器观察红外荧光,并拍片。拍片后,用活体成像仪上的软件处理小鼠活体和解剖后各组织器官的荧光信号。
2 结 果
2.1 NPs-Docetaxel的制备 NPs-Docetaxel形成过程中,溶液逐渐变成淡蓝色,透射电镜观察粒子大小为80~100 nm左右(图1)。TCEP是一种广泛运用的二硫键断裂剂,无色无味、无毒性,后期易处理。制备的纳米粒子溶液搅拌条件下透析24 h,中间发现溶液及容器壁上均有白色颗粒,可能在透析过程中,Docetaxel从粒子中逐步释放出来,聚集成白色悬浮物,部分粒子分散开。

图1 透射电镜观察白蛋白多西紫杉醇粒子外貌和形状 (1%磷钨酸染色×150万)
2.2 NPs-Docetaxel载药量和溶解度分析 高效液相检测NPs-Docetaxel溶液中Docetaxel的含量为0.42 mg/mL,HSA含量为1.95 mg/mL, Docetaxel载药量为21.5%。Docetaxel的溶解度提高了近100倍。
2.3 NPs-Docetaxel在25 ℃5%葡萄糖水溶液中的稳定性 NPs-Docetaxel的起始大小为124.7 nm,随其在25 ℃葡萄糖水溶液中放置时间的延长,纳米粒子逐渐变大,见图2。样品放置48 h以内,没有明显沉淀,粒子小于240 nm(DLS检测)。
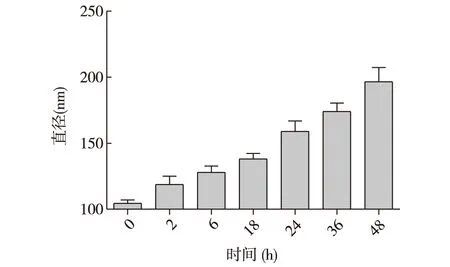
图2 白蛋白多烯紫杉醇粒子与5%葡萄糖孵育48 h内粒径的变化
2.4 Docetaxel及其制剂对大鼠血液毒性 大鼠分别连续3次给予生理盐水、Docetaxel和NPs-Docetaxel制剂后,抗凝管采血,结果显示,Docetaxel组与生理盐水组相比,白细胞数目呈显著性降低(P<0.05,图3a),而NPs-Docetaxel组白细胞与对照组相比,无显著下降(图3a)。Docetaxel和NPs-Docetaxel注射剂与对照组相比,对大鼠红细胞数量无显著影响(图3b)。NPs-Docetaxel所致的骨髓抑制较Docetaxel更低。
2.5 NIR-797-NPs-Docetaxel在荷瘤小鼠体内的分布 将1 h、24 h和72 h的NIRF数据信号提取后,获取荧光信号如图4。结果显示:24 h内,NIR-797组小鼠(左)和NIR-797-NPs-Docetaxel组小鼠(右)荧光主要在腹腔和膀胱位置富集,可能NIR经过胆道沿着肠道排泄,另外沿泌尿系统移行至膀胱,而被排出体外。72 h后,NIR-797小鼠腹腔部位荧光难以检测,主要集中于肝脏和肿瘤部位;NIR-797-NPs-Docetaxel组小鼠荧光在肠道和肿瘤部位均有聚集(图4a)。72 h后,荷瘤小鼠各组织器官心脏、肝脏、肺脏、脾脏、肾脏、肿瘤、脑、小肠、胃被解剖剥离,近红外检测NIR荧光。结果表明,NPs-Docetaxel组肿瘤部位荧光最强,肝脏和肾脏相对弱,其他器官没有检测到纳米粒子荧光,NIR-797组小鼠肿瘤部位荧光较弱(图4b)。
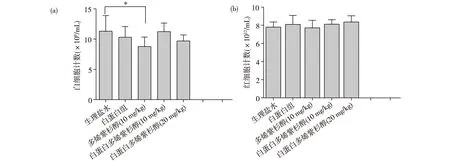
图3 大鼠全血细胞计数分析[(a)白细胞计数;(b)红细胞计数;*P<0.05]
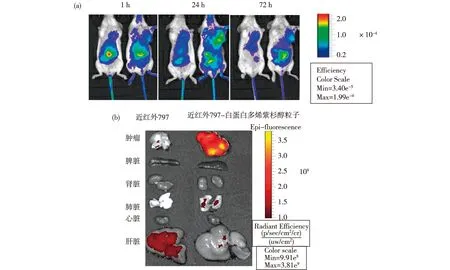
图4 小鼠成像图[(a)S180荷瘤小鼠静脉注射近红外-797、近红外-797-白蛋白多烯紫杉醇后1 h、24 h和72 h成像图; (b)72 h后,小鼠离体脏器成像]
3 讨 论
TCEP变性法可用于制备80~100 nm大小的NPs-Docetaxel。二硫键的破坏可能导致了HSA疏水性区域的暴露[11],在Docetaxel的协同作用下形成了纳米粒子。本文Docetaxel的载药量达到21.5%,大大提高了Docetaxel溶解度。临床上使用Docetaxel时,需要吐温和乙醇作为增溶剂,而NPs-Docetaxel无需吐温和乙醇增溶,避免了溶血反应的发生。纳米粒子在5%葡萄糖溶液中稳定性可达30 h,粒径仍然小于240 nm,表明NPs-Docetaxel非常稳定,符合注射剂的注射要求。NPs-Docetaxel对白细胞数量降低的影响小于Docetaxel组,骨髓抑制毒性显著降低。由于NPs-Docetaxel对肿瘤组织具有较好被动或主动靶向作用,因此,本方法制备的NPs-Docetaxel是良好的Docetaxel递送系统,具有较强的临床开发价值。
[1] 符比炜,穆 毅,路逵阳.微血管密度和血管内皮生长因子在肝细胞癌中的表达及意义[J].东南国防医药,2009,7(1):23-25.
[2] Iyer AK, Greish K, Seki T, et al.Polymeric micelles of zinc protoporphyrin for tumor targeted delivery based on EPR effect and singlet oxygen generation[J]. J Drug Target, 2007,15(7-8): 496-506.
[3] Hobbs SK, Monsky WL, Yuan F, et al. Regulation of transport pathways in tumor vessels: role of tumor type and microenvironment[J]. Proc Natl Acad Sci USA, 1998, 95(8): 4607-4612.
[4] Maeda H, Wu J, Sawa T, et al.Tumor vascular permeability and the EPR effect in macromolecular therapeutics: a review[J]. J Contr Rel, 2000, 65(1-2):271-284.
[5] Duncan R. Drug polymer conjugates potential for improved chemotherapy[J]. Anti-Cancer Drug, 1992, 3(3): 175-210.
[6] 王晓萍,丰俊东.放射治疗与分子靶向药物在肿瘤治疗中的联合应用[J].东南国防医药,2008,10(4):277-280.
[7] 耿怀成,陈龙邦.抗体介导的抗肿瘤血管治疗[J].医学研究生学报,2001,14(6):535-537.
[8] Lshima Y, Chen D, Fang J, et al. S-nitrosated human serum albumin dimer is not only a novel anti-tumor drug but also a potentiator for anti-tumor drugs with augmented EPR effects[J]. Bioconjug Chem, 2012, 23 (2): 264-271.
[9] Kratz F, Muller-Driver R, Hofmann I, et al. A novel macromolecular prodrug concept exploiting endogenous serum albumin as a drug carrier for cancer chemotherapy[J]. J Med Chem, 2000, 43(7):1253-1256.
[10]Sparreboom A, Scripture CD, Trieu V, et al. Comparative preclinical and clinical pharmacokinetics of a cremophor-free, nanoparticle albumin-bound curcumin (ABI-007) and curcumin formulated in cremophor (Taxol)[J]. Clin Cancer Res, 2005, 11(11): 4136-4143.
[11]Gong G, Zhi F, Wang K, et al. Fabrication of a nanocarrier system through self-assembly of plasma protein and its tumor targeting[J]. Nanotechnology,2011, 22(29):295603-295611.
[12]Wu D, Gao Y, Chen L, et al. Anti-tumor effects of a novel chimeric peptide on S180 and H22 xenografts bearing nude mice[J]. Peptides,2010, 31(5):850-864.
(本文编辑:张仲书; 英文编辑:王建东)
Preparation and characterization of human serum albumin-docetaxel nanoparticles
GONG Guang-ming, CHEN Mei-hui, WANG Shu-dong.
DepartmentofPharmaceutics,NanjingGeneralHospitalofNanjingMilitaryCommand,PLA,Nanjing,Jiangsu210002,China
Objective To improve the solubility of docetaxel and reduce its toxic and side effects, and to improve the targeting capability of docetaxel. Methods The human serum albumin-docetaxel nanoparticles were prepared by the disulfide bond reduction method, and were observed by electron microscope. The drug loading efficiency, stability and targeting capability of nanoparticles were explored. Results Albumin-docetaxel nanoparticles were successfully fabricated through disulfide bond reduction. Albumin-docetaxel nanoparticles were about 80-100 nm in diameter, and the loading of docetaxel was up to 21.5%. The marrow depression toxicity of albumin-docetaxel nanoparticles, which could accumulate at the tumor site, was reduced. Conclusion Albumin-docetaxel nanoparticles have good targeting effect on tumor cells, which have potential value in clinical application.
human serum albumin; docetaxel; nanoparticles; self-assembly; tumor target
南京军区南京总医院院管课题(2013055)
210002江苏南京,南京军区南京总医院制剂科
王曙东,E-mail: sdwangpharm@126.com
龚光明,陈美惠,王曙东.人血浆蛋白多西紫杉醇纳米粒子的自组装及对肿瘤的靶向性[J].东南国防医药,2016,18(5):468-471.
R945
A
10.3969/j.issn.1672-271X.2016.05.006
2016-05-05;
2016-05-17)

