下调Ets2表达对裸鼠食管鳞癌移植瘤生长及mTOR/p70S6K信号通路的影响*
韩 康,马珊珊,李庆华,王欣欣,朱相展,孟 楠,韩 莉,关方霞1,#
1)郑州大学生命科学学院 郑州 450001 2)郑州大学第一附属医院 郑州 450052
下调Ets2表达对裸鼠食管鳞癌移植瘤生长及mTOR/p70S6K信号通路的影响*
韩 康1),马珊珊1),李庆华1),王欣欣2),朱相展1),孟 楠2),韩 莉2),关方霞1,2)#
1)郑州大学生命科学学院 郑州 450001 2)郑州大学第一附属医院 郑州 450052
#通信作者,女,1969年2月生,博士,教授,研究方向:生物医学,E-mail:guanfangxia@126.com
Ets2;siRNA;Eca109;裸鼠;凋亡;mTOR/p70S6K信号通路
目的:探讨下调Ets2表达对裸鼠Eca109移植瘤生长及mTOR/p70S6K信号通路的影响。方法:选择已筛选出的在体外靶向下调Ets2基因表达的siRNA片段,构建包含此片段的慢病毒(LV-siEts2)并感染Eca109,15只裸鼠随机分为空白对照组、阴性对照组和LV-siEts2组,分别背部皮下接种Eca109、LV感染的Eca109和LV-siEts2感染的Eca109,形成移植瘤,之后观察肿瘤生长情况、绘制肿瘤生长曲线并计算肿瘤抑制率。应用qRT-PCR检测肿瘤组织中Ets2 mRNA的表达,TUNEL法检测肿瘤组织细胞的凋亡,Western blot法检测肿瘤组织中Ets2、Caspase-3、Bcl-2、E-cadherin以及mTOR/p70S6K信号通路蛋白的表达。结果:LV-siEts2组肿瘤生长速度明显变慢,肿瘤体积和质量显著小于空白对照组和阴性对照组(P<0.05);LV-siEts2组肿瘤组织中Ets2 mRNA及蛋白表达水平均显著降低;LV-siEts2能引起Eca109细胞的凋亡,且上调Caspase-3和E-cadherin蛋白表达水平,而下调Bcl-2蛋白表达水平(P<0.05);LV-siEts2能显著降低mTOR及p70S6K的蛋白表达。结论:LV-siEts2在体内通过抑制mTOR/p70S6K信号通路促进细胞凋亡,从而抑制裸鼠Eca109移植瘤的生长。
食管癌是常见的恶性肿瘤之一,在世界范围内癌症病死患者中居第6位,食管癌有两种组织学类型,在中国以食管鳞状细胞癌(鳞癌)为主[1],食管鳞癌细胞具有高恶性、低分化的特点。Ets2是Ets转录因子家族的一员,与肿瘤的发生以及发展密切相关。体内外研究[2-3]发现,前列腺癌、乳腺癌、食管癌等多种肿瘤中Ets2的表达存在异常;肺腺癌中Ets2基因的表达降低;而食管鳞癌组织中Ets2基因表达增加[4-5]。作者课题组前期体外研究[6]发现,Eca109中Ets2蛋白的表达增加,使用siRNA靶向下调Ets2的表达能有效抑制食管鳞癌细胞的增殖、诱导细胞凋亡。哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)是一种在进化上高度保守的蛋白激酶,也是重要的信号转导分子,在细胞的生长、增殖、分化和迁移上起着关键调控作用[7-8]。大量研究[9-10]发现,许多肿瘤的发生和mTOR/p70S6K信号通路的异常关系密切。因此,该实验通过慢病毒(LV)介导的siRNA,靶向下调Eca109中Ets2的表达,研究下调Est2表达对裸鼠食管鳞癌移植瘤的生长及mTOR/p70S6K信号通路的影响。
1 材料与方法
1.1 主要试剂 RPMI 1640细胞培养基和FBS购自Gemini公司,RNA提取试剂盒、逆转录试剂盒和SYBR Premix Ex TaqⅡ荧光定量试剂盒购自大连TaKaRa公司,Caspase-3和Bcl-2抗体购自上海生工生物技术有限公司,E-cadherin购自武汉三鹰生物技术有限公司,mTOR和p70S6K抗体购自美国Cell Signaling Technology公司,Ets2抗体购自美国Santa Cruz公司,TUNEL细胞凋亡原位检测试剂盒购自南京凯基生物科技有限公司,LV由上海吉凯基因化学技术有限公司构建,食管鳞癌细胞株Ecal09购自中国科学院上海生物所细胞库。
1.2 LV感染Eca109细胞 实验室前期已筛选出有效下调Ets2表达的siRNA片段(上游5’-GCAGCA ACUUGAAUUUGCUTT-3’,下游5’-AGCAAAUUCA AGUUGCUGCTT-3’),送交吉凯基因制备慢病毒。按照吉凯基因提供的慢病毒使用操作说明书进行LV感染。按照比例扩大原则将Eca109接种于6孔板中,细胞40%融合状态时进行LV感染,取6.6 μL LV原液和4 μL LV-siEts2原液分别加到1 mL Enis中混匀,逐滴加到6孔板中,37 ℃培养箱培养8~12 h,观察细胞状态并更换新鲜培养基,待融合状态达90%进行传代扩大培养。感染3~4 d后,观察荧光表达情况。采用Western blot检测Eca109细胞中Ets2蛋白的表达。
1.3 裸鼠移植瘤模型的建立及实验分组 雄性5周龄BALB/c裸鼠,体重25~30 g,购自北京维通利华实验动物技术有限公司[动物生产许可证号: SCXK(京) 2003-0002] ,在郑州大学医学院动物中心饲养,饲养条件达到SPF级,裸鼠在新环境下适应10 d开始进行实验。取对数生长期细胞接种于裸鼠右侧背部皮下,每只裸鼠接种200 μL(3×107mL-1)细胞悬液。裸鼠分为3组,每组5只。空白对照组:注射Eca109;阴性对照组:注射LV空载病毒感染的Eca109;LV-siEts2组:注射LV-siEts2病毒感染的Eca109。接种细胞1周后开始隔天测量肿瘤的长径(a)和短径(b),共测量7次,按照公式V=0.5ab2计算肿瘤的体积变化并绘制生长曲线。测量完毕后处死裸鼠,取出肿瘤并称重,肿瘤抑制率=(对照组瘤重-实验组瘤重) /对照组瘤重×100%。
1.4 qRT-PCR检测肿瘤组织中Ets2 mRNA的表达
根据RNA提取试剂盒说明书提取肿瘤组织总mRNA,逆转录为cDNA后按照SYBR Premix Ex Taq Ⅱ荧光定量试剂盒说明书进行操作,利用Fast7500 Real Time System进行qRT-PCR,每个样品设置3个复孔,以GAPDH作为内参。Ets2引物序列:上游5-TTTCG GAATCAAGAATATGGACCAG-3’,下游5’-AGGGACCC ATCAAAGGTGTCAA-3’。GAPDH引物序列:上游5’-AACCACTCCTCCACCTTTGA-3’;下游5’-CTGTTGCTG TAGCCAAATTCGT-3’。
1.5 TUNEL法检测肿瘤组织细胞的凋亡 按照TUNEL凋亡试剂盒说明书进行操作,肿瘤组织石蜡切片经过脱蜡、促渗、通透、封闭后滴加50 μL TdT酶反应液,37 ℃避光反应30 min,PBS洗片,擦干周围水分,滴加50 μL Streptavidin-FITC标记工作液,37 ℃避光反应30 min,PBS洗片后滴加50 μL Anti-FITC工作液,37 ℃避光反应30 min,最后经过DAB染色和苏木素复染即可在显微镜下观察,细胞凋亡率=凋亡细胞数/细胞总数×100%。
1.6 Western blot法检测肿瘤组织中Ets2、Caspase-3、Bcl-2、E-cadherin以及mTOR/p70S6K信号通路蛋白的表达 每组取40 mg肿瘤组织磨成粉末,加入300 μL蛋白裂解液,过夜裂解,12 000 r/min 4 ℃离心10 min,取上清液并测定蛋白浓度,加入等体积2×loadding buffer煮沸,每组分别取50 μg总蛋白,进行SDS-PAGE凝胶电泳并转移至PVDF膜,脱脂奶粉溶液封闭2 h,分别加入兔抗人Caspase-3抗体(稀释500倍使用)、兔抗人E-cadherin抗体(稀释1 000倍使用)、兔抗人Bcl-2抗体(稀释500倍使用)、兔抗人mTOR抗体(稀释1 000倍使用)、兔抗人p70S6K抗体(稀释1 000倍使用)、兔抗人Ets2抗体(稀释200倍使用)或兔抗人GAPDH抗体(稀释2 000倍使用),4 ℃孵育过夜,1×TBST洗膜3次,山羊抗兔HRP抗体(稀释2 000倍使用)室温孵育2 h,1×TBST洗膜3次,ECL化学发光法成像,结果扫描后使用Image J软件进行分析。
1.7 统计学处理 采用SPSS 21.0分析。3组间肿瘤质量和肿瘤细胞凋亡率的比较采用单因素方差分析和SNK-q检验,检验水准α=0.05。
2 结果
2.1 LV感染Eca109细胞后荧光显微镜观察结果
阴性对照和LV-siEts2组均有绿色荧光表达,表明LV成功感染Eca109细胞,见图1。
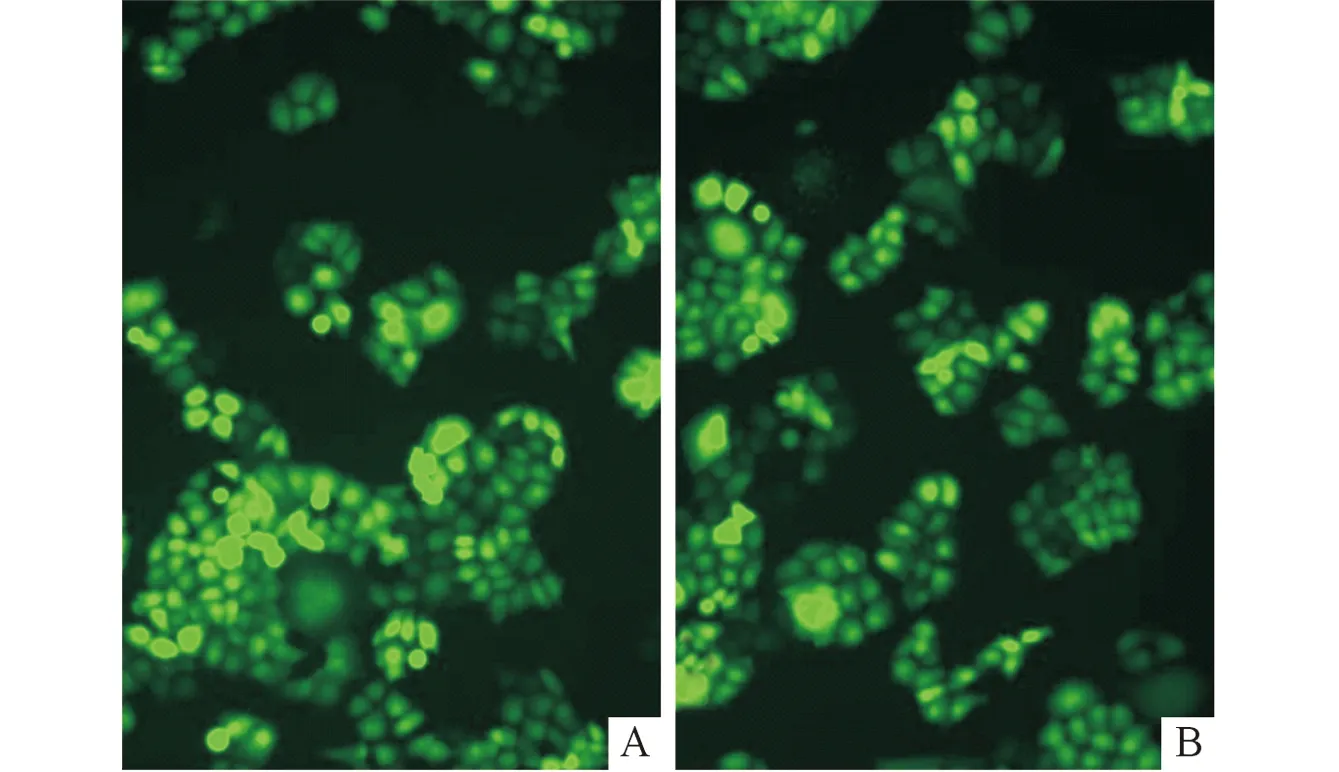
A:阴性对照组;B:LV-siEts2组。图1 LV感染Eca109细胞后荧光显微镜观察结果(×200)
2.2 各组Eca109细胞中Ets2蛋白的表达 与空白对照组相比,LV-siEts2组细胞中Ets2蛋白表达降低(图2),LV-siEts2成功下调Eca109中Ets2蛋白的表达。
2.3 肿瘤体积及质量变化情况 15只裸鼠均荷瘤成功,成瘤率100%,绘制肿瘤生长曲线(图3)。结果发现,与空白对照组相比,LV-siEts2组肿瘤体积明显减小。3组肿瘤平均质量分别为(0.65±0.13)、(0.62±0.09)和(0.21±0.06) g(F=5.581,P<0.001);LV-siEts2组肿瘤平均质量明显低于空白对照组,肿瘤抑制率约为68%,提示LV-siEts2对Eca109具有良好的抑制效果。
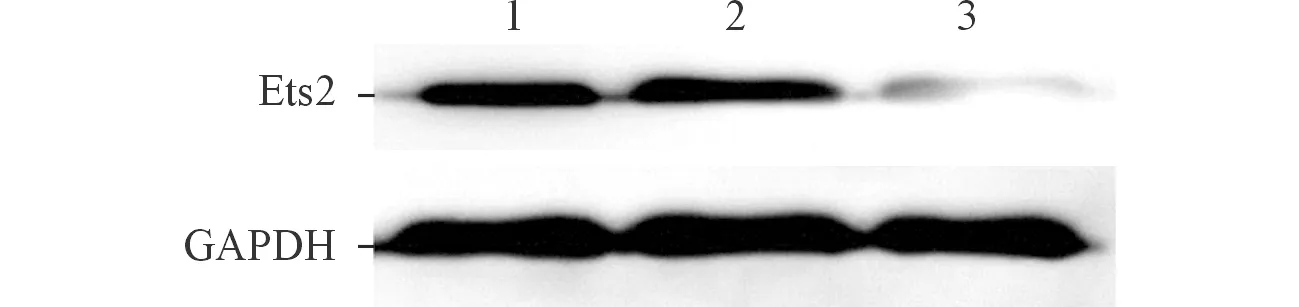
1:空白对照组;2:阴性对照组;3:LV-siEts2组。图2 各组Eca109细胞中Ets2蛋白的表达
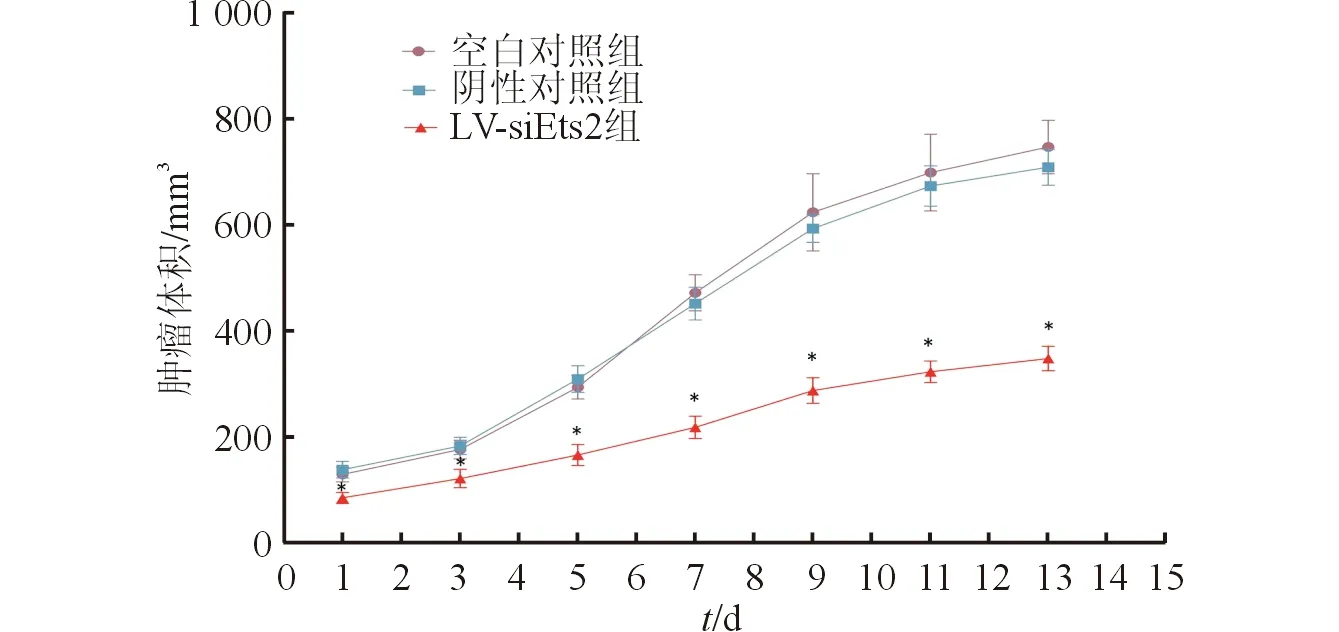
图3 肿瘤生长曲线
2.4 肿瘤组织中Ets2的表达水平 空白对照组、阴性对照组和LV-siEts2组肿瘤组织中Ets2 mRNA相对表达量分别为(1.00±0.08)、(0.92±0.05)和(0.26±0.03),差异有统计学意义(F=23.088,P=0.002)。与对照组比较,LV-siEts2组肿瘤组织中Ets2 mRNA表达水平显著降低(P<0.05)。与对照组相比,LV-siEts2组Ets2蛋白的表达水平也显著降低,见图4。
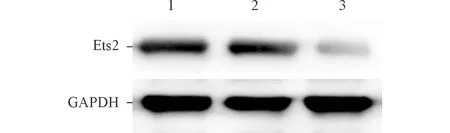
1:空白对照组;2:阴性对照组;3:LV-siEts2组。图4 各组肿瘤组织中Ets2蛋白的表达
2.5 肿瘤组织细胞的凋亡以及黏附相关蛋白的表达 空白对照组、阴性对照组和LV-siEts2组细胞凋亡率分别为(7.20±1.57)%、(8.61±1.45)%和(64.50±7.18)%,差异具有统计学意义(F=162.201,P<0.001)。与对照组相比,LV-siEts2组细胞凋亡率明显升高(图5)。与对照组相比,LV-siEts2组Caspase-3和E-cadherin蛋白表达水平升高,Bcl-2蛋白表达水平降低(图6)。

A:空白对照组;B:阴性对照组;C:LV-siEts2组。图5 各组肿瘤组织中Eca109细胞的凋亡(TUNEL,×200)

1:空白对照组;2:阴性对照组;3:LV-siEts2组。图6 各组肿瘤组织中黏附相关蛋白的表达
2.6 肿瘤组织中mTOR/p70S6K信号通路蛋白的表达 与空白对照组相比,LV-siEts2组mTOR和p70S6K蛋白表达降低,见图7。
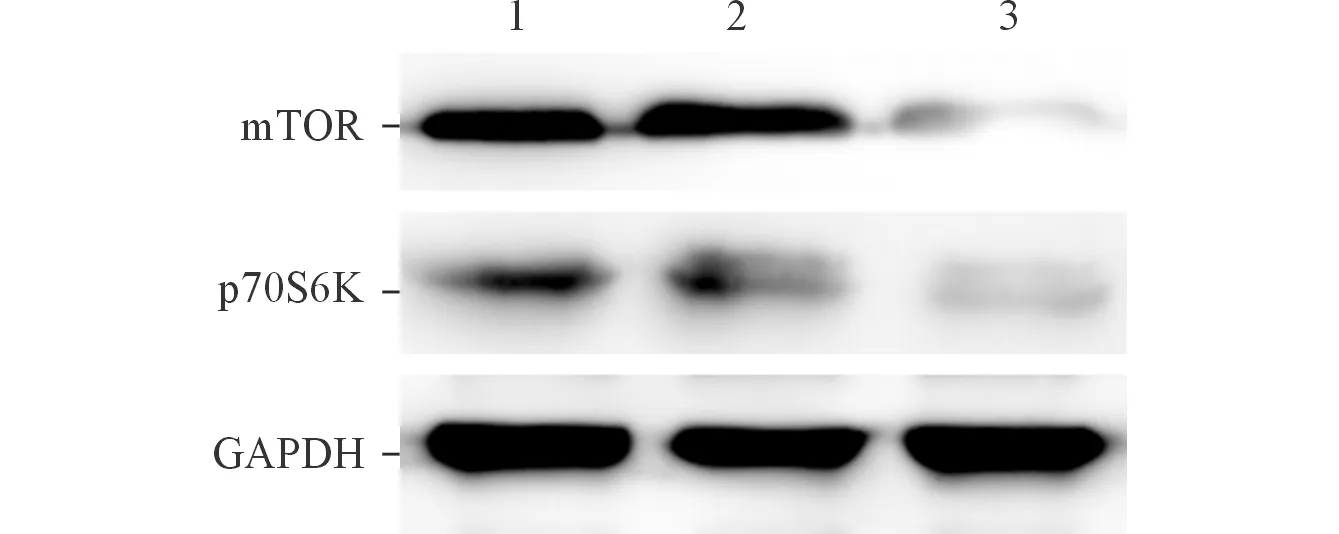
1:空白对照组;2:阴性对照组;3:LV-siEts2组。图7 各组肿瘤组织中mTOR/p70S6K信号通路蛋白的表达
3 讨论
Ets2基因位于人21号染色体上,合成包含496个氨基酸的蛋白质[11],能调控多个下游靶基因,参与调节细胞的增殖、分化、凋亡和迁移等[12]。有研究[7,13]发现,食管鳞癌组织中Ets2在mRNA和蛋白水平上均高表达;人急性单核细胞白血病细胞株SHI-1中Ets2基因高表达,靶向沉默Ets2基因的表达可促进SHI-1细胞的凋亡。作者课题组前期研究[7]发现,Ets2基因在人食管鳞癌细胞株EC1、Eca109和EC9706中均高表达,下调Ets2基因的表达能够抑制EC9706细胞的增殖,促进凋亡。该实验发现,下调Eca109中Ets2的表达能抑制肿瘤的生长;检测LV-siEts2组肿瘤组织中Ets2基因表达发现,在mRNA和蛋白水平上,其表达均显著降低。上皮细胞钙黏蛋白由E-cadherin基因编码,在维持上皮细胞表型和黏附连接中起重要作用, E-cadherin表达的降低或缺失与肿瘤细胞的黏附、浸润、迁移以及侵袭密切相关[14]。Liao等[15]研究发现,诱导胃癌细胞的迁移和侵袭后,E-cadherin蛋白表达降低。该研究结果表明,与空白对照组相比,LV-siEts2组E-cadherin蛋白表达升高,表明下调Ets2表达能增强Eca109的黏附能力,抑制迁移和侵袭。该研究发现与对照组相比,LV-siEts2组细胞凋亡率明显升高,Caspase-3蛋白表达水平升高,Bcl-2蛋白表达水平降低,表明下调Ets2表达能促进Eca109细胞的凋亡。
研究[16-17]发现,Ets2参与调控多个信号通路。PI3K通过mTOR/Ets2诱导下游基因的转录,PI3K/mTOR/Ets2信号通路在癌症的发生与发展过程中发挥重要作用。体内研究[18-19]发现,肝癌组织和食管鳞癌组织中mTOR的表达水平显著高于正常组织,且mTOR的表达水平越高,p70S6K的表达水平也越高。该研究结果表明,与对照组相比,LV-siEts2组mTOR和p70S6K蛋白表达均显著降低,Ets2表达下调能降低mTOR和p70S6K蛋白的表达,表明下调Ets2表达后可通过调节mTOR/p70S6K信号通路的活性抑制肿瘤的生长。
综上所述,Ets2可能成为食管鳞癌诊断和治疗的新型靶点,为食管鳞癌的分子治疗提供实验依据。
[1]QIU Y,ZOU YB,LI K,et al.Effect of Altered WIG-1 Expression on DDP sensitivity in a DDP-resistant esophageal squamous cancer cell line[J].Curr Cancer Drug Targets,2012,12(8):950
[2]ISLAS JF,LIU Y,WENG KC,et al.Transcription factors ETS2 and MESP1 transdifferentiate human dermal fibroblasts into cardiac progenitors[J].Proc Natl Acad Sci U S A,2012,109(32):13016
[3]PALENCIA-DESAI S,KOHLI V,KANG J,et al.Vascular endothelial and endocardial progenitors differentiate as cardiomyocytes in the absence of Etsrp/Etv2 function[J].Development,2011,138(21):4721
[4]KABBOUT M,GARCIA MM,FUJIMOTO J,et al.ETS2 mediated tumor suppressive function and Met oncogene inhibition in human non-small cell lung cancer[J].Clin Cancer Res,2013,19(13):3383
[5]LI X,LU JY,ZHAO LQ,et al.Overexpression of ETS2 in human esophageal squamous cell carcinoma[J].World J Gastroenterol,2003,9(2):205
[6]杨露,张楠楠,张彦婷,等.Ets2 siRNA 转染对 EC9706细胞增殖、侵袭、周期和凋亡的影响[J].郑州大学学报(医学版),2015,50(4):453
[7]ZHENG Y,COLLINS SL,LUTZ MA,et al.A role for mammalian target of rapamycin in regulating T cell activation versus anergy[J].J Immunol,2007,178(4):2163
[8]PEPONI E,DRAKOS E,REYES G,et al.Activation of mammalian target of rapamycin signaling promotes cell cycle progression and protects cells from apoptosis in mantle cell lymphoma[J].Am J Pathol,2006,169(6):2171
[9]ZHANG YJ,DAI Q,SUN DF,et al.mTOR signaling pathway is a target for the treatment of colorectal cancer[J].Ann Surg Oncol,2009,16(9):2617
[10]李帅帅,孙军.PI3K/AKT/mTOR信号传导通路在姜黄素抑制人肝癌细胞Cox-2表达中的作用[J].解放军医学杂志,2014,39(1):30
[11]SANIJ E,SCOTT B,WILSON T,et al.Characterization of monoclonal antibodies specific to the transcription factor ETS-2 protein[J].Immunol Lett,2003,86(1):63
[12]OIKAWA T,YAMADA T.Molecular biology of the Ets family of transcription factors[J].Gene,2003,303:11
[13]黄纯.靶向siRNA沉默Ets2基因对人急性单核细胞白血病细胞株SHI-1化疗敏感性影响的实验研究[D].武汉:华中科技大学,2010.
[14]赵荣志.上皮细胞间质化与肿瘤的转移[J].中国肺癌杂志,2011,14(7):620
[15]LIAO YL,HU LY,TSAI KW,et al.Transcriptional regulation of miR-196b by ETS2 in gastric cancer cells[J].Carcinogenesis,2012,33(4):760
[16]LI M,ZHANG Z,HILL DL,et al.Curcumin, a dietary component, has anticancer, chemosensitization, and radiosensitization effects by down-regulating the MDM2 oncogene through the PI3K/mTOR/ETS2 pathway[J].Cancer Res,2007,67(5):1988
[17]隆霜,沈宜,谢莹珊,等.乳腺癌MDA-MB-231细胞源Exosomes对内皮细胞增殖的影响及MAPK/ERK和PI3K/Akt信号通路的作用[J].解放军医学杂志,2012,37(11):1054
[18]彭贵主,吴波,单人锋,等.mTOR/P70S6K信号通路在肝细胞肝癌中的表达及临床意义[J].世界华人消化杂志,2008,16(29):3279
[19]尹玉慧,张艳,李晟磊,等.mTOR和p-p70S6K在食管鳞癌组织中蛋白表达的相关性及其临床意义[J].世界华人消化杂志,2011(23):2450
(2015-10-09收稿 责任编辑李沛寰)
Effect of downregulating Ets2 on tumor growth and mTOR/p70S6K signaling pathway in nude mice xenografted esophageal squamous cell carcinoma
HANKang1),MAShanshan1),LIQinghua1),WANGXinxin2),ZHUXiangzhan1),MENGNan2),HANLi2),GUANFangxia1,2)
1)CollegeofLifeSciences,ZhengzhouUniversity,Zhengzhou450001 2)TheFirstAffiliatedHospital,ZhengzhouUniversity,Zhengzhou450052
Ets2;siRNA;Eca109;nude mice;apoptosis;mTOR/p70S6K signaling pathway
Aim: To observe the effect of downregulating expression of Ets2 on the tumor growth and mTOR/p70S6K signaling pathway in nude mice xenografted Eca109 tumor.Methods: The siRNA which could down-regulate the expression of Ets2 effectively in vitro had been selected before. LV containing the siRNA(LV-siEts2) was established and infected Eca109. Fifteen nude mice were randomly allocated into control group, negative control group and experimental group. Eca109, Eca109 infected by LV and Eca109 infected by LV-siEts2 were inoculated subcutaneously into nude mice to establish transplantation tumor. Later,we observed tumor growth, drawn the tumor growth curve and calculated the tumor inhibition rate. The expression of Ets2 mRNA in tumor tissue was detected by qRT-PCR and cell apoptosis was detected by TUNEL. The protein expression of Ets2,Caspase-3,Bcl-2,E-cadherin and mTOR/p70S6K signaling pathway in tumor tissue was detected by Western blot. Results: The growth rate of tumors in the experimental group slowed down significantly and tumor size and weight was less than the control group and negative control group(P<0.05),besides,the mRNA and protein expression of Ets2 in tumor tissue from the experimental group was reduced significantly. The results of TUNEL demonstrated that LV-siEts2 could significantly induce apoptosis of Eca109 cells(P<0.05). The protein expression levels of Caspase-3 and E-cadherin increased and the protein expression levels of Bcl-2 decreased. In addition, The results of Western blot demonstrated that LV-siEts2 could down-regulate the protein expression level of mTOR and p70S6K significantly. Conclusion: LV-siEts2 could promote cell apoptosis by inhibiting mTOR/p70S6K signaling pathway in vivo, thus inhibiting tumor growth in nude mice xenografted Eca109 tumor.
10.13705/j.issn.1671-6825.2016.06.002
*国家自然科学基金项目 81471306,U1404313,河南省高等学校重点科研项目 15A310028
R735.1

