脂肪间充质干细胞治疗实验性自身免疫性脑脊髓炎小鼠的效果*
薛 鹏,李金凤,刘新珊,刘 金,刘凤姣,秦亚茹,段海峰#,王运良#
1)郑州大学第二附属医院神经内科 郑州 450014 2)中国人民解放军第148医院神经内科 淄博 255330 3)军事医学科学院放射与辐射医学研究所 北京 100853
脂肪间充质干细胞治疗实验性自身免疫性脑脊髓炎小鼠的效果*
薛 鹏1),李金凤2),刘新珊2),刘 金3),刘凤姣3),秦亚茹3),段海峰3)#,王运良1)#
1)郑州大学第二附属医院神经内科 郑州 450014 2)中国人民解放军第148医院神经内科 淄博 255330 3)军事医学科学院放射与辐射医学研究所 北京 100853
#通信作者:王运良,男,1964年10月生,博士,教授,研究方向:神经病学,E-mail:wangyunliang81@163.com;段海峰,男,1973年6月生,博士,教授,研究方向:白血病的干细胞治疗,E-mail:duanhf0720@163.com
多发性硬化;脂肪间充质干细胞;自身免疫性脑脊髓炎;调节性T细胞;小鼠
目的:观察脂肪间充质干细胞(ADMSC)移植治疗实验性自身免疫性脑脊髓炎(EAE)小鼠的疗效。方法:实验第0、7天采用髓鞘少突胶质细胞糖蛋白作为抗原与完全弗氏佐剂免疫小鼠,ADMSC组(n=14)小鼠于免疫后第14、21、28天尾静脉注射ADMSC(5.5×106个/只),EAE组(n=13)注射同等体积的生理盐水;对照组(n=12)不免疫,不给予ADMSC。实验过程中对小鼠进行神经功能缺损评分;第33天,取脊髓行病理观察,进行炎性细胞浸润评分和脱髓鞘评分;ELISA法检测小鼠外周血TNF-α、IL-17和IL-4水平;流式细胞术测定小鼠脾脏中CD4+Foxp3+T细胞(Treg)的比例。结果:与EAE组相比,ADMSC组小鼠神经功能缺损评分、脊髓组织中炎性细胞浸润和脱髓鞘评分降低(P<0.05);外周血IL-4水平升高,而TNF-α和IL-17水平降低(P<0.05);脾脏中Treg细胞比例明显升高(P<0.05),接近对照组水平。结论:ADMSC移植可显著改善EAE小鼠的神经功能。
多发性硬化(multiple sclerosis,MS)是以中枢神经系统白质炎性脱髓鞘病变为主要特点的自身免疫性疾病。该病病程呈现缓解-复发的发作过程,多次发作可导致运动功能障碍,最终可致全身瘫痪,严重影响患者的日常生活,降低患者的生活质量[1]。现阶段对MS治疗有效的药物是芬戈莫德,该药是一种新型免疫抑制剂,具有强大的免疫抑制功效,但有一定的局限性及不足,最常见的不良反应有头痛、流感症状、腹泻、背痛、肝转氨酶升高和咳嗽等。间充质干细胞具有强大的免疫调节和分化修复功能,间充质干细胞移植治疗逐渐成为MS的研究热点[2-6]。脂肪间充质干细胞(adipose mesenchymal stem cell,ADMSC) 因具备多向分化能力及抗炎作用等优点已成为移植修复多种疾病损伤的种子细胞之一[7-8]。作者建立了实验性自身免疫性脑脊髓炎(experimental autoimmune encephalomyelitis,EAE)小鼠模型,观察ADMSC移植后小鼠临床症状、神经功能、炎性因子表达和调节性T细胞(regulatory T cell,Treg)比例的变化,为ADMSC治疗MS的可行性提供一定的实验依据。
1 材料与方法
1.1 动物、细胞和试剂 SPF级健康雌性C57BL/6小鼠42只,体重16~20 g,购自军事医学科学院实验动物中心。ADMSC由军事医学科学院二所三室细胞库保存。髓鞘少突胶质细胞糖蛋白35-55(MOG35-55),纯度>95%,购自上海吉尔生化有限公司;百日咳毒素(PTX)和弗氏完全佐剂(CFA)购自美国Sigma公司;TNF-α、IL-4和IL-17 ELISA检测试剂盒购自北京康为世纪生物科技有限公司;CD4-FITC、Foxp3-PE抗体购自美国Biolegend公司。
1.2 EAE模型的构建 参照Hesske等[9]报道的方法建立EAE小鼠模型。简述如下:用0.01 mol/L的PBS稀释MOG35-55至终浓度为1 g/L,然后将MOG35-55稀释液与等体积CFA(结核分枝杆菌终浓度为5 g/L)混合,用10 mL注射器反复抽打混合液至油包水状态,制做成诱导EAE所需要的抗原乳剂。记免疫当天为第0天。分别于第0天和第7天在小鼠侧腹部两点皮下注射抗原乳剂0.1 mL,于第0、2天腹腔注射百日咳疫苗0.2 mL/只(含300 ng PTX)。
1.3 实验分组 根据体重随机选取12只作为对照组,余30只制备EAE模型。造模过程中3只小鼠死亡,余27只随机分为EAE组(13只)和ADMSC组(14只)。ADMSC组小鼠分别在第14、21、28天尾静脉注射ADMSC(5.5×106个/只,0.2 mL),EAE组注射同等体积的生理盐水。对照组小鼠给予生理盐水代替抗原乳剂,不接种百日咳疫苗,不注射ADMSC。
1.4 观察指标
1.4.1 小鼠一般状况 第0天开始至第33天,每日称量小鼠体重,密切观察小鼠摄食情况,并采用双盲法进行神经功能缺损评分。评分标准采用0~5级评分法:无任何症状为0分;尾巴张力降低或轻度步态笨拙为1分;双侧后肢力量轻度减弱为2分;双侧后肢力量明显减弱为3分;双侧后肢完全瘫痪为4分;后肢瘫痪合并前肢力量减弱或濒死状态为5分。
1.4.2 病理学观察 第33天通过腹腔注射戊巴比妥钠(40 mg/kg)麻醉小鼠,无菌剖开胸腔并露出心脏,通过左心室灌注无菌生理盐水至肝脏变白,之后再用多聚甲醛灌注固定,将小鼠脊髓取出后立即浸入多聚甲醛中固定,石蜡包埋,5 μm厚切片。①HE染色,光镜下观察小鼠脊髓炎性细胞浸润情况。评分标准:0分,无炎性细胞;1分,少数炎性细胞散在分布;2分,较多炎性细胞浸润在脊髓血管周围;3分,脊髓中形成较多的血管套并延伸到邻近区域内,或邻近区域内的浸润未形成血管套。②为了检测脊髓髓鞘脱失情况,进行固绿髓鞘染色(LFB)。脱髓鞘评分标准:0分,无髓鞘脱失;1分,1个小的脱髓鞘病灶;2分,2~3个脱髓鞘小病灶;3分,1~2个大的脱髓鞘病灶;4分,广泛髓鞘脱失且脱髓鞘面积大于白质总面积的20%。
1.4.3 小鼠外周血中TNF-α、IL-4和IL-17水平测定 摘取小鼠眼球取外周血,使血液自然流出(防止溶血),滴于1.5 mL EP管中,室温静置30 min,4 ℃12 000 r/min离心15 min,吸取上层血清,-20 ℃保存备用。按照ELISA检测试剂盒说明书的要求检测外周血中TNF-α、IL-4及IL-17水平。
1.4.4 小鼠脾脏Treg细胞比例的测定 第33天,颈椎脱臼法处死小鼠,每组3只,碾碎小鼠脾脏,在小鼠淋巴细胞分离液辅助下,离心获取脾脏细胞悬液,每只小鼠取细胞为1.5×106个,用CD4-FITC、Foxp3-PE抗体标记细胞,上流式细胞仪,用FlowJo 软件分析CD4+Foxp3+T细胞的比例。
1.5 统计学处理 实验数据采用SPSS 10.0分析,EAE与ADMSC组小鼠神经功能缺损评分、炎性细胞浸润评分和脱髓鞘评分的比较采用两独立样本t检验,3组小鼠体重、外周血细胞因子水平和脾脏中Treg细胞比例的比较采用单因素方差分析,两两比较采用LSD-t检验,检验水准α=0.05。
2 结果
2.1 3组小鼠疾病表现 EAE组小鼠从免疫后第9至第11天陆续发病,表现为毛色发暗,尾部远端下垂拖地,反应较迟钝,活动减少,食欲较差、摄食量减少,体重逐渐下降,神经功能缺损评分逐渐增加。第15~18天小鼠发病达到高峰期,表现为步态蹒跚不稳、跌倒,尾部完全无力、拖地,双侧后肢完全瘫痪,不能行走,严重时前肢也无力,甚至达到濒死状态。疾病高峰期过后,大部分小鼠的症状有所缓解,神经功能缺损评分降低,个别小鼠出现缓解后再加重的症状。ADMSC组小鼠治疗前表现同EAE组,治疗后症状逐渐缓解,第30天后大部分小鼠仅遗留有尾部拖垂的症状,呈EAE慢性病程表现。
从第18天开始,ADMSC组小鼠神经功能缺损评分明显低于EAE组小鼠(图1)。对照组小鼠体重逐天增加;EAE组和ADMSC组小鼠体重从第13天开始逐渐下降,在发病高峰期降至最低,之后逐渐增加,2组小鼠体重变化上差异并无统计学意义(图1)。

图1 3组小鼠神经功能缺损评分和体重的变化
2.2 小鼠脊髓病理学改变 第33天,对照组小鼠脊髓未发现明显的病理异常变化,脊髓炎性细胞浸润评分和脱髓鞘评分均为0。EAE组脊髓有大量炎性细胞浸润,小血管附近呈“袖套样”浸润,存在髓鞘脱失;ADMSC组炎性细胞明显减少,髓鞘脱失情况好转(图2、表1)。
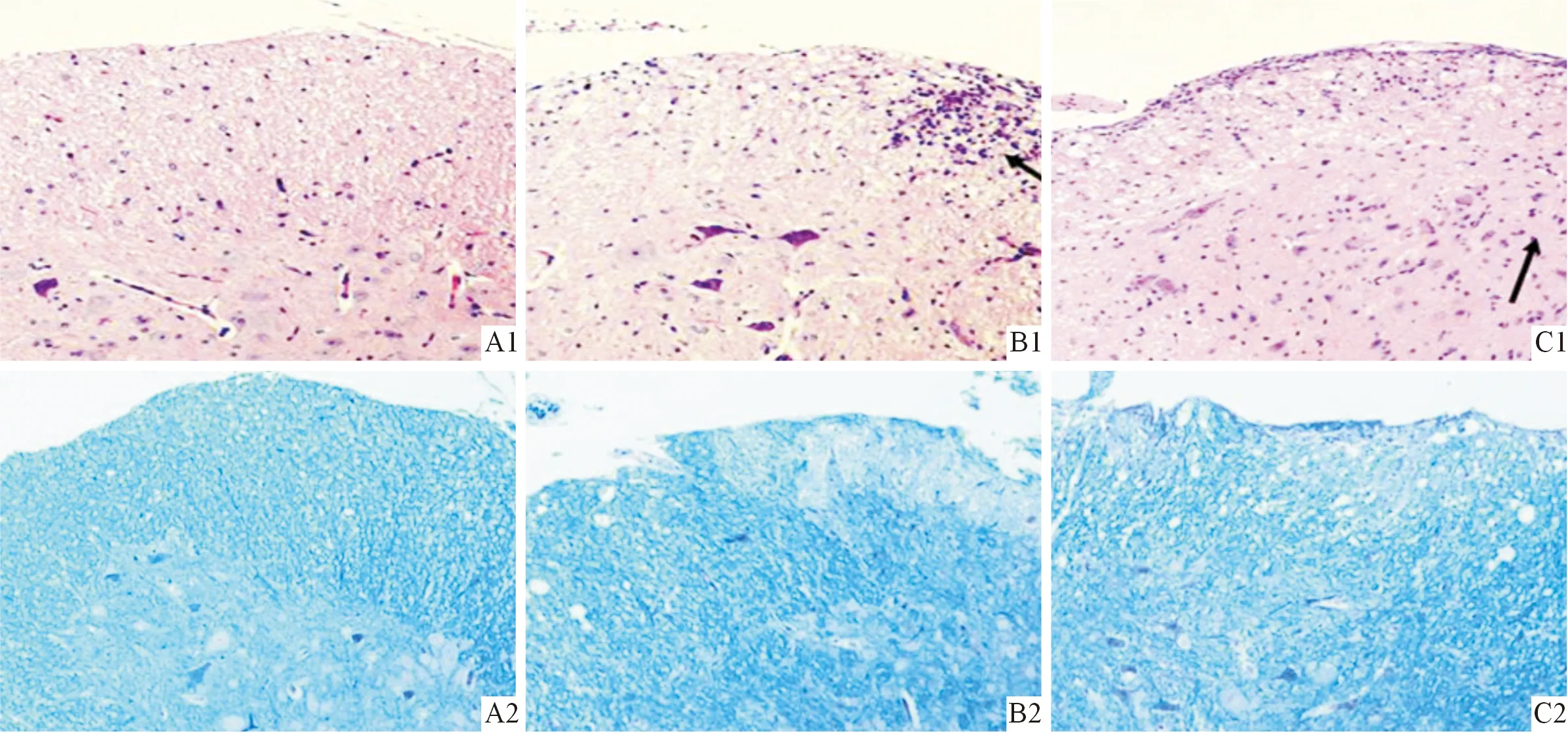
图2 对照组(A)、EAE组(B)、ADMSC组(C)小鼠脊髓HE(1)、LFB(2)染色(×100)表1 EAE组和ADMSC组小鼠 脊髓炎性细胞浸润评分、脱髓鞘评分的比较
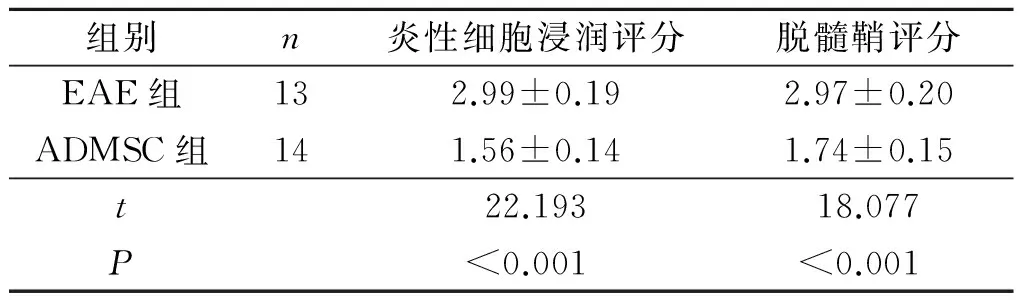
组别n炎性细胞浸润评分脱髓鞘评分EAE组132.99±0.192.97±0.20ADMSC组141.56±0.141.74±0.15t22.19318.077P<0.001<0.001
2.3 3组小鼠外周血TNF-α、IL-4及IL-17水平的比较 第33天,与对照组比较,EAE组小鼠外周血TNF-α 和IL-17水平升高,IL-4水平降低;与EAE组比较,ADMSC组小鼠外周血TNF-α 和IL-17水平降低,IL-4水平升高(P<0.01),见表2。
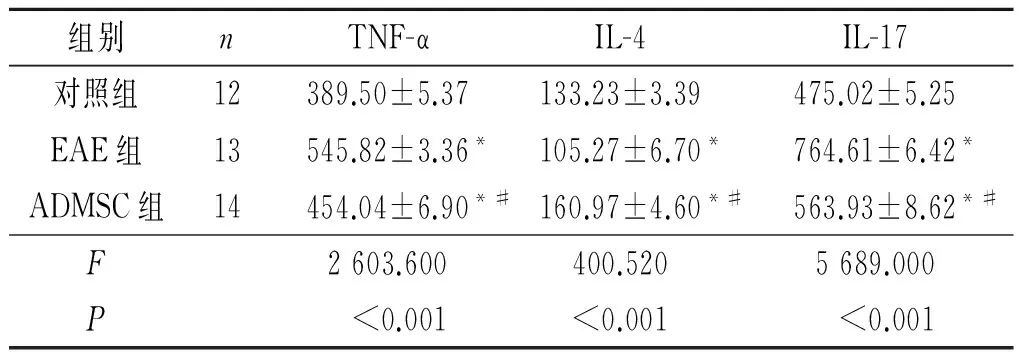
表2 3组小鼠外周血 TNF-α、IL-4及IL-17水平的比较 μg/L
*:与对照组比较,P<0.05;#:与EAE组比较,P<0.05。
2.4 3组小鼠脾脏Treg细胞比例的比较 对照组、EAE组和ADMSC组小鼠脾脏Treg细胞比例分别为(11.41±1.20)%、(5.28±2.20)%和(10.87±0.80)%,3组比较,差异有统计学意义(F=65.090,P<0.001);EAE组较对照组显著降低(P<0.05);而ADMSC组较EAE组明显升高(P<0.05),并与对照组相比无明显差异(P>0.05)。
3 讨论
MS是一种自身免疫性中枢神经系统慢性炎性脱髓鞘性疾病,神经系统炎症反应、神经元轴突损害和髓鞘脱失是其3个重要病理改变;炎症反应造成神经元髓鞘脱失,炎症反应和髓鞘破坏又损伤轴突,最终导致神经退行性病变和损伤[10-11]。目前,对于MS主要采取免疫调节治疗,但由于缺乏有效的髓鞘再生机制以及神经元不可逆的损伤和轴突损害,治疗效果并不理想。近几年来,很多研究者[2-5]发现通过干细胞移植治疗可以改善局部损伤微环境,从而促进髓鞘及神经的修复和再生,减少轴突损伤,促进形成新的突触联系并使神经信息传导功能得以恢复。
ADMSC移植是一种潜在的促使髓鞘再生和修复的有效手段[12-16]。ADMSC不仅具有免疫调节功能,还可以调节炎性因子的表达,而且具有神经修复功能和多向分化能力,可减轻神经系统的炎症反应,进而减少神经系统白质的髓鞘脱失。ADMSC可分化为神经元和神经胶质细胞,新生的神经元细胞可以弥补受损细胞的功能,使神经功能得以维持。
该实验中,作者通过注射抗原佐剂建立EAE小鼠模型,并在小鼠发病高峰期尾静脉注射ADMSC(5.5×106个/只),观察小鼠的发病情况、体重变化、神经功能缺损评分和病理学改变。研究结果表明,尾静脉注射ADMSC后EAE小鼠的神经功能缺损评分显著下降,临床症状明显减轻,炎性细胞浸润和髓鞘脱失现象明显减少。在EAE病理过程中,Th1型和Th2型细胞关系失衡,Th1型细胞、单核细胞及巨噬细胞参与了EAE的脱髓鞘过程,由Th1型细胞产生的TNF-α、IL-17等促炎细胞因子可促进T细胞和巨噬细胞的活化,并且可以直接破坏血脑屏障,使炎性细胞进入神经系统,造成神经系统髓鞘脱失,在MS的发病机制中起关键作用。Th2型细胞产生的如IL-4、IL-10等抗炎细胞因子在延缓MS病理过程中有着不可替代的作用,可促进EAE的恢复[3,17-18]。该实验中,尾静脉注射ADMSC后,EAE小鼠外周血TNF-α、IL-17水平显著降低,IL-4水平增加,提示ADMSC移植可促使细胞向Th2型细胞方向分化,改变体内促炎和抗炎细胞因子的平衡,使中枢神经系统内形成一种抑炎的微环境,从而发挥神经保护作用和髓鞘保护作用。
实验中还发现,EAE组小鼠脾脏Treg细胞比例明显高于对照组;尾静脉注射3次ADMSC后,ADMSC组小鼠脾脏Treg细胞比例明显升高,远高于EAE组;表明ADMSC可以促使原始细胞向Treg细胞分化,从而发挥免疫调节和免疫抑制作用,延缓疾病进展。
综上所述,ADMSC移植可以明显改善EAE小鼠神经功能缺损症状,缩短、延缓病程,减少神经系统白质髓鞘缺失,减轻神经系统炎症反应,有望成为治疗MS的一种新的方法。该研究为ADMSC在临床上治疗MS甚至其他脱髓鞘疾病提供了一定的实验依据。
[1]王菊蓉,张冉,王栋,等.C57BL/6小鼠实验性自身免疫性脑脊髓炎模型的建立[J].第二军医大学学报,2006,27(10):1089
[2]MERKLER D,ERNSTING T,KERSCHENSTEINER M,et al.A new focal EAE model of cortical demyelination: multiple sclerosis-like lesions with rapid resolution of inflammation and extensive remyelination[J].Brain,2006,129(Pt 8):1972
[3]CONSTANTIN G,MARCONI S,ROSSI B,et al.Adipose-derived mesenchymal stem cells ameliorate chronic experimental autoimmune encephalomyelitis[J].Stem Cells,2009,27(10):2624
[4]ZHANG J,LI Y,CHEN J,et al.Human bone marrow stromal cell treatment improves neurological functional recovery in EAE mice[J].Exp Neurol,2005,195(1):16
[5]PAYNE NL,SUN G,MCDONALD C,et al.Distinct immunomodulatory and migratory mechanisms underpin the therapeutic potential of human mesenchymal stem cells in autoimmune demyelination[J].Cell Transplant,2013,22(8):1409
[6]陈虎,丁国梁.间充质干细胞在多发性硬化症治疗中的应用:全球研究探索与展望[J].解放军医学杂志,2016,41(2):87
[7]谢敏,郝好杰,刘杰杰,等.脂肪间充质干细胞促进肝脏糖酵解对2型糖尿病大鼠高血糖的改善作用研究[J].解放军医学杂志,2016,41(7):539
[8]蒋鑫萍,姜新,王瑜,等.自体脂肪间充质干细胞治疗放射性肺损伤的应用前景及研究展望[J].吉林大学学报(医学版),2015,41(3):662
[9]HESSKE L,VINCENZETTI C,HEIKENWALDER M,et al.Induction of inhibitory central nervous system-derived and stimulatory blood-derived dendritic cells suggests a dual role for granulocyte-macrophage colony-stimulating factor in central nervous system inflammation[J].Brain,2010,133(Pt 6):1637
[10]BREX PA,CICCARELLI O,O′ RIORDAN JI,et al.A longitudinal study of abnormalities on MRI and disability from multiple sclerosis[J].N Engl J Med,2002,346(3):158
[11]TRAPP BD,PETERSON J,RANSOHOFF RM,et al.Axonal transection in the lesions of multiple sclerosis[J].N Engl J Med,1998,338(5):278
[12]GERDONI E,GALLO B,CASAZZA S,et al.Mesenchymal stem cells effectively modulate pathogenic immune response in experimental autoimmune encephalomyelitis[J].Ann Neurol,2007,61(3):219
[13]GORDON D,PAVLOVSKA G,UNEY JB,et al.Human mesenchymal stem cells infiltrate the spinal cord, reduce demyelination, and localize to white matter lesions in experimental autoimmune encephalomyelitis[J].J Neuropathol Exp Neurol,2010,69(11):1087
[14]MUNOZ JR,STOUTENGER BR,ROBINSON AP,et al.Human stem/progenitor cells from bone marrow promote neurogenesis of endogenous neural stem cells in the hippocampus of mice[J].Proc Natl Acad Sci U S A,2005,102(50):18171
[15]CAPLAN AI,DENNIS JE.Mesenchymal stem cells as trophic mediators[J].J Cell Biochem,2006,98(5):1076
[16]SCUTERI A,CASSETTI A,TREDICI G.Adult mesenchymal stem cells rescue dorsal root ganglia neurons from dying[J].Brain Res,2006,1116(1):75
[17]SCRUGGS BA,SEMON JA,ZHANG X,et al.Age of the donor reduces the ability of human adipose-derived stem cells to alleviate symptoms in the experimental autoimmune encephalomyelitis mouse model[J].Stem Cells Transl Med,2013,2(10):797
[18]MARS LT,GAUTRON AS,NOVAK J,et al.Invariant NKT cells regulate experimental autoimmune encephalomyelitis and infiltrate the central nervous system in a CD1d-independent manner[J].J Immunol,2008,181(4):2321
(2015-12-25收稿 责任编辑王 曼)
Efficacy of adipose mesenchymal stem cell on experimental autoimmune encephalomyelitis mice
XUEPeng1),LIJinfeng2),LIUXinshan2),LIUJin3),LIUFengjiao3),QINYaru3),DUANHaifeng3),WANGYunliang1)
1)DepartmentofNeurology,theSecondAffiliatedHospital,ZhengzhouUniversity,Zhengzhou450014 2)DepartmentofNeurology,the148thPLAHospital,Zibo255300 3)InstituteofRadiationMedicine,AcademyofMilitaryMedicalSciences,Beijing100853
multiple sclerosis;adipose mesenchymal stem cell;autoimmune encephalomyelitis;regulatory T cell;mouse
Aim: To observe the efficacy of adipose mesenchymal stem cell(ADMSC) on experimental autoimmune encephalomyelitis(EAE) mice.Methods: At the 0,7th day during the experiment, the mice in EAE group(n=13) and ADMSC group(n=14) were immuned with MOG35-55/CFA emulsion;at the 14th,21st,28th day,ADMSC (5.5×106cells per mouse) were injected via the tail vein in ADMSC group, while normal saline instead of ADMSC were given in EAE group. The control group(n=12) were not immuned or injectd with ADMSC. Nerve function injury scoring was performed during the experiment. At the 33th day, myelin depigmentation and inflammatory cell infiltration score for spinal cord were carried out, TNF-α,IL-17,and IL-4 level in the peripheral blood were evaluated by ELISA,and the percent of CD4+Foxp3+Treg cells were analyzed by flow cytometry. Results: Compared with those of EAE group, nerve function score, myelin depigmentation score and inflammatory cell infiltration score of the ADMSC group significantly decreased(P<0.05); the level of IL-4 increased, while the levels of IL-17 and TNF-α decreased(P<0.05); the percent of CD4+Foxp3+Treg cells significantly increased(P<0.05) and reached to the level of the control group. Conclusion: ADMSC transplantation could effectively improve neural function in experimental autoimmune encephalomyelitis mice.
10.13705/j.issn.1671-6825.2016.06.011
*国家自然科学基金项目 81201760
R742

