加速溶剂萃取-高效液相色谱法测定方便面中栀子黄色素
陈建中,葛水莲,杨明建,张 元
(1.邯郸学院生命科学与工程学院,河北 邯郸 056005;2.冀南太行山区野生资源植物研发中心,河北 邯郸 056005;3.中国医科大学药学院,辽宁 沈阳 110013)
加速溶剂萃取-高效液相色谱法测定方便面中栀子黄色素
陈建中1,2,葛水莲1,杨明建1,张 元3
(1.邯郸学院生命科学与工程学院,河北 邯郸 056005;2.冀南太行山区野生资源植物研发中心,河北 邯郸 056005;3.中国医科大学药学院,辽宁 沈阳 110013)
建立一种检测方便面中栀子黄色素的加速溶剂萃取-高效液相色谱方法。采用加速溶剂萃取法萃取方便面,以甲醇为萃取剂,在1 500 psi和50 ℃静态循环提取2 次,用乙腈饱和的正己烷溶液除脂。采用XBridgeTMC18(4.6 mm×250 mm,5 μm)色谱柱,以乙腈-0.1%甲酸溶液为流动相,藏花素和藏花酸在二极管阵列检测器中的检测波长为441 nm和427 nm进行分离分析。结果表明,藏花素和藏花酸在1.0~20 μg/mL范围内具有良好的线性关系(r>0.999 6);平均回收率(n=6)在83.64%~94.82%之间;相对标准偏差为0.92%~2.13%,方法的定量限和检出限分别为0.5~1.0 μg/g和0.05~0.20 μg/g,本方法快速简便、自动化程度高、准确可靠,是一种适合测定方便面中栀子黄色素的方法。
高效液相色谱;加速溶剂萃取;栀子黄;方便面
栀子黄色素是栀子果实或藏红花的提取物,是一种橙红色液体和黄色粉末的水溶性类胡萝卜天然色素[1-2],主要成分是藏花素和藏花酸[3-4]。该色素具有降血脂、抑制肿瘤、抗氧化、天然无毒害,营养保健等功效[5-6]。我国在1989年起就将栀子黄色素列入许可使用的食品添加剂中,广泛应用于饮料、糕点或方便面等各类食品中[7-10]。但为避免食品中过量使用该食品着色剂而造成食品安全问题,GB 2760—2014《食品添加剂使用标准》中规定了各类食品中栀子黄的最大使用量[11],且在19 98年发布了GB/T 17335—1998《食品中栀子黄的测定》以控制其含量[12]。
栀子黄色素的检测方法主要有薄层色谱法[13]、紫外-可见分光光度法[14]、高效液相色谱法[15]等,在提取纯化方面检测栀子黄色色素用得较广泛的是紫外-可见分光光度法[16-20],但高效液相色谱法测定栀子黄色素准确高效,在检测定量方面越来越受到亲睐[21-23]。各类检测方法的重点和难点在于优化前处理方法,尽可能的提取栀子黄色素,并减少杂质对检测结果的干扰,提高检出限和方法的灵敏度,缩短检出时间。目前只有糕点、饮料、酒等简单基质有国标方法[12]与少量文献报道应用高效液相色谱法测定[24-25],且多以栀子苷为对照品[13,24]。而在GB 7912—2010《食品添加剂:栀子黄》中规定藏花素与藏花酸是栀子黄色素的测定成分,且其分析方法为薄层色谱法。因此以栀子苷为对照品比较不合理。目前,尚没有专门针对面条制品中栀子黄色素以藏花素和藏花酸为对照品的高效液相色谱测定方法。而目前大多采用水浴加热回流提取和柱层析法前处理,操作繁杂费时[21-22],而加速溶剂萃取法具有快速简便,使用溶剂少等优点,因此本实验采用加速溶剂萃取法能够快速简便的提取面条制品中栀子黄色素,再液液萃取除去脂肪,采用高效液相色谱法测定面条制 品中栀子黄色素的含量,并以藏花素和藏花酸为对照品,以期找到适合面条制品中栀子黄色素的测定方法,为食品中栀子黄色素的测定进一步提供依据。
1 材料与方法
1.1 材料与试剂
桶装方便面( 含栀子黄) 市购。藏花素和藏花酸(纯度>98%) 美国Chroma DEX公司;乙腈、甲醇、正己烷(均为色谱纯) 美国Fisher Scientific公司;乙酸(纯度>99.8%,色谱纯) 西陇化工有限公司;尼龙滤膜(0.22 μm) 津隆有限公司;超纯水(电导率≤0.10 mS/m,25 ℃)。
1.2 仪器与设备
高效液相色谱仪 美国Waters公司;ASE350加速溶剂萃取仪 美国Dionex公司;AB204-S电子天平瑞士Mettler Toledo公司;Milli-Q超纯水处理系统 美国Millipore公司;KQ-500DE型超声仪 昆山市超声仪器有限公司;高速台式冷冻离心机 美国Beckman Coulter公司;FW-100高速万能粉碎机 北京中兴伟业仪器有限公司;涡旋混匀仪 美国OSTC公司。
1.3 方法
1.3.1 标准溶液的制备
分别准确称取藏花素和藏花酸10.0 mg到10 mL容量瓶中,甲醇溶解后定容,分别制成质量浓度为1.0 mg/mL的储备液,于-18 ℃冰箱中保存待用。分别准确移取1 mL藏花素和藏花酸储备液到同一10 mL容量瓶中,用甲醇稀释定容制成100 μg/mL的混合标准溶液,分别移取100、200、500、1 000、2 000 μL混合标准溶液分别到10 mL容量瓶中,用甲醇稀释定容至刻度,配成1、2、5、10、20 μg/mL藏花素和藏花酸混合标准曲线工作液。
1.3.2 样品前处理
取适量的方便面经磨粉机处理后待用,准确称取方便面粉末2.000 g,放到不锈钢萃取池中10 mL,甲醇为萃取剂,萃取剂体积为10 mL,在50 ℃温度和1500 psi条件下进行加热和静态循环萃取2次,氮气吹扫50 s,加速溶剂萃取完成后,用乙腈饱和的正己烷除脂,用氮吹浓缩仪将提取液浓缩10 mL以下,并用甲醇定容至10 mL,然后经0.22 μm微孔滤膜过滤,供高效液相色谱仪测定。
1.3.3 色谱条件
色谱柱:XBridgeTMC18(4.6 mm×250 mm,5 μm);流动相:0 min时,V(乙腈)∶V(0.1%甲酸溶液)=85∶15;梯度变化后5 min,V(乙腈)∶V(0.1%甲酸溶液)=30∶70;梯度变化后8 min,V(乙腈)∶V(0.1%甲酸溶液)=5∶95;梯度变化后9 min,V(乙腈)∶V(0.1%甲酸溶液)=85∶15;等度变化后12 min,V(乙腈)∶V(0.1%甲酸溶液)=85∶15;流速:1.2 mL/min;柱温:常温;二极管阵列(photodiode array,PDA)检测器;检测波长:441 nm(藏花素),427 nm(藏花酸);进样量:10 μL。
2 结果与分析
2.1 高效液相色谱分析条件的选择
2.1.1 检测波长的选择
以5 μg/mL的藏花素和藏花酸混合标准溶液进样,以PDA为检测器,所得光谱图如图1所示,藏花素在441 nm波长处有最大吸收;藏花酸在427 nm波长处有最大吸收,因此选择441 nm作为藏花素的检测波长;选择427 nm作为藏花酸的检测波长。

图1 藏花素(A)和藏花酸(B)的PDA光谱图Fig. 1 Adsorption spectra of crocin (A) and crocetion (B)
2.1.2 流动相的选择
本实验分别考察乙腈-水、甲醇-水、乙腈-0.1%甲酸溶液、甲醇-0.1%甲酸溶液、甲醇-乙酸铵溶液等作为流动相时,藏花素和藏花酸的出峰情况。结果表明,50%等度洗脱时在V(乙腈)-V(0.1%甲酸溶液)峰形较好,乙腈-水、甲醇-水、甲醇-0.1%甲酸溶液、甲醇-乙酸铵溶液作为流动相时,存在峰形矮胖或拖尾严重或无法看到峰形等现象,这可能是因为被测组分与色谱柱上的硅醇基团相互作用,引起次级保留效应,造成样品组分峰拖尾现象。通过在流动相中加入酸性改良剂(如甲酸),有效缓解酸性组分的次级保留效应,使藏花酸的峰形得到明显改善。但在各种流动相的等度洗脱下,待测成分与杂质不能得到良好分离。因此通过调节流动相梯度和流速,使藏花素和藏花酸控制在12 min内出峰,且使样品与杂质分开,分离度良好。因此实验最终选择的高效液相色谱条件为0 min时,V(乙腈)∶V(0.1%甲酸溶液)= 85∶15;梯度变化后5 min,V(乙腈)∶V(0.1%甲酸溶液)=30∶70;梯度变化后8 min,V(乙腈)∶V(0.1%甲酸溶液)=5∶95;梯度变化后9 min,V(乙腈)∶V(0.1%甲酸溶液)=85∶15;等度变化后12 min,V(乙腈)∶V(0.1%甲酸溶液)=85∶15;流速为1.2 mL/min;柱温为常温。在12 min内实现藏花素和藏花酸的分离,如图2和图3所示。图4为方便 面样品图中藏花素的光谱图,以验证样品中的色谱峰是藏花素。
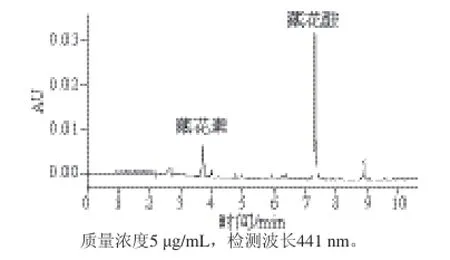
图2 栀子黄色素标准品色谱分离图Fig. 2 Chromatograpm of gardenia yellow standard

图3 方便面样品色谱图Fig. 3 Chromatogram of gardenia yellow in instant noodle
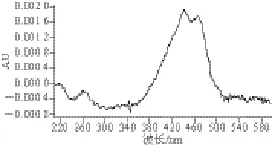
图4 样品中藏花素的光谱图Fig. 4 Absorption spectrum of crocin in sample
2.2 样品前处理条件优化
2.2.1 萃取剂的选择
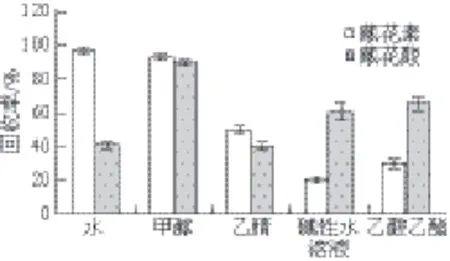
图5 5 种溶剂的回收率Fig. 5 Recoveries of gardenia yellow extracted with fi ve solvents
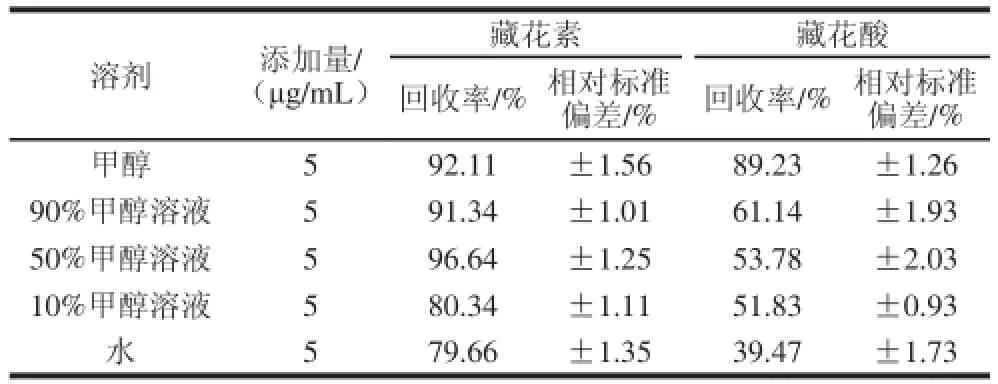
表1 萃取剂的提取效率(n==66)Table 1 Extraction effi ciency of different extraction solvents (n == 66))
栀子黄色素是一种溶于水、甲醇、乙醇等极性溶剂,不溶于苯、正己烷等非极性溶剂的混合物。实验选择水、碱性溶液、甲醇、乙腈、乙酸乙酯的溶剂进行预实验,对比了5 种提取溶剂的萃取率,如图5所示,结果显示甲醇和溶液的提取率相对理想,因此实验选择考察甲醇溶液提取栀子黄色素。在固定温度为50 ℃,静态时
间为10 min,循环2 次;氮气吹扫50 s。分别考察甲醇、90%甲醇溶液、50%甲醇溶液、10%甲醇溶液、水对样品中栀子黄色素的萃取率,结果如表1所示,甲醇萃取效率整体效果最好;甲醇溶液次之;水对藏花酸的萃取率偏低,对藏花素萃取率较高,总体不理想;因此选择甲醇作为萃取剂。
2.2.2 加速溶剂萃取方法的优化选择
加速溶剂萃取过程中萃取剂的用量较少,且萃取剂的体积有一定的限制,故不考虑萃取体积的影响。实验考察了萃取温度、萃取时间,结果如图6所示,萃取温度50 ℃的萃取效率比40 ℃的高,60~120 ℃萃取率随温度升高有所提高,但重复性和稳定性逐渐变差,说明提高温度可能减弱栀子黄色素与面条制品的吸附力,加快栀子黄色素进入溶剂中,同时温度过高影响栀子黄色素的稳定性,温度尽量控制在60 ℃以下,因此选择50 ℃作为萃取温度。静态萃取时间在10 min后变化不大,为缩短前处理时间,静态萃取时间选择10 min。与传统的水浴加热回流法相比较[21],萃取时间明显缩短,萃取溶剂体积明显减少。
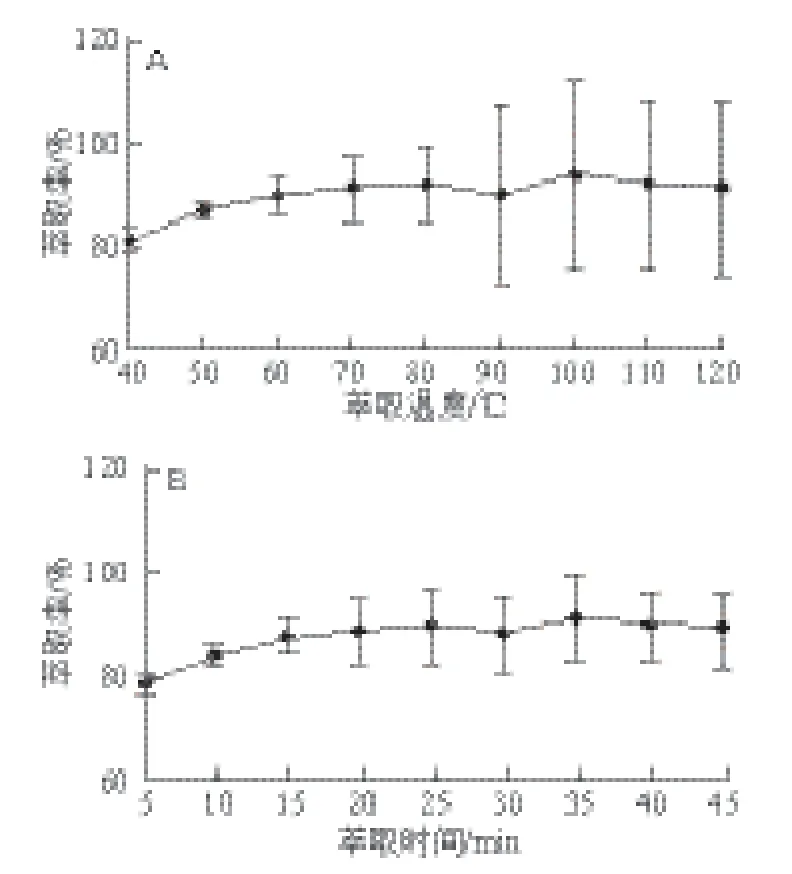
图6 萃取温度(A)和萃取时间(B)对栀子黄色素萃取率的影响Fig. 6 Infl uence of extraction temperature and time on the recovery of gardenia yellow
2.3 方法评价
2.3.1 方法的分离效果和线性关系
从图2可知,藏花素和藏花酸在1.3.3节色谱条件下,栀子黄色素混合标准溶液的分离效果良好。以峰面积(Y)对质量浓度(X)绘制标准曲线,得到的藏花素和藏花酸的标准曲线方程、线性范围和相关系数,将标准溶液稀释至响应值是噪音的3 倍(即信噪比RSN=3)为检出限,加标样品稀释至响应值是噪音的10 倍(即信噪比RSN=10)为定量限,结果见表2。结果表明,藏花素和藏花酸的标准曲线线性关系良好。方法的定量限和检出限分别为0.5~1.0 μg/g和0.05~0.20 μg/g。
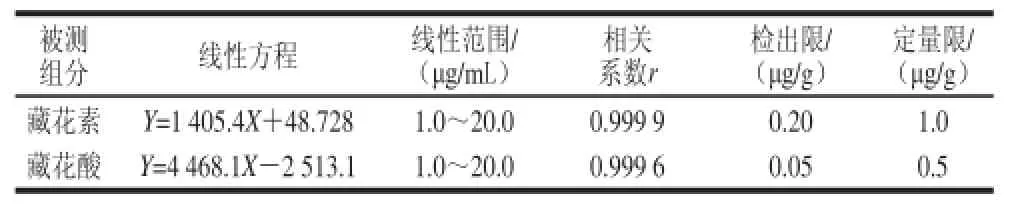
表2 栀子黄色素的线性方程、相关系数、线性范围、检出限和定量限Table 2 Standard curve equations with correlation coeffi cients and limits of detection for gardenia yellow
2.3.2 加标回收率和精密度实验结果
准确称取样品2.00 g,加入混合标准品,加标量分别为2、5、10 μg/mL的混合标准溶液1 mL,按照1.3.2节处理样品,平行处理6 份。结果表明,藏花素和藏花酸的平均回收率(n=6)为83.64%~94.82%;相对标准偏差为0.92%~2.13%,结果如表3所示。

表3 栀子黄色素加标回收率和精密度(n==66)Table 3 Recoveries and precision (relative standard deviation) of gardenia yellow in spiked samples (n == 66))
2.3.3 方法重复性和稳定性
准确称取样品2.000 g,加入1 mL 5 μg/mL混合标准溶液,按照1.3.2节方法处理样品,平行处理6份,相对标准偏差在0.72%~1.82%之间,可见该方法重复性较好。将其中一个样品分别放置0、2、4、8、12 h后,测定藏花素和藏花酸的峰面积的相对标准偏差分别为1.89%和1.73%,可见栀子黄色素在12 h内稳定性良好。
2.4 实际样品的测定结果

表4 6 个批次方便面样品的测定(n==66)Table 4 Results of determination of gardenia yellow in 6 batches of instant noodles (n == 66))
应用本方法对6 个批次的桶装方便面进行了测定,结果见表4。GB 2760—2014《食品添加剂使用标准》中规定了面条制品中栀子黄的最大使用量不能超过1.5 g/kg,样品中多含藏花素,不含藏花酸,藏花素的含量不超过国标中对栀子黄含量的规定。
3 结 论
本实验采用加速溶剂萃取法,在一定温度和压力条件下减少栀子黄色素对面条制品的吸附,提高栀子黄色素的萃取率,结果表明,在50 ℃温度和1500 psi条件下进行以甲醇溶液为萃取剂,萃取剂体积为10 mL,加热和静态循环萃取2 次,用乙腈饱和的正己烷除脂,藏花素和藏花酸的回收率可达83.64%~94.82%间,且无杂质干扰,为方便面中栀子黄色素的检测方法的建立提供依据。
[1] 陆伟, 钱骅, 张卫明, 等. 栀子黄色素的提取及精制研究[J]. 中国食品添加剂, 2010(1): 77-80. DOI:10.3969/ j.issn.1006-2513.2010.01.013.
[2] ZHU Xingyi, MANG Yili, SHEN Fengqiong, et al. Homogenate extraction of gardenia yellow pigment from Gardenia jasminoides Ellis fruit using response surface methodology[J]. Journal of Food Science and Technology, 2014, 51(8): 1575-1581. DOI:10.1007/ s13197-012-0683-2.
[3] 任治军, 何开泽, 谭健, 等. 大孔吸附树脂精制栀子黄色素[J]. 食品科学, 2005, 26(11): 157-162. DOI:10.3321/ j.issn:1002-6630.2005.11.034.
[4] 胡居吾, 熊伟, 李雄辉, 等. 大孔树脂-溶剂萃取法精制高色价栀子黄色素的集成技术研究[J]. 天然产物研究与开发, 2011, 23(2): 304-308. DOI:10.3969/j.issn.1001-6880.2011.02.026.
[5] 梅蕾蕾, 胡晓. 栀子中藏花素的药理学和药代动力学研究进展[J].中国临床药理学与治疗学, 2013, 18(7): 837-840.
[6] 唐秋琳, 赵海, 戚天胜, 等. 天然食用黄色素研究进展[J]. 中国食品添加剂, 2006(2): 68-73. DOI:10.3969/j.issn.1006-2513.2006.02.019.
[7] 邱斌, 陈卫平, 王青. 栀子黄色素稳定性研究[J]. 食品研究与开发, 2009, 30(9): 190-192. DOI:10.3969/j.issn.1005-6521.2009.09.057.
[8] 陈旭华, 林艳华, 史亚峰, 等. 栀子黄色素在方便面中的应用研究[J]. 食品科技, 2007, 32(12): 175-177. DOI:10.3969/ j.issn.1005-9989.2007.12.054.
[9] OZEKI N, UENO E, ITO Y, et al. Analysis of turmeric oleoresin, gardenia yellow, and annatto extract in foods using reversed-phase thin-layer chromatography/scanning densitometry[J]. Journal of the Food Hygienics Society of Japan, 2000, 41(6): 347-352. DOI:10.3358/ shokueishi.41.347.
[10] YANG Wenhan, WANG Jinhua, LI Xiaolin, et al. A new method research for determination of natural pigment crocin yellow in foods by solid-phase extraction ultrahigh pressure liquid chromatography[J]. Journal of Chromatography A, 2011, 1218(11): 1423-1428. DOI:10.1016/j.chroma.2010.12.121.
[11] 卫生部. GB2760—2014 食品添加剂使用标准[S]. 北京: 中国标准出版社, 2014.
[12] 中国预防医学科学院劳动卫生与职业病研究所. GB/T 17335—1998 食品中栀子黄的测定[S]. 1998.
[13] 李严巍, 王梅, 阎惠芳, 等. 食品中栀子黄色素的定性、定量方法[J].食品与发酵工业, 1996(6): 39-42. DOI:10.13995/j.cnki.11-1802/ ts.1966.06.009.
[14] 高丽, 邓青云, 姜益泉, 等. 栀子黄色素提取及其稳定性的研究[J]. 中国酿造, 2012, 31(5): 176-179. DOI:10.3969/ j.issn.0254-5071.2012.05.048.
[15] 蒋志国, 陈文学, 刘四新, 等. 低速逆流色谱分离制备栀子黄色素中的藏花素[J]. 色谱, 2011, 29(3): 277-280. DOI:10.3724/ SP.J.1123.2011.00277.
[16] 谢凤霞, 邱祖民, 涂盛辉, 等. 浸提法与超声波提取法提取栀子黄色素的比较[J]. 南昌大学学报(理科版), 2005, 29(3): 278-281. DOI:10.3969/j.issn.1006-0464.2005.03.021.
[17] 贺鹏, 罗旭璐, 阚欢, 等. 3种栀子中栀子黄色价、栀子苷及总皂苷含量比较[J]. 江苏农业科学, 2014(8): 287-288; 289. DOI:10.3969/ j.issn.1002-1302.2014.08.106.
[18] 李雄辉, 赵萍, 季清荣, 等. 不同提取工艺对栀子黄色素提取效果的比较[J]. 食品研究与开发, 2006, 27(6): 192-194. DOI:10.3969/ j.issn.1005-6521.2006.06.071.
[19] 曲晓兰, 刘希欣, 高红莉, 等. 微波-表面活性剂协同提取栀子黄色素的工艺[J]. 食品研究与开发, 2010, 31(8): 25-27. DOI:10.3969/ j.issn.1005-6521.2010.08.008.
[20] 钟雪梅, 罗乔奇, 唐敏, 等. 均匀设计法优化栀子黄色素的提取工艺[J]. 华西药学杂志, 2009, 24(2): 160-162. DOI:10.13375.CNKI. WCJPS.2009.02.004.
[21] 李永利, 张焱, 翟志雷, 等. 高效液相色谱法测定食品中栀子黄[J]. 中国卫生检验杂志, 2008, 18(1): 72; 150. DOI:10.3969/ j.issn.1004-8685.2008.01.030.
[22] 丁艳, 孙益民, 马芝森, 等. 高效液相色谱法测定食品中的栀子黄的研究[J]. 食品科学, 2006, 27(2): 199-202. DOI:10.3321/ j.issn:1002-6630.2006.02.043.
[23] 丁呈华, 曹丰璞, 杨浩, 等. 高效液相色谱法同时测定栀子黄、柠檬黄和日落黄色素[J]. 许昌学院学报, 2010, 29(5): 101-102. DOI:10.3969/j.issn.1671-9824.2010.05.030.
[24] 中国国家标准化管理委员会. GB/T 5009.149—2003 食品中栀子黄的测定[S]. 2003.
[25] 陈艳华, 于中军. 高效液相色谱法测定蛋糕中的栀子黄[J]. 中国实用医药, 2010, 24(5): 155. DOI:10.3969/j.issn.1673-7555.2010.24.123.
Determination of Gardenia Yellow in Instant Noodle by Accelerated Solvent Extraction and High Performance Liquid Chromatography
CHEN Jianzhong1,2, GE Shuilian1, YANG Mingjian1, ZHANG Yuan3
(1. College of Life Science and Engineering, Handan College, Handan 056005, China; 2. Wild Resources Plant Research Center of South Hebei Mt. Taihang, Handan 056005, China; 3. School of Pharmacy of China Medical University, Shenyang 110013, China)
A method was developed for the determination of gardenia yellow in instant noodle by accelerated solvent extraction (ASE) and high performance liquid chromatography (HPLC). The crushed samples were extracted twice using ASE with methanol at 50 ℃ and 1 500 psi, followed by defatting using n-hexane saturated with acetonitrile. Then the gardenia yellow were eluted on XBridgeTMC18with a mobile phase composed of acetonitrile and 0.1% formic acid solution, and detected by photo-diode array (PDA) detector at 441 nm for crocin and 427 nm for crocetion. The developed method had a linear range of 1.0□20 μg/mL for the two analytes with good correlation coeffi cients (r > 0.999 6). The mean re coveries were 83.64%□94.82%, with relative standard deviation (RSD) of 0.92%□2.13% (n = 6). The limit of quantitation (LOQ) and the limit of detection (LOD) of this method for gardenia yellow were 0.5□1.0 μg/g and 0.05□0.2 μg/g, respectively. The method proved to be quick, simple, automated, reliable, accurate, and suitable to detect gardenia yellow in instant noodle.
high performance liquid chromatography (HPLC); accelerated solvent extraction (ASE); gardenia yellow; instant noodle
10.7506/spkx1002-6630-201610036
TS202.3
A
1002-6630(2016)10-0208-05
陈建中, 葛水莲, 杨明建, 等. 加速溶剂萃取-高效液相色谱法测定方便面中栀子黄色素[J]. 食品科学, 2016, 37(10): 208-212. DOI:10.7506/spkx1002-6630-201610036. http://www.spkx.net.cn
CHEN Jianzhong, GE Shuilian, YANG Mingjian, et al. Determination of gardenia yellow in instant noodle by accelerated solvent extraction and high performance liquid chromatography[J]. Food Science, 2016, 37(10): 208-212. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201610036. http://www.spkx.net.cn
2015-08-05
河北省科技计划项目(13222907;12272502);邯郸市科学技术研究与发展计划项目(1422104057-2;1323108093-9);邯郸学院校级项目(15202)
陈建中(1978—),男,副教授,硕士,研究方向为天然食药植物活性物质研发。E-mail:cjzhong@126.com

