利用卡氏白和尼罗红染色观察稻瘟病菌有性世代的结构
顾卓侃 李玲 王教瑜 柴荣耀 王艳丽 张震 毛雪琴 邱海萍 孙国昌
(1杭州师范大学 生命与环境科学学院, 杭州 310036;2浙江省农业科学院 植物保护与微生物研究所, 杭州 310021;3浙江农林大学 农业与食品科学学院, 浙江 临安 311300; *通讯联系人, E-mail: wangjiaoyu78@sina.com; sungc01@sina.com)
利用卡氏白和尼罗红染色观察稻瘟病菌有性世代的结构
顾卓侃1,2李玲2,3王教瑜2,*柴荣耀2王艳丽2张震2毛雪琴2邱海萍2孙国昌2,*
(1杭州师范大学 生命与环境科学学院, 杭州 310036;2浙江省农业科学院 植物保护与微生物研究所, 杭州 310021;3浙江农林大学 农业与食品科学学院, 浙江 临安 311300;*通讯联系人, E-mail: wangjiaoyu78@sina.com; sungc01@sina.com)
GU Zhuokan, LI Ling, WANG Jiaoyu, et al. Observation of sexual structure ofMagnaportheoryzaevia Calcofluor white and Nile red staining. Chin J Rice Sci, 2016, 30(6): 668-672.
稻瘟病菌(Magnaportheoryzae)是异宗配合的子囊菌,但至目前,关于其有性世代产生过程和结构的研究相对较少。本研究利用两个稻瘟病菌菌株Guy-11与2539在多种培养基上进行杂交试验,观察有性世代产生情况。结果表明,两菌株在所有参试培养基上杂交后均能产生子囊壳,但子囊壳的数量、产生速度和成熟度各不相同,以燕麦培养基为最佳。为了进一步观察有性世代的结构,我们采用卡氏白和尼罗红对子囊和子囊孢子进行染色和荧光观察。荧光显微镜下,子囊和子囊孢子的细胞壁均能被卡氏白染成清晰的亮蓝色,细胞结构清晰可辨。成熟的子囊壳内可产生大量的子囊,子囊中含有8个子囊孢子,子囊孢子通常含有4个细胞。同时,子囊孢子能够被尼罗红染成橘红色,表明子囊孢子中储藏大量的脂肪类物质。本研究提供了一种有效的观察稻瘟病菌有性世代结构的荧光染色方法,为后续的研究奠定了基础。
稻瘟病菌; 有性生殖; 卡氏白; 尼罗红;
稻瘟病是世界各稻区危害最为严重的病害之一,其病原菌为稻瘟病菌(Magnaportheoryzae)[1]。稻瘟病菌是一种异宗配合的子囊菌,能够寄生多种禾本科作物及杂草[2,3]。1971年,Hebert首次报道马唐瘟菌能够在人工培养基上获得有性世代[4]。其后,国内外学者对稻瘟病菌及草瘟病菌做了大量的研究[5]。1976年,Kato等[6]报道了稻瘟病菌能在培养基上形成有性世代,其后各国学者也对此做了相关实验及证实,证明不同的稻瘟病菌菌株产生有性世代的能力差异极大,不同的环境条件能显著影响子囊壳的产生[7-10]。但至目前,在自然环境下仍未发现稻瘟病菌有性世代。因此,与稻瘟病菌无性阶段和侵染机制的研究相比,关于其有性世代产生过程和结构的观察相对较少。
利用特异的荧光染料和显微观察研究病菌的结构,并明确其所含成分,在稻瘟病菌侵染机制的研究中有较多的应用。卡氏白(Calcofluor White)能够结合真菌细胞壁中的纤维素和几丁质,在荧光显微镜下能够观察到蓝色荧光[11]。尼罗红(Nile Red)是一类苯吩哑嗪酮类化合物, 可以与脂类物质结合并发出橙红色荧光[12,13]。尼罗红发出的荧光能够于水中迅速发生猝灭,而多余的染料不需要清除,这相较于苏丹黑、尼罗蓝-A等染料可以更准确地区分细胞内的脂类物质和其他贮藏物[14],因而常被用于检测动物及微生物细胞内的油脂含量。卡氏白和尼罗红染色在比较稻瘟病菌细胞壁强度和分生孢子细胞内脂类转移过程中已有应用[15,16],但利用这两种物质对有性阶段进行染色观察,尚未见报道。
本研究利用两个稻瘟病菌菌株,观察了在多种培养基上的有性世代产生情况,并利用卡氏白和尼罗红染色对子囊和子囊孢子结构进行了荧光观察,研究结果为进一步研究稻瘟病菌有性世代产生的条件和产生过程提供了基础和方法。
1 材料与方法
1.1 供试菌株
稻瘟病菌菌株Guy-11、2539作为供试菌株。
1.2 培养基
参试培养基包括完全培养基(Complete medium,CM)[17]、燕麦培养基(Oatmeal agar medium,OMA)[18]、马铃薯葡萄糖培养基(Potato Dextrose Agar,PDA,马铃薯200 g/L,葡萄糖20 g/L)、淀粉酵母培养基(Starch yeast medium,Starch,酵母粉2 g/L,可溶性淀粉10 g/L,琼脂粉15 g/L)、基本培养基(Minimal medium,MM)[17]、V8培养基(V8 medium,V8)[19],均按已报道的方法进行配制。
1.3 对峙培养方法
从完全培养基[17]上培养生长5d的菌株菌落边缘切取2 mm×2 mm菌丝块,置于5种不同培养基平板上对峙培养,在24 h黑暗环境下27℃下生长7d至菌落相互接触,然后将各处理移至22℃恒温光照培养箱继续培养。
1.4 调查记录
对峙培养24 d后,通过奥利巴斯SZX10体式镜(东京,日本)观测并拍摄各种类型的培养基上子囊壳的形成情况和形态特征。
1.5 形态结构观察
将在燕麦培养基上生长28d后的Guy-11与2539杂交产生的子囊壳用牙签挑至载玻片上,覆上盖玻片,用牙签轻轻敲击盖玻片,压碎子囊壳,释放出子囊和子囊孢子,分别使用50 μg/mL的卡氏白(Calcofluor white,Fluorescent Brightener,Sigma)和尼罗红(Nile Red)染色,在奥林巴斯Xa21荧光显微镜下(东京,日本)观察子囊壳、子囊及子囊孢子结构。
2 结果与分析
2.1 不同培养基上稻瘟病菌有性世代形成情况
对峙培养24 d后,在燕麦培养基和马铃薯培养基上,产生大量子囊壳(图1-A)。成熟的子囊壳具有长长的喙(图1-B),喙突出菌落表面,形成一个个肉眼可见的小黑点。无数的小黑点,密密麻麻,在菌落交界处形成一条子囊壳带。同时,马铃薯葡萄糖培养基上还存在着一些正在生长或尚未成熟的子囊壳,这些子囊壳的喙非常短小,刚刚突出菌落表面或仍埋在培养基内。淀粉酵母培养基上只能形成极少量成熟的子囊壳,多数的子囊壳埋在培养基内,通过培养基背部给光能够看到。V8培养基与基本培养基上无法形成成熟的子囊壳,但在背光照射下仍能发现培养基内发育不成熟的子囊壳(图1-C)。计数统计表明,5种培养基中,以燕麦片培养基上产生的子囊壳数量最多(图1-C),并且最早可见(14~15 d)。
2.2 子囊壳结构的卡氏白染色观察
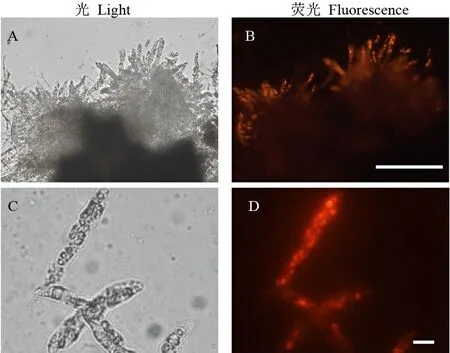
使用牙签隔着盖玻片轻轻敲打,可压碎子囊壳。大量的子囊和部分的孢子会从破裂的子囊壳中游离出来。利用卡氏白能够与细胞壁结合的特性,对碾碎的子囊壳进行染色,能够清晰地辨别子囊与子囊孢子的轮廓结构(图-2)。一个子囊通常含有8个子囊孢子,紧密排列在子囊内部。子囊孢子呈钝菱形,通常有3个隔膜,4个细胞,与稻瘟病菌分生孢子的结构有着明显的差异。仔细比较荧光亮度可以发现,子囊孢子细胞壁的亮度明显高于子囊壳和子囊壁,表明子囊孢子细胞壁中的纤维素和几丁质含量最高。
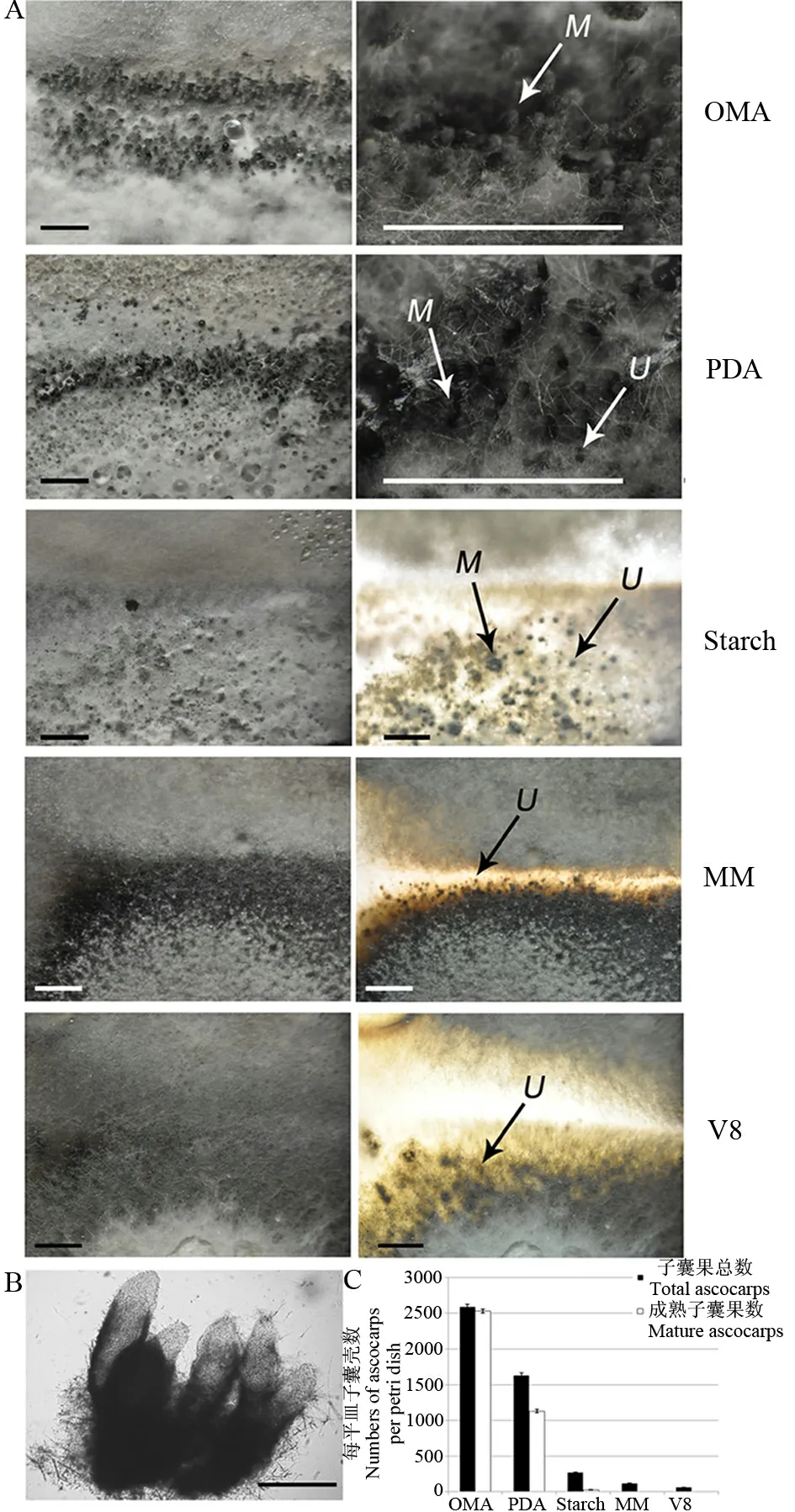
A-燕麦培养基(OMA)、马铃薯葡萄糖培养基(PDA)、淀粉酵母培养基(Starch)、基本培养基(MM)、V8培养基(V8)子囊壳形成情况;M,成熟的子囊壳;U,不成熟的子囊壳;标尺=1000 μm。B-显微镜下成熟子囊壳的形态;标尺=100 μm。C-各培养基上子囊壳的形成数量统计。
A, Perithecia formed on oatmeal agar (OMA), potato dextrose agar (PDA), starch yeast medium (Starch), minimal medium (MM) and V8 medium (V8). M, Mature perithecia; U, Unmatured perithecia. Bars=1000 μm. B, Microscopical analysis of morphology of perithecia. Bars=100 μm. C, Number of total and mature perithecia formed on different media.
图1 各培养基上子囊壳的形成情况
Fig. 1. Perithecia formed on different media.
2.3 子囊与子囊孢子的尼罗红染色
尼罗红能特异地结合真菌细胞中的脂类物质,荧光显微镜下呈现橙红色荧光[15]。利用尼罗红溶液对稻瘟病病菌的子囊壳、子囊及子囊孢子进行染色(图3),显微镜下可见,子囊孢子内部被染成明亮的橙红色,而子囊壳、子囊、子囊与孢子的间隙以及子囊孢子的细胞壁几乎不能被染色,表明子囊孢子的内部富含脂类物质,这点与无性孢子类似。

A~D-大量游离的子囊,标尺=100 μm; E-一个完整的子囊,标尺=10 μm; H-放大的子囊孢子,标尺=10 μm。
A-D, Asci migrated from a perithecium, Bars=100 μm; E and F, An intact ascus, bar=10 μm; G and H, Magnified image of an ascospore, bar = 10 μm.
图2 子囊与子囊孢子的卡氏白染色观察
Fig. 2. Structure of perithecia stained with Calcofluor white (Fluorescent Brightener) under a fluorescent microscopy.
3 小结与讨论
我们的实验结果表明,燕麦片培养基上更有利于稻瘟病菌有性世代的产生,此前也有相关的报道[3]。然而在其他参试培养基上都有初期的子囊壳产生,只是无法充分成熟或发育极慢。这表明稻瘟病菌有性世代的启动是由菌株本身的特性(交配型)决定的,但不同的营养成分可以极大地干扰其有性世代的发育和是否能产生可育的后代。自然条件下,很难发现有性生殖的存在[4]。在寄主叶片和茎干等发病部位,未见发现有性世代的报道,很可能是因为这些部位的营养物质无法满足有性世代形成对营养的需求。燕麦培养基上子囊壳发育良好,或许暗示着在水稻或其他禾本科植物籽粒上,有形成可育的有性后代的可能。
A~B-标尺=100 μm; C~D-标尺=10 μm。
A and B, Bar =100 μm; C and D, bar =10 μm.
图3 子囊与子囊孢子的尼罗红染色
Fig. 3. Perithecia and ascospores stained with Nile red.
子囊壳破碎后能够分离出大量的子囊,只凭借光学显微镜进行观察,很难清楚分辨其中子囊孢子的个数、排列情况和细胞结构。借助卡氏白对细胞壁的染色,通过荧光显微镜观察,则有效地屏蔽了子囊和孢子内容物以及杂质的干扰,从而清楚地分辨子囊和子囊孢子的细胞结构。为进一步分析不同菌株有性世代的发育状况和分离有性生殖相关突变体奠定了基础。同时,研究结果也表明,子囊孢子的细胞壁成分与分生孢子类似,均含有纤维素和几丁质等主要成分。尼罗红是脂肪的特异性染料,子囊孢子细胞可以被染上明亮的橙红色,表明细胞内富含脂质。这与分生孢子的情况类似,分生孢子内贮藏的大量脂肪在萌发过程中迅速降解,提供病菌致病过程的营养与能量[15]。稻瘟病菌的子囊孢子同样含有大量脂类物质,应该可以满足萌发和致病的需要,具有潜在的致病能力。而有关子囊孢子的萌发的详细过程、能否形成典型侵染结构及其致病能力等,仍需进一步研究。
对比有利于有性世代形成的实验室条件,我国南方稻区晚稻生育后期的温度与光照适合稻瘟病菌有性世代的形成。也有部分研究者根据分子遗传学上的证据推测,稻瘟病菌在东南亚等稻瘟病菌发源地,存在自然的有性生殖过程[20]。但即便如此,直接证据却一直很难发现,至今尚未在自然条件下发现稻瘟病菌的子囊壳。因此,明确稻瘟病菌有性世代产生的条件、过程和结构特点,将有助于在自然界中探寻病菌有性过程,完善病菌生活史,进一步明确病菌进化与变异,为病害流行测报和防控策略的制定提供理论依据。
[1] Barr M E. Magnaporthe, Telimenella, and Hyponectria (Physosporellaceae).Mycologia,1997: 952-966.
[2] Zeigler R S. Recombination inMagnaporthegrisea.AnnRevPhytopathol, 1998,36: 249-275.
[3] 沈瑛, 金敏忠. 我国稻瘟病菌有性态的研究. 中国农业科学, 1994,27: 25-29.
[4] Hebert T. The perfect stage ofPyriculariagrisea.Phytopathology, 1971,61: 83-87.
[5] Yaegashi H, Yamada M. Pathogenic race and mating type ofPyriculariaoryzaefrom Soviet Union, China, Nepal, Thailand, Indonesia and Colombia.JpnJPhytopathol, 1986, 52: 225-234.
[6] Kato H, Yamaguchi T, Nishihara N. The perfect state ofPyriculariaoryzaeCav. in culture.AnnPhytopatholSocJapan, 1976, 42: 507-510.
[7] Kolmer J A, Ellingboe A H. Genetic relationships between fertility and pathogenicity and virulence to rice inMagnaporthegrisea.CanJBot, 1988,66: 891-897.
[8] Levy M, Romao J, Marchetti M, et al. DNA fingerprinting resolves pathotype diversity in a plant pathogenic fungus.PlantCell, 1991, 3: 95-102.
[9] Silue D, Notteghem J. Production of perithecia ofMagnaporthegriseaon rice plants.MycolRes,1990, 94: 1151-1152.
[10]Valent B, Crawford M S, Weaver C G, et al. Genetic studies of fertility and pathogenicity inMagnaporthegrisea(Pyriculariaoryzae).IowaStateJRes, 1986, 60: 569-594.
[11]Nagata T, Takebe I. Cell wall regeneration and cell division in isolated tobacco mesophyll protoplasts.Planta, 1970,92: 301-308.
[12]Lambert M, Moss C W. Comparison of the effects of acid and base hydrolyses on hydroxy and cyclopropane fatty acids in bacteria.JClinMicrobiol, 1983,18: 1370-1377.
[13]Diaz G, Melis M, Batetta B, et al. Hydrophobic characterization of intracellular lipids in situ by Nile Red red/yellow emission ratio.Micron, 2008, 39: 819-824.
[14]Kranz R G, Gabbert K K, Madigan M T. Positive selection systems for discovery of novel polyester biosynthesis genes based on fatty acid detoxification.ApplEnvironMicrobiol, 1997, 63: 3010-3013.
[15]Wang J, Zhang Z, Wang Y, et al. PTS1 peroxisomal import pathway plays shared and distinct roles to PTS2 pathway in development and pathogenicity ofMagnaportheoryzae.PloSOne, 2013, 8: e55554.
[16]Li L, Wang J, Zhang Z, et al.MoPEX19, which is essential for maintenance of peroxisomal structure and woronin bodies, is required for metabolism and development in the rice blast fungus.PloSOne, 2014, 9: e85252.
[17]Talbot N J, Ebbole D J, Hamer J E. Identification and characterization ofMPG1, a gene involved in pathogenicity from the rice blast fungusMagnaporthegrisea.PlantCell, 1993,5: 1575-1590.
[18]Yi M, Park J H, Ahn J H, et al.MoSNF1 regulates sporulation and pathogenicity in the rice blast fungusMagnaportheoryzae.FungalGenetBiol, 2008, 45: 1172-1181.
[19]Kent C R, Ortiz-Bermudez P, Giles S S, et al. Formulation of a defined V8 medium for induction of sexual development ofCryptococcusneoformans.ApplEnvironMicrobiol, 2008, 74: 6248-6253.
[20]Saleh D, Xu P, Shen Y, et al. Sex at the origin: An asian population of the rice blast fungusMagnaportheoryzaereproduces sexually.MolEcol, 2012,21: 1330-1344.
Observation of Sexual Structure ofMagnaportheoryzaevia Calcofluor White and Nile Red Staining
GU Zhuo-kan1, 2, LI Ling2, 3, WANG Jiao-yu2,*, CHAI Rong-yao2, WANG Yan-li2, ZHANG Zhen2,MAO Xue-qin2, QIU Hai-ping2, SUN Guo-chang2,*
(1School of Life and Environmental Science, Hangzhou Normal University, Hangzhou 310036, China;2Institute of Plant Protection and Microbiology, Zhejiang Academy of Agricultural Sciences, Hangzhou 310021, China;3College of Agriculture and Food Science, Zhejiang A&F University, Ling′an 311300, China;*Corresponding authors, E-mail: wangjiaoyu78@sina.com; sungc01@sina.com)
Magnaportheoryzaeis an economically important heterothallic ascomycete which causes rice blast, the most destructive rice disease worldwide. To the present, sexual generation of the fungus has been relatively less investigated. In the present work, Guy-11 and 2539, twoM.oryzaestrains in opposite mating types, were cross cultured on six deferent substrates to induce the sexual generation. The strains produced ascocarps on all of the substrates tested, however, the number, forming time and ripeness degree of the ascocarps varied largely with the producing substrates, among which oatmeal agar(OMA) gave the optimum value. In order to better detect the structures of sexual generation, the asci and ascospores were stained with Fluorescent Brightener and Nile red, and examined using a fluorescence microscopy. Under the fluorescence microscope, the cell walls were stained bright blue by Fluorescent Brightener, which greatly improved the visibility of asci and ascospores. Numbers of asci were found in mature ascocarps, with eight ascospores in each ascus, and an ascospore usually has four cells. Meanwhile, the ascospores can be stained bright orangey-red by Nile red, indicating they are rich in lipids. These findings showed that the fluorescence staining is an effective method to observe the structure of sexual generation inM.oryzae.
Magnaportheoryzae; sexual generation; Calcofluor White; Nile Red
2016-03-03; 修改稿收到日期: 2016-07-27。
国家自然科学基金资助项目(31170136, 31470249); 浙江省公益技术研究农业项目(2013C32019)。
S435.111.4+1
A
1001-7216(2016)06-0668-05
顾卓侃, 李玲, 王教瑜, 等. 利用卡氏白和尼罗红染色观察稻瘟病菌有性世代的结构. 中国水稻科学, 2016, 30(6): 668-672.

