水稻根系中磷高效吸收和利用相关基因表达对低磷胁迫的应答
胡训霞 史春阳 丁艳 张萍 葛永胜 刘玉金 王泽港 葛才林,*
(1扬州大学 生物科学与技术学院, 江苏 扬州 225009;2江苏润扬种业有限公司, 江苏 仪征 211400;*通讯联系人, E-mail:clge@yzu.edu.cn; yzlyjseed@163.com)
水稻根系中磷高效吸收和利用相关基因表达对低磷胁迫的应答
胡训霞1史春阳1丁艳1张萍1葛永胜1刘玉金2,*王泽港1葛才林1,*
(1扬州大学 生物科学与技术学院, 江苏 扬州 225009;2江苏润扬种业有限公司, 江苏 仪征 211400;*通讯联系人, E-mail:clge@yzu.edu.cn; yzlyjseed@163.com)
HU Xunxia, SHI Chunyang, DING Yan, et al. Response of gene expression related to efficient phosphorus absorption and utilization to low-P stress in rice roots. Chin J Rice Sci, 2016, 30(6): 567-576.
研究水稻耐低磷机制,对高效利用土壤磷的水稻品种改良具有重要意义。应用基因芯片和qRT-PCR技术,分析了耐低磷水稻品种仪2434和低磷敏感品种通粳981根系中磷高效吸收和利用相关基因表达对低磷胁迫的应答。水稻叶片磷含量的测定结果表明,低磷胁迫下仪2434的叶片磷含量较对照降幅小,这表明仪2434较通粳981具有更强的磷素吸收利用能力。基因芯片检测结果表明,在低磷胁迫下的仪2434根系中,PHR1、osa-miR399s和SPXs基因的表达诱导、激活磷饥饿信号途径;APA、PAPs、MPE、PA、PEPC和VDAC1、C4-DT/MAT等基因的表达诱导,增强有机磷水解酶和有机酸的合成和分泌,促进介质中难溶性磷的活化;OsPT2、OsPT6基因的表达诱导,促进仪2434根系对磷的高效吸收。qRT-PCR检测结果表明,仪2434根系中与磷饥饿信号转导、磷活化、磷高效吸收相关的8个代表性基因(PHR1、SPX、PAP、APA、PEPC、MFS、OsPT2、OsPT6)的表达水平均随低磷处理时间的延长呈逐步增高的趋势;经低磷处理后,所检测的8个基因在仪2434根系中的转录水平均显著高于其在通粳981根系中的转录水平,PHR1、APA、OsPT2在通粳981根系中的表达诱导作用不明显,且仪2434根系组织和根系分泌的酸性磷酸酶活性较通粳981增强更显著,这可能是仪2434较通粳981对低磷胁迫有较高耐性的主要机制之一。
水稻; 低磷胁迫; 基因表达; 磷活化; 磷高效吸收
磷是植物生长发育必需的大量元素之一,在植物体内发挥着重要作用。磷不仅参与许多重要物质如蛋白质、脂质、核酸的生物合成过程,也参与能量代谢、物质运输、光合作用、信号转导等途径,且磷素对提高植物的抗逆性也有重要作用[1]。同时,磷也是植物利用效率最低的营养元素,尽管全球极大多数土壤中总磷含量高,但就土壤磷对植物的有效性而言,全球约有43%的耕地[2]、我国约有2/3的耕地[3]表现为土壤磷的“遗传学缺乏”[4]。
为获得农产品的高产,需大量增施磷肥,常导致如下后果的产生:过快消耗并浪费宝贵的磷矿资源,导致磷矿资源的耗竭[5];导致水体富营养化等环境问题[6-7];增高农业生产成本,并导致土壤物理质量退化[8]。为解决上述问题,利用生物和非生物途径,活化和充分利用土壤中原有的固定态磷,以降低农业生产对磷肥的依赖,减少磷肥施用量,已成为更经济和环保地解决作物磷营养问题的最新发展趋势。
在长期的进化过程中水稻已形成多种机制以适应低磷环境,如根系形态变化、土壤磷活化(根系有机酸和酶分泌)、磷高效吸收运转、体内磷分配和平衡、代谢途径改变以及调节其他元素的吸收等方面[9-11]。上述低磷适应机制显然与水稻体内基因表达对低磷胁迫的应答相关[12-13]。
根据本实验室前期对水稻材料的筛选结果,耐低磷水稻材料可分为两大类型,即磷高效吸收利用型和根系形态重塑型。充分利用现有的磷高效吸收利用型水稻材料,分析磷高效吸收利用相关基因对低磷胁迫的应答和调控机制,发掘土壤磷高效利用的关键基因,可为磷高效水稻新品种的选育提供材料和理论指导。
1 材料与方法
1.1 实验材料及培养
供试水稻材料:本实验室前期筛选出的磷高效吸收利用型耐低磷水稻仪2434(YI2434)和低磷敏感型水稻通粳981(TJ981)[14]。种子由江苏润扬种业有限公司提供。
材料培养和处理:分别取饱满水稻种子,浸入10%(V/V)双氧水中灭菌30 min,之后用去离子水反复冲洗干净。种子于25℃温水中浸种,发芽后的幼苗用水稻完全培养液(按国际水稻研究所提供的配方配制,pH = 5.4)进行培养。待水稻幼苗生长至3叶1心时,选择长势基本一致的秧苗用泡沫板固定移栽于容量为1 L的塑料盆中,同时设全磷和低磷(磷含量分别为0.32 mmol/L和0.016 mmol/L)两个处理。每盆10株,并设置3个重复组,每天更换一次培养液,并将培养液pH调为5.4。整个培养过程在光照培养箱中进行,条件如下,温度35℃,14 h光照/10 h黑暗。将水稻培养至所需处理天数后,取根尖样品用去离子水冲洗,液氮速冻后保存于超低温冰箱中备用。
1.2 水稻叶片磷含量的测定
取低磷处理不同时间的水稻幼苗叶片,置于鼓风干燥箱内,105℃杀青30 min,然后80℃烘干至恒量,用微型粉碎机将叶片干样粉碎,过0.25 mm筛,称取0.3000 g叶片粉末,用H2SO4-H2O2消煮至清亮色,磷含量的测定采用钼锑抗比色法[15]。
1.3 基因芯片检测及数据分析
以耐低磷品种仪2434为材料,在低磷处理15 d后,分别取对照和1/20低磷处理的水稻根系(处理和对照组均设置3个生物学重复),用去离子水冲洗,液氮速冻,送至北京博奥生物有限公司进行Agilent mRNA表达谱芯片检测。其基本操作过程如下:
用Trizol (Invitrogen, USA)提取根系总 RNA,并纯化(NucleoSpin© RNA clean-up Kit , MACHEREY-NAGEL,Germany);经电泳质检合格后,合成第一链和第二链cDNA,并纯化双链cDNA;以cDNA 为模板,用T7 Enzyme Mix 合成cRNA后纯化(RNA Clean-up Kit , MN);取5 μg cRNA,用CbcScriptⅡ酶和随机引物进行反转录,并纯化(PCR NucleoSpinExtract II Kit, MN);取上述反转录产物进行KLENOW 酶标记、纯化;标记产物溶于杂交液中于45℃下杂交过夜,并对芯片进行清洗、甩干;芯片用Agilent G2565CA 微阵列扫描仪进行扫描,得到杂交图片;采用Feature Extraction图像分析软件进行芯片图像分析,将图像信号转化为数字信号;将原始数据输入到GeneSpring GX软件中,用percentile shift法对信号值进行归一化处理;对生物学重复进行方差分析,并进行差异基因筛选。
表1 用于实时荧光定量PCR的特异性引物序列
Table 1. The primer sequences used for qRT-PCR verification.

GeneID基因ID功能注释Functionannotation上游引物Forwardprimer下游引物ReverseprimerOs01g0239000PHR15'-CGCAAGGTGAAGGTGGACT-3'5'-CGATGTTGTGGCGAGTGAG-3'Os07g0614700SPX5'-CCCATCCAATGACCACC-3'5'-TTGAAAGCCAAAACACG-3'Os10g0116800PAP5'-ATCACTATGACTGGAGGGG-3'5'-TGTTTCTGCTGCTGATGTG-3'Os05g0192100APA5'-AGTAGCACAAAGCAGCAATA-3'5'-CGTTCAGCATCTCCGTC-3'Os01g0758300PEPC5'-TCCAAGCCGCCTTTAGAA-3'5'-ATCACGGTCTCCACCCATC-3'Os06g0324800MFS5'-CCCTACGATGGATACTGGC-3'5'-AGGATGAAGGTGGTGGTGTT-3'Os03g0150800QsPT25'-AGCAAGGTCGGGTGGAT-3'5'-GAAGGTGAGTGCGTAGAGC-3'Os08g0564000OsPT65'-GCCTGCTCTTCACCTTCC-3'5'-CCGACGACAACGACAAAA-3'
利用分子功能注释系统(http://bioinfo.capitalbio. com/ mas3/)对基因芯片中检测的差异表达基因进行序列比对,并进一步利用NCBI(http://www.ncbi.nlm.nih.gov/)、UniProtKB/Swiss-Prot(http:// www.uniprot.org/uniprot/)对差异表达基因的类型和生物学功能进行查询和核对。
1.4 磷活化与吸收相关基因的实时荧光定量PCR验证
1.4.1 引物设计和合成
根据基因芯片分析结果,选取8个与磷饥饿信号转导、磷活化和高效吸收相关的差异表达基因进行qRT-PCR验证。在NCBI数据库中搜索相关基因的mRNA序列,利用Primer 5.0软件设计所需的引物(表1),引物均在GENEWIZ公司合成。
1.4.2 水稻根系总RNA提取
低磷处理5、10、15、20 d后,分别取水稻根系,采用植物总RNA提取试剂盒(RNA prep pure plant kit,TIANGEN公司,北京)提取总RNA。
1.4.3 cDNA第一链合成
取适量所提取的总RNA,采用快速反转录试剂盒(FastQuant RT Kit , TIANGEN公司,北京) 进行逆转录,并将不同样品所合成第一链cDNA的浓度统一调整为300 ng/μL,然后根据需要分装,用于后续实验。
1.4.4 实时荧光定量PCR
利用Primer Premier 5.0软件设计适合实时荧光定量PCR反应的引物。将上述cDNA作为模版,配制实时荧光定量PCR反应体系20μL:10 μL SYBR© Premix ExTaqTM II(2×)(宝生物工程有限公司,大连)、0.8 μL PCR 正向引物(10 μmol/L)、0.8μL PCR 反向引物(10μmol/L)、0.4μL ROX Reference DyeⅡ(50×)、2 μL cDNA 模板、6μL ddH2O,并以Ubiquitin5(UBQ5)[16]作为内参基因,应用ABI PRISM 7500 实时 PCR 系统(Applied Biosystems, USA)进行PCR反应。反应程序设定如下:95℃下预变性30 s;然后设定40个循环,95℃下变性5 s,55℃(根据不同引物选取合适的退火温度)下退火30 s,72℃下延伸30 s。每个样品重复4次。
1.5 水稻根系酸性磷酸酶活性的测定
1.5.1 根系组织酸性磷酸酶活性的测定
参考McLachlan[17]等方法并略加改动。称取5 g洗净的水稻鲜根,加入8 mL 0.2 mol/L醋酸钠缓冲液(pH 5.8)冰浴研磨成匀浆后,12000 r/min离心20 min,取上清液1 mL,加入2 mL 0.05 mol/L对硝基苯磷酸二钠(p-NPP),30℃下黑暗反应30 min,然后加入2 mL 2 mol/L NaOH终止反应。以无酶反应为空白对照,在450 nm波长下测定吸光值,同时作对硝基苯酚(p-NP)的标准曲线。根系组织酸性磷酸酶活性以单位时间内单位重量鲜根水解p-NPP生成的p-NP的量来表示(mg·h-1g-1)。
1.5.2 根系分泌酸性磷酸酶活性的测定
参考Ni[18]等方法并略加改动。取水稻幼苗2株,用去离子水冲洗干净根系,置于含有100 mL 1 mmol/L对硝基酚磷酸二钠(p-NPP)(pH=5.4)培养液的锥形瓶中,锥形瓶用黑色薄膜包裹,正常光照培养2 h后,吸取1 mL反应液加入到5 mL 1 mol/L NaOH的试管中,摇匀。以无酶反应为空白对照,450 nm处测定吸光值,同时作对硝基苯酚(p-NP)的标准曲线。然后剪取根系称量鲜质量,根系分泌酸性磷酸酶活性以单位时间内单位质量鲜根水解p-NPP生成的p-NP的量来表示(mg·h-1g-1)。
1.6 数据统计分
采用Microsoft Excel 的单因素方差分析进行数据统计分析。
2 结果与分析
2.1 低磷胁迫对水稻叶片磷含量的影响
图1结果表明,无论是低磷处理组还是对照组,两供试水稻品种叶片磷含量随着时间的延长呈增加的趋势。低磷胁迫下,通粳981叶片磷含量随时间的增幅要明显小于仪2434,而且这种差异性随着低磷胁迫处理天数的增加变得更显著。与对照组相比,低磷胁迫下通粳981叶片磷含量较对照出现极显著的下降,而仪2434磷含量较对照降幅小。这表明低磷条件下仪2434较通粳981具有更强的吸收利用磷素的能力,即仪2434较通粳981对低磷具有更强的耐性。
2.2 仪2434根系中低磷胁迫诱导表达基因的芯片分析
以耐低磷品种仪2434为材料的基因芯片检测结果表明,仪2434根系中对低磷胁迫的有效差异表达基因[FC (abs)≥2.0]共有3316 个,其中,诱导表达基因1329 个(FC≥2.0),下调表达基因1987个(FC≤0.5)。根据基因的类型和可能功能,从诱导表达基因(P值≤ 0.05,同时FC≥2.0)中筛选与磷饥饿信号转导、磷活化与高效吸收相关的基因如表2所示。
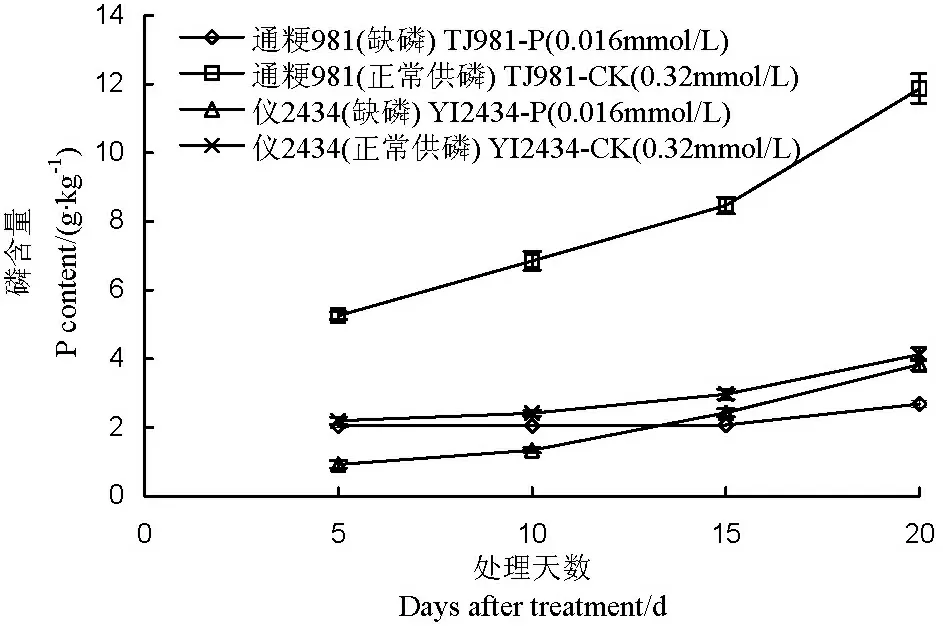
图1 低磷处理不同天数仪2434和通粳981叶片磷含量
Fig.1. The P content in leaves of YI 2434 and TJ 981 after low phosphorus treatment.
2.2.1 磷饥饿信号途径相关基因表达对低磷胁迫的应答
属于MYB转录因子的磷饥饿应答调节蛋白(PHR1)基因通过PHR1结合序列在植物磷饥饿信号转导中起关键作用,PHR1作为磷吸收、运输和磷营养平衡的正调节子,受其调控表达的下游基因包括miR399s、PHO2(Phosphate2)、IPS1/At4(信号分子编码基因)、SPXs(SPX结构域含有蛋白)、PHT(高亲和性磷载体)和PAPs(紫色酸性磷酸酶)等,且PHR1正调控miR399s、PHT1、SPXs等基因的表达[19]。
某些microRNAs参与调节植物体内主要营养物质的平衡,其中miR399在植物感知磷营养缺乏中有重要作用,在维管组织(尤其是伴随细胞和韧皮部)中,miR399的表达受到磷缺乏的强烈诱导,且在地上部被磷缺乏所诱导表达的miR399可长距离运输到地下部根系中,调节其靶标基因PHO2和磷载体蛋白(PTs)基因的表达和剪切加工[20]。
SPXs通过调节磷的韧皮部装载、叶中磷的重新定位、液泡磷的进出在植物体内磷动态平衡中发挥重要作用,也可通过SPX结构域和其他蛋白发生相互作用;水稻中SPXs的表达受到磷饥饿的强烈诱导,也受到磷饥饿信号途径中PHRs和PHO2的调节[20]。
因此,磷缺乏可激活植物体内的磷饥饿信号途径,调控下游功能基因的表达,进而促进根系对磷的吸收和运转。我们发现,低磷胁迫显著诱导仪2434根系中osa-miR399d、osa-miR399i、osa-miR399j和2个PHR1和多个SPXs基因的表达(表2),激活仪2434根系中的磷饥饿信号途径,进而促进对其下游与磷吸收、运转相关的功能基因表达的调控作用。
2.2.2 磷活化相关基因表达对低磷胁迫的应答
酸性磷酸酶(APA)主要存在于根的表皮细胞或由根分泌到土壤中,根系分泌的酸性磷酸酶能将复杂的有机磷化合物水解为磷酸盐,提高磷的生物有效性,在低磷条件下,磷高效型水稻材料可通过显著提高根系APA活性增强对磷胁迫环境的适应性[21];紫色酸性磷酸酶(PAPs)是金属磷酸酯酶(MPEs)家族的一员,能催化磷酸酯或酸酐水解,释放无机磷[22],玉米低磷响应基因ZmPAP18参与根外磷素的活化与吸收以及无机磷由根部向其他组织的转运[23];植酸酶(PA)是一种特殊类型的酸性磷酸酶,可催化土壤或植物组织内的植酸及其衍生物水解为磷酸盐与肌醇,将枯草芽孢杆菌的植酸酶基因在烟草过表达,可以显著增加根系分泌的植酸酶活性和植物体内磷含量[24]。表2结果表明,低磷胁迫下仪2434根系中1个APA基因、6个PAP基因、2个PA基因、1个MPE基因的表达受到低磷胁迫的显著(或极显著)诱导,表明低磷胁迫增强仪2434根系中有机磷水解酶生物合成。
表2 低磷胁迫对仪2434根系中与磷饥饿信号、磷活化和高效吸收相关基因表达的影响
Table 2. Effect of low-P stress on the expression of genes related to phosphorus starvation signals, phosphorus activation and high efficiency absorption.
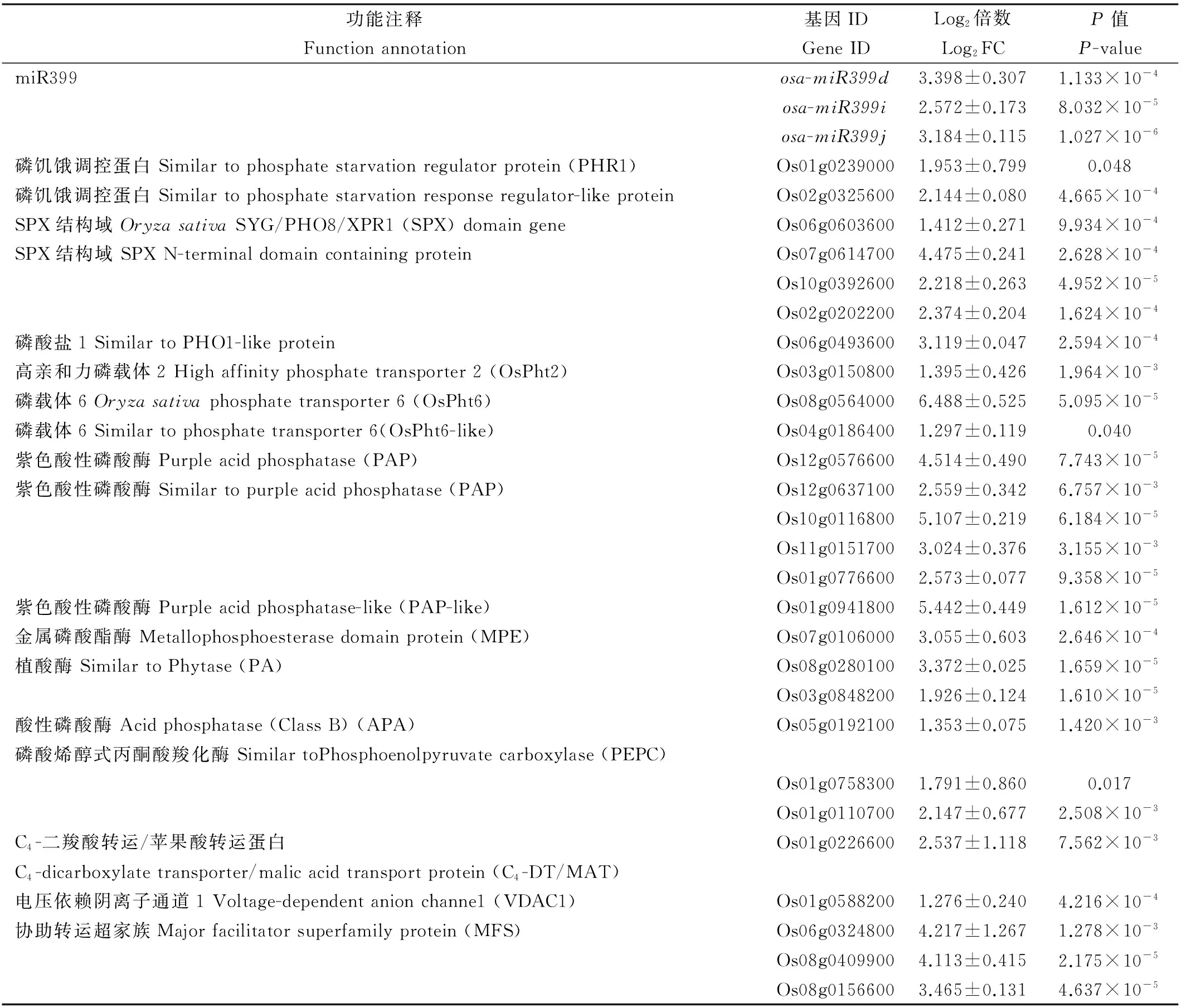
功能注释Functionannotation基因IDGeneIDLog2倍数Log2FCP值P-valuemiR399osa-miR399d3.398±0.3071.133×10-4osa-miR399i2.572±0.1738.032×10-5osa-miR399j3.184±0.1151.027×10-6磷饥饿调控蛋白Similartophosphatestarvationregulatorprotein(PHR1)Os01g02390001.953±0.7990.048磷饥饿调控蛋白Similartophosphatestarvationresponseregulator-likeproteinOs02g03256002.144±0.0804.665×10-4SPX结构域OryzasativaSYG/PHO8/XPR1(SPX)domaingeneOs06g06036001.412±0.2719.934×10-4SPX结构域SPXN-terminaldomaincontainingproteinOs07g06147004.475±0.2412.628×10-4Os10g03926002.218±0.2634.952×10-5Os02g02022002.374±0.2041.624×10-4磷酸盐1SimilartoPHO1-likeproteinOs06g04936003.119±0.0472.594×10-4高亲和力磷载体2Highaffinityphosphatetransporter2(OsPht2)Os03g01508001.395±0.4261.964×10-3磷载体6Oryzasativaphosphatetransporter6(OsPht6)Os08g05640006.488±0.5255.095×10-5磷载体6Similartophosphatetransporter6(OsPht6-like)Os04g01864001.297±0.1190.040紫色酸性磷酸酶Purpleacidphosphatase(PAP)Os12g05766004.514±0.4907.743×10-5紫色酸性磷酸酶Similartopurpleacidphosphatase(PAP)Os12g06371002.559±0.3426.757×10-3Os10g01168005.107±0.2196.184×10-5Os11g01517003.024±0.3763.155×10-3Os01g07766002.573±0.0779.358×10-5紫色酸性磷酸酶Purpleacidphosphatase-like(PAP-like)Os01g09418005.442±0.4491.612×10-5金属磷酸酯酶Metallophosphoesterasedomainprotein(MPE)Os07g01060003.055±0.6032.646×10-4植酸酶SimilartoPhytase(PA)Os08g02801003.372±0.0251.659×10-5Os03g08482001.926±0.1241.610×10-5酸性磷酸酶Acidphosphatase(ClassB)(APA)Os05g01921001.353±0.0751.420×10-3磷酸烯醇式丙酮酸羧化酶SimilartoPhosphoenolpyruvatecarboxylase(PEPC)Os01g07583001.791±0.8600.017Os01g01107002.147±0.6772.508×10-3C4-二羧酸转运/苹果酸转运蛋白C4-dicarboxylatetransporter/malicacidtransportprotein(C4-DT/MAT)Os01g02266002.537±1.1187.562×10-3电压依赖阴离子通道1Voltage-dependentanionchanne1(VDAC1)Os01g05882001.276±0.2404.216×10-4协助转运超家族Majorfacilitatorsuperfamilyprotein(MFS)Os06g03248004.217±1.2671.278×10-3Os08g04099004.113±0.4152.175×10-5Os08g01566003.465±0.1314.637×10-5
P-值为对生物学重复组进行单因素方差分析的P值,P≤0.05显著,P≤0.01极显著;Log2FC代表处理与对照转录表达信号值归一化后的差值。
P-value is the value of one-way ANOVA of biological replicates;P≤0.05 indicates significant difference andP≤0.01 indicates extremely significant difference. Log2FC stands for the difference between the control and treated group after the transcriptional data is normalized.
植物在适应低磷胁迫时,根还会向土壤中分泌一些有机酸(柠檬酸盐和苹果酸等),以溶解一些难溶的含磷化合物,以供植物的吸收和利用。磷酸烯醇式丙酮酸羧化酶(PEPC)可催化磷酸烯醇式丙酮酸反应生成草酰乙酸,进入三羧酸循环(TCA),生成柠檬酸、苹果酸等有机酸[25]。植物根系有机酸分泌不仅涉及有机酸的合成,也涉及有机酸的跨膜转运和经阴离子通道向根际的分泌[26]。低磷胁迫能促使水稻根系有机酸的分泌,这在耐低磷品种中表现尤为明显[9]。表2结果表明,仪2434根系中2个PEPC基因和1个电压依赖阴离子通道1(VDAC1)基因的表达受低磷胁迫的显著诱导,PEPC基因的诱导能促进有机酸的合成,VDAC1基因的诱导可以促进有机酸的分泌。另外,我们还发现,仪2434根系中1个具有阴离子通道1活性的C4-二羧酸转运/苹果酸转运蛋白基因(C4-DT/MAT)的表达也受到低磷胁迫的显著诱导,表明该基因在低磷胁迫下促进苹果酸、柠檬酸等的转运和分泌中也有重要作用。
综上,作为耐低磷的水稻品种,仪2434根系在低磷胁迫下可通过基因表达的调控,增强有机磷水解酶和有机酸的合成和分泌,进而促进介质中难溶性磷的活化。
2.2.3 磷载体相关基因表达对低磷胁迫的应答
低磷胁迫诱导磷载体基因的表达,是植物在营养缺乏条件下高效吸收磷素的最主要途径。根据结构和亚细胞定位的不同,所有单子叶和双子叶植物的磷载体基因分为四类:PHT1、PHT2、PHT3和PHT4、PHT1家族为高亲和性磷载体,PHT1家族基因主要在植物根部特异性表达。在水稻中OsPT1、OsPT2、OsPT6、OsPT8属于PHT1家族,过表达OsPT2能促进磷素从根部到地上部分的运输,缓解磷缺乏症状,促进磷缺乏条件下植物体内磷的积累[27];OsPT6在磷吸收和转运中均有重要作用[28],OsPT6主要在根和叶中表达,在对磷缺乏的应答中有重要作用[29]。本研究结果显示,仪2434根系中OsPT2、OsPT6 等磷载体基因的表达受到低磷胁迫的显著诱导(表2)。这表明,在低磷胁迫下的仪2434根系中能通过高亲和性磷载体的上调表达,促进对低磷介质中磷的高效吸收。
协助转运超家族蛋白(MFS)是地球上两大膜转运蛋白家族之一,广泛存在于所有生物体中,在溶质单向转运、协同转运、逆向转运中发挥重要作用。MFS包含74个家族,每一个家族均与特定底物(包括离子、磷酸糖、药物、神经递质、核苷、氨基酸、多肽)的运输有关[30]。其中,磷载体属于MFS超家族。本研究发现,仪2434根系中3个MFS基因的表达受到低磷胁迫的显著诱导(表2),至于这些MFS超家族基因的上调表达是否与磷运转有关有待于更深入的研究。
2.3 水稻根系中诱导表达基因的荧光定量PCR验证
为验证基因芯片的检测结果,并分析仪2434根系中诱导表达基因与其耐低磷特性的相关性,以耐低磷品种仪2434和低磷敏感品种通粳981为材料,从磷饥饿信号转导、紫色酸性磷酸酶、磷载体蛋白、有机酸合成和分泌相关这四类基因中选取8个代表性基因,应用荧光定量PCR(qRT-PCR)分别检测低磷处理5、10、15、20d后两水稻品种根系中所选取基因的转录水平随时间的变化(图2)。
qRT-PCR验证结果表明,在经低磷处理15 d的仪2434根系中供试的8个基因均表现为上调表达,且其上调表达倍数与基因芯片检测结果基本一致,这表明,本研究关于基因芯片的检测结果有极高的可靠性。
随低磷处理时间的延长,仪2434根系中8个供试基因的表达水平均呈现逐步增高的趋势;在低磷胁迫下,仪2434根系中PHR1(Os01g0239000)、SPXs(Os07g0614700)、APA(Os05g0192100)、PEPC(Os01g0758300)、MFS超家族(Os06g0324800)、OsPT6(Os08g0564000)等基因的表达水平就显著高于对照2倍以上,表明仪2434根系中磷饥饿信号转导、磷活化、磷高效吸收相关基因的表达可对低磷胁迫作出快速应答。
两水稻品种相比,低磷胁迫下耐低磷品种仪2434根系中这8个基因的表达水平均显著高于其在低磷敏感型品种通粳981根系中转录水平;不仅如此,在通粳981根系中PHR1、APA、OsPT2等基因随低磷处理时间的延长其表达诱导作用不明显(相对转录水平低于对照的2倍),尤其是作为磷饥饿信号转导中关键基因的PHR1在通粳981根系中的表达诱导作用不明显,可能致使受其正调控的下游基因未见明显的表达上调,这可能是仪2434较通粳981对低磷胁迫有较高耐性的主要原因之一。
2.4 低磷胁迫下水稻根系酸性磷酸酶活性分析
2.4.1 低磷胁迫对水稻根系组织酸性磷酸酶活性的影响
酸性磷酸酶(APA)是一种重要的水解有机态磷的诱导酶,其活性受到磷丰缺状况的影响。磷饥饿能诱导植物体内合成的和根系分泌的APA活性的增强[31-32]。图3结果表明,两个水稻品种在低磷胁迫下其根系组织APA活性均高于对照组,低磷敏感型水稻品种通粳981根系中APA活性较对照的增幅较小,而耐低磷型水稻仪2434受低磷胁迫后其根系酸性磷酸酶活性不仅极显著高于对照,且其增幅明显高于通粳981。APA活性的增高有利于根系中有机磷化合物的水解,提高植物体内有机磷的重复利用率。这可能是仪2434具有较强耐低磷胁迫能力的原因之一。

A, B, C, D, E, F, G, H 分别表示PHR1 (Os01g0239000)、SPXs(Os07g0614700)、PAPs(Os10g0116800)、APA(Os05g0192100)、PEPC(Os01g0758300)、MFSs(Os06g0324800)、OsPT2 (Os03g0150800)、OsPT6 (Os08g0564000)基因。*、**分别表示在P<0.05和P<0.01水平上差异显著。
A, B, C, D, E, F, G, H represent the genes ofPHR1 (Os01g0239000),SPXs(Os07g0614700),PAPs(Os10g0116800),APA(Os05g0192100),PEPC(Os01g0758300),MFSs(Os06g0324800),OsPT2 (Os03g0150800),OsPT6 (Os08g0564000), respectively.*,**represent significant difference atP< 0.05 andP< 0.01, respectively.
图2 仪2434(YI2434)和通粳981(TJ981)根系中与磷饥饿信号、磷活化和高效吸收相关基因转录水平随时间变化的qRT-PCR验证结果
Fig. 2. Transcription level of phosphorus starvation signals, phosphorus activation and high efficiency absorption related gene changes with low-P treated time in YI2434 and TJ981 roots by qRT-PCR.

*、**分别表示在P<0.05和P<0.01水平上差异显著。
*,**show significant difference atP< 0.05 andP< 0.01, respectively.
图3 低磷胁迫15 d仪2434和通粳981根系酸性磷酸酶活性。
Fig. 3. The acid phosphatase activity in YI2434 and TJ981 at 15 days after low-P treatment.
2.4.2 低磷胁迫对水稻根系分泌酸性磷酸酶活性的影响
水稻根系分泌APA能够活化介质中的有机磷供其吸收利用,对于提高磷素的利用效率具有重要的作用。图4结果表明,低磷胁迫能极显著提高两供试品种水稻根系分泌APA的活性,且低磷胁迫下耐低磷水稻仪2434根系所分泌APA活性较对照增高的程度明显高于通粳981,这说明仪2434可能通过高效活化介质中难溶态有机磷来提高对低磷胁迫的适应能力。
3 讨论
在低磷胁迫15d时,与通粳981相比,仪2434叶片磷含量降低幅度较小,表明仪2434根系能高效吸收低磷介质中的磷素,表现出对低磷胁迫较高的耐性。基因芯片的检测结果显示,在经低磷处理15 d的仪2434根系中,PHR1、osa-miR399d、osa-miR399i、osa-miR399j和SPXs基因的诱导表达,激活了磷饥饿信号途径,从而上调与磷活化(APA、PAPs、MPE、PA、PEPC、ADAC1和C4-DT/MAT等)、吸收和运转(OsPT2、OsPT6)相关的下游功能基因的表达。这些基因的上调表达可以加快有机磷和无机磷的活化,促进根系对低磷介质中磷的高效吸收利用。qRT-PCR试验中,供试的8个基因上调倍数与基因芯片检测结果基本一致,表明基因芯片的检测结果是可靠的。随低磷处理时间的延长,仪2434根系中供试的8个基因表达水平均呈现逐步增高的趋势,表明仪2434根系中磷饥饿信号转导、磷活化、磷高效吸收利用相关基因的表达可对低磷胁迫作出快速应答。两个水稻品种相比,仪2434根系中8个供试基因在低磷胁迫下的转录水平均显著高于通粳981,PHR1、APA、OsPT2在通粳981根系中的表达诱导作用不明显,且仪2434根系中酸性磷酸酶的活性也显著高于通粳981,这表明低磷胁迫诱导表达的基因可调控相应蛋白的合成,进而促进根际环境和植株体内有机磷的水解,增强了仪2434根系对磷的高效吸收利用。综上,磷饥饿信号途径、磷活化、吸收与转运相关基因的上调表达,活化了体内外磷素,提高了机体内磷的供应水平。这可能是仪2434耐低磷的重要机制之一。

*、**分别表示在P<0.05和P<0.01水平上差异显著。
*,**shows significant difference atP< 0.05 andP< 0.01,respectively.
图4 低磷胁迫15 d仪2434和通粳981根系分泌酸性磷酸酶活性
Fig. 4. Acid phosphatase activity secreted by roots in YI2434 and TJ981 at 15 days after low-P treatment.
[1] 郭再华, 孟萌, 侯彦琳. 磷、砷双重胁迫对不同耐低磷水稻苗期生长及磷、砷吸收的影响. 应用与环境生物学报, 2009, 15(5): 596-601.
Guo Z H, Meng M, Hou Y L. Effect of P and As couple stress on growth, and P and As absorption of different P-tolerant rice seedlings.ChinJApplEnvironBiol, 2009, 15(5): 596-601.(in Chinese with English abstract)
[2] Xiao K, Katagi H, Harrison M, et al. Improved phosphorus acquisition and biomass production inArabidopsisby transgenic expression of a purple acid phosphatase gene fromM.truncatula.PlantSci, 2006, 170(2): l91-202.
[3] 李俊艳, 胡红青, 李荣纪,等. 改性磷矿粉对油菜幼苗生长和土壤性质的影响. 植物营养与肥料学报, 2009, 15(2): 441-446.
Li J Y, Hu Q H, Li R J, et al. Modified phosphate rock by γ-poly glutamic acid and its effects on the growth of rapeseed seedlings and soil properties.PlantNutrFertSci, 2009, 15(2): 441-446.(in Chinese with English abstract)
[4] 叶思诚, 谭晓风, 袁军. 植物低磷适应机制研究进展. 经济林研究, 2012, 30(2): 128-133.
Ye S C, Tan X F, Yuan J. Advances in research on mechanism of plant acclimation to low phosphorus.NonForRes, 2012,30(2): 128-133.(in Chinese)
[5] 胡慧蓉, 郭安, 王海龙. 我国磷资源利用现状与可持续利用的建议. 磷肥与复肥, 2007, 22(2): 1-5.
Hu H R,Guo A, Wang H L. Present status of China′s phosphorus resource utilization & some suggestions for sustainable development.PhosComFert, 2007, 22(2): 1-5.(in Chinese)
[6] 王森, 朱昌雄, 耿兵. 土壤氮磷流失途径的研究进展. 中国农学通报, 2013, 29(33): 22-25.
Wang S, Zhu C X,Geng B. Research advancement in loss pathways of nitrogen and phosphorus in soils.ChinAgricSciBull, 2013, 29(33): 22-25.(in Chinese with English abstract)
[7] 付春平, 钟成华, 邓春光. 水体富营养化成因分析. 重庆建筑大学学报, 2005, 27(1): 128-131.
Fu C P,Zhong C H, Deng C G. Analysis on cause of the eutrophication of water body.JChongqingArchitUniv, 2005, 27(1): 128-131.(in Chinese with English abstract)
[8] 李强, 许明祥, 齐治军, 等. 长期施用化肥对黄土丘陵区坡地土壤物理性质的影响. 植物营养与肥料学报, 2011, 17(1): 103-109.
Li Q, Xu M X, Qi Z J, et al. Effects of long-term chemical fertilization on soil physical properties of slope lands in the loess hilly region.PlantNutrFertSci, 2011, 17(1): 103-109.(in Chinese with English abstract)
[9] 李德华, 向春雷, 姜益泉, 等. 低磷胁迫下水稻不同品种根系有机酸分泌的差异. 中国农业通报, 2005, 21(11): 186-188.
Li D H, Xiang C L, Jiang Y Q, et al. Difference of organic acid secretion from roots of various rice varieties under the stress of low phosphorus.ChinAgricSciBull, 2005, 21(11): 186-188.(in Chinese with English abstract)
[10]Panigrahy M, Rao D N, Sarla N. Molecular mechanisms in response to phosphate starvation in rice.BiotechnolAdv, 2009 27(4): 389-97
[11]Cai H M, Xie W B, Zhu T, et al. Transcriptome response to phosphorus starvation in rice.ActaPhysiolPlant, 2012, 34: 327-341.
[12]Li L, Liu C, Lian X. Gene expression profiles in rice roots under low phosphorus stress.PlantMolBiol, 2010, 72(4-5): 423-432.
[13]Oono Y, Kawahara Y, Yazawa T, et al. Diversity in the complexity of phosphate starvation transcriptomes among rice cultivars based on RNA-Seq profiles.PlantMolBiol, 2013, 83: 523-537.
[14]史春阳, 葛永胜, 胡训霞, 等. 不同基因型耐低磷水稻品种的筛选. 扬州大学学报(印刷中).
Shi C Y, Ge Y S, Hu X X, et al.Screening of different low phosphorous tolerant genotypes rice varieties.JYangzhouUniv(in press).
[15]汤绍虎, 罗充. 植物生理学实验教程. 第一版.重庆.西南师范大学出版社, 2012: 35-38.
Tang S H, Luo C. Plant Physiology Experiments Tutorial. 1st edn. Chongqing: Southwest China Normal University Press, 2012: 35-38.(in Chinese)
[16 ]Jain M, Nijhawan A, Tyagi A K, et al. Validation of housekeeping genes as internal control for studying gene expression in rice by quantitative real-time PCR.BiochemBiophysResCommun, 2006, 345(2): 646-651.
[17]McLachlan K D, Elliot D E, Marco D G, et al. Leaf acid phosphataseisozymes in the diagnosis of phosphorus status in field-grown wheat.CropPasSci, 1987, 38(1): 1-13.
[18]Ni J J, Wu P, Luo A C, et al. Low phosphorus effects of the metabolism on rice seedlings.CommunSoilSciPlanAnal, 1996, 27(18): 3073- 3084.
[19]Hou Q Z, Yi Y Z, Si Q H, et al. Analysis of phosphorus-deficient responsive miRNAs and cis-elements from soybean (GlycinemaxL.).JPlantPhysiol, 2010, 167 (15): 1289-1297.
[20]Doerner P. Phosphate starvation signaling: A threesome controls systemic Pi homeostasis.CurrOpinPlantBiol, 2008, 11: 536-540.
[21]严宽, 王昌全, 李焕秀,等. 磷水平对杂交水稻及其亲本根系酸性磷酸酶活性的影响. 中国水稻科学, 2010, 24(1): 43-48.
Yan K, Wang C Q, Li H X, et al. Effects of phosphorus level on the activity of acid phosphatase in roots of hybrid rice and its parents.ChinJRiceSci, 2010, 24(1): 43-48.(in Chinese with English abstract)
[22]Schenk G,Miti C N, Hanson G R, et al. Purple acid phosphatase: A journey into the function and mechanism of a colorful enzyme.CoordinChemRev, 2013, 257(2): 473-482.
[23]苏顺宗, 刘丹, 吴玲, 等. 玉米低磷响应基因ZmPAP18 的表达特征与序列变异分析. 分子植物育种, 2013, 11(4): 509-516.
Su S Z, Liu D, Wu L, et al. Expression and sequence variation analysis of a low-phosphorus responsive geneZmPAP18 in maize.MolPlantBreeding, 2013, 11(4):509-516.(in Chinese with English abstract)
[24]Lung S C, Leung A, Kuang R, et al. Phytase activity in tobacco (Nicotianatabacum) root exudates is exhibited by a purple acid phosphatase.Phytochem, 2008, 69(2): 509-516.
[25]杨建峰, 贺立源. 缺磷诱导植物分泌低分子量有机酸的研究进展. 安徽农业科学, 2006, 34(20): 5171-5175.
Yang J F, He L Y. Research advance in the exudation ofprganic acid in phosphorus-deficient plant.JAnhuiAgricSci,2006, 34(20): 5171-5175.(in Chinese with English abstract)
[26]陈声奇, 陈爱珠, 周畅. 植物忍耐低磷胁迫机理的研究进展. 湖南农业科学, 2007(2): 43-46.
Chen S Q, Chen A Z, Zhou C. Current Research on adaptation mechanisms of plants to phosphorus deficiency stress.AgriSciHunan, 2007(2): 43-46.(in Chinese )
[27]Liu F, Wang Z Y, Ren H Y, et al.OsSPX1 suppresses the function ofOsPHR2 in the regulation ofexpression ofOsPT2 and phosphate homeostasis in shoots of rice.PlantJ, 2010, 62(3): 508-517.
[28]Ai P, Sun S, Zhao J, et al. Two rice phosphate transporters,OsPht1; 2 andOsPht1; 6, have different functions and kinetic properties in uptake and translocation.PlantJ, 2009, 57(5): 798-809.
[29]Wu P,Shou H X, Xu G H, et al. Improvement of phosphorus efficiency in rice on the basis of understanding phosphate signaling and homeostasis.CurrOpinPlantBiol, 2013, 16: 1-8.
[30]Reddy V S, Shlykov M A, Castillo R, et al. The major facilitator superfamily (MFS) revisited.FEBSJ, 2012, 279(11): 2022-2035.
[31]李永夫, 金松恒, 叶正钱,等. 低磷胁迫对山核桃幼苗根系形态和生理特征的影响. 浙江林学院学报, 2010, 27(2):239-245.
Li Y F,Jin S H, Ye Z Q, et al. Root morphology and physiological characteristics in Carya cathayensis seedlings with low phosphorus stress.JZhejiangColl, 2010, 27(2): 239-245.(in Chinese with English abstract)
[32]李锋, 李木英, 潘晓华,等. 不同水稻品种幼苗适应低磷胁迫的根系生理生化特性. 中国水稻科学, 2004, 18(1): 48-52.
Li F,Li M Y, Pan X X, et al. Biochemical and physiological characteristics in seedlings roots of different rice cultivars under low-phosphorus stress.ChinJRiceSci, 2004, 18(1): 48-52.(in Chinese with English abstract)
Response of Gene Expression Related to Efficient Phosphorus Absorption and Utilization to Low-P Stress in Rice Roots
HU Xun-xia1, SHI Chun-yang1, DING Yan1, ZHANG Ping1, GE Yong-sheng1, LIU Yu-jin2,*,WANG Ze-gang1, GE Cai-lin1,*
(1College of Bioscience and Biotechnology, Yangzhou University, Yangzhou 225009,China;2Jiangsu Runyang Seed Limited Company, Yizheng 211400, China;*Corresponding author, E-mail:clge@yzu.edu.cn; yzlyjseed@163.com)
It is important to elucidate the mechanism of low phosphorus tolerance in rice for the improvement of utilization efficiency of soil phosphorus. With two different rice varieties, low-P tolerant variety Yi 2434 and low-P sensitive variety Tongjing 981, the gene expression related to phosphorus absorption and utilization in rice seedling roots were determined by using gene chip and qRT-PCR technology. The phosphorus content showed that compared with the control group, the phosphorus content in the leaves of Yi 2434 decreased by a less percentage than that in Tongjing 981 under low-P stress, indicating that Yi 2434 had a high efficiency in phosphorus absorption from low phosphorus medium compared with Tongjing 981. The gene chip results showed that the expressions ofPHR1,osa-miR399sandSPXstriggered the phosphorus starvation signal pathway, and the induced gene expressions ofAPA,PAPs,MPE,PA,PEPCandVDAC1,C4-DT/MATenhanced the synthesis and secretion of organophosphorus hydrolase and organic acid, promoted the reactivation of insoluble phosphorus in media, and the induced gene expressions ofOsPT2 andOsPT6 accelerated the absorption of phosphorus in Yi 2434 roots under low-P stress. qRT-PCR results showed that the transcriptional levels of the eight key genes(PHR1,SPX,PAP,APA,PEPC,MFS,OsPT2,OsPT6 ) related to phosphorus starvation signal transduction, phosphorus activation and efficient absorption were continuously increased along with the low-P treatment in Yi 2434 roots. Furthermore, the transcriptional levels of these eight genes in Yi 2434 roots were significantly higher than those in Tongjing 981 roots under the low-P stress and the induced expression ofPHR1,APA,OsPT2 genes in Tongjing 981 roots was very low under low-P stress. Additionally, the activities of both acid phosphatase (APA) in the tissues of roots and secreted by roots in Yi 2434 increased more significantly than that in Tongjing 981, which is possibly one of the key pathway to confer Yi 2434 higher tolerance to the low-P stress than Tongjing 981.
rice; low phosphorus stress; gene expression; phosphorus activation; efficient phosphorus absorption
2016-02-02; 修改稿收到日期: 2016-04-28。
农业公益性行业科研专项(201103007)。
S143.2; S511.01
A
1001-7216(2016)06-0567-10
胡训霞, 史春阳,丁艳, 等. 水稻根系中磷高效吸收和利用相关基因表达对低磷胁迫的应答. 中国水稻科学, 2016, 30(6): 567-576.

