急性肠系膜血管缺血性疾病诊断的Meta分析
宋 弢,沈 平,王西墨
急性肠系膜血管缺血性疾病诊断的Meta分析
宋弢1,沈平2,王西墨2
目的:评价目前常用的血浆标志物及CT血管造影(CTA)检查对于肠系膜血管缺血性疾病(AMI)诊断的价值。方法:按照《流行病学观察行研究的meta分析》中的要求进行设计。使用随机效应模型对指标进行合并。如果研究提供的数据不足以重建四格表则被排除。结果:24篇文献被纳入最终的研究。合并后,D-乳酸的敏感性为74%(95%CI=61.0%~84.7%),特异性为74%(95%CI=69%~79%);D二聚体敏感性为96%(95%CI=89%~99%),特异性为40%(95%CI=33%~47%);肠型脂肪酸结合蛋白的敏感性为77%(95%CI=66%~86%),特异性为77%(95%CI=72%~82%);谷胱甘肽巯基转移酶的敏感性为68%(95% CI=55%~80%),特异性为85%(95%CI=76%~92%);CT诊断AMI的敏感性为93%(95%CI=90%~96%),特异性为96%(95%CI= 94%~97%)。结论:血浆标志物可能有助于排除非AMI,但其可靠性仍需进一步验证。CTA在诊断AMI上具有很高的准确性。
急性肠系膜缺血性疾病;诊断;CT血管造影;血清标志物
急性肠系膜血管缺血性疾病(acute mesenteric ischemia,AMI)是一类凶险的腹部急症。AMI是由各种原因引起肠道急性血流灌注不足、回流受阻所致的肠壁缺血、坏死和肠管运动功能障碍[1-2]。尽管AMI的年发病率仅为0.09%~0.2%,但其死亡率却很高[3]。快速作出诊断并进行外科处置对降低AMI的死亡率至关重要[4]。然而,AMI患者的体征通常模糊多变,且目前缺乏有效的实验室筛查手段。即使临床怀疑肠系膜缺血,确诊也需要有创且耗时的血管造影或CTA[5]。因此,尽管临床医生对AMI的重视不断提高,实验室和影像学检查手段也在不断进步,AMI的早期诊断仍是我们面临的一大难题。本研究的主要目的是总结和评价目前针对AMI患者常用的实验室检查和影像学检查诊断特性以及手术预后状况。
1 资料与方法
1.1文献检索本研究按照《流行病学观察行研究的meta分析》中的要求进行设计[6]。两位研究者使用Pubmed及EMBASE对1966年1月—2015年12月的文献进行了搜索。关键词为acute mesenteric ischemia。为识别CT造影风险及血管造影风险,使用关键词angiography和risk,angiography和complications,CT和risk,及CT和complications在Pubmed中进行检索。所有检索限于以人类为研究对象及英文文献。两位研究者独立阅读所有检索结果的题目及摘要筛选出可能纳入的文献,而后阅读其全文。如果二人对文献纳入与否存在争议,则通过讨论解决。检索纳入文献的参考文献已期发现可能遗漏的文献。
研究纳入标准:成人(≥18岁),数据完整可以重建4格表。病例报道,综述及仅针对治疗的研究被排除在外。
1.2证据质量评价使用诊断性研究质量评价工具2(QUADAS-2)对纳入研究的质量进行评价[7]。研究者事先确定质量评价所需要考察的项目。如果某研究未明确说明检查结果对研究者设盲,则此研究被评为“高偏倚”。如果某研究并未纳入阴性对照患者,则其不能完整评估诊断性能,那么此研究将仅作为描述性研究而不会纳入meta分析。
1.3数据分析两位研究者独立地对数据进行提取。提取的数据包括:人种,患者纳入标准,参考标准,发病率,诊断试验的结果。使用Meta-DiSc软件对数据进行合并分析并绘制SROC曲线。
数据不完整的研究将不被纳入诊断性能(敏感度,特异度,似然比)的计算。合并研究的异质性以Cochrane’sχ2和I2表示,I225%,50%,75%分别代表低、中、高异质性[8]。
2 结果
2.1文献检索结果及质量评价PUBMED数据库检索共检出文献1156篇,EMBASE数据库共检出文献406篇。在阅读题目和摘要摘要后,筛选出93篇文献进行进一步评价。再阅读全文后,24篇文献被纳入最后的meta分析。这24项研究包括17项前瞻性研究及7项回顾性研究。根据病史及查体结果,20项研究可报告发病率并计算诊断敏感性。这些研究纳入患者的标准及诊断手段各异,包括病史,体格检查,实验室检查及影像学检查。文献筛选流程见图1。
使用QUADAS-2对所有诊断性研究进行了评价。仅5项研究明确说明其患者来自急诊病人。许多研究并未详细描述其纳入标准,而且并未报道检查结果与参考标准之间的差距。大多是研究使用分类变量阈值来判断实验室检查的结果。
2.2血清学检查3项研究评价了D-乳酸水平的诊断准确度。不同研究使用的的阈值有所不同。Block报道D-乳酸的敏感性为90%,特异性为23%(阈值≥0.20 mmol/L)[9]。而Shi等[10]报道在阈值设为31.8 μg/mL时,敏感性为66.7%,特异性为85.9%。而Murray等[11]报道其敏感性为89%,特异性为86%。合并后,D-乳酸的敏感性为74.1%(95%CI= 61.0%~84.7%),特异性为74.2%(95%CI=69.1%~78.9%)。敏感性的异质性较低为40%(I2=48.4%,χ2= 3.88,P=0.144),而特异性的异质性很高(I2=97.8%,χ2= 92.11,P<0.001),详见图2。

图1 文献筛选流程
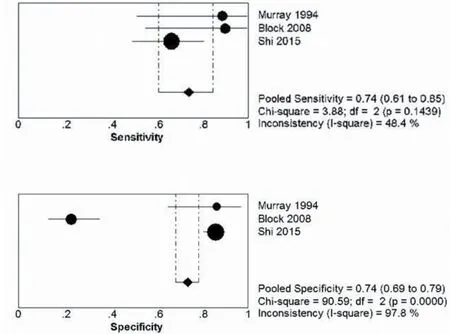
图2 D-乳酸合并后森林图
5项研究评价了D-二聚体的诊断性能[9,12-15]。所有研究的敏感性均在90%以上,而特异性从18%到7%不等。合并后敏感性为96%(95%CI=89%~99%),特异性为40%(95%CI=33%~47%)。PLR为1.76(95%CI=1.20~2.57),NLR为0.12(95%CI)。同样D-二聚体指标合并后敏感性异质性较低(I2=0%,χ2=0.68,P=0.97),而特异性异质性明显I2=86.4%,χ2=29.13,P<0.001)。详见图3。
近年,人们开始对脂肪酸结合蛋白(i-FABP)在肠缺血方面的应用开展了研究。本次纳入的有3项研究[10,16-17],其敏感性从64%到100%不等,特异性从75%到98%。合并后,i-FABP的敏感性为77%(95% CI=66%~86%),特异性为77%(95%CI=72%~82%)。敏感性的异质性较高为40%(I2=77.2%,χ2=8.79,P= 0.012),而特异性的异质性也较高(I2=83.8%,χ2= 12.36,P=0.002)。详见图4。
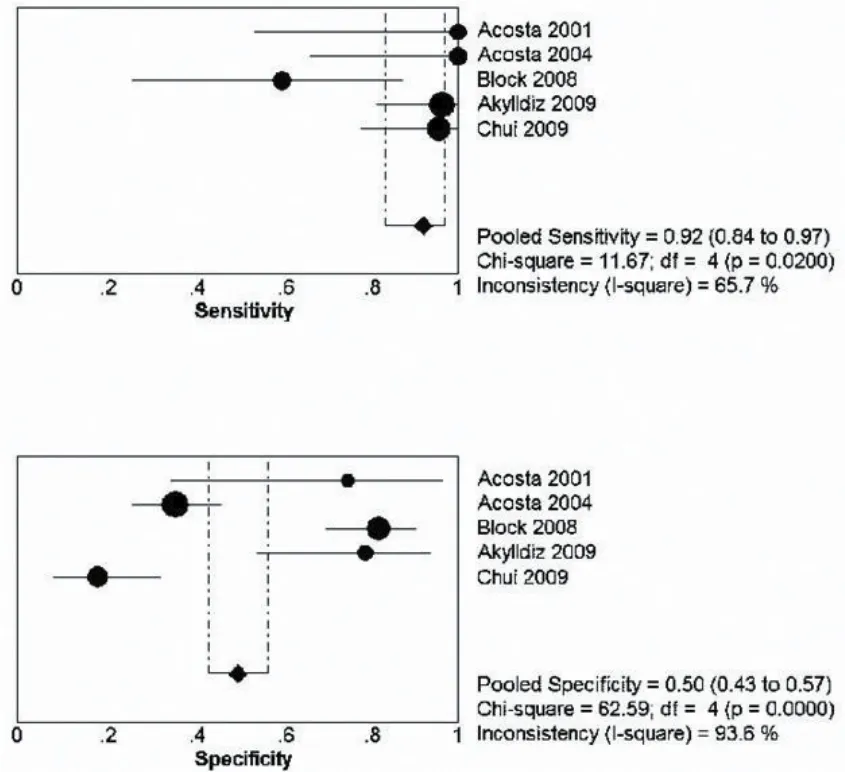
图3 D-二聚体合并后森林图

图4 i-FABP合并后森林图
GST在诊断AMI方面应用不是非常广泛,本研究共纳入三项研究,其报道敏感性从20%~100%不等。合并后敏感性为68%(95%CI=55%~80%),特异性为85%(95%CI=76%~92%)[9,18-19]。详见图5。
2.3影像学检查绝大部分研究利用CTA进行肠系膜缺血的诊断。虽然在文献筛选过程中发现部分研究使用MRI,但这些研究均不符合本次系统评价的纳入标准而被排除。共有8项研究报告了CT诊断肠系膜缺血的诊断准确度[13,20-26]。文献报道的诊断敏感性从83%到100%不等,而特异性从67%到100%不等。合并后,CT诊断AMI的敏感性为93% (95%CI=90%~96%),特异性为96%(95%CI=94%~97%)。敏感性的异质性为中度(I2=51.1%,χ2= 14.329,P=0.046),而特异性的异质性也较高(I2= 87.2%,χ2=54.78,P<0.001)。详见图6。
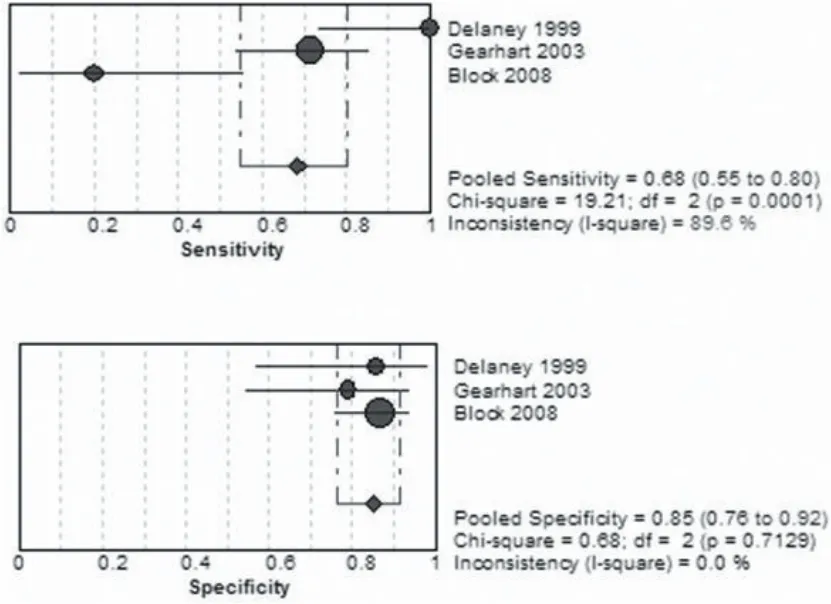
图5 GST合并后森林图

图6 CTA合并后森林图
2.4发表偏倚的评价由于关于CTA的文献纳入较多,我们对其发表偏倚进行了评价。使用Egger’s回归进行评价,其P值为0.054。故可认为未出现明显的发表偏倚。见表1。
3 讨论
AMI是一种死亡率很高的疾病。如果患者可以得到及时的诊治,则预后较好。而如果诊断延误,则可能导致肠坏死及多器官衰竭。目前,仅通过临床基本检查建立AMI的诊断仍是临床上面临的一大难题。患者的主诉、病史及体格检查并不具有特异性,并且目前的常用的实验室检查也无法满足明确诊断AMI的要求。增强CT及双期肠系膜CTA在诊断AMI方面拥有较高的准确性。但其需注射造影剂,费用较高,并且需要有经验的影像科医生进行诊断。因此,人们开展了大量研究寻找及评估可以准确便捷的诊断AMI的方法。

表1 各研究指标Meta分析结果
乳酸是较为常用的一种诊断AMI的实验室检查,但乳酸水平轻度升高常代表疾病的晚期阶段如:透壁性坏死,无氧代谢及死亡而并非肠早期缺血的状态。D-二聚体在AMI的早期即可升高,但是多种疾病均可导致其水平异常,因此其特异性较差。I-FABP仅存在于小肠中,在组织损伤后可被释放入血,但是急性肠炎,克劳恩氏病及单纯肠梗阻的患者血中I-FABP的水平也会升高。
一般认为,一项检查的阴性似然比(NLR)应足够低才可满足作为筛查性检查的要求。在本次研究中,我们发现D-二聚体阴性的NLR较低,但因其95%的可信区间较大而不能作为独立的诊断手段。血清乳酸水平其敏感性及NLR均不及D-二聚体。并且这两项检查的特异度均不理想。另外,在针对血清学指标的各项研究间存在较大异质性,由于各指标纳入研究较少,因此无法进行亚组分析。我们考虑可能是纳入研究时间跨度较大,因此各研究使用检测技术之间的差异可能造成部分异质性的出现。
总体来说,本次纳入的关于CT检查的研究之间的结果差异相对较小。但也有单个研究在敏感性或特异性与其它相比有较大差异。在Wiesner等开展的回顾性研究中使用了大量不同影像学征象及扫描策略使其得出的敏感性较其他研究较小。同样,Blachar等的研究使用了从10排到64排多种CT进行扫描,并且在判读结果时将“可能患病”也作为阳性病例计算,导致其特异性明显低于其他研究。在Menke等[27]在先前发表的关于AMI的CT诊断的meta分析中,6项符合标准的研究被纳入且QUADAS质量评价较高。其报道合并后CT诊断的敏感性为93.3%,特异性95.9%。本次研究纳入3项新的研究,病例数增加261例,尽管样本量增加了42%,但本次分析的结果与前次类似。
鉴于大多是关于外科手术预后的文献属于回顾性研究,明确其病例训责标准对评估偏倚及可用性至关重要。不同的研究对患者分类的标准也有所不同。如根据手术类型分类(肠管切除术,血运重建术),堵塞血管的类型(肠系膜静脉血栓形成,肠系膜上动脉栓塞),最终诊断(ICD-9,活检报告)。一些研究根据外科处理方式及诊断进行分层分别报道诊断死亡率(实验室检查或CT),但有些研究并未对纳入患者加以区分。
许多关于腹部创伤患者的研究显示,阴性手术探查并不会提高死亡率及并发症发生率[28-29]。但是,AMI的患者一般比创伤患者年龄更大,体质更差,合并疾病更多。Woo等[30]报道,肠系膜缺血可疑的患者接受手术后,最终肠系膜缺血患者的死亡率(48.8%)要高于非肠系膜缺血患者(39.3%)。在Thuijls等报道,为明确AMI诊断而接受手术的21名患者有7名死亡,而其他疾病的24名患者却未出现死亡。在这24名患者中,仅5名患者未进行治疗仅做探查。也就是说,24名非AMI患者仍有13名要接受手术。因此,准确评价接受手术的风险及获益,确定手术标准非常重要。
总而言之,本研究纳入关于AMI诊断的最新研究,分析显示,血浆标志物可能有助于排除非AMI,但其可靠性仍需进一步验证。CTA在诊断AMI上具有很高的可靠性。除了先验概率最低的患者人群,CTA基本可明确诊断。但如果先验概率很高,患者可能更适合直接考虑手术。因为未发现的AMI的发病率及死亡率很高。临床医师应充分了解AMI疾病表现的多样性及复杂性。
[1]Acosta S,Bjorck M.Acute thrombo-embolic occlusion of the supe⁃rior mesenteric artery:a prospective study in a well defined popula⁃tion[J].Eur J Vasc Endovasc Surg,2003,26(2):179-183.
[2]Cooke M,Sande MA.Diagnosis and outcome of bowel infarction on an acute medical service[J].Am J Med,1983,75(6):984-992.
[3]Kassahun WT,Schulz T,Richter O,et al.Unchanged high mortali⁃ty rates from acute occlusive intestinal ischemia:six year review [J].Langenbecks Arch Surg,2008,393(2):163-171.
[4]Kougias P,Lau D,Elsayed HF,et al.Determinants of mortalityand treatment outcome following surgical interventions for acute mesenteric ischemia[J].J Vasc Surg,2007,46(3):467-474.
[5]Taourel PG,Deneunille M,Pradel JA,et al.Acute mesenteric isch⁃emia:diagnosis with contrast-enhanced CT[J].Radiology,1996, 199(3):632-636.
[6]Stroup DF,Berlin JA,Morton C,et al.Meta-analysis of observa⁃tional studies in epidemiology:a proposal for reporting.Meta-anal⁃ysis Of Observational Studies in Epidemiology(MOOSE)group[J]. JAMA,2000,283(15):2008-2012.
[7]Whiting PF,Rutjes AW,Westwood ME,et al.QUADAS-2:a re⁃vised tool for the quality assessment of diagnostic accuracy studies [J].Ann Intern Med,2011,155(8):529-536.
[8]Higgins JP,Thompson SG,Deeks JJ,et al.Measuring inconsisten⁃cy in meta-analyses[J].BMJ,2003,327(7414):557-560.
[9]Block T,Nilsson TK,Bjorck M,et al.Diagnostic accuracy of plas⁃ma biomarkers for intestinal ischaemia[J].Scand J Clin Lab In⁃vest,2008,68(3):242-248.
[10]Shi H,Wu B,Wan J,et al.The role of serum intestinal fatty acid binding protein levels and D-lactate levels in the diagnosis of acute intestinal ischemia[J].Clin Res Hepatol Gastroenterol, 2015,39(3):373-378.
[11]Murray MJ,Gonze MD,Nowak LR,et al.Serum D(-)-lactate lev⁃els as an aid to diagnosing acute intestinal ischemia[J].Am J Surg,1994,167(6):575-578.
[12]Acosta S,Nilsson TK,Bjorck M.D-dimer testing in patients with suspected acute thromboembolic occlusion of the superior mesen⁃teric artery[J].Br J Surg,2004,91(8):991-994.
[13]Akyildiz H,Akcan A,Ozturk A,et al.The correlation of the D-di⁃mer test and biphasic computed tomography with mesenteric com⁃puted tomography angiography in the diagnosis of acute mesenteric ischemia[J].Am J Surg,2009,197(4):429-433.
[14]Chiu YH,Huang MK,How CK,et al.D-dimer in patients with suspected acute mesenteric ischemia[J].Am J Emerg Med,2009, 27(8):975-979.
[15]Acosta S,Nilsson TK,Bjorck M.Preliminary study of D-dimer as a possible marker of acute bowel ischaemia[J].Br J Surg,2001,88 (3):385-388.
[16]Thuijls G,Van Wijck K,Grootjans J,et al.Early diagnosis of in⁃testinal ischemia using urinary and plasma fatty acid binding pro⁃teins[J].Ann Surg,2011,253(2):303-308.
[17]Kanda T,Fujll H,Tani T,et al.Intestinal fatty acid-binding pro⁃tein is a useful diagnostic marker for mesenteric infarction in hu⁃mans[J].Gastroenterology,1996,110(2):339-343.
[18]Delaney CP,O'neill S,Manning F,et al.Plasma concentrations of glutathione S-transferase isoenzyme are raised in patients with in⁃testinal ischaemia[J].Br J Surg,1999,86(10):1349-1353.
[19]Gearhart SL,Delaney CP,Senagore AJ,et al.Prospective assess⁃ment of the predictive value of alpha-glutathione S-transferase for intestinal ischemia[J].Am Surg,2003,69(4):324-329;discussion 9.
[20]Aschoff AJ,Stuber G,Becker BW,et al.Evaluation of acute mes⁃enteric ischemia:accuracy of biphasic mesenteric multi-detector CT angiography[J].Abdom Imaging,2009,34(3):345-357.
[21]Barmase M,Kang M,Wig J,et al.Role of multidetector CT angiog⁃raphy in the evaluation of suspected mesenteric ischemia[J].Eur J Radiol,2011,80(3):e582-587.
[22]Blachar A,Barnes S,Adam SZ,et al.Radiologists'performance in the diagnosis of acute intestinal ischemia,using MDCT and specif⁃ic CT findings,using a variety of CT protocols[J].Emerg Radiol, 2011,18(5):385-394.
[23]Karkpatrich ID,Kroeker MA,Greenberg HM.Biphasic CT with mesenteric CT angiography in the evaluation of acute mesenteric ischemia:initial experience[J].Radiology,2003,229(1):91-98.
[24]Ofer A,Abadi S,Nitecki S,et al.Multidetector CT angiography in the evaluation of acute mesenteric ischemia[J].Eur Radiol,2009, 19(1):24-30.
[25]Yikilmaz A,Karahan OI,Senol S,et al.Value of multislice com⁃puted tomography in the diagnosis of acute mesenteric ischemia [J].Eur J Radiol,2011,80(2):297-302.
[26]Wiesner W,Hauser A,Stenibrich W.Accuracy of multidetector row computed tomography for the diagnosis of acute bowel isch⁃emia in a non-selected study population[J].Eur Radiol,2004,14 (12):2347-2356.
[27]Menke J.Diagnostic accuracy of multidetector CT in acute mesen⁃teric ischemia:systematic review and meta-analysis[J].Radiology, 2010,256(1):93-101.
[28]Crookes B A,Shackford SR,Gratton J,et al."Never be wrong": the morbidity of negative and delayed laparotomies after blunt trau⁃ma[J].J Trauma,2010,69(6):1386-91;discussion 91-92.
[29]Morrison JE,Wisner DH,Bodai BI.Complications after negative laparotomy for trauma:long-term follow-up in a health mainte⁃nance organization[J].J Trauma,1996,41(3):509-513.
[30]Woo K,Major K,Kohanzadeh S,et al.Laparotomy for visceral ischemia and gangrene[J].Am Surg,2007,73(10):1006-1008.
(收稿:2015-08-06修回:2016-01-10)
(责任编辑周振理牛凯军)
Diagnosis of Acute Mesenteric Ischemia:A Meta-analysis
SONG Tao,SHEN Ping,WANG Xi-mo.Tian⁃jin Medical University,Tianjin(300070),China
ObjectiveTo evaluate the value of plasma biomarkers and computed tomography angiography (CTA)in the diagnosis of acute mesenteric ischemia(AMI).MethodsThe design of this meta-analysis fol⁃lowed the recommendations from the Meta-analysis of Observational Studies in Epidemiology.Summary esti⁃mates of diagnostic accuracy were computed by using a random-effect model.The studies without enough data to reconstruct cross-table were excluded.ResultsTwenty-four studies were included in the meta-analysis.The pooled sensitivity and specificity for D-lactate was 74%(95%confidence interval[CI]=61%~84%)and 74%(95%CI=69%~79%)respectively.The pooled sensitivity and specificity for D-dimer was 96%(95%CI=89%~99%)and 40%(95%CI=33%~47%)respectively.The pooled sensitivity and specificity for intestinal fatty acid binding protein(i-FABP)was 77%(95%CI=66%~86%)and 77%(95%CI=72%~82%)respectively.The pooled sensitivity and specificity for Glutathione S-transferase(GST)was 68%(95%CI=55%~80%)and 85%(95%CI= 76%~92%)respectively.The pooled sensitivity and specificity for CTA was 93%(95%CI=90%~96%)and 96%(95%CI=94%~97%)respectively.ConclusionThe plasma biomarkers may be helpful for excluding AMI, but their reliability need further confirmation.The CTA had high accuracy in the diagnosis of AMI.
Acute mesenteric ischemia;diagnosis;computed tomography angiography;serum biomarkers
R657.2
A
1007-6948(2016)03-0219-05
10.3969/j.issn.1007-6948.2016.03.003
1.天津医科大学研究生院(天津 300070)
2.天津市南开医院(天津 300100)
王西墨,E-mail:wangximo@126.com

