整体法在化学解题中的应用
吕兆兰
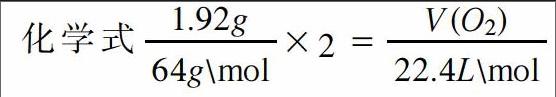
【摘 要】整体思维可以帮助学生开阔自己的思路,有利于提高学生对化学学习的兴趣以及化学解题的效率。本文主要从电子得失、元素整合、物质转化、溶液变色四方面进行分析。
【关键词】整体法 高中化学 解题
【中图分类号】G 【文献标识码】A
【文章编号】0450-9889(2016)09B-0150-02
整体法是一种全局把握的思维方式,学生运用得当就会变成解决化学难题的一把利器。老师的职责就是要将这把利器交给学生,让他们能够在考试沙场上披荆斩棘,为自己创造人生辉煌。笔者具有多年高中化学教学经验,就如何教导学生利用整体思维解题具有一定的研究与探索,下面简要介绍几点经验,希望能够对大家有所帮助。
一、电子得失,变换思维
整体法主要应用于化学计算中,能够减少化学计算量,达到快速解题的目的,在化学的很多章节中都有所体现,尤其是在学习金属的相关知识时,使用整体法解题的频率最高,希望大家多加注意,把握解题的要点所在。
在课堂教学中,老师要时刻注意提醒学生整体思维的妙处,在遇到任何题目都要做到整体把握,只有在大观上看清题目,才能够找到最高效最便捷的解题方式,使学生能够减轻学习负担。例如,当我们在学习完金属的知识之后,笔者会给学生出这样的题目,让他们进行思维训练:将1.92gCu放入到一定量的浓HNO3中,使得Cu完全溶解,直至生成的气体越来越浅,一共收集到标准状况下672ml,然后再将收集到的气体置于容器中并且倒扣在水面上,求需要通入多少毫升标准状况下的氧气才能够让容器充满?如果按照一般的解题思路,需要从头到尾的列出化学方程式,然后再根据各个物质的量依次进行计算,直至求出所需答案。这种方法还没有实施就已经觉得十分困难了,因此需要另辟蹊径。抛开细节,我们会发现这些化学反应全部是氧化还原反应,如果我们能够将氧化剂和还原剂的得失电子相等作为一个整体进行考虑,就能够起到化繁为简的作用。在整个过程中,HNO3将Cu氧化后自身被还原,之后又再次被氧气所氧化,最后又变成了HNO3,所以相当于HNO3的化合价并未发生改变,改变的只是Cu被氧化。这样就可以依据电子得失守恒列出化学式,解之可得,V(O2)=0.336L,所以题目的正确答案为336ml。这道题利用整体法将复杂的反应过程忽略,直接抓住解题的关键——得失电子守恒,从而快速求出答案。
由上可知,当我们用常规思维无法快速解题时,我们需要学会变换思维,换一个角度思考之后也就会有新的发现,提高解题速度。
二、元素整合,巧求质量
化学是一门综合性很强的学科,与化学知识相关的题型又有很多,所以作为老师要教会学生解题技巧,让他们在平时训练中抓住解题规律,避免出现学生通过题海战术来增加自己的做题经验的情况,使他们能够轻松愉快的学习。
在化学学习中,经常会遇见与混合物相关的题目,一般都是求解混合物中各个物质的质量的题目。很多学生在遇到类似的题目时,都会觉得一头雾水而无法下手,为了改变这种现状,老师就要多下功夫,帮助学生理清解题思路,掌握这类题型的解题技巧。例如,在学生进行习题训练时,笔者会要求学生练习这样的题目:有一种混合物,是由K2S和Al2S3 混合而成,这两种物质的物质的量之比为3∶2,则含有32g硫元素的这种混合物的质量是多少?这就是一道简单的与混合物相关的题目,考查了硫元素的知识。题干中只给出了两种物质的物质的量之比,但是观察两种物质的化学式K2S和Al2S3,我们可以将它们看作一个整体,得出一个新的化学式K6Al4S9,这样我们就能够得出混合物中硫元素的对应关系:K6Al4S9→9S,这样只需要带入题干中所给出的数据就能够轻松地求出混合物的质量为70g。这是一种最简单的解题方式,但是有一点需要引起注意,那就是将两个化学式化为一个化学式时,需要关注元素的变化以及新的化学式要符合化学式的条件,只有注意到这些,才能够继续解题。
与混合物相关的题目有很多,上例只是其中之一,老师在平时教学中可以多多进行总结归纳,最后与学生分享,使学生能够快速地解决类似的问题,提高解题效率。
三、物质转化,紧抓关键
化学试题中会存在很多的计算题,学生由于天生对计算题敏感,所以大都会卡在计算题中不能前进。这是许多学生的一个通病,作为化学老师一定要想办法帮助学生克服这个障碍,让他们能够从容坦然地面对计算题。
解答计算题也是有技巧的,需要老师在旁不断地指导学生,让学生觉得解答计算题也是一种乐趣。计算题的种类有很多,而且也是高考的必考题目,所以进行大量的题目训练有时是必不可少的,老师可以为学生挑选一些合适的题目,让学生在实战中增加解题经验。例如,很多学生都会遇到这样的题目:
(下转第156页)
(上接第150页)
有5.1g镁铝合金,投入到500ml2mol\L的稀盐酸溶液中,然后再加入一定量的4mol\L的氢氧化钠溶液,如果要使沉淀物质达到最大量,那么需要加入氢氧化钠溶液的体积为多少( )。
A.300ml B.250ml
C.200ml D.100ml
这道题考查学生分析物质之间的转化,由于题目中涉及到化学反应较多,如果学生根据化学式一一进行求解,则会显得十分困难复杂,所以只需要考虑在反应中各个元素的量的变化即可,只有镁元素和铝元素在反应的最后变成了沉淀物质的组成部分,沉淀物分别为氢氧化镁和氢氧化铝,所以整个反应都不包含氯离子和钠离子,而这最后生成了氯化钠,由此可以得知n(Hcl)=n(NaOH),仅根据这条信息我们就得出需要加入的氢氧化钠溶液的体积为2×0.5÷4=0.25l,所以这道题目的正确答案为选项B。
在这道题的解答中,也应用了整体思维,正是由于整体法的应用,才能够忽略反应中的复杂过程,直接面对解题要害。
四、溶液变色,妙解原因
溶液发生颜色变化,也是一类经典的考题,就如同喷泉实验一样,在各个类型的考试中都会有所渗透,因此老师也要注意这类题目的讲解,让学生能够无忧地面对考试。
溶液变色会有很多的原因,老师可以在平时教学中多做总结分析,将这些相关的知识总结在一起,与学生一起讨论分享,使学生能够做到有恃无恐。下面以一道例题为例,讲解溶液变色的原理。已知浅绿色溶液Fe(NO3)2中,存在如下的平衡:Fe2++2H2O→Fe(OH)2+2H+,若在此溶液中加入一定的盐酸之后溶液的颜色将变( ),其原因是( )。不少学生会认为颜色变为绿色或者加深,是由于加入盐酸之后,是上述的平衡向逆反应方向移动,其实这样答题的话就会掉入命题者的圈套而失分。解题时应从全局考虑,由于溶液中含有亚硝酸离子,当加入盐酸之后,会有较多的氢离子,此时硝酸根离子在酸性溶液中会具有强氧化性,因而会将亚铁离子氧化为铁离子,所以溶液会变成棕黄色,而不是变成绿色。这道题的关键就是不要掉进陷阱中,可逆反应是存在的,但是在氧化性面前就会显得微乎其微,所以这一点一定要注意。
学生在解题时,一定要做到全局把握,只有把握解题的关键才能够正确的找到解题的突破口,轻松地解答题目,为考试的胜利奠定基础。
总之,通过整体法的教学实践,能够扩宽学生的解题思路,使学生的思维不再受到局限,对题目有个整体客观的把握。如果学生能够将整体法运用得得心应手,对于大部分化学难题都会无往不利。作为化学老师,一定要将整体法的应用作为教学的重点内容,培养学生的整体思维,在整体上提高学生的化学素养。
(责编 罗汝君)

