紫外光谱法研究2-羟甲基苯并咪唑与DNA的相互作用
郁有祝,宋群立,郭玉华
(1.安阳工学院化学与环境工程学院,河南安阳455000;2.许昌幼儿师范学校,河南许昌461700)
紫外光谱法研究2-羟甲基苯并咪唑与DNA的相互作用
郁有祝1,宋群立2,郭玉华1
(1.安阳工学院化学与环境工程学院,河南安阳455000;2.许昌幼儿师范学校,河南许昌461700)
用紫外光谱法和黏度法研究2-羟甲基苯并咪唑与DNA的相互作用,考察离子强度对两者相互作用的影响。结果表明:在pH=7.40的Tris-HCl缓冲溶液中,DNA使2-羟甲基苯并咪唑的紫外吸收光谱减色且红移,测得2-羟甲基苯并咪唑与DNA的结合常数为5.2×107L·mol-1。随2-羟甲基苯并咪唑浓度增大,DNA黏度增大,NaCl浓度增加,DNA-2-羟甲基苯并咪唑体系吸光度无明显变化,2-羟甲基苯并咪唑以嵌插作用方式与DNA结合。
2-羟甲基苯并咪唑;DNA;紫外光谱;黏度;相互作用
D01∶10.19329/j.cnki.1673-2928.2016.06.004
苯并咪唑是含2个氮原子的芳香杂环,这种特殊的结构可以与生物体内的酶和受体等形成氢键。以苯并咪唑环构筑的药物分子,有广泛的生物活性,如作为组胺受体拮抗剂、质子泵抑制剂、抗高血压、抗菌、抗病毒、抗癌、镇痛等[1]。同时,独特的π-共轭结构以及对DNA序列具有高度的选择性亲和作用,使它的衍生物作为分子探针应用于DNA结构的研究。唐凌天等[2]研究发现在pH= 3.4时2-(4-二甲氨基苯基)-5-氟-6-吗啉-1-氢-苯并咪唑(1)与小牛胸腺DNA存在明显的相互作用,分子(1)是一种潜在的测定DNA的定量试剂。因此,苯并咪唑化合物与DNA相互作用的研究,有助于人们从分子水平上了解药物的作用机理,为设计临床上以DNA为靶标的药物分子提供理论指导。
本文利用紫外光谱结合黏度法研究了2-羟甲基苯并咪唑与DNA的相互作用机理及作用方式,并进一步求出它们的结合常数。
1 实验部分
1.1 仪器与试剂
HP8453紫外光谱仪;乌贝路德黏度计(上海良晶玻璃仪器厂);pHS-2C型酸度计(上海虹益仪器仪表有限公司)。
2-羟甲基苯并咪唑按文献方法合成和纯化[3],配制成浓度为1.00×10-3mol.L-1储备液;小牛胸腺DNA(Sigma公司),用含有50mmol/L NaCl的Tris-HCl(pH=7.40)缓冲溶液配制,其浓度确定见文献[4],浓度为3.89×10-4mol/L,溶液保存于4℃冰箱中备用;0.05mol/L Tris-HCl溶液(pH=7.4);1mol/L NaCl溶液;所用试剂均为分析纯,实验用水为二次蒸馏水。
1.2 实验方法
1.2.1 紫外吸收光谱
分别取0.5mL 1.00×10-3mol.L-12-羟甲基苯并咪唑、不同体积3.89×10-4mol/L DNA溶液、2.0mL 0.05mol/L Tris-HCl(pH=7.4)缓冲溶液于10mL比色管中,用蒸馏水定容,混匀后放置30min,以相应的DNA和Tris-HCl缓冲溶液为参比,测定其在200~400nm的紫外吸收光谱图。
1.2.2 DNA黏度测定
用乌贝路德黏度计测量黏度,温度恒定在(25 土0.1)℃。黏度测试中,固定DNA的浓度,2-羟甲基苯并咪唑浓度逐渐增加。测试液相对黏度的测量方法及计算见文献[5]。
2 结果与讨论
2.1 2-羟甲基苯并咪唑与DNA作用的紫外吸收光谱
2-羟甲基苯并咪唑与DNA相互作用的紫外吸收光谱图如图1所示。加入DNA后,没有新的吸收峰出现,但最大吸收波长处的吸收峰强度随DNA浓度的增大明显减小,且吸收峰出现少许红移。据Long E C[6]的研究结果,减色效应、红移现象是物质与DNA发生嵌插作用的标志。通常认为,插入小分子与碱基对之间存在的堆积作用使得小分子的π*轨道与碱基的π轨道发生偶合,从而导致π-π*跃迁能量减小,产生红移现象。同时偶合的π*轨道因部分填充电子,使得π-π*跃迁的概率减小,从而产生减色效应。同时还看到在215nm
处出现等吸收点,这说明二者形成了稳定的络合物[7]。
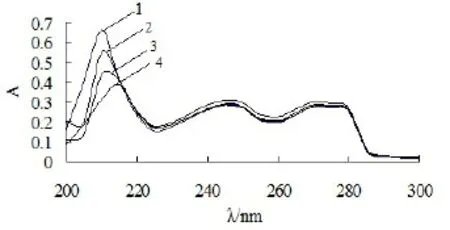
图1 不同DNA浓度下2-羟甲基苯并咪唑紫外吸收光谱图
2.2 结合常数
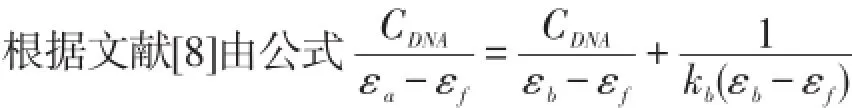
可求小分子与DNA的结合常数kb。其中,εa为加有一定量DNA的2-羟甲基苯并咪唑的摩尔吸光系数,εb为完全结合DNA后2-羟甲基苯并咪唑的摩尔吸光系数,εf为未加DNA的2-羟甲基苯并咪唑的摩尔吸光系数,CDNA为DNA的浓度。根据该公式,以CDNA/(εa-εf)对CDNA作图得到直线(如图2),直线的斜率与截距之比即为结合常数Kb,求得2-羟甲基苯并咪唑与ctDNA的结合常数Kb=5.2×107L·mol-1。
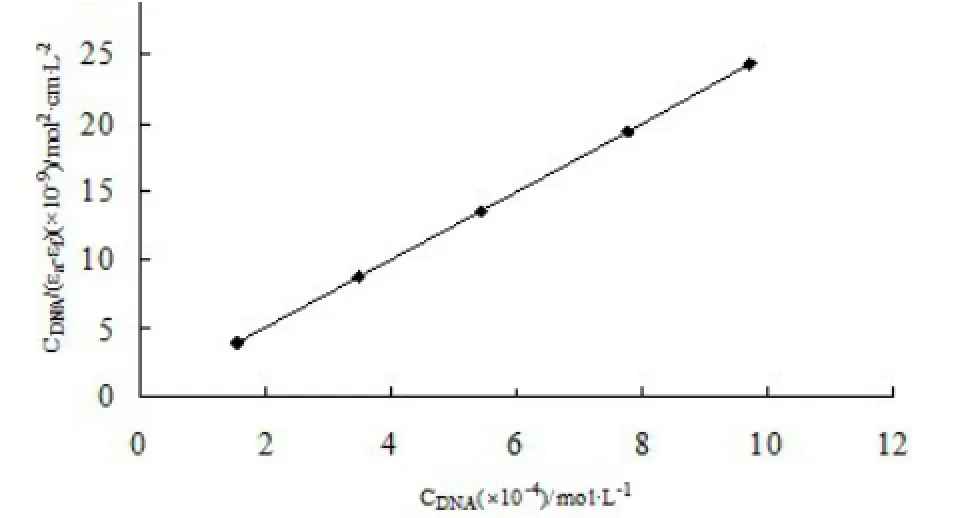
图2 2-羟甲基苯并咪唑与DNA的结合常数
2.3 黏度实验
黏度法也被认为是检测小分子与DNA相互作用的重要依据之一[9]。当小分子以嵌插模式与DNA结合时,DNA的相邻碱基对的距离会变大以容纳插入的小分子,导致DNA双螺旋伸长,DNA溶液的黏度增大;而以静电或者沟槽模式结合,DNA溶液的黏度无明显变化[10]。由图3可见,随着2-羟甲基苯并咪唑浓度的增大,DNA相对黏度不断增大,表明2-羟甲基苯并咪唑以嵌插模式与DNA结合,这与2.1结论相一致。
2.4 离子强度的影响
离子强度对2-羟甲基苯并咪唑-DNA体系吸光度的影响如图4所示,随着NaCl浓度的增大,体系的吸光度几乎没有变化,说明2-羟甲基苯并咪唑与DNA之间不存在静电作用[11]。

图3 2-羟甲基苯并咪唑对DNA黏度的影响

图4 离子强度的影响
3 结论
紫外光谱法、离子强度的影响及黏度实验表明,在pH=7.40的Tris-HCl缓冲体系中,2-羟甲基苯并咪唑以嵌插方式与DNA结合,测得结合常数为5.2×107L·mol-1。本文为苯并咪唑类药物的药理研究提供一定的理论依据。
[1]孟江平,耿蓉霞,周成合,等.苯并咪唑类药物研究进展[J].中国新药杂志,2009,18(16)∶1506-1514.
[2]唐凌天,王毅,刘新起,等.光谱法研究2-(4-二甲氨基苯基)-5-氟-6-吗啉-1-氢-苯并咪唑与小牛胸腺DNA的相互作用[J].光谱学与光谱分析,2005,25(10)∶1618-1621.
[3]陈伟.苯并咪唑衍生物的合成及其金属配合物羰基化催化反应研究[D].西安:西北大学,2010.
[4]CATER M T,RODRIGUEZ M,BARD A J.Voltammetric studies of the interaction of metal chelates with DNA.2.Trischelated complexes of cobalt(III)and iron(II)with 1,10-phen⁃anthroline and 2,2'-bipyridine[J].J Am Chem Soc,1989,111 (24)∶8901-8911.
[5]刘幸平,胡润淮,杜薇.物理化学[M].北京∶科学出版社,2002,275.
[6]LONG E C,BARTON J K.On Demonstration DNA Interca⁃lation[J].Accounts Chem.Res.,1990,23(9)∶271-273.book=2016,ebook=27
O657.32
A
1673-2928(2016)06-0010-03
2016-03-11
郁有祝(1978-),男,山东临沂人,安阳工学院副教授,主要从事有机分析方面研究。

