miR-31协同5-Fu发挥抗肿瘤作用的体内研究
张伟 谭永胜 马和平
·论著·
miR-31协同5-Fu发挥抗肿瘤作用的体内研究
张伟 谭永胜 马和平
目的 探讨miR-31在胃癌细胞对化疗药物5-氟尿嘧啶(5-Fu)敏感性方面的影响,以及在小鼠体内miR-31联合5-Fu对胃癌生长的影响和机制。方法 实时定量PCR的方法检测临床耐药胃癌患者癌组织和非胃癌患者胃组织中以及PBMC中的miR-31的表达,野生型MFC细胞和耐5-Fu 的MFC-R细胞中miR-31的表达,同时,流式细胞术检测耐药胃癌患者癌组织和非胃癌患者外周血中Treg细胞的比例,分析miR-31和FOXP3的相关性。MTS检测miR-31对MFC细胞增殖的影响。miR-31和5-Fu联合用药后对小鼠体内肿瘤生长的影响,LDH释放实验检测CD+8T细胞对MFC的杀伤影响。结果 临床耐药胃癌患者癌组织和PBMC中的miR-31水平显著低于非胃癌患者(P<0.05),而外周CD3+CD+4CD25+FOXP3+T细胞比例显著高于非癌症患者(P<0.05),且二者呈负相关(P<0.05)。而在耐5-Fu的MFC细胞中,miR-31的水平降低。当转染miR-31到MFC细胞中后,miR-31的高表达增加了细胞对5-Fu的敏感性(P<0.05)。小鼠体内实验证实,miR-31协同5-Fu可以显著抑制MFC细胞在小鼠体内生长,并且miR-31可以降低荷瘤小鼠肿瘤浸润以及外周的Treg的比例,增强CD+8T细胞的CTL功能(P<0.05)。结论 miR-31能够抑制胃癌MFC细胞的生长可能是通过直接增加癌细胞对化疗药物的敏感性,并且通过抑制Treg细胞的功能来实现的。
胃癌;miR-31;5-Fu;FOXP3;肿瘤抑制
胃癌是一种极为常见的恶性肿瘤,被认为是导致患者死亡的第三大肿瘤。尽管现在临床上有诸多抗胃癌的药物,但是因为该肿瘤的易复发和易转移性,导致该疾病预后较差,经典化疗药物的五年生存率仅有10%,转移性的胃癌患者的生存期不超过1年[1]。目前备受瞩目的免疫药物,如抗VEGFR-2的单抗ramuciru mab,作为二线药物对于转移性胃癌患者的生存率有所改善。而其他的抗血管生产药物,如贝伐单抗,舒尼替尼,索拉非尼不能改善生存率[2-4]。随着免疫调节在肿瘤的发生发展中越来越受到重视,越来越多的以免疫分子为靶点的药物应用到临床治疗中,如PDL-1的单抗,EGFR的单抗,HER2的单抗等,取得了良好的抗肿瘤效果。 调节性T细胞(Treg)对免疫系统的调节具有重要的功能,叉头蛋白P3(FOXP3)是Treg细胞的重要转录因子。Treg在肿瘤的发生发展中发挥重要的作用,主要是通过抑制效应性CD+4T细胞和CD+8T细胞的功能而促进肿瘤生长[5,6]。 肿瘤组织中FOXP3+的Treg细胞增多预示肿瘤预后较差以及肿瘤进展较快。在卵巢癌,乳腺癌和肺癌中,Treg细胞含量增加[7-9]。也有研究显示在胃癌患者中,外周血中的Treg数量增加[10]。Treg细胞介导的对细胞毒性T细胞,DC以及NK细胞的免疫抑制功能成为肿瘤免疫逃逸的重要机制之一。因此,探究Treg在胃癌中的变化机制对于胃癌的发生发展和治疗有重要意义。miRNA是一些短的非编码RNA,是在进化过程中形成的保守的具有多效性功能的小分子RNA。其主要是通过与基因的3’-UTR区结合,在翻译水平或者转录水平调节靶基因的表达,进而参与细胞生长增殖和肿瘤发生[11-13]。一个microRNA通常可以调控十几个靶基因。人体中,约有六百多个microRNA调控基因组中1/3的mRNA编码。有研究显示,miRNA具有抑制癌基因表达而抑制肿瘤生长的作用,某些miRNA在肿瘤生长方面表现出了双向作用[14-16]。因此,miRNA可以作为肿瘤治疗的一个潜在的靶点,以及肿瘤的生物学标志。miR-31 具有多个靶基因,在乳腺癌中,miR-31表达受到抑制后,增加了肿瘤的转移[17]。在前列腺癌中,miR-31的下调增加了癌细胞对化疗药物的抗药性[18]。但是miR-31在胃癌中的表达及作用尚不清楚。在本研究中,我们先用软件TargetScan Human 6.2预测到FOXP3是miR-31潜在的一个靶基因。进一步分析了胃癌患者中Treg与miR-31的表达水平的相关性阐明了miR-31和FOXP3在胃癌进展中的作用,为胃癌的治疗提供了新的思路。
1 材料与方法
1.1 材料与试剂 外周血,人胃癌组织和非胃癌组织来源于内蒙古医院肿瘤科患者以及消化科怀疑胃癌但经组织病理检查确诊的非胃癌患者,胃癌患者对于化疗药物均产生多药物耐药且接受了手术治疗。小鼠胃癌细胞MFC培养于含有10%胎牛血清的RPMI-1640培养基中。SPF级的615小鼠购买于中国科学院上海生物研究所。PE-anti FOXP3 抗体(克隆号150D)购于Biolegend公司。5-氟脲嘧啶(5-Fu)购于Sigma公司。miR-31mimic, miR-31NC,miR-31 inhibitor 和miR-31 inhibitor NC 由invitrogen公司合成。pGL3-FOXP3-3’UTR(含FOXP3启动子的质粒)由本实验室构建。所有实验均通过了内蒙古人民医院医学伦理委员会同意。
1.2 5-Fu耐药细胞株的筛选 根据文献报道用逐步增加5-Fu药物浓度的方法筛选耐5-Fu的MFC细胞。具体方法为先用MTS(Promega公司)法检测5-Fu对BGC-823的IC50浓度约为7.49 g/ml。MFC细胞在培养过程中首先加入7.5 g/ml的5-Fu培养24 h,将死亡的细胞用PBS洗去,再加入10 g/ml的5-Fu培养 24 h,反复用浓度逐步增加(10、15、20、25 g/ml)的5-Fu培养4次后,将存活的MFC细胞消化下来并维持在7.5 g/ml的培养基中培养。培养2周后,去掉5-Fu后进行细胞实验,得到的抗5-Fu的MFC细胞命名为MFC-R。
1.3 质粒的构建 pGL3-FOXP3-3’UTR的构建方法参照Rouas的方法进行构建[19]。
1.4 RT-PCR检测miR-31的表达 按照说明书,TRizol法提取组织和细胞的总RNA,紫外分光光度计检测总RNA的浓度。以5 g的总RNA 为模板进行逆转录获得cDNA第一链。以CDNA为模板,采用SYBR Green real-time PCR Master Mix试剂盒进行实时定量PCR 检测miR-31的表达,U6为内参。所用引物序列为:miR-31 P1:TAATACTGCCTGGTAATGATGA,P2:GTCGTATCCAGTGCAGGGTCCGAGGTATTCGCACTGGATACGACAGCTAT;U6 P1:GCGCGTCGTGAAGCGTTC,P2:GTGCAGGGTCCGAGGT[19]。结果采用2-ΔΔCT进行分析。
1.5 细胞处理 MFC细胞按2×105个/ml接种于6孔板,培养24 h细胞达到70%融合的时候, 分别单独给予50 nmol/L的miR-31 mimic或者miR-31 NC,或者联合10 g/ml的5-Fu处理细胞72 h,MTS法检测细胞的存活率。
1.6 流式细胞术实验 为了检测外周T细胞中FOXP3的表达,取胃癌患者和非胃癌者的外周血,用淋巴细胞分离液ficoll分离人PBMC,细胞计数仪计数后调整细胞浓度为2×106个/ml,接种到6孔板中培养,同时加入PMA和离子霉素刺激24 h。收获细胞,PBS洗涤细胞一次,加入抗人的APC-anti CD4抗体,per-cp-anti CD25抗体,室温孵育30 min。PBS洗涤细胞1次,离心手机细胞,4%多聚甲醛固定细胞30 min,破膜剂再与细胞孵育20 min后。加入PE-anti FOXP3抗体,孵育40 min,PBS洗涤细胞1次,离心,去上清,细胞过滤后,用C6 accuri 流式细胞仪检测FOXP3的表达。为了检测肿瘤细胞的生长增殖情况,MFC和MFC-R细胞经5-Fu处理24 h,收获细胞,然后用70%的冰冷乙醇在-20℃固定细胞1 h。PBS洗涤细胞3次后,去上清,再用100 μl PBS重悬细胞,加入PE-anti Ki67 抗体,避光染色30 min。流式细胞仪检测Ki67的表达。
1.7 双荧光报告基因检测 为了确定FOXP3是否为miR-31的靶基因,将miR-31mimic,miR-31 NC,miR-31 inhibitor,miR-31 inhibitor NC分别与pGL3-FOXP3-3’UTR质粒共转染T淋巴瘤细胞株Jurkat细胞,转染48 h 后收获细胞,用双荧光素酶报告基因检测系统(Promega公司)检测荧光强度。
1.8 小鼠体内实验 6~8周的615小鼠接种MFC和MFC-R肿瘤细胞1周后,待肿瘤开始长出将小鼠随机分为8组,每组6只,分别为, MFC组,MFC-R组,MFC+5-Fu组,MFC-R+5-Fu组,MFC+miR-NC+5-Fu组,MFC-R+miR-NC +5-Fu组(50 mg/kg),MFC+miR-31+5-Fu组,MFC-R+ miR-31+5-Fu组。未接种肿瘤的小鼠为正常对照组。每2天测量肿瘤体积大小,肿瘤体积按V=1/2ab2。21 d后,处死小鼠,取肿瘤组织检测miR-31的表达。取小鼠瘤组织和脾脏检测小鼠FOXP3的表达。为了检测CD+8T细胞的功能,将瘤组织的淋巴细胞分离后,细胞计数,并调整细胞浓度到1×106个/ml,该细胞作为效应细胞。同时,将MFC细胞收获,并调整细胞浓度,该细胞作为靶细胞。将效靶细胞比例分别调整为25∶1,10∶1,5∶1,2.5∶1接种到96孔板中,培养12 h。用LDH试剂盒检测CD+8T细胞的CTL功能。
1.9 统计学分析 应用SPSS 17.0统计软件,计量资料以±s表示,采用t检验,并进行相关性分析,P<0.05为差异有统计学意义。
2 结果
2.1 miR-31和FOXP3在胃癌患者和非癌患者中的表达 为了检测抗化疗药患者组织中miR-31的表达水平,手术切除的癌组织以及非癌组织用来提取总RNA,并逆转录为cDNA。同时提取外周血中PBMC的总RNA,并逆转录为cDNA。实时定量PCR的结果显示胃癌组织中的miR-31的表达水平显著低于非癌组织(P<0.05)。并且胃癌患者的PBMC中miR-31水平显著低于非胃癌患者的(P<0.05)。将胃癌患者和非癌患者的外周血分离获得PBMC后,流式细胞术检测外周T细胞中FOXP3的表达。结果显示胃癌患者的外周T细胞的FOXP3水平显著高于对照非癌患者(P<0.05)。并且miR-31与FOXP3在胃癌组织中的表达呈负相关(R2分别为0.7863和0.7135,P<0.05)。见图1,表1。

图1 胃癌患者和非胃癌患者的组织,PBMC中miR-31和 CD+4CD25+FOXP3的表达;A.胃癌患者和非胃癌患者组织中miR-31的表达水平;B.胃癌患者和非胃癌患者PBMC中miR-31的表达水平;C.胃癌患者和非胃癌患者PBMC中CD+4CD25+FOXP3+ Treg的水平;D.组织中miR-31与FOXP3的相关性。E.PBMC中miR-31与FOXP3的相关性
表1 miR-31在瘤患者和非瘤者中不同组织中的表达水平 n=20,±s
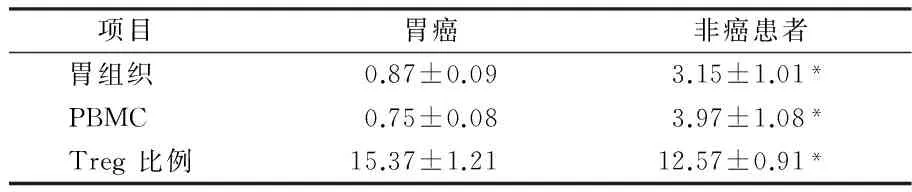
表1 miR-31在瘤患者和非瘤者中不同组织中的表达水平 n=20,±s
注:与肿瘤患者相比较,*P<0.01
项目胃癌非癌患者胃组织0.87±0.093.15±1.01*PBMC0.75±0.083.97±1.08*Treg比例15.37±1.2112.57±0.91*
2.2 miR-31在耐5-Fu和非耐药胃癌细胞MFC中的表达 为了检测miR-31是否与胃癌细胞的耐药性有关,我们筛选出了耐5-Fu的细胞株,MFC-R。MFC和MFC-R细胞分别用10 g/ml的5-Fu处理24 h后,收获细胞,提取细胞的总RNA。实时定量PCR检测miR-31在MFC和MFC-R细胞中的表达水平,结果显示MFC-R中的miR-31水平显著低于MFC中的miR-31水平(P<0.05)。为了进一步检测miR-31与MFC耐药的相关性,MFC和MFC-R细胞分别用5-Fu 10 g/ml)联合miR-31 mimic,miR-31 NC(各50 nmol/L)处理48 h后,流式细胞术检测胞内Ki67的表达水平,以反映细胞存活情况。结果显示miR-31显著促进了MFC和MFC-R对5-Fu的敏感性,这个结果提示miR-31可增加胃癌细胞对化药5-Fu的药物敏感性。见图2,表2。

图2 miR-31对小鼠胃癌细胞MFC耐5-Fu的影响;A.野生型MFC和耐5-Fu的MFC-R中miR-31的表达水平;B.流式检测miR-31在MFC和MFC-R对5-Fu敏感性的影响
表2 流式检测ki67在不同细胞中的表达水平 n=6,%,±s

表2 流式检测ki67在不同细胞中的表达水平 n=6,%,±s
注:与vehicle组比较,*P<0.05;与5-Fu+miR-31对照比较,#P<0.05
组别MFCMFC-Rvehicle1.12±0.131.35±0.455-Fu+miR-31对照0.65±0.08*1.14±0.38#5-Fu+miR-310.37±0.05*0.47±0.09*
2.3 miR-31联合5-Fu降低了肿瘤在小鼠体内的生长速率 将MFC,MFC-R细胞接种到SPF级的615小鼠背部皮下。待7 d后,小鼠肿瘤开始长出时开始给药,腹腔注射5-Fu,50 mg/kg,尾静脉注射miR-31 mimics和miR-31 NC(200 nmol/L),给药3次/周,共给药3周。每2天记录肿瘤大小,计算肿瘤体积。结果表明,miR-31显著增加了小鼠体内MFC胃癌细胞对5-Fu的药物敏感性。而且逆转了抗5-Fu的细胞株MFC-R对5-Fu的耐药性。见图3,表3。
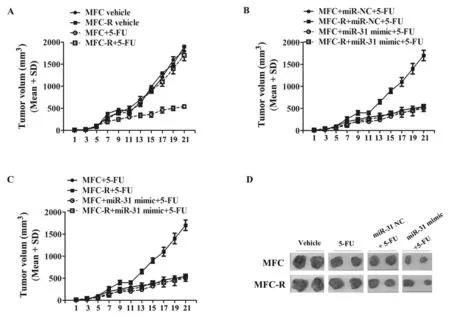
图3 miR-31和5-Fu联合用药对小鼠胃癌MFC增殖的影响。A.5-Fu对MFC和MFC-R在小鼠体内FOXP3抗体避光孵育40 min,PBS洗涤1次,过滤后,流式细胞仪检测FOXP3的表达。结果显示,miR-31生长的影响。B,C.miR-31联合5-Fu用药对MFC和MFC-R在小鼠体内生长的影响。D.小鼠体内肿瘤生长代表图
2.4 miR-31表达增加可以降低外周以及肿瘤浸润的T细胞中FOXP3的水平 将各组荷瘤小鼠的瘤组织取出,研磨后,滤网过滤,获得单细胞悬液。细胞计数后,调整细胞浓度为5×106个/ml。加入APC-anti mouse CD4,per-cp-anti mouse CD25 抗体,室温避光孵育30 min后,将细胞固定破膜,再加入PE-anti mouse给药组的瘤组织中,FOXP3的表达水平显著下降(P<0.05)。这说明FOXP3是miR-31的潜在作用靶点。为了证实FOXP3与miR-31的相关性,将miR-31mimic,miR-31 NC,miR-31 inhibitor,miR-31 inhibitor 分别于pGL3-FOXP3-3’UTR共转染Jurkat细胞后检测FOXP3的表达水平。双荧光报告基因和weatern blot结果显示,miR-31 能显著降低FOXP3的水平,表明FOXP3是miR-31的作用靶点。为了进一步验证这一结果,我们将荷瘤小鼠的脾细胞取出后,流式细胞术检测脾脏中T细胞的FOXP3的表达,结果与组织浸润的T细胞的FOXP3水平一致(结果未显示)。见表4,图4。

图4 miR-31对FOXP3的表达水平的影响;A.各组荷瘤小鼠瘤组织中浸润的T细胞中FOXP3表达水平;B.转染的Jurkat细胞中FOXP3的表达水平;C.共转染的Jurkat细胞中荧光报告基因水平检测;D.共转染的Jurkat细胞中FOXP3蛋白水平的检测
表3 动物体内肿瘤重量 n=6,g,±s
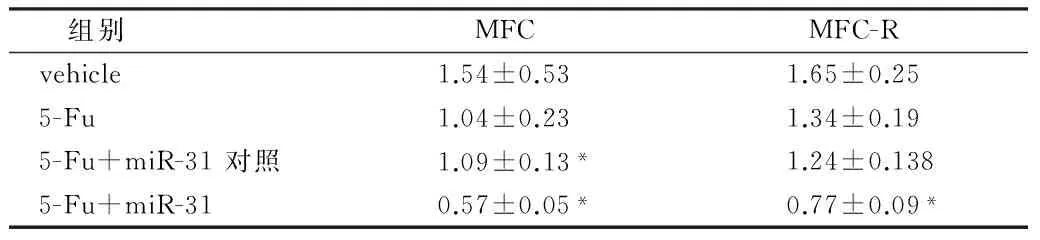
表3 动物体内肿瘤重量 n=6,g,±s
注:与vehicle组比较,*P<0.05
组别MFCMFC-Rvehicle1.54±0.531.65±0.255-Fu1.04±0.231.34±0.195-Fu+miR-31对照1.09±0.13*1.24±0.1385-Fu+miR-310.57±0.05*0.77±0.09*
表4 肿瘤组织中FoxP3的表达水平 n=6,%,±s

表4 肿瘤组织中FoxP3的表达水平 n=6,%,±s
注:与miR-31 对照组比较,*P<0.05,#P<0.05
类别MFCmiR-31对照1.21±0.09miR-31mimic0.64±0.02#inhibitor对照1.19±0.15miR-31inhibitor1.87±0.07*
2.5 miR-31表达增加可以增强CD+8T细胞的CTL功能 CD+8T细胞在抗肿瘤方面有重要作用,为了检测miR-31改变FOXP3后是否增强CD+8T的CTL功能,我们将肿瘤组织中的淋巴细胞用淋巴细胞分离液分离后,检测CD+8T细胞的CTL功能。结果表明,miR-31高表达的肿瘤组织能诱导更强的CTL功能。见图5。

图5 各组药物处理的肿瘤组织浸润的CD+8T细胞的CTL功能检测
3 讨论
MicroRNA 已被证实在肿瘤细胞的分化,增殖,凋亡和转移方面具有重要作用[20]。miR-31作为一种小分子非编码RNA与多种肿瘤细胞的耐药性有密切的关系,如前列腺癌[21]。 有研究表明,抗凋亡蛋白E2F6是miR-31潜在的靶点,miR-31就是通过该分子发挥生物学功能的,但是在某些肿瘤细胞中 miR-31表达水平下降,从而导致其抗药性的出现。在本研究中,我们证实miR-31可以增加胃癌细胞对5-Fu的药物敏感性,并且miR-31可以FOXP3为靶点,降低Treg细胞的比例。Treg在免疫系统中发挥了免疫抑制功能,可以通过分泌抑制性细胞因子IL-10,TGF-b等抑制CD+4T和CD+8T的功能。而CD+8T细胞在抗肿瘤过程中发挥了重要的作用。因此提高CD+8T细胞的功能也成为抑制肿瘤生长的靶点之一。
我们的研究显示,miR-31在体外可以提高胃癌细胞MFC对5-Fu的敏感性,其具体的机制可能是通过抑制了E2F6蛋白而发挥功能[20]。但是更有意义的是对小鼠体内的荷瘤的抑制作用,miR-31显著增强了5-
Fu对MFC在615小鼠体内的抑制作用。其机制除了可能直接增加MFC对5-Fu的敏感性外,还可能通过降低Treg细胞的水平,从而进一步提高了CD+8T细胞的杀伤功能。我们的研究发现,在小鼠荷瘤后,给予miR-31后,与5-Fu组相比,进一步抑制了肿瘤的生长增殖。肿瘤浸润的T细胞中,miR-31降低了FOXP3的表达,提示Treg的功能被抑制。同时检测了外周Treg的比例,脾脏中T细胞的FOXP3的表达水平下降,Treg功能被抑制。
目前,免疫分子在抗肿瘤中的作用越来越被重视,并且逐步应用到临床肿瘤治疗中。有研究报道,在小细胞肺癌、卵巢癌、肺癌、胃癌、黑色素瘤等肿瘤浸润的T细胞中,Treg比例上调[22,23]。Treg通过分泌IL-10,TGF-b,等细胞因子抑制CD+8T细胞,NK细胞的细胞毒作用。还可以诱导抗原递呈细胞表面的IDO的表达,发生免疫耐受。FOXP3作为Treg的重要转录因子,对其生物功能有重要影响。因此,抑制FOXP3的表达,即可减弱Treg的免疫抑制功能。FOXP3作为miR-31的一个潜在的靶点,可以被其抑制,从而促进了免疫系统的抗肿瘤作用。我们的研究表明,miR-31可以增加胃癌细胞对化药5-Fu的敏感性,可能是通过抑制E2F6实现的,但是其具体的分子机制尚不清楚,有待于我们后期的进一步研究。在小鼠体内,miR-31可以和化药5-Fu协同发挥抗胃癌的作用,其机制为一方面增加了肿瘤细胞对5-Fu的敏感性,另一方面降低了FOXP3的表达,抑制了Treg的比例,增强了T细胞的杀瘤效应,该研究为胃癌的抗肿瘤治疗提供了新的思路和靶点。
1 Orditura M,Galizia G,Sforza V,et al.Treatment of gastric cancer. World J Gastroenterol,2014,20: 1635-1649.
2 Van CE,Sagaert X,Topal B,et al.Gastric cancer.Lancet,2016,pii:S0140-6736(16)30354-3.
3 Aroldi F,Ogliosi C,Zaniboni A.Ramucirumab-paclitaxel as second-line therapy for advanced gastric cancer: Poliambulanza experience.Recenti Prog Med,2016,107:193-198.
4 Sibertin-Blanc C,Ciccolini J,Norguet E,et al.Monoclonal antibodies for treating gastric cancer: promises and pitfalls.Expert Opin Biol Ther,2016,16:759-769.
5 Somasundaram R,Jacob L,Swoboda R,et al.Inhibition of cytolytic T lymphocyte proliferation by autologous CD+4/CD25+ regulatory T cells in a colorectal carcinoma patient is mediated by transforming growth factor-beta.Cancer Res,2002,62:5267-5272.
6 Awwad M, North RJ.Cyclophosphamide-induced immunologically mediated regression of a cyclophosphamide-resistant murinetumor: a consequence of eliminating precursor L3T4+ suppressor T-cells.Cancer Res,1989,49:1649-1654.
7 Woo EY,Chu CS,Goletz TJ,et al.Regulatory CD4(+)CD25(+) T cells in tumors from patients with early-stage non-small cell lung cancer and late-stage ovarian cancer.Cancer Res,2001,61:4766-4772.
8 Woo EY,Yeh H,Chu CS,et al.Cutting edge: Regulatory T cells from lung cancer patients directly inhibit autologous T cell proliferation.J Immunol,2002,168:4272-4276.
9 Liyanage UK,Moore TT,Joo HG,et al.Prevalence of regulatory T cells is increased in peripheral blood and tumor microenvironment of patients withpancreas or breast adenocarcinoma.J Immunol,2002,169:2756-2761.
10 Kindlund B,Sjöling,Yakkala C,et al.CD4 regulatory T cells in gastric cancer mucosa are proliferating and express high levels of IL-10 but little TGF-β.Gastric Cancer,2016,24:iv56.
11 Bartel DP.MicroRNAs: genomics,biogenesis,mechanism,and function.Cell,2004,116:281-297.
12 Bartel DP.MicroRNAs: target recognition and regulatory functions.Cell,2009,136:215-233.
13 Hwang HW,Mendell JT.MicroRNAs in cell proliferation,cell death,and tumorigenesis.Br J Cancer,2007,96:R40-44.
14 Kent OA,Mendell JT.A small piece in the cancer puzzle: microRNAs as tumor suppressors and oncogenes.Oncogene,2006,25:6188-6196.
15 Calin GA,Croce CM.MicroRNA signatures in human cancers.Nat Rev Cancer,2006,6:857-866.
16 Ding M,Lin B,Li T,et al.A dual yet opposite growth-regulating function of miR-204 and its target XRN1 in prostate adenocarcinoma cells and neuroendocrine-like prostate cancer cells.Oncotarget,2015,6:7686-7700.
17 Krner C,Keklikoglou I,Bender C,et al.MicroRNA-31 sensitizes human breast cells to apoptosis by direct targeting of protein kinase C epsilon (PKCepsilon).J Biol Chem,2013,288:8750-8761.
18 Bhatnagar N,Li X,Padi SK,et al.Downregulation of miR-205 and miR-31 confers resistance to chemotherapy-induced apoptosis in prostatecancer cells.Cell Death Dis,2010,1:e105.
19 Kim HS,Lee KS,Bae HJ,et al.MicroRNA-31 functions as a tumor suppressor by regulating cell cycle and epithelial-mesenchymal transitionregulatory proteins in liver cancer.Oncotarget,2015,6:8089-8102.
20 Bhatnagar N,Li X,Padi SK,et al.Downregulation of miR-205 and miR-31 confers resistance to chemotherapy-induced apoptosis in prostate cancer cells.Cell Death Dis,2010,1:e105.
21 Lujambio A,Esteller M.How epigenetics can explain human metastasis: a new role for microRNAs.Cell Cycle,2009,8:377-382.
22 Medina PP,Slack FJ.microRNAs and cancer: an overview. Cell Cycle,2008,7:2485-2492.
23 Rouas R,Fayyad-Kazan H,El Zein N,et al.Human natural Treg microRNA signature: role of microRNA-31 and microRNA-21 in FOXP3 expression.Eur J Immunol,2009,39:1608-1618.
Study on the anti-tumor effects of miR-31 combined with 5-Fu in vitro and in vivo
ZHANGWei,TANYongsheng,MAHeping.DepartmentofInterventionTreatment,People’sHospitalofInnerMongoliaAutonomousRegion,Hohhot010017,China
Objective To explore the effects of miR-31 on the sensitivity of 5-fluorouracil (5-Fu) in gastric cancer cells in vitro,and to investigate the effects of miR-31 combined with 5-Fu on mice in vivo.Methods The expression levels of miR-31 in peripheral blood mononuclear cell (PMBC) and the cancer tissues of patients with gastric cancer and with clinical resistance and the expression levels of miR-31 in PMBC and gastric tissues of patients without gastric cancer were detected by Real-time PCR,moreover, which in wild type MFC cells and MFC cells with chemoresistance to 5-Fu (MFC-R cells) were also detected by Real-time PCR in vitro.Meanwhile the proportion of Treg cells (CD+3CD+4CD+25FOXP3+T cells) in gastric cancer tissues of patients with gastric cancer and in peripheral blood of patients without gastric cancer were detected by flow cytometry,moreover, the correlation between miR-31and FOXP3 was analyzed. The effects of miR-31on proliferation of MFC cells were detected by MTS,moreover, the effects of miR-31 combined with 5-Fu on tumor growth of mice in vivo were detected by MTS. Besides the effects of CD+8T cells on MFC were detected by LDH releasing assay.Results The expression levels of miR-31 in cancer tissues and PMBC of patients with gastric cancer as well as clinical resistance were significantly lower than those of patients without gastric cancer (P<0.05), however, the proportion of CD+3CD+4CD+25FOXP3+T cells in peripheral blood of patients with gastric cancer was significantly higher than that of patients without gastric cancer (P<0.05),furthermore, there was an negative correlation between them (P<0.05). However in MFC cells with chemoresistance to 5-Fu,the expression levels of miR-31were decreased. After miR-31was transfected into MFC cells, the high-expression of miR-31increased the sensitivity to 5-Fu (P<0.05). The experimental results in mice in vivo showed that miR-31combined with 5-Fu could obviously inhibit the growth of MFC cells in mice in vivo,moreover, miR-31 could decrease tumor infiltration of mice with tumor and could decrease the proportion of Treg cells in peripheral blood of mice and enhance CTL function of CD+8T cells (P<0.05).Conclusion miR-31can inhibit the growth of gastric cancer MFC cells by increasing the sensitivity of cancer cells to chemotherapeutic drugs directly and by inhibiting the function of Treg cells.
gastric cancer;miR-31;5-fluorouracil;FOXP3;tumor inhibition
10.3969/j.issn.1002-7386.2016.22.009
010017 呼和浩特市,内蒙古自治区人民医院介入诊疗科
R 735.2
A
1002-7386(2016)22-3395-06
2016-05-24)

