IL-17和IRF4在类风湿关节炎中的表达及临床意义*
李茜 张国栋 刘毅, 薛丽佳 林辉
(1.西南医科大学附属医院风湿免疫科, 四川 泸州 646000;2.中南大学湘雅二医院内科, 湖南 长沙 410083;
·论著·
IL-17和IRF4在类风湿关节炎中的表达及临床意义*
李茜1张国栋2刘毅1,3薛丽佳3林辉3
(1.西南医科大学附属医院风湿免疫科, 四川 泸州 646000;2.中南大学湘雅二医院内科, 湖南 长沙 410083;
3. 四川大学华西医院风湿免疫科, 四川 成都 610041)
目的 研究类风湿关节炎(RA)患者外周血单核细胞(PBMC)中白介素17(IL-17)、干扰素调节因子4(IRF4)的表达并探讨其临床意义。方法 收集四川大学华西医院门诊及住院RA患者30例(RA组),根据疾病活动性评分(DAS28)分为病情活动组16例,病情稳定组14例,另选取健康自愿者20例(健康对照组)。分离外周血得到单核细胞,采用流式细胞术检测IL-17水平,荧光定量PCR(RT-PCR)检测IL-17 mRNA、IRF4 mRNA表达水平。同时将健康对照组PBMC给予Th17细胞极化条件(CD3/CD28联合IL-6、IL-23、TGF-β,Th17细胞特异刺激组))及对照处理(CD3/CD28,对照组)培养72 h后用RT-PCR检测IL-17 mRNA、IRF4 mRNA表达水平。结果 RA病情活动组IL-17水平及IL-17 mRNA和IRF4 mRNA水平高于病情稳定组(P<0.01)。病情稳定组IL-17水平及IL-17 mRNA和IRF4 mRNA表达水平也高于健康对照组(P<0.05)。健康对照组PBMC在Th17细胞极化条件处理培养72 h后Th17细胞特异刺激组组IL-17 mRNA、IRF4 mRNA水平显著高于对照组(P<0.05)。结论 RA患者中IL-17 mRNA与IRF4 mRNA表达水平升高,IRF4可能参与Th17细胞增加通过上调IL-17水平参与疾病发生,这可能成为RA治疗的新靶点。
类风湿关节炎; 白细胞介素17; 干扰素调节因子4
类风湿关节炎(rheumatoid arthritis, RA)是一种累及多关节的慢性侵蚀性滑膜炎,其中以T细胞浸润滑膜,释放大量细胞因子及炎症介质,导致软骨和骨质破坏为其主要特点[1]。目前研究发现, IL-23参与了实验性自身免疫性脑脊髓炎的发病环节[2],并且IL-23能够诱导一种IL-17+T细胞产生,正是这种产生IL-17+T的T细胞后来被命名为Th17细胞,其证实参与了RA的发病[2]。干扰素调节因子(interferon regulatory factor,IRF)是一组能诱导和调节干扰素及其信号通路的转录因子。研究发现干扰素调节因子4(IRF4)是T细胞、B细胞和浆细胞分化成熟的必要调节因子[3]。IRF4作为Th17细胞非特异性的转录因子,可与其他转录因子相互作用,调控Th17细胞分化,参与多种自身免疫性疾病[4]。本研究通过检测RA患者外周血单核细胞(peripheral blood mononuclear cells,PBMC)中IL-17蛋白水平,IL-17 mRNA和IRF4 mRNA表达水平,以及正常人PBMC在Th17细胞极化条件下 IL-17 mRNA,IRF4 mRNA表达水平,探索IRF4调控RA Th17细胞分化机制,为RA治疗提供新的潜在靶点。
1 资料与方法
1.1 一般资料 收集2015年10月至2016年2月在华西医院门诊和住院部的RA患者30例,其中女性22例,男性8例,平均年龄(45.60±11.28)岁,均符合美国风湿病学会1987年修订的RA诊断标准。按照疾病活动性评分(DAS28)将疾病活动性分为四级:缓解(<2.6),轻度活动(2.6~3.2),中度活动(3.2~5.1)和重度活动(>5.1),并将DAS28评分为2.6~5.1的患者作为活动组(16例),治疗后病情稳定组(14例)。另选取性别和年龄匹配的健康志愿者20例为健康对照组,平均年龄(41.32±12.17)岁。
1.2 试剂与仪器 人淋巴细胞分离液Ficoll(天津灏洋生物制剂公司),PRMI-1640培养基(美国Hyclo公司),胎牛血清(美国Gibco公司)。佛波酯、离子霉素、莫能霉素(Sigma公司),固定破膜试剂盒(美国eBioscience公司),CD3/CD28单抗混合剂(美国Gibco公司),重组IL-6、IL-23、TGF-β(美国Gibco公司),Hank’s平衡盐溶液(美国Gibco公司),Trizol(美国Invitrogen公司),RT-PCR试剂盒(德国QIAGEN公司),IRF4、IL-17、β-actin引物由上海英峻生物技术有限公司合成,BV510标记的CD4及同型对照(美国BD公司),PE-Cy7标记的IL-17及同型对照(美国eBioscience公司)。FACS Calibur流式细胞仪(美国BD公司),实时荧光定量PCR仪CFX-96(美国Bio-Rad公司)。
1.3 方法
1.3.1 流式细胞术检测PBMC中IL-17蛋白水平 收集RA组和健康对照组肝素抗凝血采用Ficoll法分离得到单核细胞。加入佛波酯(50 ng/mL)、离子霉素(500 ng/mL)及阻断剂莫能霉素,37 ℃,5% CO2细胞培养箱中培养5 h。然后取出细胞悬液,用1 ml冷PBS洗涤1次,留下200 μL细胞悬液,加入BV510标记的抗人CD4抗体,孵育30 min,洗涤1次。留下100 μL细胞悬液,加入100 μL固定剂A反应20 min, 再加入透膜剂B 2 ml,洗涤2次后加入PE-Cy7标记的抗人IL-17抗体,反应30 min后洗涤1次,以250 μL预冷PBS重悬,用流式细胞仪测定,结果用Cellquest软件分析。上述抗体反应均设置同型对照管。
1.3.2 荧光定量PCR(RT-PCR)检测PBMC IL-17 mRNA和IRF4 mRNA表达水平 收集RA患者组及健康对照组PBMC后采用Trizol法提取RNA,并逆转录成cDNA,以cDNA为模板,采用SYBR GreenI嵌合荧光法进行定量PCR,按试剂盒说明建立PCR反应体系(总体积20 μL)。引物设计见表1。 PCR循环条件:95 ℃ 5 s → 各基因退火温度(IRF4为61.2 ℃,IL-17为61.1 ℃,β-actin为57.0 ℃)10 s,40循环。用内参基因β-actin标准化得到-ΔCT值,采用2-ΔΔCT计算目的基因的相对表达量。
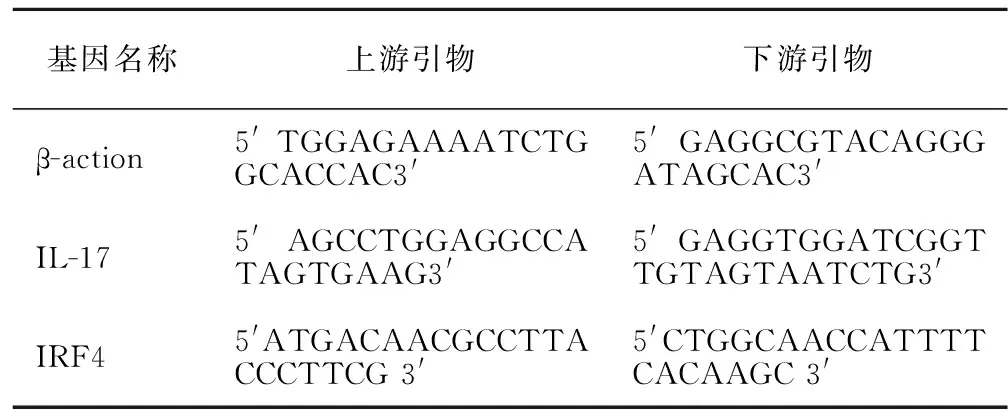
表1 β-肌动蛋白,IL-17和I RF4的引物序列
1.3.3 RT-PCR检测Th17细胞极化条件处理后健康对照组PBMC IL-17 mRNA和IRF4 mRNA表达水平 收集健康对照组的PBMC后,按1×106个细胞比例接种于6孔板中,Th17细胞特异刺激组为CD3/CD28+IL-6+IL-23+TGF-β处理,对照组为CD3/CD28处理,将细胞置于37 ℃、5% CO2培养箱中培养72 h后,用RT-PCR检测IL-17 mRNA和IRF4 mRNA表达水平。

2 结果
2.1 两组PBMC中 IL-17蛋白水平的比较 流式细胞术检测 RA组和健康对照组PBMC IL-17蛋白水平见图1。其中病情活动组IL-17蛋白水平(1.34±0.35)显著高于病情稳定组(0.64±0.22,P<0.01),而病情稳定组也高于健康对照组(0.45±0.13,P<0.05)。
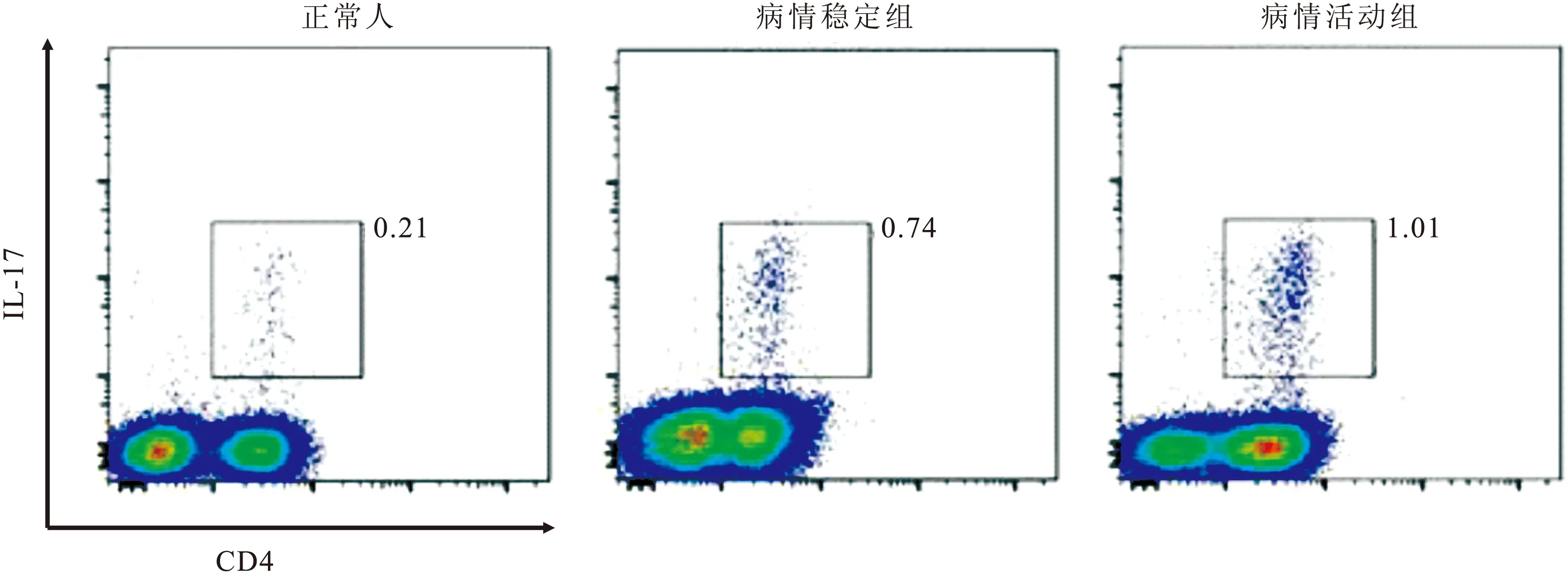
图1 两组PBMC细胞中IL-17蛋白水平
Figure 1 The levels of IL- 17 in PBMC of RA
2.2 两组PBMC 中IL-17 mRNA和IRF4 mRNA表达水平比较 RT-PCR检测两组PBMC IL-17 mRNA,IRF4 mRNA表达水平结果显示,RA病情活动组高于RA病情稳定组和健康对照组(P<0.05),并且RA病情稳定组同样高于健康对照组(P<0.05)。

表2 两组PBMC中IL-17 mRNA和IRF4 mRNA表达水平
注:与稳定组相比,①P<0.01;与对照组相比,②P<0.05,③P<0.05。
2.3 PBMC在Th17细胞极化处理后IL-17 mRNA和IRF4 mRNA表达水平比较 RT-PCR检测结果显示,Th17细胞特异刺激组IL-17 mRNA,IRF4 mRNA表达水平高于对照组(P<0.05)。

Table 3 The expression of IL-17mRNA and IRF4 mRNA in different stimulation

组别IL-17mRNAIRF4mRNATh17细胞特异刺激组1.50±0.37①1.34±0.45②对照组1.04±0.290.92±0.38
注:与对照组相比,①P<0.05,②P<0.05。
3 讨论
类风湿关节炎是一种以滑膜增生及关节软骨和骨质侵蚀性破坏为特征的自身免疫性疾病。Th17细胞是一种新型辅助性T细胞,主要以分泌IL-17为特征。研究发现,RA患者外周血中IL-17水平、关节液中IL-17水平明显升高,其中关节液中更高[5]。关节液中的IL-17与IL-17受体结合,通过MAP激酶途径和NF-κB途径发挥其生物学作用。IL-17可上调滑膜成纤维细胞及软骨细胞基质金属蛋白酶表达,诱导破骨细胞祖细胞向成熟破骨细胞分化,促进软骨蛋白多糖及胶原降解,加重骨质及软骨破坏[6]。IRF4作为Th17细胞的转录因子,虽不如RORγt特异性强,但近年在多发性硬化小鼠模型的研究中发现,通过干扰IRF4的表达可以明显降低Th17细胞分化以及IL-17产生,从而降低疾病炎症及临床评分[7]。因此探讨RA患者IL-17蛋白水平,IL-17 mRNA、IRF4 mRNA表达水平以及健康对照组的PBMC在Th17细胞极化条件下IL-17 mRNA、IRF4 mRNA表达水平变化,对了解RA中Th17细胞调控机制具有重要意义。
在本研究中,活动期RA患者中IL-17蛋白水平及IL-17 mRNA、IRF4 mRNA表达水平明显高于RA病情稳定组及健康对照组,且病情稳定组上述指标也高于健康对照组。但RA是如何产生大量Th17细胞具体机制尚不清楚,既往大多数的研究集中在Th17细胞特异性转录因子RORγt[8],而近年发现IRF4对Th17细胞分化也是必不可少的,虽然具体调节机制不清,但一些研究发现可能通过以下机制调控Th17细胞分化:①IRF4通过IL-1信号通路激活而大量表达,调节Th17细胞分化。Chung等[9]研究显示,在Th17细胞分化早期, IL-1受体mRNA 表达水平明显增高,IL-1通过与IL-6的协同作用促进IRF4及RORγt产生,其中IRF4增加更明显,从而促进早期Th17细胞分化。②Mudter等[10]在实验中发现IRF4可与STAT3共同诱导RORγt表达,增强RORγt诱导Th17细胞产生的能力,从而间接调控Th17细胞分化。进一步研究发现当IRF4缺乏时,T细胞中RORγt表达降低,IL-17水平降低,即使上调RORγt也只能部分恢复Th17细胞的分化[11]。③此外还有研究报道在肠道黏膜中IRF4能通过CD103+CD11b+ DC细胞产生IL-6来促进肠道Th17细胞分化,当CD103+CD11b+ DC细胞缺乏IRF4时,不仅会影响树突状细胞分化同样IL-17水平也同时降低[12-13]。
本实验中在体外培养健康对照组PBMC中发现CD3/CD28联合IL-6、IL-23、TGF-β刺激后IL-17 mRNA、IRF4 mRNA表达水平较对照组明显升高。既往研究也证实,CD3/CD28可协同促进Th17细胞产生,IL-6和TGF-β是促进初始CD4+T细胞分化为Th17细胞所必需的[14-15],IL-23对维持Th17细胞增殖也十分重要[16]。在Th17细胞极化条件下,不仅IL-17 mRNA水平升高,而IRF4 mRNA水平也增加,间接表明IRF4与Th17细胞增多有关,IRF4参与了Th17细胞的转录调控。这和Huber等[17]的研究结果一致,其发现在体外Th17细胞极化条件下,IL-6可诱导IL-21产生,而IRF4通过IL-21促进Th17细胞分化,此外IL-21在IRF4维持Foxp3, RORα,RORγt平衡中起关键性作用。
4 结论
RA患者病情活动组中存在高水平IL-17 mRNA、 IRF4 mRNA表达,并且体外培养健康对照组PBMC在Th17细胞特异性刺激下IL-17 mRNA、IRF4 mRNA的表达水平也明显升高,这进一步说明IRF4作为Th17细胞的间接调控转录因子参与了RA的发病机制。因此,通过深入研究IRF4对RA Th17细胞的调控机制,可能为RA Th17细胞的靶向治疗提供新的靶点。
[1]Imboden JB. The immunopathogenesis of rheumatoid arthritis[J]. Annu Rev Pathol, 2009,4:417-434.
[2]Yousefi B, Jadidi-Niaragh F, Azizi G,etal. The role of leukotrienes iimmunopathogenesis of rheumatoid arthritis[J]. Mod Rheumatol, 2014,24(2):225-235.
[3]Xu WD, Pan HF, Ye DQ,etal. Targeting IRF4 in autoimmune diseases[J]. Autoimmun Rev, 2012,11(12):918-924.
[4]Biswas PS, Bhagat G, Pernis AB. IRF4 and its regulators: evolving insights into the pathogenesis of inflammatory arthritis[J]. Immunol Rev, 2010,233(1):79-96.
[5]林辉, 周燕莉,李箭,等. 关节液Th17细胞变化在类风湿关节炎免疫炎症中的作用[J]. 四川大学学报(医学版),2013,44(6):907-910.
[6]Lubberts E, Joosten LA, van de Loo FA,etal. Reduction of interleukin-17-induced inhibition of chondrocyte proteoglycan synthesis in intact murine articular cartilage by interleukin-4[J]. Arthritis Rheum, 2000,43(6):1300-1306.
[7]Yang C, He D, Yin C,etal. Inhibition of Interferon Regulatory Factor 4 Suppresses Th1 and Th17 Cell Differentiation and Ameliorates Experimental Autoimmune Encephalomyelitis[J]. Scand J Immunol, 2015,82(4):345-351.
[8]Yang J, Xu P, Han L,etal. Cutting edge: Ubiquitin-specific protease 4 promotes Th17 cell function under inflammation by deubiquitinating and stabilizing RORgammat[J]. J Immunol, 2015,194(9):4094-4097.
[9]Chung Y, Chang SH, Martinez GJ,etal. Critical regulation of early Th17 cell differentiation by interleukin-1 signaling[J]. Immunity, 2009,30(4):576-587.
[10] Mudter J, Yu J, Zufferey C,etal. IRF4 regulates IL-17A promoter activity and controls RORgammat-dependent Th17 colitis in vivo[J].Inflamm Bowel Dis,2011, 17(6): 1343-1358.
[11] Brustle A, Heink S, Huber M,etal. The development of inflammatory T(H)-17 cells requires interferon-regulatory factor 4[J]. Nat Immunol, 2007,8(9):958-966.
[12] Persson EK, Uronen-Hansson H, Semmrich M,etal. IRF4 transcription-factor-dependent CD103(+)CD11b(+) dendritic cells drive mucosal T helper 17 cell differentiation[J]. Immunity, 2013,38(5):958-969.
[13] Schlitzer A, McGovern N, Teo P,etal. IRF4 transcription factor-dependent CD11b+ dendritic cells in human and mouse control mucosal IL-17 cytokine responses[J]. Immunity, 2013,38(5):970-983.
[14] Bettelli E, Carrier Y, Gao W,etal. Reciprocal developmental pathways for the generation of pathogenic effector TH17 and regulatory T cells[J]. Nature, 2006,441(7090):235-238.
[15] Veldhoen M, Hocking RJ, Atkins CJ,etal. TGFbeta in the context of an inflammatory cytokine milieu supports de novo differentiation of IL-17-producing T cells[J]. Immunity, 2006,24(2):179-189.
[16] Hirota K, Martin B, Veldhoen M. Development, regulation and functional capacities of Th17 cells[J]. Semin Immunopathol, 2010,32(1):3-16.
[17] Huber M, Brustle A, Reinhard K,etal. IRF4 is essential for IL-21-mediated induction, amplification, and stabilization of the Th17 phenotype[J]. Proc Natl Acad Sci U S A, 2008,105(52):20846-20851.
Expression and significance of IL-17 and IRF4 in patients with rheumatoid arthritis
LI Xi1, ZHANG Guodong2, LIU Yi3, et al
(1.DepartmentofRheumatologyandImmunology,SouthwestMedicalUniversity,Luzhou646000,Sichuan,China;2.DepartmentofInternalMedicine,XiangyaHospital,CentralSouthUniversity,Changsha410083,China;3.DepartmentofRheumatologyandImmunology,WestChinaHospital,SichuanUniversity,Chengdu610041,China)
Objective To investigate the expression and clinical significance of IL-17 and IRF4 in patients with rheumatoid arthritis (RA). Methods 30 RA patients were divided into active RA patients (16 cases) and stable RA patients (14 cases). 20 healthy people were taken as the healthy controls (HC). The peripheral blood monocyte cells (PBMC) from HC and RA patients were collected. The levels of IL- 17 were measured by flow cytometry. The expression levels of IL- 17mRNA and IRF4 mRNA in HC and RA patients were measured by real-time PCR (RT- PCR). The PBMC from HC were stimulated with anti-CD3/anti-CD28 monoclonal antibodies in the absence or presence of IL-6、IL-23 and TGF-β. After co-culture, the levels of IL-17mRNA and IRF4mRNA were analyzed by RT- PCR. Results The levels of IL-17, IL-17mRNA and IRF4 mRNA of RA stable patients were significantly higher than that of active RA patients(P<0.01).The levels of IL-17, IL-17mRNA and IRF4 mRNA in RA stable patients were higher than that of HC (P<0.05). Under A-CD3/A-CD28+IL-6+IL-23+TGFβ stimulated PBMC the expression of IL- 17mRNA, IRF4 mRNA were all higher than that of controls (A-CD3/ A-CD28) (P<0.05).Conclusion IL- 17mRNA and IRF4 mRNA in RA patients are highly expressed. IRF4 may play an important role in the development of RA. IRF4 may regulate the differentiation of Th17 cells, which makes IRF4 to be potential target for RA therapy.
Rheumatoid arthritis; IL-17; Interferon regulatory factor 4
国家自然科学基金(81102274);四川省科技厅国际合作项目(2014HH0027);成都市科技攻关项目(10GGYB644SF-023)
刘毅,教授,博士生导师,本刊常务编委,E-mail:yi2006liu@163.com
R 593.22
A
10.3969/j.issn.1672-3511.2016.11.007
2016-07-01;
2016-08-13; 编辑: 张文秀)

