尘肺病合并类风湿关节炎患者胸部CT影像学特点*
崔贝贝 周丁子 林辉 蔡娅菲 薛丽佳 刘毅
(1.四川大学华西医院风湿免疫科, 四川 成都 610041;2. 四川大学华西第四医院职业病科, 四川 成都 610041)
·论著·
尘肺病合并类风湿关节炎患者胸部CT影像学特点*
崔贝贝1周丁子2林辉1蔡娅菲1薛丽佳1刘毅1
(1.四川大学华西医院风湿免疫科, 四川 成都 610041;2. 四川大学华西第四医院职业病科, 四川 成都 610041)
目的 分析尘肺病合并类风湿关节炎(RA)患者临床表现及胸部CT特点,探讨尘肺病在RA发病中的重要作用。方法 收集在四川大学第四附属医院住院的尘肺病患者中符合2009年ACR诊断分类标准的RA患者12例,研究受试者的尘肺病相关资料、RA表现及胸部CT影像学特点等指标。结果 研究纳入RA合并尘肺病患者平均年龄(50.41±10.56)岁;工种主要为凿石或掘进,粉尘接触年限平均为7.36年;RA病程平均病程为(6.03±4.09)年,88.8%的患者类风湿因子水平升高。RA合并尘肺病患者的胸部CT表现以0.1~0.3 cm小结节(100%)为主,还可出现肺大疱(16%)、空洞(25%)、胸膜增厚(33.3%)、肺气肿(41.6%)等改变。结论 尘肺病与RA存在密切联系,应结合RA合并尘肺病患者血清学及胸部CT 特点,重视该类患者的筛查和诊治。
尘肺病; 类风湿关节炎; 胸部CT; 类风湿因子
环境因素在自身免疫疾病发生及发展中具有重要作用。人类衣食住行中所接触的化工产品,微生物甚至放射性物质都会影响自身的免疫系统。尘肺病是长期吸入生产性粉尘而引起的以肺组织弥漫性纤维化为主的全身性疾病,其特征是肺内有粉尘阻留并有胶原型纤维增生和肺组织反应,肺泡结构永久性破坏。按照粉尘及病因可分为矽肺病,煤尘肺病,铸工尘肺病,混合性尘肺病及其他尘肺病,其中以大量游离二氧化硅粉尘引起的矽肺最为常见[1]。研究表明,长期暴露于粉尘中,不仅引起肺组织病理性改变,还将引起自身免疫系统紊乱而导致疾病[2-7]。
类风湿关节炎(Rheumatoid arthritis,RA)是一种常见的自身免疫性疾病,以小关节对称性关节肿痛为特征性表现。RA与尘肺病的相关性在既往国外研究中被多次探讨;然而RA合并尘肺病患者典型胸部影像学表现却较少涉及,在国内外报道中主要以个案的形式出现,缺乏系统性回顾分析。本研究回顾性分析RA合并尘肺病患者的临床表现,总结该类患者胸部CT的影像学特点,为临床诊断该类疾病提供进一步线索和依据。
1 资料与方法
1.1 病例资料 收集2012年1月到2016年6月在四川大学第四附属医院住院符合国家GBZ70-2009职业病尘肺病诊断标准的尘肺病患者中符合2009年ACR诊断分类标准的RA患者。排除标准:年龄≤18岁或≥70岁;合并其他结缔组织病患者。
1.2 胸部CT采集 西门子SOMATOM 16CT 扫描机,层厚5 mm,层间距5 mm, 扫描范围从肺尖到肺底,均用两套窗宽、窗位观察,肺窗窗宽1200,窗位-600, 纵窗窗窗宽400,窗位40。
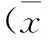
2 结果
2.1 一般资料 本研究共纳入受试者12例,均为男性患者,均存在长期吸烟史,主要工种为碎石及掘进,涉及放炮、碎石、打钻等日常作业。粉尘接触年限平均为7.36年。受试者中尘肺病I期患者3人,Ⅱ期患者5人,Ⅲ期患者4人。所有患者均存在咳嗽、咳痰症状,少数患者存在呼吸困难,1人存在咯血症状。尘肺病相关资料,见表1。RA平均病程为(6.03±4.09)年。受试者RA表现为晨僵,以双手、双足小关节为主的全身关节肿痛,部分患者合并手足小关节关节畸形。多数受试者类风湿因子呈高滴度阳性,C反应蛋白升高。受试者RA相关资料,见表2。
表1 受试者基本信息及尘肺病相关资料
Table 1 Characteristics of patients and clinical manifestations of silicosis

分类 n(×10-2)年龄50.41±10.56工种碎石10(83.3)掘进2(16.7)接触年限>5年6(50.0)<5年6(50.0)矽肺分期Ι级3(25.0)Ⅱ级5(41.7)Ⅲ级4(33.3)矽肺症状呼吸困难3(25.0)咳嗽12(100.0)咳痰12(100.0)

表2 受试者RA相关资料
注:抗CCP抗体:抗环瓜氨酸肽抗体;RF:类风湿因子;CRP:C反应蛋白。
2.2 受试者胸部CT影像学特点 尘肺Ι期的3例受试者均有双肺0.1~0.3 cm小结节改变,2例患者出现胸膜增厚,1例患者合并肺气肿及散在纤维条索改变;尘肺Ⅱ期5例受试者均有小结节样改变,两例患者出现肺空洞,其余肺部表现包括胸膜增厚,肺气肿,纤维条索等;尘肺Ⅲ期的4例患者亦均存在小结节样改变,其中两例患者出现肺大疱,其余肺部表现类似于Ⅱ期患者(表3,图1、2)。
表3 受试者胸部CT影像学表现
3 讨论
尘肺病与自身免疫疾病相关性的研究具有悠久历史。早在1914年Bramwell[2]观察并描述了石匠中较常见硬皮病表现。粉尘暴露与系统性红斑狼疮、干燥综合征、ANCA相关血管炎等自身免疫疾病的相关性研究也屡有报道[3-7]。尘肺病患者RA的研究最早追溯于1950年,Caplan分析了近14 000例因患有尘肺病申请索赔的煤炭工人,发现此群体RA发生率约为0.4%,并且RA发生与肺组织纤维化程度相关,随后二氧化硅暴露引起的RA合并双肺外周多发结节的临床表现称为“Caplan综合征”[8]。
本研究受试者中,类风湿因子阳性者占8/9,且其中7例为高滴度阳性(大于3倍以上),而既往研究也曾提示二氧化硅暴露可能与抗CCP抗体及类风湿因子水平升高相关。一项瑞典人口病例对照研究,共计纳入577名RA患者及659例随机健康对照,结果提示二氧化硅暴露个体抗CCP抗体阳性RA患病率增高,而抗CCP抗体阴性RA比例与对照组无差异[9]。另有研究表明,尘肺病患者即使早期缺乏RA的典型表现,也可能长期出现类风湿因子阳性,并逐渐发展为RA[10]。值得注意的是,其他类型粉尘,如纺织粉尘、空气污染颗粒等也可能增加RA发生[11-12]。

图1 尘肺病Ⅱ期患者合并RA胸部CT表现
Figure 1 CT images of a patient with RA and Ⅱ grade silicosis
注:双肺小结节影,合并肺纹理增多,胸膜增厚,空洞

图2 尘肺病Ⅲ期患者合并RA胸部CT表现
Figure 2 CT images of a patient with RA and Ⅲ grade silicosis
注:双肺多发大小约0.1~0.3 cm小圆结节影,周围见大量纤维条索灶,在双肺上叶尖后段部分融合,形成对称的软组织密度片团影,双肺肺气肿,肺大疱
本研究针对RA合并尘肺病患者胸部CT改变的回顾性分析。 既往对于这类患者肺部影像学研究较少,而涉及胸部CT影像特点的仅有个案报道。Caplan曾以X线胸片研究为基础, 描述二氧化硅暴露RA患者其肺部表现主要以直径0.5~5 cm大小类风湿结节为特征,45%病例缺乏或仅为尘肺病Ⅰ期表现。随后这一观点很长时间被认可,直到2002年Honma等[13]回顾性分析3667例罹患尘肺病的煤矿工人的尸检结果提出,类风湿型尘肺可能存在两种类型,一种类型是Caplan所描述,另一种类型表现为粉尘沉积所致小结节样改变而缺乏类风湿结节样改变。本研究结果显示,RA合并尘肺病患者胸部CT表现以双肺散在0.1~0.3 cm小结节影为主要特点,这一结果符合Honma与Vallyathan提出的该类疾病第二种类型肺脏改变,即以尘肺改变为主,本次研究所纳入的12例受试者肺部均无类风湿结节样改变。除小结节改变外,胸膜增厚、肺大疱、肺气肿等情况在受试者中也较为常见。特别值得注意的是,本研究中3例受试者出现肺空洞表现,其中2例曾接受抗痨治疗,类风湿型尘肺患者结核发生率增加也曾在既往研究中被提及[14-16]。
尘肺病与自身免疫疾病共同病理机制目前尚不明确。 二氧化硅是硅的氧化产物,通常以多种晶体形式存在于尘肺病患者的肺组织内。晶体硅作为异物,长期刺激尘肺病患者的免疫系统,形成慢性炎症反应,促使成纤维细胞增殖,肺组织纤维化改变[17-18]。研究提示,在尘肺病患者中,效应T细胞的Fas介导凋亡通路受抑制,而Treg细胞Fas介导细胞凋亡增加,导致效应T细胞过度表达,免疫耐受失衡,此过程由 IL-1b,IFN-r,IL-4,IL-17等炎症因子参与完成[19-20]。此外,尘肺病患者体内存在多种自身抗体,包括抗核抗体、抗SCL-70抗体、抗CD95/Fas抗体等[21]。
4 结论
长期粉尘暴露可能引发自身免疫系统紊乱,因此应重视粉尘接触职业者中自身免疫疾病的筛查和诊治。本研究及既往研究皆提示,尘肺病与RA密切相关,类风湿型尘肺的肺部改变以尘肺样改变为主要特点,尚需警惕肺结核等合并疾病。探讨尘肺病与RA相互作用机制,可能有助于从根本揭示RA发生的病理机制,值得广大风湿病和职业病研究者进一步热切关注。
[1]Seaman DM, Meyer CA, Kanne JP. Occupational and environmental lung disease [J]. Clin Chest Med, 2015;36(2):249-68.
[2]Bramwell B. Diffuse scleroderma: its frequency; its occurrence in stonemasons: its treatment by fibrinolysis in elevation of temperature due to fibrinolysis injection[J]. Edinburgh Med, 1914, 12: 387.
[3]Koeger AC, Lang T, Alcaix D,etal. Silica-associated connective tissue disease. A study of 24 cases[J]. Medicine (Baltimore),1995,74(5):221-237.
[4]Sanchez-Roman J, Wichmann I, Salaberri J,etal. Multiple clinical and biological autoimmune manifestations in 50 workers after occupational exposure to silica[J]. Ann Rheum Dis, 1993,52(5): 534-538.
[5]Conrad K, Mehlhorn J, Lüthke K, Dörner T,etal. Systemic lupus erythematosus after heavy exposure to quartz dust in uranium mines: clinical and serological characteristics[J]. Lupus,1996,5(1): 62-69.
[6]Rosenman KD, Moore-Fuller M, Reilly MJ. Connective tissue disease and silicosis[J]. Am J Ind Med,1999,35(4): 375-381.
[7]Lucas CD, Amft N, Reid PT. Systemic lupus erythematosus complicating simple silicosis [J]. Reid Occupational Medicine,2014, 64 (5):387-390.
[8]Caplan A. Certain unusual radiological appearances in the chest of coal-miners suffering from rheumatoid arthritis[J]. Thorax,1953, 8:29-37.
[9]Stolt P, Källberg H, Lundberg I,etal. Silica exposure is associated with increased risk of developing rheumatoid arthritis: results from the Swedish EIRA study [J]. Ann Rheum Dis, 2005,64(4): 582-586.
[10] Essouma M, Noubiap JJ. Is air pollution a risk factor for rheumatoid arthritis? [J]. J Inflamm (Lond),2015,12:48. doi: 10.1186/s12950-015-0092-1.
[11] MyEIRA Study Group. Occupational exposure to textile dust increases the risk of rheumatoid arthritis: results from a Malaysian population-based case-control study[J]. Ann Rheum Dis, 2016,75(6):997-1002.
[12] Klareskog L, Stolt P, Lundberg K,etal. A new model for an etiology of rheumatoid arthritis: smoking may trigger HLA-DR (shared epitope)-restricted immune reactions to autoantigens modified by citrullination[J]. Arthritis Rheum, 2006,54(1): 38-46.
[13] Honma K, Vallyathan V. Rheumatoid Pneumoconiosis: A comparative study of autopsy cases between Japan and North America[J]. Ann Occup Hyg,2002,46: 265-267.
[14] Siribaddana AD, Wickramasekera K, Palipana WM,etal. A study on silicosis among employees of a silica processing factory in the Central Province of Sri Lanka [J]. Ceylon Med J, 2016,61(1):6-10.
[15] Farazi A, Jabbariasl M. Silico-tuberculosis and associated risk factors in central province of Iran[J]. Pan Afr Med J,2015,20(7):333.
[16] Barve K, Karkhanis V, Joshi JM. Tuberculosis or an unusual occupational exposure? [J]. Indian J Tuberc, 2014, 61(1): 343-344.
[17] Pollard KM. Silica, silicosis, and Autoimmunity[J]. Frontiers in Immunol, 2016,7:97. doi: 10.3389/fimmu.2016.00097.
[18] Parks CG, Conrad K, Cooper GS. Occupational exposure to crystalline silica and autoimmune disease [J]. Environ Health Perspect,1999,107:793-802.
[19] Miller FW, Pollard KM, Parks CG,etal. Criteria for environmentally associated autoimmune diseases[J]. J Autoimmun, 2012,39(4): 253-258.
[20] Pedersen M, Jacobsen S, Klarlund M,etal. Environmental risk factors differ between rheumatoid arthritis with and without auto-antibodies against cycliccitrullinated peptides[J]. Arthritis Res Ther,2006, 8(4): R133.
[21] Svärd A, Skogh T, Alfredsson L,etal. Associations with smoking and shared epitope differ between IgA- and IgG-class antibodies to cyclic citrullinated peptides in early rheumatoid arthritis[J]. Arthritis Rheumatol,2015,67(8): 2032-2037.
A respective study on CT images of patients with both pneumoconiosis and rheumatoid arthritis
CUI Beibei1,ZHOU DingZi2,LIN Hui1,et al
(1.DepartmentofRheumatologyandImmunology,WestChinaHospital,SichuanUniversity,Chengdu610041,China;2.DepartmentofOccupationMedicine,NO.4WestChinaHospital,SichuanUniversity,Chengdu610041,China)
Objective To analyze the clinical features and chest CT images of patients with both pneumoconiosis and rheumatoid arthritis, and study the important roles of pneumoconiosis in rheumatoid arthritis. Methods A retrospective study on inpatient of No.4th affiliated hospital of Sichuan University from 2012 to 2016 was performed. Patients with pneumoconiosis met ACR classification criteria of rheumatic arthritis were enrolled. The features of pneumoconiosis and rheumatic arthritis as well as images of chest CT scan were analyzed. Results 12 patients with both pneumoconiosis and rheumatoid arthritis were recruited into the study. The average age of the subjects was 50.41±10.56. The vocations of the subjects included mason and driving. The average duration of silica exposure was 6.03±4.09 years. 88.8 percents of the subjects showed positive rheumatoid factor. Chest CT scan of patients with both pneumoconiosis and rheumatoid arthritis mainly showed nodules in lungs, 0.1-0.3cm in diameter, and other appearance include pneumatocele, cavity, pleural thickening, and emphysema. Conclusion There is a tight correlation between pneumoconiosis and rheumatoid arthritis. Accurate diagnoses of patients with both pneumoconiosis and rheumatoid arthritis should be made on the basis of serological and CT scan features.
Pneumoconiosis; Rheumatoid arthritis; Chest CT scan; Rheumatoid factor
国家自然科学基金(81102274);四川省科技厅国际合作项目(2014HH0027); 成都市科技攻关项目(10GGYB644SF-023)
林辉,副教授,本刊审稿专家,E-mail:lhacd@163.com
R 593.22; R 135.2
A
10.3969/j.issn.1672-3511.2016.11.010
2016-07-01;
2016-08-07; 编辑: 张文秀)

