7种杀菌剂对姜瘟病菌Z-AQ-2菌株的抑菌活性
胡小梅, 徐 进, 毛连刚, 冯 洁, 曹坳程
(中国农业科学院植物保护研究所, 植物病虫害生物学国家重点实验室, 北京 100193)
7种杀菌剂对姜瘟病菌Z-AQ-2菌株的抑菌活性
胡小梅, 徐 进, 毛连刚, 冯 洁*, 曹坳程*
(中国农业科学院植物保护研究所, 植物病虫害生物学国家重点实验室, 北京 100193)
青枯菌4号生理小种引起的姜瘟病是我国生姜生产上的巨大障碍。本研究以分离自5种不同寄主的8株青枯菌为研究对象,采用最小抑制浓度法(MIC)评价了它们的铜抗性水平,发现分离于山东安丘的4号小种Z-AQ-2菌株的铜抗性水平最高,为1.6 mmol/L;采用生长速率法测定了7种常用杀菌剂对Z-AQ-2菌株的室内毒力,结果表明:3%中生菌素可湿性粉剂对姜瘟病菌的抑菌活性最高,其EC50为5.2 mg/L,其次为6%寡糖·链蛋白可湿性粉剂,EC50为21.2 mg/L,20%叶枯唑可湿性粉剂在3种不含铜的农药中EC50值最高,为58.7 mg/L,4种铜制剂抑菌效果相对较差,EC50为51.5~148.7 mg/L;进一步采用Colby法评价了叶枯唑与氢氧化铜、叶枯唑与中生菌素以及中生菌素与氨基寡糖素的混用效果,结果表明:三组药剂的混用均可产生增效或加成效果。
青枯菌; 室内毒力; Colby; 铜抗性
植物细菌性青枯病(bacterial wilt of plants)是由茄科雷尔氏菌(Ralstoniasolanacearum,简称青枯菌)引起的一种世界性重大病害。该病广泛分布于热带、亚热带、温带甚至高纬度地区,对农业生产构成了巨大威胁[1]。青枯菌菌系复杂多样,依据其寄主范围可划分为5个不同的生理小种(race,r);根据其对3种双糖(麦芽糖、乳糖、纤维二糖)和对3种己醇(甘露醇、山梨醇和甜醇)的氧化利用情况,可划分为5个生化变种(biovar,bv)[2];根据内源葡聚糖酶等核心基因的系统进化关系,可划分为与地理分布密切相关的4个演化型[3]。由青枯菌4号小种引起的姜瘟病在山东、四川、重庆、贵州和广西等地区的生姜主栽区普遍发生,常年造成的平均产量损失约20%~30%,重病田块则可高达70%,甚至绝产,成为我国生姜产业健康发展的制约瓶颈[4]。姜瘟病菌可于土壤和水体中长期存活,成为翌年的主要初侵染来源;病原菌通过生姜植株地下部根茎及根部自然空隙或伤口侵入,随后进入维管束组织大量增殖,最终造成植株死亡。受侵染植株肉质根茎初呈水渍状,黄褐色,内部逐渐软化腐烂,散发臭味,最后仅残留外皮。由于姜瘟病菌寄主广泛,且迄今为止生产上尚无抗(耐)病品种,因此该病的防治主要依赖于化学药剂。目前国内外广泛应用于姜瘟病等细菌病害防治的化学农药主要为铜制剂。但相关研究显示:由于长期过量使用铜制剂,已造成植物相关黄单胞菌(Xanthomonasspp.)和假单胞菌(Pseudomonasspp.)等属的细菌出现了铜抗性菌株[5-6]。王英等发现番茄青枯病菌对氢氧化铜、喹啉铜等含铜药剂的抗性水平已达到了高抗,对噻菌铜的抗性水平也为中抗[7]。
鉴于此,本研究于室内离体条件下采用最小抑制浓度法,比较了分离自5个不同寄主的8株青枯菌对铜的抗性水平差异;采用生长速率法测定了7种常用杀菌剂对引起姜瘟病的青枯菌4号小种的抑菌效果,以期探明其抑菌活性;采用Colby法评价了叶枯唑和氢氧化铜、叶枯唑和中生菌素以及中生菌素和氨基寡糖素的混配效果,以期筛选获得新型、高效、低毒的杀菌剂,为姜瘟病的科学防治提供更为有效、安全的药剂使用参考。
1 材料和方法
1.1 供试杀菌剂
采用生产上常规应用的7种杀菌剂:20%叶枯唑可湿性粉剂(广东省东莞市瑞德丰生物科技有限公司)、3%中生菌素可湿性粉剂(广东省东莞市瑞德丰生物科技有限公司)、47%春雷·王铜可湿性粉剂(日本北兴化学工业株式会社)、6%寡糖·链蛋白可湿性粉剂(中国农科院植保所廊坊农药中试厂)、20%噻菌铜悬浮剂(浙江龙湾化工有限公司)、30%琥胶肥酸铜悬浮剂(中国农科院植保所廊坊农药厂)、46%氢氧化铜水分散粒剂(美国杜邦公司)。
1.2 供试培养基及菌株
供试菌株及对照:于山东安丘和四川雅安姜瘟病重病田块内,采集疑似病株的地上部假茎和地下部根茎材料,进行病原菌分离,作为试验材料。为比较不同寄主分离的菌株间的铜抗性水平差异,以本实验室分离保存的6株青枯菌菌株作为参照。各分离菌株和种以下分类归属等信息详见表1。
供试培养基:青枯菌菌株常规培养采用普通NA培养基,病株样品的青枯菌分离与鉴定使用TZC或SMSA培养基。发病后期腐烂程度高的样品采用SMSA,反之则TZC培养基。(1)NA培养基:葡萄糖10 g、酵母浸膏粉0.5 g、多聚蛋白胨5 g、牛肉膏3 g,定容至1 000 mL,琼脂18 g,pH=7,121℃灭菌20 min。(2)TZC培养基:NA培养基冷却至50℃后,加红四氮唑至终浓度50 mg/L。(3)SMSA培养基:酸水解酪蛋白1 g、细菌蛋白胨10 g、丙三醇5 mL、细菌琼脂粉 15 g,定容至1 000 mL。121℃灭菌15 min。培养基冷却至50℃后,分别加入结晶紫、硫酸多黏菌素、杆菌肽、氯霉素、青霉素和红四氮唑至终浓度为5、100、25、5、0.5和50 mg/L。

表1 供试菌株
1.3 试验方法
1.3.1 供试菌株的分离及PCR验证
疑似罹病生姜根茎样品经自来水反复洗净后,以70%的乙醇进行表面消毒。以灭菌解剖刀切取小块病组织,放于灭菌水中静置悬浮20~30 min,用接种环蘸取少量悬浮液于SMSA或TZC平板上画线,将平板置于28℃培养 48~72 h,观察分离结果。挑取典型的青枯菌野生菌落,采用青枯菌种通用特异性引物AU759f/AU760r(AU759f:gTCgCCgTCAACTCACTTTCC;AU760r:gTCgCCgTCAgCAATgCggAATCg)进行菌落PCR分子鉴定[8],鉴定阳性的菌落以接种环转移至NA 培养基上,28℃培养48 h后保存于无菌水中备用[9]。
1.3.2 供试菌株铜抗性水平测定
采用最小抑制浓度法(minimum inhibition concentration,MIC)对供试菌株的铜耐受性水平进行评价。分别将NA平板上生长48 h的各供试菌株(表1)以灭菌水洗脱,采用比浊法[10]配制成浓度为3×108cfu/mL的菌悬液,各菌悬液取1 μL稀释至3×105cfu/mL,分别涂布于硫酸铜终浓度为0、0.2、0.4、0.6、 0.8、1.0、1.2、1.4、1.6和1.8 mmol/L的NA平板上。30℃条件下,培养48~72 h后观测菌落生长情况,以菌株能正常生长的最高浓度作为MIC值。各浓度处理重复3次。
1.3.3 供试药剂对姜瘟病菌菌株Z-AQ-2的毒力测定
采用生长速率法测定供试杀菌剂对姜瘟病菌菌株Z-AQ-2的室内离体抑菌活性。取10 μL浓度为3×105cfu/mL的Z-AQ-2菌悬液,加入到含有2 mL NB培养基的5 mL离心管中,随后加入不同体积的供试杀菌剂母液,使之形成一定的浓度梯度。各处理重复3次,供试药剂的浓度梯度见表2。

表2 供试杀菌剂的浓度梯度
参照张大明的方法进行抑菌率计算[11]。不含药剂阳性对照组于180 r/min, 28℃条件下振荡培养至菌液浓度A600为0.8~1.2时(即进入对数生长期),以只含药剂的NB培养基进行校准,测量各处理的A600。计算各药剂对Z-AQ-2的抑菌活性,公式如下:
抑制率(%)=(阳性对照A600-处理组A600)/阳性对照A600×100。
1.3.4 Colby法评价药剂混用效果
取10 μL稀释好的Z-AQ-2菌悬液加入到含有2 mL液体NB培养基的 5 mL离心管中,分别将20%叶枯唑可湿性粉剂和46%氢氧化铜水分散粒剂、20%叶枯唑可湿性粉剂和3%中生菌素可湿性粉剂以及3%中生菌素可湿性粉剂和6%寡糖·链蛋白可湿性粉剂按一定浓度比例加入到上述离心管中,各处理重复3次。以只含菌液不含药剂的NB培养基为阳性对照,180 r/min、28℃振荡培养至菌液浓度的A600为0.8~1.2时(即进入对数生长期),以不含菌液只含药剂的NB培养基进行校准,测量各处理的A600,计算各药剂浓度下的青枯菌存活率和理论存活率:
存活率(%)=处理组A600/阳性对照A600×100;
E0=X1·X2……Xn/100(n-1);
E0为混剂的理论存活率;n为混用杀菌剂的数量;X1表示施用第1种杀菌剂后青枯菌的存活率;X2表示施用第2种杀菌剂后青枯菌的存活率;Xn表示施用第n种杀菌剂后青枯菌的存活率。E是混剂使用后实际存活率,当E0-E>5%时,说明产生增效作用;当E0-E<-5%时,说明产生拮抗作用;当E0-E值介于±5%时,说明产生加成作用[12]。
1.4 数据分析
采用DPS 9.50对各药剂剂量的对数值和生长抑制率的几率值进行回归分析,计算各药剂对青枯菌4号小种线性回归方程的相关系数及95%置信区间。
2 结果与分析
2.1 姜瘟病菌分离鉴定结果
青枯菌在SMSA或TZC培养平板上生长48 h后,典型的野生型菌落形态为圆形或不规则,外缘为白色,中央为淡粉红色(图1)。本研究于2014年至2015年间于山东安丘和四川雅安两地分离获得了12个姜瘟病菌,从中选取了编号为Z-AQ-2(安丘)与Sichuan 2-2(雅安)的2个菌株为本试验研究对象。采用青枯菌种特异性检测引物AU759f/AU760r的鉴定结果显示:各供试菌株均可扩增获得片段大小约280 bp条带(图2)。

图1 姜瘟病菌菌株的菌落形态Fig.1 Colony morphology of Ralstonia solanacearum on SMSA medium

图2 引物AU759f/AU760r对供试菌株的 PCR扩增结果Fig.2 PCR amplification results of pathogenic bacterial strains using primers AU759f/AU760r
2.2 供试菌株铜抗性水平测定结果
采用MIC法对不同寄主上分离的青枯菌菌株进行铜抗性水平鉴定。结果显示,从不同寄主上分离的菌株对硫酸铜的抗性水平差异明显。其中,从马铃薯上分离的3号小种菌株PO41和POYN(5-4-1)在8株青枯菌菌株中对铜的抗性水平最低, 其MIC值均为0.6 mmol/L;从生姜上分离的4号小种菌株Z-AQ-2和Sichuan 2-2对铜的抗性水平最高,其MIC值分别为1.6 mmol/L和1.2 mmol/L,分别高于和等于报道的耐金属贪铜菌CH34菌株的MIC值(1.2 mmol/L)[13];从烟草上分离的1号小种菌株Tb43和从番茄上分离的1号小种菌株Tm1的MIC值分别0.8 mmol/L、1.2 mmol/L;从桑树上分离的5号小种菌株m11和m2的MIC值分别为0.6 mmol/L和1.0 mmol/L(图3)。
2.3 杀菌剂对姜瘟病菌菌株Z-AQ-2的毒力测定结果
2.3.1 不含铜杀菌剂之间抑菌活性比较
3种不含铜杀菌剂中,中生菌素和氨基寡糖素均属于抗生素类杀菌剂,叶枯唑属噻唑类杀菌剂。其中,3%中生菌素可湿性粉剂对姜瘟病菌菌株Z-AQ-2的抑菌活性最强,其EC50为5.2 mg/L;6%寡糖·链蛋白可湿性粉剂次之,EC50为21.2 mg/L;20%叶枯唑可湿性粉剂抑菌活性相对较差,EC50为58.7 mg/L(表3)。
2.3.2 含铜杀菌剂之间抑菌活性比较
表3结果显示:4种含铜杀菌剂中,无机铜对Z-AQ-2菌株的抑菌活性总体上优于有机铜。各供试杀菌剂抑菌效果从高至低依次为:47%春雷·王铜可湿性粉剂,EC50为51.1 mg/L;46%氢氧化铜水分散粒剂,EC50为62.9 mg/L;30%琥胶肥酸铜悬浮剂,EC50为147.2 mg/L, 20%噻菌铜悬浮剂,EC50为148.7 mg/L。
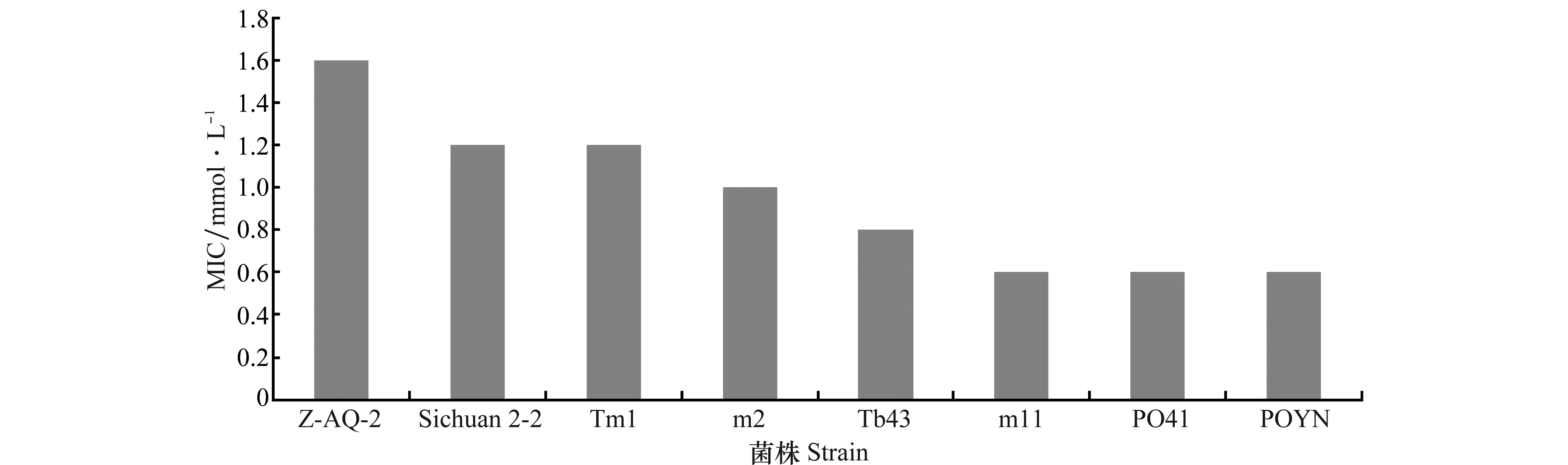
图3 供试菌株对铜离子的MIC值Fig.3 MIC value of the tested strains
2.3.3 含铜与不含铜的杀菌剂之间的抑菌活性比较
表3结果进一步揭示出供试抗生素类和噻唑类杀菌剂的抑菌效果明显优于含铜杀菌剂,且抗生素类杀菌剂的抑菌效果高于噻唑类杀菌剂。其中对青枯菌4号小种Z-AQ-2菌株抑菌效果最好的是3%中生菌素可湿性粉剂,它是一种已登记用于姜瘟病防治的杀菌剂;其次是6%寡糖·链蛋白可湿性粉剂,它虽没有登记作为姜瘟病的防治药剂,但已有报道其对青枯病有良好的防治效果[14]。

表3 7种杀菌剂对姜瘟病菌菌株Z-AQ-2的EC50测定结果
2.4 Colby法对叶枯唑和氢氧化铜、叶枯唑和中生菌素以及中生菌素和氨基寡糖素的混用效果评价
2.4.1 叶枯唑与中生菌素混用组合对姜瘟病菌菌株Z-AQ-2的抑菌效果
表4显示:在处理剂量下20%叶枯唑可湿性粉剂对Z-AQ-2的抑制率约为20%~40%,3%中生菌素可湿性粉剂对Z-AQ-2的抑制率约为25%~75%,各浓度组合后对Z-AQ-2的抑制率约为40%~93%之间,参照Colby 法对复配结果进行简单检验,结果表明:当叶枯唑和中生菌素混用时Eo-E介于±5%之间,2种杀菌剂的混用对Z-AQ-2的联合作用类型属于加成作用。

表4 叶枯唑和中生菌素混用组合对姜瘟病菌菌株Z-AQ-2的抑菌效果检验(Colby法)
2.4.2 叶枯唑与氢氧化铜混用组合对姜瘟病菌菌株Z-AQ-2的抑制效果
由表5可知,在处理剂量下20%叶枯唑可湿性粉剂对Z-AQ-2的抑制率约为20%~40%,46%氢氧化铜水分散粒剂对Z-AQ-2的抑制率约为50%~55%,各浓度组合后对Z-AQ-2的抑制率约在90%~97%之间。Colby法检验结果表明:当叶枯唑和中生菌素混用时Eo-E值大于5%,2种杀菌剂的混用对Z-AQ-2的联合作用类型属于增效作用。
2.4.3 氨基寡糖素与中生菌素混用组合对姜瘟病菌菌株Z-AQ-2的抑菌效果
表6中的结果显示:在处理剂量下6%氨基寡糖素可湿性粉剂对Z-AQ-2的抑制率约为20%~30%,3%中生菌素可湿性粉剂对Z-AQ-2的抑制率约为15%~50%,各浓度组合后对Z-AQ-2的抑制率约在40%~70%之间,参照Colby 法对复配结果进行简单检验,结果表明:当氨基寡糖素与中生菌素混用时Eo-E值大于5%,2种杀菌剂的混用对Z-AQ-2的联合作用类型属于增效作用。
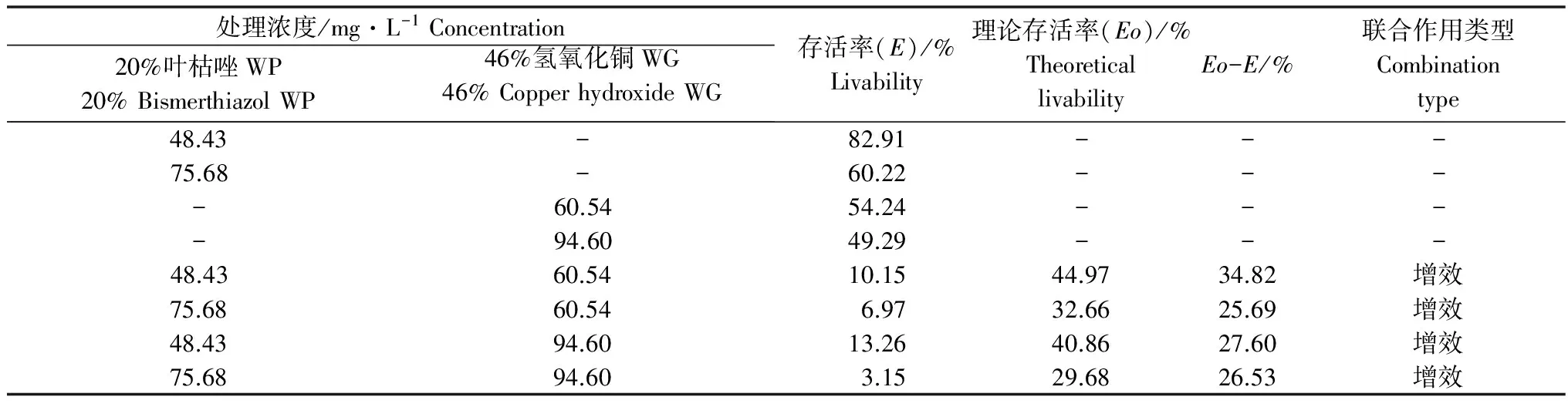
表5 叶枯唑和氢氧化铜混用组合对姜瘟病菌菌株Z-AQ-2的抑菌效果检验(Colby法)

表6 氨基寡糖素和中生菌素混用组合对姜瘟病菌菌株Z-AQ-2的抑菌效果检验(Colby法)
3 结论和讨论
铜制剂在植物病害防治中的应用已有超过百年的历史,特别是植物细菌性病害,在缺乏经济有效替代产品的情况下,铜制剂至今仍是细菌病害防控的主要药剂。但长期对铜制剂的过度依赖,铜抗性菌株已在包括西瓜嗜酸菌、丁香假单胞菌和野油菜黄单胞菌等多种植物病原细菌中发现。青枯菌菌系变异类型较多,且栽培寄主植物缺乏抗性品种。因此,我国青枯病的防治主要依赖于使用铜制剂和农用链霉素进行灌根处理。特别是在姜瘟病的防治中,生姜生产企业和农户大多长期、单一、过量的使用噻菌铜、氢氧化铜等铜制剂。目前青枯菌对铜抗性的相关报道虽不多见,但番茄青枯病GMI1000菌株中携带了与丁香假单胞菌高度同源的铜抗性基因簇[15]。因此本研究首先比较了不同寄主来源的青枯菌菌株间的铜耐受性水平差异,结果表明:分离于安丘单季作生姜主栽区的姜瘟病菌株Z-AQ-2对铜的耐受程度最高,达到1.6 mmol/L, 分离自四川雅安的姜瘟病菌株Sichuan 2-2和分离自广州番茄的菌株Tm1次之,均为 1.2 mmol/L。
杀菌剂的室内离体抑菌效果通常以抑菌中浓度EC50作为衡量指标,测定方法通常可分为3类:1)基于测量抑菌圈直径的碟片法或打孔法;2)基于测量细菌培养液A600值的生长速率法;3)基于计量菌落数的平板培养法。本研究前期使用打孔法的试验结果显示:部分供试杀菌剂仅可在远高于田间推荐用量的条件下,产生抑菌效果,且加药孔内有明显的药剂残留痕迹。因此推测有些杀菌剂由于剂型、水溶性及其有效成分在培养基凝胶结构中的扩散速度等原因,以该方法评价获得的结果不能反映出其真实毒力效果。刘晓妹等在防治番茄青枯病的复配剂筛选研究中同样观察到以打孔法无法准确评价5种杀菌剂的毒力差异[16]。因此本研究在随后的研究中采用了生长速率法评价供试杀菌剂毒力效果。
试验中杀菌剂对姜瘟病菌株Z-AQ-2毒力测定结果显示:4种含铜杀菌剂的EC50为51.1~148.7 mg/L(表3),均显著高于中生菌素和氨基寡糖素,表明含铜药剂对姜瘟病菌的离体生测效果不理想;其中,抗生素春雷霉素和铜的复配剂春雷·王铜是供试铜制剂中EC50最低的,也是唯一一个抑菌效果优于叶枯唑的杀菌剂。国内相关研究结果表明,抗生素与铜的复配剂不仅对离体青枯菌抑制效果优于单剂,且对田间青枯病的防效也同样高于单剂[17-18]。本研究对杀菌剂简单复配的结果也发现当铜制剂与叶枯唑进行混用时能有效提高抑菌效率,这为减少铜制剂的使用,减缓病原菌抗药性的发展以及提高农药的使用效率提供了一个良好发展的方向。
中生菌素和氨基寡糖素在本研究中表现出相当强的离体抑菌效果,EC50分别为5.2 mg/L和21.2 mg/L。作为我国农药毒性分级标准中的低毒抗生素类杀菌剂,中生菌素和氨基寡糖素不仅对病原微生物的增殖具有抑制作用,且能诱导寄主植物产生系统抗性[19-20]。大田和温室试验生测结果表明:中生菌素和氨基寡糖素对水稻白叶枯病、柑橘细菌性溃疡病、番茄青枯病、西瓜枯萎病、棉花黄萎病、番茄晚疫病、烟草病毒病、黄瓜白粉病、生菜立枯病等均有良好的防效[21]。
本研究结果显示杀菌作用机理不同的中生菌素和氨基寡糖素对姜瘟病菌的室内毒力活性显著高于传统铜制剂,该结果为姜瘟病田间防治的药剂轮换、杀菌剂复配提供了有价值的参考依据,并有助于延缓姜瘟病菌铜抗性菌株的产生。
[1] 华静月, 张长龄, 何礼远,等. 我国植物细菌青枯菌的生化型和其他生理差异[J]. 植物保护学报, 1984, 11(1): 42-50.
[2] 徐进, 冯洁. 植物青枯菌遗传多样性及致病基因组学研究进展[J]. 中国农业科学, 2013, 46(14): 2902-2909.
[3] Fegan M, Prior P.How complex is the “Ralstoniasolanacearumspecies complex”[M]∥Allen C, Prior P, Hayward A C. Bacterial wilt disease and theRalstoniasolanacearumspecies complex St. Paul:APS, 2005: 449-462.
[4] 孙霞, 王波. 生姜病害研究概述[J]. 安徽农学通报, 2009, 15(10): 159-161.
[5] Basim H, Minsavage G V, Stall R E, et al. Characterization of a unique chromosomal copper resistance gene cluster fromXanthomonascampestrispv.vesicatoria[J]. Applied and Environmental Microbiology, 2005, 71(12): 8284-8291.
[6] Berg J,Tom-Petersen A, Nybroe O.Copper amendment of agricultural soil selects for bacterial antibiotic resistance in the field [J]. Letters in Applied Microbiology, 2005, 40(2): 146-151.
[7] 王英, 尹显慧, 王梅, 等. 几种杀菌剂对番茄青枯病菌的抑菌活性[J]. 山地农业生物学报, 2014, 33(3): 8-12.
[8] Pan Zhechao, Xu Jin,Prior P, et al. Development of a specific molecular tool for the detection of epidemiologically active mulberry causing-disease strains ofRalstoniasolanacearumphylotype I (historically race 5-biovar 5) in China [J]. European Journal of Plant Pathology, 2013, 137(2): 377-391
[9] 徐进, 顾钢, 潘哲超, 等. 福建烟草青枯菌演化型及生化变种鉴定研究[J]. 植物保护, 2010, 16(6): 66-71.
[10]严益民. 比浊法在测定发酵液菌体浓度中的应用[J]. 抚顺石油学院学报, 2001, 21(1): 23-26.
[11]张大明. 黄姜粗提物对植物病原真菌及细菌抑制效果的初步研究[D].武汉: 华中农业大学, 2005.
[12]Colby S R. Calculating synergistic and antagonistic responses of herbicide combinations [J]. Weeds, 1967, 15(1): 20-22.
[13]Monchy S, Benotmane M A, Wattiez R.et al. Transcriptomic and proteomic analyses of the pMOL30-encoded copper resistance inCupriavidusmetalliduransstrain CH34 [J].Microbiology, 2006, 152:1765-1776.
[14]孔德英,肖崇刚.氨基寡糖素对番茄青枯病防治作用[J].西南农业大学学报(自然科学版),2015,27(3):327-330.
[15]Salanoubat M, Genin S, Artiguenave F, et al. Genome sequence of the plant pathogenRalstoniasolanacearum[J]. Nature, 2002, 415(6871): 497-502.
[16]刘晓妹, 浦金基, 王玉萍. 防治番茄青枯病复配剂筛选[J]. 农药, 2003, 42(8): 26-27.
[17]赵志祥, 严婉荣, 陈圆, 等. 几种杀菌剂对生姜青枯病菌的毒力测定[J]. 贵州农业科学, 2015, 43(9): 79-78.
[18]叶建如, 顾钢, 张瀛. 几种药剂防治烟草青枯病的药效评价[J]. 中国烟草科学, 2013, 34(1): 72-76.
[19]蒋细良, 王劲波, 王慧敏, 等. 中生菌素对水稻悬浮细胞过氧化物酶基因转录表达的影响[J]. 中国生物防治, 2006, 22(3): 207-210.
[20]孙艳秋, 李宝聚, 陈捷. 寡糖诱导植物防卫反应的信号转导[J]. 植物保护,2005, 31(1): 5-9.
[21]杨普云, 李萍, 王战鄂, 等. 植物免疫诱抗剂氨基寡糖素的应用效果与前景分析[J]. 中国植保导刊, 2013, 33(3): 20-21.
(责任编辑:杨明丽)
Antibacterial activity of seven bactericides to Ralstonia solanacearum strain Z-AQ-2
Hu Xiaomei, Xu Jin, Mao Liangang, Feng Jie, Cao Aocheng
(Institute of Plant Protection, Chinese Academy of Agricultural Sciences, State Key Laboratory for Biology of Plant Diseases and Insect Pests, Beijing 100193, China)
Bacterial wilt of edible ginger caused byRalstoniasolanacearumrace 4 is a severe threat to the production of ginger. EightR.solanacearumstrains isolated from 5 plant species were selected to investigate their copper resistance phenotype. The results showed that the strain Z-AQ-2 ofR.solanacearumrace 4 had the highest resistance to copper compounds, with the MIC value of 1.6 mmol/L.The study also examined the bacteriostatic activity of seven bactericides commonly used in the field. The results showed that 3% zhongshengmycin WP had the highest inhibition rates among the seven bactericides, with the EC50value of 5.2 mg/L, followed by 6% oligosaccharins WP and 20% bismerthiazol WP, with the EC50values of 21.2 mg/L and 58.7 mg/L, respectively. We evaluated the bacteriostatic activity of bismerthiazol plus copper hydroxide, bismerthiazol plus zhongshengmycin, and oligosaccharins plus zhongshengmycin by the method of Colby and the results showed that all the three mixtures had good synergism effect.
Ralstoniasolanacearum; toxicity; Colby; copper resistance
2015-12-25
2016-02-04
国家自然科学基金(31272008,31371908,31571975); 公益性行业(农业)科研专项(201303015); 国家科技支撑计划(2015BAD08B03)
S 436.32
B
10.3969/j.issn.0529-1542.2016.06.038
* 通信作者 E-mail: jfeng@ippcaas.cn;caoac@vip.sina.com

